| |
| Med Sci (Paris). 36: 28–32. doi: 10.1051/medsci/2020198.Obésité et cancer du sein Deux maladies du vieillissement limitées par l’activité physique Delphine Le Guennec,1a Stéphanie Rougé,1b Florence Caldefie-Chézet,1c Marie-Paule Vasson,1d and Adrien Rossary1e 1Laboratoire de biochimie, biologie moléculaire et nutrition, Équipe ECREIN, Unité de Nutrition Humaine, Université Clermont Auvergne, INRAE, UNH
,
F-63000Clermont-Ferrand
,
France MeSH keywords: Vieillissement, Tumeurs du sein, Exercice physique, Femelle, Humains, Obésité, Facteurs de risque, Charge tumorale, physiologie, épidémiologie, étiologie, anatomopathologie |
Le vieillissement chez la femme induit une immunosénescence et la ménopause. Ces changements favorisent le développement de maladies chroniques telles que l’obésité ou le cancer du sein. Les déterminants majeurs de la qualité du vieillissement sont l’accompagnement nutritionnel et une activité physique (AP) régulière. La littérature suggère que l’AP est bénéfique contre le développement du cancer du sein après la ménopause chez les femmes obèses [1]. Cependant, les mécanismes mis en jeux sont mal compris et peu d’études se sont concentrées sur le système immunitaire au cours de la carcinogenèse mammaire dans un contexte d’obésité associée à l’AP. |
Le vieillissement chez la femme Le vieillissement entraîne l’apparition de troubles métaboliques et inflammatoires qui peuvent être réduits par des stratégies préventives et non thérapeutiques comme l’accompagnement nutritionnel, la mobilité et l’AP afin de garder une qualité de vie satisfaisante [2].
Le vieillissement induit une détérioration du système immunitaire appelée immunosénescence, caractérisée par une diminution de la réponse immunitaire innée et adaptative, une dysfonctionnement de l’immunité et l’involution du thymus. La fonction et le phénotype des cellules immunitaires sont affectés avec une baisse de l’expression et de l’activité de certains de leurs récepteurs, contribuant à la perte du chimiotactisme et de la destruction cellulaire. Une diminution du potentiel lymphoïde est observée avec un déclin des lymphocytes T et B [1]. Le système immunitaire vieillissant crée une inflammation chronique à bas bruit avec une augmentation de la sécrétion de cytokines pro-inflammatoires (IL-1 [interleukine-1], TNF-α [
tumor necrosis factor-
a], IL-6 [interleukine-6], CRP [protéine C réactive]). Cet environnement favorise les dommages tissulaires et contribue à un vieillissement biologique accru [1]. Les mécanismes de compensation qui se mettent alors en place augmentent l’incidence des maladies auto-immunes et de nombreux cancers.
Chez la femme, avec le vieillissement, un autre processus se met en place : la ménopause. Les œstrogènes ne sont plus sécrétés par les ovaires mais le sont alors au niveau du tissu adipeux par aromatisation [3]. La prise de masse grasse est favorisée avec un accroissement du tissu adipeux viscéral et ses effets défavorables sur le système cardio-métabolique sous-jacent [3]. Le tissu mammaire, principalement composé d’adipocytes, est un microenvironnement favorable au développement de lésions précancéreuses [4]. Par l’intermédiaire de leurs récepteurs, les œstrogènes favorisent la prolifération cellulaire du tissu mammaire ainsi que le risque d’erreurs dans la réplication de l’ADN, facteurs liés de manière causale au cancer du sein. Ces deux facteurs, liés au vieillissement naturel chez la femme, favorisent le développement du cancer du sein [5]. |
Le cancer du sein est le cancer féminin le plus répandu dans le monde et représente 25 % des nouveaux cas de cancer (1,7 million de nouveaux cas diagnostiqués par an) [5]. En France, il représente un tiers de l’ensemble des nouveaux cas de cancers (58 459 nouveaux cas en 2018) [6]. Près d’une femme sur neuf développera un cancer du sein. L’âge moyen au diagnostic est de 63 ans en 2012 et moins de 10 % des cancers surviennent avant 40 ans. L’incidence augmente jusqu’à 65 ans. Ce cancer est la première cause de décès par cancer en France chez les femmes avec un âge médian de 74 ans (12 146 décès en 2018). Néanmoins, la mortalité a diminué entre 2005 et 2012 de 1,5 % par an en moyenne. La survie nette standardisée sur l’âge est de 87 % à 5 ans et 76 % à 10 ans. Cette évolution inverse s’explique notamment par un dépistage organisé, conduisant à des diagnostics plus précoces et par l’amélioration de la prise en charge.
Divers facteurs influencent le développement de ce cancer, l’âge en restant le principal. L’histoire hormonale et reproductive de la femme a un rôle important, la plupart des cancers du sein sont hormono-dépendants. Plus la durée d’exposition de la glande mammaire aux hormones est importante, plus le risque de développer un cancer du sein augmente. Les menstruations précoces, les grossesses après 30 ans, l’absence de grossesse à terme et la ménopause tardive (après 50 ans) augmentent le nombre de cycles menstruels [6]. Certains facteurs de risques sont endogènes, tels que les antécédents familiaux de cancer (sein, ovaires) ou les prédispositions génétiques (mutations BRCA [
breast cancer
]1 et 2, CHK2 [
checkpoint kinase 2
] et ATM [
ataxia telangiesctasia mutated
]) [6, 7]. Il existe des facteurs de risques exogènes liés à nos modes de vie tels que la consommation d’alcool, de tabac, un régime riche en graisses animales et en sucre, l’obésité, la sédentarité et le manque d’activité physique [5]. À l’inverse, l’allaitement maternel et une AP régulière sont des facteurs protecteurs [8]. En prévention, puis à tous les stades du cancer, l’AP et le maintien d’un poids sain (correspondant à un indice de poids corporel [IMC]
1
compris entre 20 et 25) sont des facteurs importants dans la prise en charge des patientes.
Bien que longtemps considéré comme une masse unique de cellules malignes, il est maintenant établi que le cancer est un véritable organe multicellulaire. Les cellules tumorales évoluent et coexistent avec un microenvironnement composé de nombreux types cellulaires comme les adipocytes, les fibroblastes, les cellules stromales et les cellules immunitaires. L’interaction dynamique entre ces cellules permet la progression tumorale faisant suite à leurs activations et sécrétions. Parmi les cellules du microenvironnement tumoral, les adipocytes représentent le composant majoritaire du stroma. La production d’adipokines, telles que la leptine ou l’adiponectine, est reliée à la quantité de tissu adipeux et se révèle importante lors du développement de cellule cancéreuse chez les personnes en situation d’obésité. |
L’obésité est associée à un risque accru de développement du cancer du sein après la ménopause, mais aussi à un mauvais pronostic et à une mauvaise réponse au traitement [4, 5]. L’obésité est définie par un IMC supérieur à 30 kg/m². Une expansion pathologique du tissu adipeux blanc se met en place, caractérisée par une hypertrophie et une hyperplasie des adipocytes, favorisant l’hypoxie, la production d’espèces réactives de l’oxygène et de cytokines pro-inflammatoires [4]. L’hypertrophie des adipocytes entraine leur nécrose et un stimulus phagocytaire important. L’inflammation accrue dans le tissu adipeux modifie le phénotype des cellules immunitaires résidentes. Les macrophages s’infiltrent et forment des structures caractéristiques en couronne (
crown-like
) autour des adipocytes nécrosés. Ces macrophages de type 1 jouent un rôle clé dans l’inflammation chronique et la résistance à l’insuline. Une corrélation positive existe entre le nombre et la taille des adipocytes et l’obésité. Ainsi, le tissu adipeux d’une personne obèse devient la principale source de cytokines pro-inflammatoires comme l’IL-6, le LIF (
leucocyte inhibitory factor
), le TNF-α et l’IL-1, au dépend des cytokines anti-inflammatoires de type 2 comme l’IL-4, l’IL-5 ou l’IL-10, dont les taux sont diminués [9]. L’inflammation favorise l’expression du gène
CYP19
et l’activité de l’aromatase au sein du tissu adipeux, augmentant localement la production d’œstradiol [3, 4]. Ces altérations et sécrétions favorisent le développement du cancer et la mortalité qui s’ensuit. Un transfert de triglycérides des adipocytes vers les cellules cancéreuses se met en place, augmentant le potentiel métastatique [10]. L’AP et la mobilité constituent une stratégie fondamentale de lutte contre l’obésité et le cancer du sein.
|
La mobilité et l’activité physique Si l’on tient compte du seuil que représente la ménopause dans la vie d’une femme, l’AP réduit le risque de cancer du sein de 27 % avant la ménopause et de 31 % après celle-ci [11, 12]. Une relation dose-réponse entre l’AP et le risque de développer un cancer du sein a été démontré et la réduction moyenne est estimée à 25 % [12]. L’impact de l’AP sur la cancérogenèse est fondé sur la modulation des hormones sexuelles, de l’insuline, des marqueurs inflammatoires et de la fonction immunitaire [13]. Indépendamment du statut ménopausique et de l’IMC, l’AP est associée à une diminution des niveaux d’œstrogènes, entraînant un effet antiprolifératif dès un niveau d’AP modérée [12]. Les muscles squelettiques, qui représentent environ 40 % du poids total du corps, jouent un rôle important dans la régulation du métabolisme énergétique. Lors d’un exercice, les muscles vont augmenter leur consommation d’énergie. Des exercices réguliers vont favoriser à terme une élévation du métabolisme, avec une réduction de l’adiposité et une meilleure sensibilité à l’insuline.
Un autre rôle important de l’AP est la réduction de l’inflammation observée dans l’obésité ou lors du vieillissement [2]. La pratique d’une AP régulière diminue l’inflammation et la réponse au stress, notamment par la sécrétion de myokines anti-inflammatoire, comme l’IL-10 ou l’IL-2, [14] qui diminuent en retour la sécrétion de cytokines pro-inflammatoires telles que l’IL-6 ou MCP (
monocyte chemoattractant protein
)-1. Or l’inflammation est liée à tous les événements impliqués dans le développement et la progression du cancer. Cependant, les effets bénéfiques de l’AP sur l’inflammation causée par le cancer ne sont pas encore totalement établis. Dans les modèles de cancer du sein chez les rongeurs, l’AP imposée réduit le taux sérique des médiateurs de l’inflammation comme l’IL-6 après 20 semaines d’entraînements, et est associée à une croissance tumorale plus lente [14]. Les preuves épidémiologiques de l’importance des taux sanguins d’IL-6 et de TNF-α dans la croissance tumorale sont moins convaincantes, notamment du fait de la difficulté à évaluer l’adéquation entre le comportement du patient et l’AP proposée [14].
En ce qui concerne le système immunitaire, les effets anti-inflammatoires de l’AP se traduisent par une baisse du nombre de monocytes pro-inflammatoires circulants au profit de lymphocytes T régulateurs. L’immunité à médiation cellulaire est favorisée avec l’augmentation du nombre de macrophages et de lymphocytes T cytotoxiques. L’AP est capable de renforcer les défenses immunitaires anti-tumorales et de ralentir l’immunosénescence [2]. La littérature suggère que l’AP, grâce à ses effets anti-inflammatoires et immunomodulateurs, est bénéfique pour prévenir le développement du cancer du sein après la ménopause chez les femmes obèses, que ce soit en prévention primaire, secondaire ou tertiaire [15]. Malgré ces données, peu de recherches ont été menées sur l’évolution du système immunitaire dans cette situation. |
Notre projet : explorer l’impact de l’activité physique sur la croissance tumorale
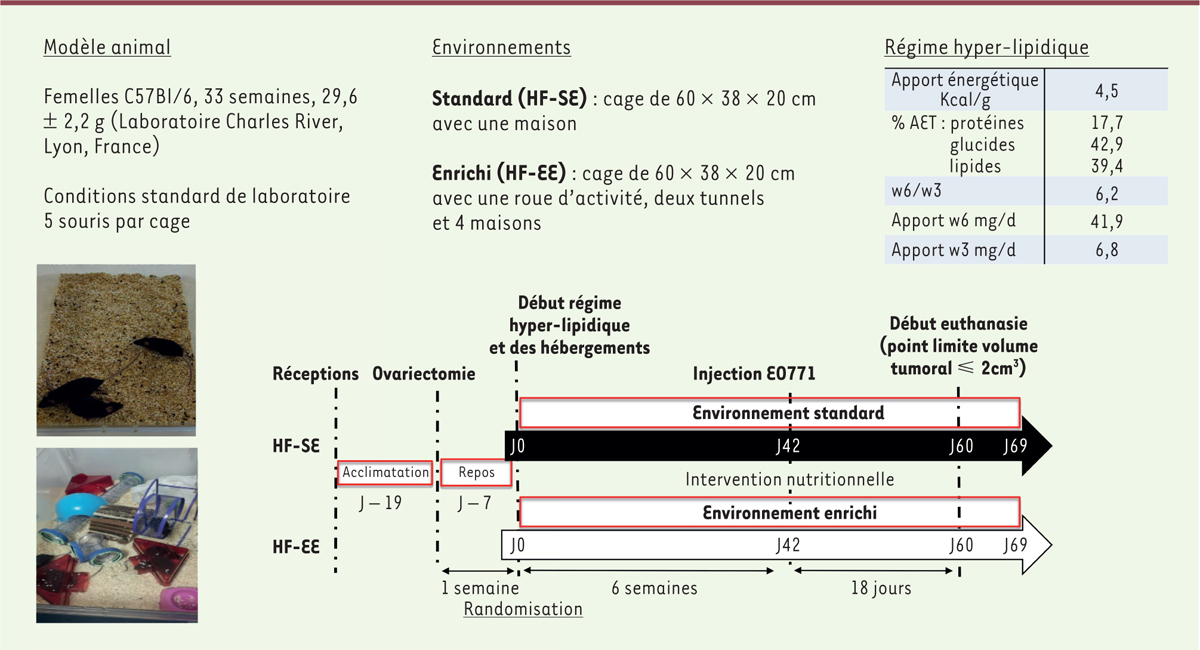
Notre objectif est d’explorer l’impact de l’AP spontanée sur l’environnement tissulaire mammaire dans un modèle de croissance tumorale
(
Figure 1
)
. Des souris C57Bl/6, âgées de 33 semaines, sont ovariectomisées et nourries avec un régime riche en graisses. Les souris sont séparées en deux groupes suivant leur mode d’hébergement : tandard (SE,
standard environment
), proche de la sédentarité, ou enrichi (EE,
enriched environment
) qui favorise une AP spontanée. Après six semaines, des cellules néoplasiques EO771 (issues d’une lignée d’adénocarcinome médullaire spontanée de souris C57Bl/6) sont implantées dans le fat-pad de la quatrième glande mammaire gauche (5 × 10
5
cellules dans 100 µl de matrigel). Le point limite de la croissance tumorale est fixé à 2 cm
3
. Les cytokines et les chimiokines sont alors analysées dans le micro-environnement tumoral, la glande mammaire controlatérale, le tissu adipeux inguinal et le muscle gastrocnémien. Au cours de l’expérimentation, le volume tumoral a été mesuré avec un pieds à coulisse grâce à la formule V = 4/3π × (largeur/2)
2
× (longueur/2). L’AP a été mesurée grâce à la calorimétrie indirecte avec le système TSE PhenoMaster/LabMaster.
 | Figure 1.
Matériel et méthodes.
|
Après euthanasie et ponction cardiaque des souris, le sang a été centrifugé pour récupérer le plasma et les tissus ont été prélevés et stockés à – 80 °C jusqu’à analyse. Les cytokines ont été dosées par une technique multiplex (kit Miliplex) à partir du broyat de tissu ou du plasma dilué de façon appropriée.
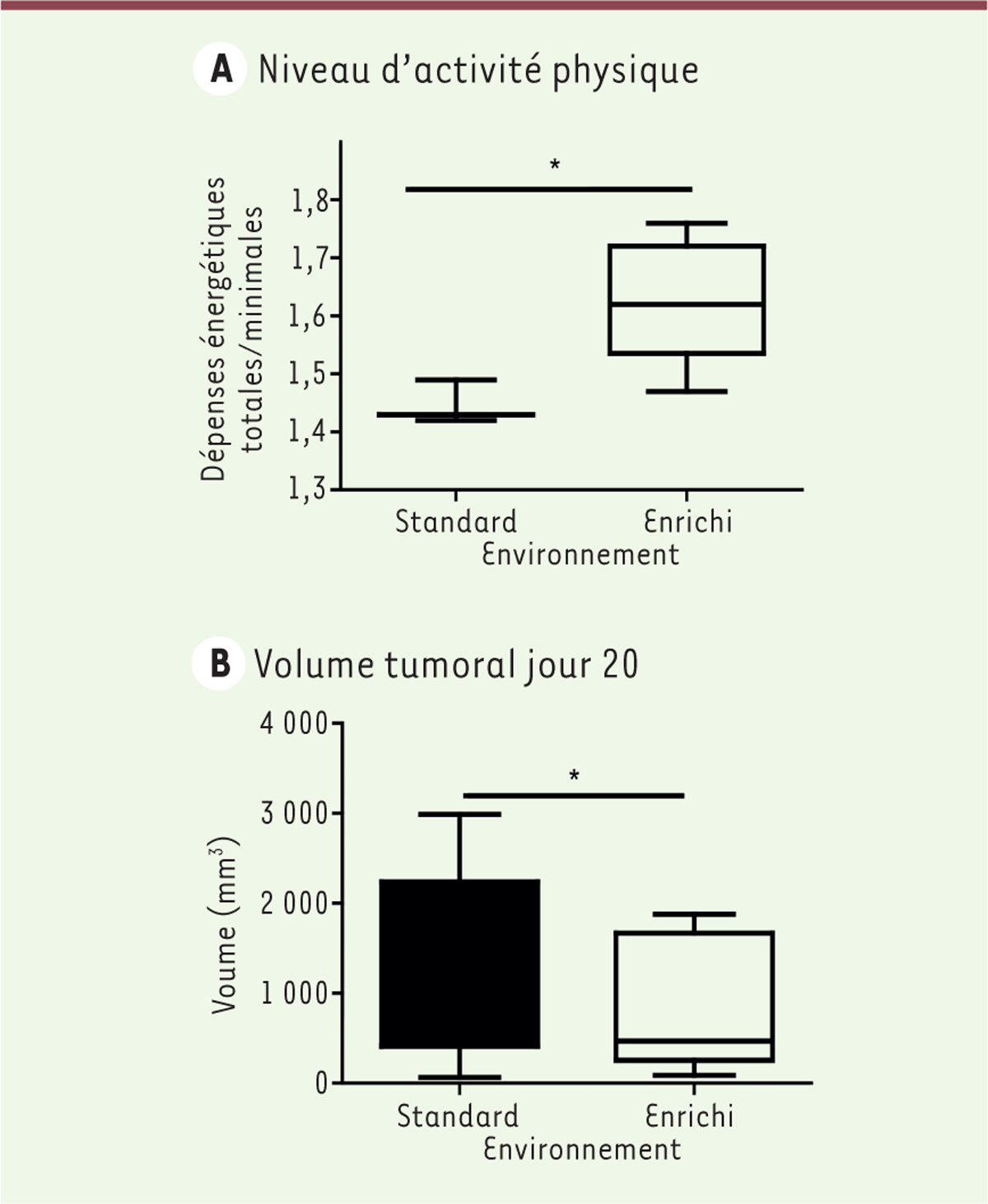
Nos premiers résultats montrent que l’EE augmente le niveau d’AP comparé au SE
(
Figure 2A
)
et l’AP ralentit la croissance tumorale. Vingt jours après l’implantation des cellules EO771, le volume tumoral est de 634 ± 388 mm³ en EE contre 1 572 ± 678 mm³ en SE
(
Figure 2B
)
. Ce modèle animal confirme donc les observations de la littérature sur l’intérêt de l’AP pour limiter la croissance tumorale mammaire.
 | Figure 2.
Volume tumoral et niveau d’activité physique. A. Niveau d’activité physique en fonction de l’environnement.
Les résultats sont représentés comme étant la dépense énergétique totale divisée par la dépense énergétique minimale [moyenne ± SEM (
standard error of the mean
(Ou erreur standard sur la moyenne.))] (
n
= 10 animaux/groupe).
B. Volume tumoral en fonction de l’environnement 20 jours après implantation des cellules EO771.
Les résultats sont exprimés comme la moyenne ± SEM (
n
= 10 animaux/groupe). Un test statistique de Mann-Whitney a été utilisé [standard (SE)
versus
enrichi (EE)] pour analyser ces résultats. *
p
< 0.05 est considéré comme étant significatif.
|
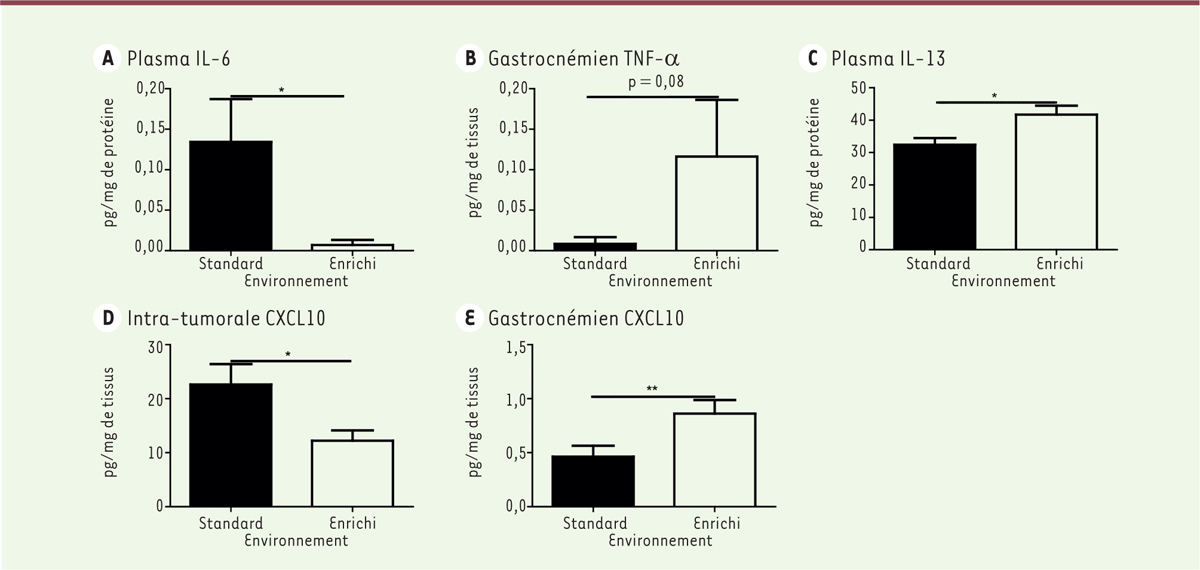
L’AP spontanée induit une baisse de la quantité d’IL-6 circulante, mais est accompagnée d’une tendance à l’augmentation de la quantité de TNF-α dans le muscle gastrocnémien
(Figures 3A et 3B)
. En ce qui concerne les cytokines anti-inflammatoires, la quantité d’IL-13 par mg de protéines plamsatiques est augmentée
(
Figure 3C
)
, favorisant l’accroissement du nombre de lymphocytes Thelper 2 (Th2). Ces résultats sont en accord avec la littérature où l’AP augmente de manière transitoire la sécrétion de cytokines pro-inflammatoires au sein des muscles, mais induit par la suite une réponse systémique anti-inflammatoire [15]. Une baisse de la quantité de CXCL (
C-X-C motif chemokine
)10 est observée dans les masses tumorales, alors qu’elle augmente dans le muscle gastrocnémien
(Figures 3D et 3E)
. Cette observation confirme l’importance des microenvironnements tissulaires dans la régulation des recrutements cellulaires et nécessite des investigations plus détaillées. Par ailleurs, la chimiokine CXCL10 est sécrétée en réponse à l’INF (interféron)-γ et au TNF-α. Nos résultats sont en accord avec la littérature puisque l’augmentation du TNF-α est associée à une augmentation de CXCL10 dans le muscle gastrocnémien en EE comparé au SE.
 | Figure 3.
Taux de cytokines dans le plasma et les tissus. A.
Quantités d’IL-6 par mg de protéines totales plasmatiques.
B.
Quantités de TNF-α par mg de muscle gastrocnémien.
C.
Quantités d’IL-13 par mg de protéines totales plasmatiques.
D.
Quantités de CXCL10 intra-tumoral par mg de tissu.
E.
Quantités de CXCL10 par mg de muscle gastrocnémien. Tous les résultats (A-E) sont exprimés sous forme de moyennes ± SEM (
n
= 6 animaux/groupe). Un test statistique de Mann-Whitney a été utilisé [standard (SE)
versus
enrichi (EE)] pour analyser ces résultats. *
p
< 0.05 est considéré comme étant significatif.
|
|
Une conclusion et des perspectives…
De nos jours, un nombre croissant de données suggère le rôle positif de l’AP dans le cancer du sein, notamment chez les patientes obèses, sans mécanisme clairement identifié. Nos résultats préliminaires suggèrent que l’AP spontanée permet de réduire la croissance tumorale mammaire dans le modèle murin utilisé. Cela semble passer par un effet anti-inflammatoire global et une régulation tissu-pécifique. Le modèle animal que nous utilisons, et à partir duquel nos premières données expérimentales sont cohérentes avec la littérature, permettra l’étude plus précise des mécanismes impliqués, notamment sur les échanges survenant entres tissus, dans des situations de prévention primaire ou secondaire et vis-à-vis d’intensités d’activités physiques différentes. Ces résultats pourraient permettre une adaptation plus fine de l’AP chez les personnes en situation d’obésité. Nous émettons l’hypothèse que l’AP a un effet anti-inflammatoire également au sein de la tumeur et des tissus immunitaires secondaires comme le thymus ou les ganglions inguinaux. Nous nous attendons à observer un recrutement plus important au sein de la tumeur de cellules immunitaires de type 2 comme les lymphocytes T régulateurs,
helper
ou les macrophages de type 2 pour l’EE comparé au SE, et cela en corrélation avec l’intensité d’AP.‡
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Patterson
RE
,
Cadmus
LA
,
Emond
JA
,
et al.
Physical activity, diet, adiposity and female breast cancer prognosis: a review of the epidemiologic literature.
.
Maturitas.
2010;
;
66
:
:5.
–
15
.
2.
Weyh
C
,
Krüger
K
,
Strasser
B
.
Physical activity and diet shape the immune system during aging.
.
Nutrients.
2020;
;
12
:
:622.
.
3.
Leeners
B
,
Geary
N
,
Tobler
PN
,
Asarian
L
.
Ovarian hormones and obesity.
.
Hum Reprod Update.
2017;
;
23
:
:300.
–
321
.
4.
Engin
AB
,
Engin
A
,
Gonul
II
.
The effect of adipocyte-macrophage cross-talk in obesity-related breast cancer.
.
J Mol Endocrinol.
2019;
;
63
:
:R201.
–
R222
.
5.
World Cancer Research Fund/American Institute for Cancer Research.
.
Diet, nutrition, physical activity and cancer : A global perspective. Continous update.
.
Project Expert Report.
2018
.
Available at
dietandcancerreport.org
.
.
6.
Sofi
NY
,
Jain
M
,
Kapil
U
,
et al.
Reproductive factors, nutritional status and serum 25(OH)D levels in women with breast cancer: a case control study.
.
J Steroid Biochem Mol Biol.
2018;
;
175
:
:200.
–
204
.
7.
Shiovitz
S
,
Korde
LA
.
Genetics of breast cancer: a topic in evolution.
.
Ann Oncol.
2015;
;
26
:
:1291.
–
1299
.
8.
Collaborative Group on Hormonal Factors in Breast Cancer.
Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease.
.
Lancet.
2002;
;
360
:
:187.
–
195
.
9.
Spyrou
N
,
Avgerinos
KI
,
Mantzoros
CS
,
et al.
Classic and novel adipocytokines at the intersection of obesity and cancer: diagnostic and therapeutic strategies.
.
Curr Obes Rep.
2018;
;
7
:
:260.
–
275
.
10.
Himbert
C
,
Delphan
M
,
Scherer
D
,
et al.
Signals from the adipose microenvironment and the obesity-cancer link: a systematic review.
.
Cancer Prev Res.
2017;
;
10
:
:494.
–
506
.
11.
Brown
JC
,
Winters-tone
K
,
Lee
A
,
et al.
Cancer, physical activity, and exercise.
.
Compr Physiol.
2012;
;
2
:
:2775.
–
2809
.
12.
Ennour-Idrissi
K
,
Maunsell
E
,
Diorio
C
.
Effect of physical activity on sex hormones in women: a systematic review and meta-analysis of randomized controlled trials.
.
Breast Cancer Res.
2015;
;
17
:
:139.
.
13.
Kang
DW
,
Lee
J
,
Suh
SH
,
et al.
Effects of exercise on insulin, IGF axis, adipocytokines, and inflammatory markers in breast cancer survivors: a systematic review and meta-analysis.
.
Cancer Epidemiol. Biomark Prev.
2017;
;
26
:
:355.
–
365
.
14.
Dalamaga
M.
.
Interplay of adipokines and myokines in cancer pathophysiology: emerging therapeutic implications.
.
World J Exp Med.
2013;
;
3
:
:26.
–
33
.
15.
Le Guennec
D
,
Rossary
A
.
The interrelationship between physical activity and metabolic regulation of breast cancer progression in obesity via cytokine control.
.
Cytokine Growth Factor Rev.
2020;
;
52
:
:76.
–
87
.
|