| |
| Med Sci (Paris). 36: 23–27. doi: 10.1051/medsci/2020192.
Impact des bioinsecticides à base de
Bacillus thuringiensis
sur le développement de cancers de l’intestin
Aurélia Joly,1a Julie Soltys,1b Armel Gallet,1c and Raphaël Rousset1d 1Équipe « Bioinsecticides, Environnement et Santé », Université Côte d’Azur, CNRS, INRAE, ISA
,
France MeSH keywords: Animaux, Bacillus thuringiensis, Agents de lutte biologique, Humains, Insecticides, Tumeurs de l'intestin, Lutte biologique contre les nuisibles, Facteurs de risque, physiologie, effets indésirables, épidémiologie, étiologie, méthodes |
L’intestin moyen de drosophile comme modèle d’étude
L’intestin est un organe vital qui, en plus de remplir les fonctions de digestion et d’absorption des nutriments, constitue la principale barrière face aux agresseurs ingérés avec la nourriture. Ceux-ci peuvent être de différente nature, comme par exemple des agents biologiques pathogènes (virus, bactéries, toxines) ou des produits chimiques (médicaments, pesticides, polluants). Il est crucial pour l’organisme que cet organe, malgré son activité quotidienne intense et les attaques qu’il subit, demeure intègre. L’intestin a ainsi développé une capacité phénoménale de renouvellement, qui est de quelques jours chez les mammifères et de deux semaines environ chez les insectes. Il est pourvu pour cela de cellules souches intestinales (
intestinal stem cells
ou ISC) qui sont par définition indifférenciées et qui résident au sein même du tissu. Ces ISC adaptent leur prolifération et leur différenciation afin de renouveler les cellules endommagées ou mortes de l’intestin, tout en limitant le risque de développer des cancers.
De par ses similitudes structurelles et fonctionnelles avec celui des vertébrés, l’intestin de drosophile sert de modèle pour l’étude des processus d’homéostasie (équilibre cellulaire et physiologique en condition normale) et de régénération [1]. Son extrémité antérieure est l’équivalent de l’œsophage des mammifères, l’intestin moyen correspond à l’intestin grêle et la partie postérieure au colon
(
Figure 1A
)
. L’intestin moyen/grêle fait l’objet de nombreuses études du fait de son rôle crucial dans l’absorption des nutriments et la réponse immune. Il est colonisé par un ensemble de bactéries composant le microbiote intestinal, avec lequel il entretient une relation mutualistique où chacune des deux parties en tire des bénéfices. Malgré des similitudes morphologiques et fonctionnelles, quelques différences subsistent entre l’intestin moyen de la drosophile et l’intestin grêle des mammifères. Alors que l’épithélium de l’intestin grêle s’organise en cryptes et en villosités, l’épithélium intestinal de drosophile est plat
(
Figure 1A
)
. Ce dernier ne produit pas de mucus, mais, comme chez tous les insectes, possède à la place une membrane péritrophique. Les ISC se divisent en fonction des besoins de façon symétrique, pour générer deux ISC ou deux précurseurs, ou asymétrique pour donner une ISC et un précurseur. Il existe deux types de lignées de cellules différenciées issues de la division des ISC : la lignée des entérocytes (EC) et celle des cellules sécrétrices
(
Figure 1B
)
. Alors que les EC sont responsables principalement de la production des enzymes digestives et l’absorption des nutriments, les cellules sécrétrices se distinguent par différentes fonctions chez les mammifères : la sécrétion de peptides antimicrobiens par les cellules de Paneth, la sécrétion de mucus par les cellules goblet, la sécrétion d’interleukines par les cellules tuft et la sécrétion d’hormones par les cellules entéroendocrines (EEC). Chez la drosophile, les cellules de Paneth, goblet et tuft sont absentes et leurs fonctions sont en grande partie assurées par les EC et EEC. Cependant, certaines fonctions précises sont assurées par d’autres cellules. Ainsi, les cellules du proventricule, situées à l’extrémité antérieure de l’intestin moyen, sécrètent des molécules (mucines) de la membrane péritrophique qui sont similaires à celles du mucus sécrétées par les cellules goblet chez les mammifères.
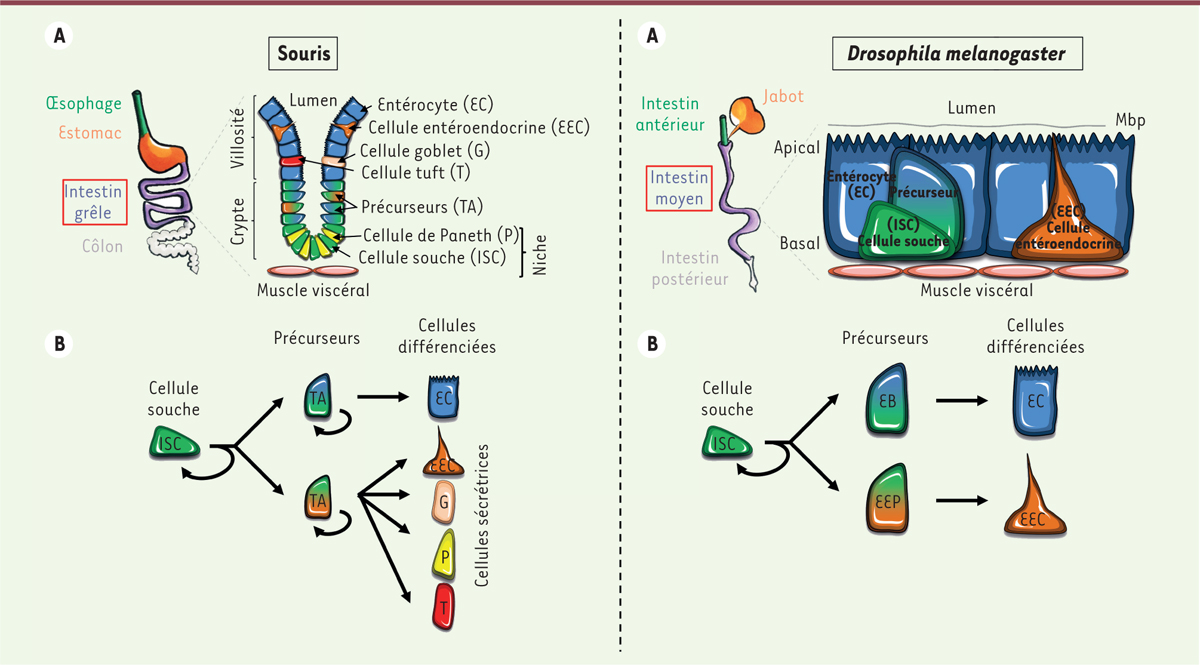
 | Figure 1.
Organisation tissulaire et cellulaire (A) et lignage issu des cellules souches (B) de l’intestin grêle de souris (à gauche) et de l’intestin moyen de drosophile (à droite). A.
L’intestin grêle chez la souris est organisé en une succession de cryptes et villosités. Les ISC sont localisées à la base des cryptes, qui fournit tous les signaux nécessaires au bon fonctionnement des cellules souches (niche). Les cellules différenciées issues de la division des ISC migrent au sommet des villosités, à l’exception des cellules de Paneth qui restent dans la crypte. Chez la drosophile, l’intestin moyen est plat. Les ISC restent cependant localisées au niveau basal.
B.
La division asymétrique des ISC permet un renouvellement de la cellule souche pour maintenir un
pool
constant (flèche de retour), et la génération d’un précurseur, soit de la lignée entérocyte, soit de la lignée entéroendocrine. Les précurseurs TA de mammifères possèdent également des capacités prolifératives (flèches de retour). Voir le texte principal pour les détails. ISC :
Intestinal Stem Cell
; TA :
Transit-Amplifying cells
; EC : entérocyte ; EEC : cellule entéroendocrine ; G : cellule goblet ; P : cellule de Paneth ; T : cellule tuft ; EB : entéroblaste ; EEP : précurseur EEC ; mbp : membrane péritrophique.
|
Plusieurs voies de signalisation conservées (Wnt/Wg,
Wingless integration/Wingless
; BMP,
Bone Morphogenetic Pathway
; TNF-a,
Tumor Necrosis Factor alpha
; JNK,
c-Jun N-terminal Kinase
; JAK/STAT,
Janus Kinase/Signal Transducers and Activators of Transcription
; Notch ; EGFR,
Epidermal Growth Factor Receptor
; Hippo/Yorkie) régulent l’homéostasie et la régénération de l’épithélium intestinal en contrôlant la prolifération, la différenciation, l’inflammation et la mort cellulaire [1]. La dérégulation de ces voies est très souvent impliquée dans le développement de pathologies inflammatoires et tumorales
(
Figure 2
)
. L’activation de la voie du TNF-a est ainsi un facteur important dans l’apparition des maladies inflammatoires de l’intestin (colite ulcéreuse, maladie de Crohn) [2]. Des mutations du gène
APC
(
Adenomatous Polyposis Coli
) dans la voie Wnt/Wg, de Ras dans la voie de l’EGFR et de p53 sont les plus fréquentes et mènent au développement de tumeurs de l’intestin, notamment la polypose adénomateuse familiale (qui précède le développement tumoral dans la quasi-totalité des cas) et le cancer colorectal [3]. Il a été montré à la fois chez la souris et la drosophile que les cellules qui sont à l’origine de cette tumorigenèse sont les ISC [4,5]. L’inflammation est un élément clé au développement de cancers, permettant sa progression de la dysplasie à la tumorigenèse
(
Figure 2
)
. Il s’avère donc important de contrôler les mécanismes inflammatoires afin qu’ils ne deviennent pas chroniques. Lors d’infections, la présence dans l’intestin de bactéries allochtones (provenant de l’extérieur et n’appartenant pas au microbiote intestinal) est rapidement détectée, ce qui conduit à la mise en place d’une réaction immunitaire inflammatoire transitoire qui est bénéfique afin de se débarrasser de l’agresseur
(
Figure 2
)
. Il est désormais bien établi que cette inflammation augmente le risque de cancers, comme en témoigne la bactérie
Helicobacter pylori
dans le cadre de cancers gastriques [6]. Une étude a par ailleurs montré que l’infection par la bactérie opportuniste
Pseudomonas aeruginosa
(retrouvée chez l’homme) de drosophiles possédant une forme latente de l’oncogène Ras induisait une dysplasie de l’intestin, révélant une synergie entre infection bactérienne et prédisposition génétique [7]. Chez la drosophile, la dysplasie est un dysfonctionnement provoqué par une augmentation de l’activité de la voie JNK, se caractérisant par une hyper-prolifération des ISC et leur mauvaise différenciation [8]. Le développement de dysplasies de l’intestin devient fréquent avec l’âge. En effet, lors du vieillissement, apparait une perte de diversité du microbiote, notamment de bactéries bénéfiques, ce qui provoque un déséquilibre (dysbiose) en faveur de bactéries pro-inflammatoires. Cette dysbiose entraine une activation chronique de plusieurs voies de signalisation inflammatoires, notamment les voies NF-kB (
nuclear factor-kappa B
) et JNK [9]. Ainsi, bactéries, inflammation, dysplasie et cancer sont étroitement liés, mettant en lumière l’importance de l’équilibre cellulaire et physiologique des cellules intestinales.
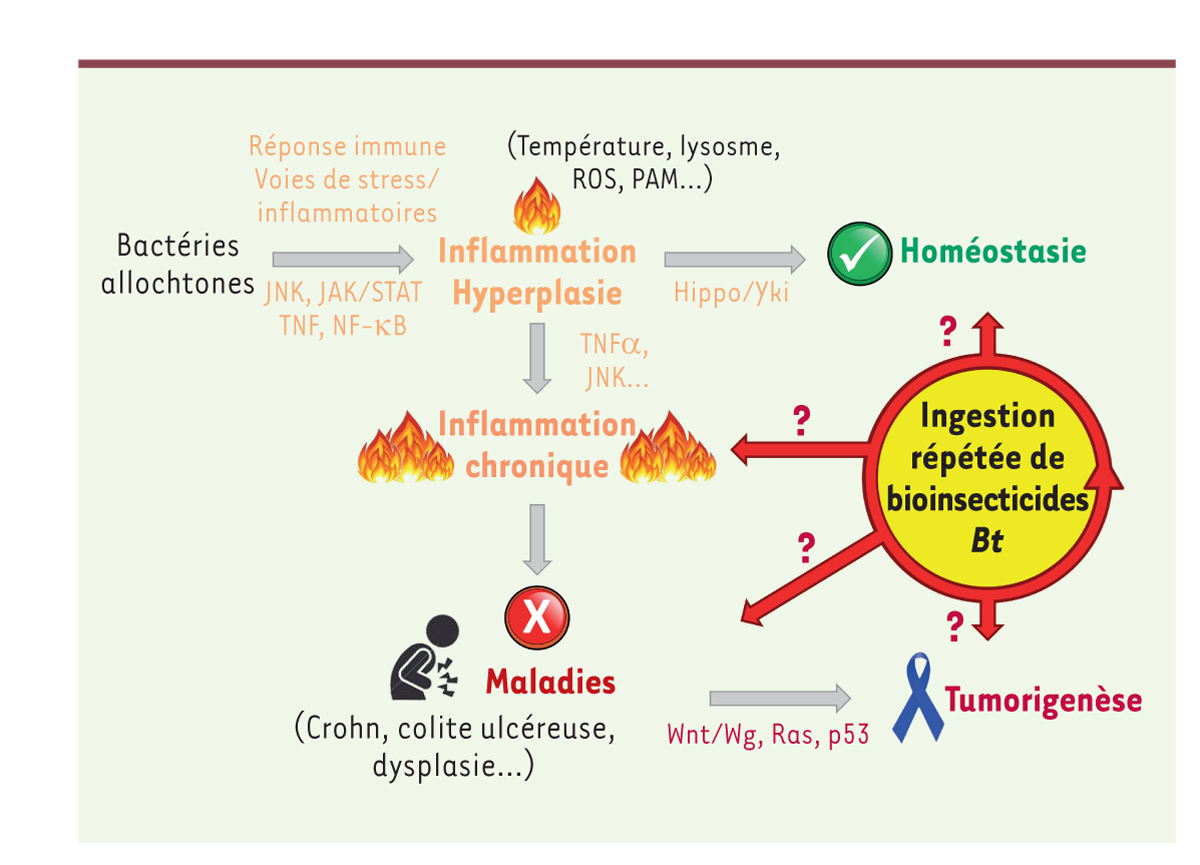
 | Figure 2.
Réponse intestinale à des infections bactériennes.
L’intestin met en place une réaction inflammatoire transitoire afin de combattre les bactéries allochtones. Dans certains cas, une inflammation chronique se développe, qui débouche sur des maladies intestinales (maladie de Crohn, colite ulcéreuse, dysplasie, etc.), voire des cancers. Notre projet est d’évaluer si l’ingestion chronique de bioinsecticides à base de la bactérie
Bacillus thuringiensis
(
Bt
) pourrait déclencher ou renforcer cette voie pathologique. Voir le texte principal pour les détails. ROS : espèces réactives d’oxygène ; PAM : peptides antimicrobiens.
|
|
Les bioinsecticides à base de Bacillus thuringiensis
Face aux incitations à réduire l’utilisation des pesticides chimiques (tel que le plan EcoPhyto II en France
1
), celle des bioinsecticides ne cesse de croître en compensation pour lutter contre les nuisibles. Parmi eux, ceux à base de spores de la bactérie allochtone
Bacillus thuringiensis
(
Bt
) représentent le second insecticide le plus vendu (75% des bioinsecticides et 4% du marché global des insecticides en 2018, représentant plus de 32 000 tonnes/an). Ces produits permettent de lutter notamment contre les larves de la famille des lépidoptères (chenilles de papillons) qui attaquent les cultures maraîchères (choux, tomates, maïs etc.).
Bt
est une bactérie Gram-positive sporulante appartenant au groupe
B. cereus
,
Bt
et
B. cereus
étant très proches génétiquement. À l’instar de
B. cereus
,
Bt
possède les mêmes gènes codant les entérotoxines responsables des syndromes diarrhéiques [10].
Bt
se distingue de
B. cereus
par son pouvoir entomopathogène dû à la présence dans la spore, forme résistante qu’adopte la bactérie en condition défavorable, d’un corps d’inclusion cristallin contenant des toxines appelées Cry. La cible des bioinsecticides
Bt
, composés de la bactérie sous forme de spores et des cristaux Cry, est le tube intestinal des ravageurs. Après ingestion, les cristaux sont solubilisés, libérant les toxines Cry dans l’intestin. Une fois activées par des enzymes protéolytiques digestives, elles se lient à des récepteurs de types cadhérines, amino-peptidases, phosphatases alcalines et transporteurs à «
ATP Binding Cassette
» (également appelés « transporteurs ABC »). Ces interactions spécifiques entrainent la formation de pores dans l’épithélium intestinal. Les bactéries
Bt
végétatives qui ont germé peuvent alors traverser la barrière intestinale pour se multiplier dans le milieu intérieur, ce qui provoque une septicémie. Après son ingestion,
Bt
tue le ravageur, appelé alors sensible ou cible, en deux à trois jours.
L’accroissement actuel de l’utilisation des bioinsecticides augmente la présence des spores de
Bt
dans l’environnement et dans l’alimentation. Bien que des études aient montré l’innocuité de
Bt
pour des organismes non-cibles (insectes non-ensibles et vertébrés) sur une courte période (toxicité aiguë) [11], les effets indésirables potentiels d’une exposition à long terme (toxicité chronique) ne sont pas connus. Le groupe
B. cereus
est responsable de nombreuses intoxications alimentaires, qui sont largement attribuées à
B. cereus
lui-même. Cependant, l’agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses ; Saisine n° 2013-A-0039) et l’autorité européenne de sécurité des aliments (EFSA ; EFSA-Q-2015-00254) soulignent le manque d’études sur les effets à long terme de
Bt
et sur la probable sous-estimation de l’implication de
Bt
dans des toxi-infections alimentaires. Une étude récente vient de montrer que plusieurs souches
Bt
provenant de biopesticides commerciaux ont été retrouvées dans des aliments associés à des intoxications humaines [10]. Deux études de cohortes de grande envergure (623 080 femmes au Royaume-Uni, et 68 946 femmes/hommes en France) se sont attachées à estimer l’impact de la nourriture issue de l’agriculture biologique (« bio ») sur la santé humaine [12, 13]. Les deux études ont trouvé une baisse de l’incidence des lymphomes non-hodgkiniens, pour lesquels les pesticides sont un facteur à risque. L’étude d’outre-Manche a montré de plus une augmentation de l’incidence du cancer du sein (post-ménopausé) associée à la consommation « bio ». En revanche, manger de la nourriture « bio », plutôt que des aliments traités en agriculture conventionnelle (avec pesticides), n’induit pas d’amélioration sur le développement du cancer colorectal. Cela soulève donc la question quant à l’effet potentiellement néfaste de l’exposition aux biopesticides sur ce type de cancers. Ces résultats souffrent cependant de la limite des études épidémiologiques impliquant une multiplicité des facteurs et de leurs interactions possibles. Par exemple, le style/condition de vie et la qualité nutritionnelle ne sont pas les mêmes pour les consommateurs de produits « bio » par rapport à la population générale, rendant difficile les conclusions quant au facteur véritablement déterminant. Une autre étude a utilisé le modèle drosophile pour évaluer l’effet de la nourriture « bio » sur la santé, et a montré un bénéfice pour certains critères de vie tels que la longévité et la fertilité [14]. Cependant, tout comme les deux études épidémiologiques décrites ci-dessus, le traitement d’origine des produits n’est pas contrôlé. De plus, les mouches ont été élevées sur des milieux contenant exclusivement des extraits de fruits/légumes « bio » ou conventionnels, c’est-à-dire sans complément nutritif additionnel, ce qui ne correspond pas à une nourriture optimale de la mouche (notamment au niveau protéique). Ainsi, mêmes les mouches nourries avec des fruits ou légumes conventionnels montrent une durée de vie limitée et une fertilité réduite par rapport à des mouches élevées sur un milieu traditionnel de laboratoire. Toutes ces études présentent donc une certaine limite, et il apparaît nécessaire de développer un modèle d’étude qui permette d’évaluer de manière contrôlée l’impact à long terme des bioinsecticides, notamment ceux à base de
Bt
qui sont largement majoritaires.
|
Notre projet de recherche
Notre projet de recherche est d’étudier les impacts d’une prise alimentaire quotidienne de spores de
Bt
(bioinsecticides commerciaux) sur le développement de maladies inflammatoires et de cancers de l’intestin grâce à la drosophile (
Drosophila melanogaster
)
(
Figure 2
)
. Ce modèle « insecte » présente l’avantage de ne pas être sensible à la toxicité aiguë des spores de
Bt
et de ses toxines, ce qui nous permet d’analyser les effets de l’exposition chronique à long terme. Des travaux antérieurs de l’équipe ont montré que l’ingestion ponctuelle de faibles quantités de bactéries
Bt
végétatives (forme proliférative) induisait, via les voies de signalisation JNK, JAK/STAT et Hippo/Yorkie, une augmentation transitoire du nombre de cellules (hyperplasie), compromettant la physiologie de l’intestin adulte [15]. Afin de mimer au mieux une exposition naturelle, notre équipe a développé un protocole d’intoxication chronique utilisant une dose de bioinsecticides commerciaux qui correspond à la quantité de spores
Bt
retrouvée sur les légumes après traitement (dose environnementale d’épandage). Nous utilisons ce protocole pour évaluer l’impact de l’ingestion chronique des bioinsecticides
Bt
sur la longévité et la physiologie intestinale des mouches, en focalisant notre étude sur des drosophiles adultes matures, mais également sur des drosophiles fragiles, c’est-à-dire nouvellement écloses (mouches immatures), âgées ou encore ayant des prédispositions génétiques à développer des pathologies intestinales, puisque ces facteurs pourraient se révéler aggravant pour l’intoxication par
Bt
. Nous étudions à partir de ces différentes populations si l’ingestion chronique de
Bt
avec la nourriture affecte leur durée de vie, ainsi que la morphologie et la physiologie de leur intestin. Grâce à des techniques de biologie cellulaire, nous regardons après dissection des intestins si la structure, la composition cellulaire et l’organisation intercellulaire au sein du tissu sont affectées, et si oui quels peuvent en être les mécanismes.
L’utilisation de la drosophile permettra d’aborder cette problématique d’un point de vue génétique, moléculaire, cellulaire et physiologique. La conservation des mécanismes régissant l’homéostasie, l’inflammation et la réponse immunitaire de l’intestin suggère que, si impact il y a,
Bt
pourrait avoir un effet semblable chez les mammifères, dont l’homme. Il sera ainsi intéressant d’analyser les effets des produits
Bt
chez d’autres modèles animaux tels que la souris. Ces travaux permettront à terme de déterminer si une inflammation induite de façon persistante par l’ingestion répétée de
Bt
via l’alimentation pourrait favoriser et/ou accélérer le développement de pathologies inflammatoires de l’intestin, voire des cancers
(
Figure 2
)
. Si tel est le cas, il sera important à l’avenir d’établir un seuil de quantité de
Bt
par gramme de fruits/légumes au-dessus duquel l’aliment serait impropre à la consommation afin d’optimiser les conditions d’usage des bioinsecticides
Bt
(dose d’épandage, nombre de traitements) et de consommation des denrées traitées (méthodes de lavage). De plus, il pourrait être préconisé aux personnes fragiles présentant déjà des pathologies inflammatoires intestinales d’être particulièrement attentives à la consommation de ces produits alimentaires « bio ». Enfin, nos travaux permettront également de renforcer les connaissances fondamentales sur la relation entre les bactéries allochtones, l’inflammation et le développement de tumeurs.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions tous les membres de notre équipe « Bioinsecticides, Environnement et Santé » pour leur aide et pour les échanges scientifiques fructueux sur notre projet.
Ce projet est soutenu par la Ligue Nationale Contre le Cancer (allocation doctorale d’Aurélia Joly, appel à projets 2018), par le PNR-EST ANSES & ECOPHYTO II (2017) et par la Fondation ARC pour la recherche sur le cancer (contrat N°20171206145). Ce travail bénéficie également d’une aide du gouvernement français, gérée par l’Agence Nationale de la Recherche au titre du projet Investissements d’Avenir UCAJEDI portant la référence n° ANR-15-IDEX-01.
|
Footnotes |
1.
Li
H
,
Jasper
H
.
Gastrointestinal stem cells in health and disease: from flies to humans.
.
Dis Model Mech.
2016;
;
9
:
:487.
–
499
.
2.
Ruder
B
,
Atreya
R
,
Becker
C
.
Tumour necrosis factor alpha in intestinal homeostasis and gut related diseases.
.
Int J Mol Sci.
2019;
;
20
:
3.
Poulin
EJ
,
Haigis
KM
.
No back seat for a progression event - K-RAS as a therapeutic target in CRC.
.
Genes Dev.
2017;
;
31
:
:333.
–
335
.
4.
Barker
N
,
Ridgway
RA
,
Van
Es JH
,
et al.
Crypt stem cells as the cells-of-origin of intestinal cancer.
.
Nature.
2009;
;
457
:
:608.
–
611
.
5.
Lee
WC
,
Beebe
K
,
Sudmeier
L
,
et al.
Adenomatous polyposis coli regulates Drosophila intestinal stem cell proliferation.
.
Development.
2009;
;
136
:
:2255.
–
2264
.
6.
de Martel
C
,
Franceschi
S
.
Infections and cancer: established associations and new hypotheses.
.
Crit Rev Oncol Hematol.
2009;
;
70
:
:183.
–
194
.
7.
Apidianakis
Y
,
Pitsouli
C
,
Perrimon
N
,
et al.
Synergy between bacterial infection and genetic predisposition in intestinal dysplasia.
.
Proc Natl Acad Sci USA.
2009;
;
106
:
:20883.
–
20888
.
8.
Biteau
B
,
Hochmuth
CE
,
Jasper
H
.
JNK activity in somatic stem cells causes loss of tissue homeostasis in the aging Drosophila gut.
.
Cell Stem Cell.
2008;
;
3
:
:442.
–
455
.
9.
Jasper
H
.
Intestinal stem cell aging: origins and interventions.
.
Annu Rev Physiol.
2020;
;
82
:
:203.
–
26
.
10.
Johler
S
,
Kalbhenn
EM
,
Heini
N
,
et al.
Enterotoxin production of Bacillus thuringiensis isolates from biopesticides, foods, and outbreaks.
.
Front Microbiol.
2018;
;
9
:
:1915.
.
11.
Rubio-Infante
N
,
Moreno-Fierros
L
.
An overview of the safety and biological effects of Bacillus thuringiensis Cry toxins in mammals.
.
J Appl Toxicol.
2016;
;
36
:
:630.
–
648
.
12.
Bradbury
KE
,
Balkwill
A
,
Spencer
EA
,
et al.
Organic food consumption and the incidence of cancer in a large prospective study of women in the United Kingdom.
.
Br J Cancer.
2014;
;
110
:
:2321.
–
2326
.
13.
Baudry
J
,
Assmann
KE
,
Touvier
M
,
et al.
Association of frequency of organic food consumption with cancer risk: findings from the NutriNet-anté prospective cohort study.
.
JAMA Intern Med.
2018;
;
178
:
:1597.
–
1606
.
14.
Chhabra
R
,
Kolli
S
,
Bauer
JH
.
Organically grown food provides health benefits to Drosophila melanogaster.
.
PLoS One.
2013;
;
8
:
15.
Loudhaief
R
,
Brun-Barale
A
,
Benguettat
O
,
et al.
Apoptosis restores cellular density by eliminating a physiologically or genetically induced excess of enterocytes in the Drosophila midgut.
.
Development.
2017;
;
144
:
:808.
–
819
.
|