| Med Sci (Paris). 36: 16–22. doi: 10.1051/medsci/2020190.Agriculture et hémopathies malignes chez l’adulte Quel rôle des expositions professionnelles aux pesticides ? Amandine Busson,1a Anne-Claire Gac,2b Bérengère Gruson,3c Matthieu Meryet-Figuière,4d Isabelle Baldi,5e Séverine Tual,4f and Pierre Lebailly4g 1Institut National de la Santé et de la Recherche Médicale (Inserm), Unité Mixte de Recherche (UMR) 1086 ANTICIPE ; Université de Caen Normandie, Esplanade de la Paix
,
14000Caen
,
France 2Centre Hospitalier Universitaire (CHU) de Caen, Institut d’hématologie de Basse-Normandie
,
avenue côte de Nacre
,
14000Caen
,
France 3Centre Hospitalier Universitaire (CHU) d’Amiens-Picardie, Service d’hématologie clinique et de thérapie cellulaire
,
30 avenue de la Croix Jourdain
,
80054Amiens Cedex 4
,
France 4Institut National de la Santé et de la Recherche Médicale (Inserm), Unité Mixte de Recherche (UMR) 1086 ANTICIPE, Université de Caen Normandie, Centre Régional de Lutte contre le Cancer François Baclesse
,
3 avenue du Général Harris
,
14076Caen Cedex 05
,
France 5Institut National de la Santé et de la Recherche Médicale (Inserm), Unité (U) 1219 EPICENE, ISPED, Bordeaux Population Health Centre de Recherche, Université de Bordeaux Case 11
,
146 rue Léo Saignat
,
33076Bordeaux Cedex
,
France
;
Centre Hospitalier Universitaire (CHU) de Bordeaux, Service de Médecine du Travail et Pathologies Professionnelles
,
Place Amélie Raba-Léon
,
33000Bordeaux
,
France MeSH keywords: Adulte, Âge de début, Agriculture, Agrochimie, Tumeurs hématologiques, Humains, Exposition professionnelle, Pesticides, Facteurs de risque, statistiques et données numériques, toxicité, épidémiologie, étiologie, effets indésirables, analyse |
Travail en milieu professionnel agricole
Depuis plus de 50 ans, l’hypothèse d’un lien entre expositions agricoles et survenue d’HM existe dans la littérature. Dès 1968, il a été montré que les agriculteurs californiens et les personnes habitant en zone rurale en Norvège présentaient de plus forts taux de mortalité pour certaines HM [
4
]. En 1992, une première méta-analyse généraliste montrait des élévations de risques de 5 % [IC95 % = 0,98-1,12] de LNH, de 12 % [IC95 % = 1,04-1,21] de MM, de 16 % [IC95 % = 1,03-1,29] de LH, et de 7 % [IC95 % = 1,03-1,11] de leucémies, en s’appuyant sur respectivement 14, 12, 12, et 23 études [
5
].
L’expertise collective « Pesticides et Santé » menée par l’Inserm [
2
] a identifié 9 méta-analyses sur les HM (LNH, MM, LH et leucémies) en milieu agricole, publiées entre 1995 et 2008. Celles-ci incluaient chacune de 6 à 50 études et montraient des élévations de risques en population agricole variant de 3 % [IC95 % = 0,96-1,12] à 39 % [IC95 % = 1,18-1,65] pour les LNH et/ou MM, de 9 % [IC95 % = 0,96-1,24] à 25 % [IC95 % = 1,11-1,42] pour les LH, et de 9 % [IC95 % = 1,00-1,19] à 10 % [IC95 % = 1,02-1,18] pour les leucémies, plus spécifiquement de 10 % [IC95 % = 0,97-1,26] pour les leucémies myéloïdes chroniques (LMC) et de 6 % [IC95 % = 0,97-1,16] pour les LAM. Par ailleurs, cette même expertise a rapporté les résultats de différentes grandes études prospectives, dont
l’agricultural health study
(AHS)
(
Tableau I
)
, qui indiquaient que la population agricole était plus à risque de développer des HM. Parmi elles, le projet NOCCA
(
Tableau I
)
a montré une augmentation du risque de LNH chez les agriculteurs (SIR
CLL
= 1,09 [IC95 % = 1,04-1,14] ; SIR
MM
= 1,07 [IC95 % = 1,03-1,11]) et chez les agricultrices (SIR
MM
= 1,14 [IC95 % = 1,05-1,24]) sur près de 15 millions d’individus étudiés résidant en Scandinavie [
6
].
Tableau I
| Nom (référence) |
Année d’inclusion ou de construction |
Design de l’étude |
Objectif |
Aire géographique |
Population (effectifs et descriptif) ou nombre d’études incluses |
Site internet |
|
AGRIculture et CANcer (AGRICAN) [
8
]
|
2005-2007 |
Cohorte prospective |
Évaluer le risque de cancer lié aux expositions professionnelles en secteur agricole par types de cancer |
11 départements français couverts par des registres de cancer en population au moment de l’inclusion : Côte d’Or, Doubs, Gironde, Isère, Loire-Atlantique, Manche, Bas-Rhin, Haut-Rhin, Somme, Tarn et Vendée |
181 842 individus adultes, actifs et retraités, affiliés à la Mutualité Sociale Agricole, l’assurance maladie du régime agricole français, pendant au moins 3 ans |
www.agrican.fr
|
|
AGRIcultural COHort Study (AGRICOH) [
13
]
|
2010 |
Consortium d’études de cohortes |
Soutenir et maintenir la collaboration et le partage/la mise en commun des données pour rechercher l’association entre des expositions agricoles et différentes maladies |
12 pays - 5 continents Afrique du Sud, Australie, Canada, Chili, Costa Rica, Danemark, France, Norvège, Nouvelle-Zélande, République de Corée, Royaume-Uni, États-Unis |
29 cohortes De quelques centaines à plusieurs centaines de milliers d’agriculteurs |
https://agricoh.iarc.fr/
|
|
Agricultural Health Study (AHS) [
10
]
|
1993-1997 |
Cohorte prospective |
Évaluer la santé des agriculteurs américains et de leurs conjoints |
2 États américains : Caroline du Nord et Iowa |
52 394 agriculteurs applicateurs de pesticides, 32 345 de leurs conjoints et 4 916 applicateurs de pesticides commerciaux d’Iowa |
https://aghealth.nih.gov/
|
|
EPIdemiology of LYMPHoid neoplasms (EPILYMPH) [
12
]
|
1998-2004 |
Étude cas-témoin multicentrique |
Tester des hypothèses spécifiques sur l’effet des changements dans notre environnement physique, professionnel et humain sur l’incidence des HM |
Allemagne, Espagne, Finlande, France, Irlande, Italie, République Tchèque |
Entre 1998-2003, 2 348 cas de lymphomes incidents et 2 462 contrôles ont été recrutés pour l’étude EPILYMPH dans six pays européens |
|
|
The International Multiple Myeloma Consortium (IMMC) [
9
]
|
2007 |
Consortium d’études cas-témoins |
IMMC a été mis en place pour entreprendre des projets de recherche pour mieux comprendre les facteurs de risque du myélome multiple (MM), de gammapathie monoclonale de signification indéterminée (MGUS) et les conditions connexes |
Collaboration internationale (Canada, Europe dont Epilymph) |
11 études cas-témoins |
https://www.lymphomacoalition.org/121-uncategorised/569-latest-research-from-immc
|
|
International Lymphoma Epidemiology Consortium (INTERLYMPH) [
7
]
|
2001 |
Consortium d’études cas-témoins |
Étendre les connaissances sur l’étiologie et la survie des lymphomes |
Amérique du Nord (Canada et États-Unis), Europe et Australie |
20 études cas-témoins |
https://epi.grants.cancer.gov/interlymph/
|
|
North American Pooled Project (NAPP) [
11
]
|
2013 |
Analyse poolée d’études cas-témoins |
Evaluer les associations entre les expositions agricoles et les risques de lymphomes non hodgkiniens, de lymphomes hodgkiniens, de myélomes multiples et de sarcome des tissus mous chez les hommes canadiens et américains. |
Continent nord-américain : Canada (Alberta, Colombie britannique, Manitoba, Québec, Ontario et Saskatchewan) et États-Unis (Iowa, Kansas, Minnesota, et Nebraska) |
4 études cas-témoins |
https://www.occupationalcancer.ca/2013/north-american-pooled-project/
|
|
Nordic Occupational Cancer (NOCCA) [
6
]
|
Non applicable |
Croisement de données de recensements de population et de maladies |
Présenter les données d’incidence par catégorie professionnelle pour les populations nordiques. |
5 pays scandinaves : Danemark, Suède, Norvège, Finlande et Islande |
L’étude couvre les 15 millions de personnes âgées de 30 à 64 ans lors des recensements de 1960, 1970, 1980/1981 et / ou 1990 et les 2,8 millions de cas de cancer incidents diagnostiqués et reportés les registres nationaux de cancers |
https://astra.cancer.fi/NOCCA/
|
Présentation des grandes études épidémiologiques analysant les associations entre survenue de cancers, notamment ou exclusivement les HM, et expositions agricoles.
|
Plus récemment
(
Tableau I
)
, des efforts internationaux ont permis de créer plusieurs consortiums et grandes études portant sur la survenue des HM (INTERLYMPH, EPILYMPH, IMMC) dans la population générale mais aussi plus spécifiquement chez les agriculteurs (AGRICOH). Après uniformisation des classifications des emplois et des LNH, INTERLYMPH a montré également un excès de risque de LNH associé à l’emploi agricole, en particulier au travail sur cultures (OR = 1,10 [IC95 % = 0,97-1,24]) lorsque la durée de l’emploi dépassait 10 ans (OR = 1,18 [IC95 % = 1,00-1,41]) [
7
].
Des questions demeurent sur les nuisances pouvant entraîner des risques de HM en milieu agricole (poussières, mycotoxines, gaz d’échappement, virus animaux…) et, même pour les pesticides, la nuisance la plus étudiée à ce jour, de nombreuses interrogations persistent. Leur étude est particulièrement difficile du fait de leur multiplicité, plus de 1 000 substances pesticides ayant pu être utilisées par les agriculteurs au cours de ces dernières décennies et plus de 300 étant encore sur le marché en France. De plus, peu d’études ont identifié les secteurs de production agricole associés à des augmentations de risque et la définition de l’exposition aux pesticides a souvent été limitée à celle de l’application de pesticides sur cultures. Récemment, la cohorte française AGRICAN
(
Tableau I
)
a montré une augmentation du risque de MM chez les agriculteurs ayant commencé à utiliser des pesticides sur cultures dans les années 1960, particulièrement les cultures de maïs (HR≥20 ans : 1,73 [IC95 % = 1,08-2,78]) et chez les utilisateurs d’insecticides sur animaux (HR = 1,48 [IC95 % = 1,11-1,98]) [
8
].
Expositions professionnelles agricoles aux pesticides
En analysant la littérature épidémiologique disponible et les hypothèses mécanistiques, l’expertise collective de l’Inserm concluait à une présomption forte d’un lien avec l’exposition aux pesticides pour les MM et LNH et à une présomption moyenne pour les leucémies [
2
]. Depuis cette expertise, une nouvelle méta-analyse a synthétisé les recherches menées durant les trois dernières décennies sur le rôle des expositions professionnelles aux pesticides (familles chimiques et/ou molécules) sur la survenue de LNH. À partir des résultats de 44 publications, les auteurs n’ont pu documenter des élévations de risques de LNH en lien qu’avec l’utilisation de (1) trois familles d’insecticides sur les cinq considérées : carbamates, organophosphorés, organochlorés et (2) quatre familles d’herbicides sur les huit considérées : les phénoxy-herbicides, les carbamates/thiocarbamates, les herbicides à base de glyphosate et les triazines [
14
]. La cohorte AHS est aujourd’hui une des rares études permettant l’analyse des effets des expositions professionnelles à des pesticides spécifiques. Elle étudie plus particulièrement le rôle de 49 molécules, essentiellement des insecticides (principalement des organophosphorés) et des herbicides. Par exemple, cette étude montre que l’exposition à l’insecticide lindane (un organochloré) était associée à un risque augmenté de LNH et plus particulièrement de lymphome folliculaire, et que l’exposition aux insecticides DDT (un organochloré) ou terbufos (un organophosphoré) augmentait le risque de LNH, notamment le risque de lymphomes à petites cellules, de LLC, et de lymphomes de la zone marginale. Parallèlement, et alors qu’aucune association n’a été détectée entre l’exposition aux insecticides diazinon (un organophosphoré) ou perméthrine (un pyréthrinoïde) et les LNH globalement, le diazinon a été associé à la survenue de lymphomes folliculaires et la perméthrine à la survenue de MM [
10
]. L’étude NAPP (
North American Pooled Project
)
(
Tableau I
)
a montré des augmentations significatives du risque de MM chez les hommes utilisateurs de l’insecticide carbamate carbaryl (OR = 2,02 [IC95 % = 1,28-3,21]), du fongicide captane (OR = 1,98 [IC95 % = 1,04-3,77]) ou de l’insecticide organochloré DDT (OR = 1,44 [IC95 % = 1,05-1,97]) [
11
].
À partir des différents consortiums évoqués plus haut, quelques résultats entre HM et pesticides spécifiques ont pu être récemment produits. Un risque augmenté de survenue de LLC a ainsi été observé chez les professionnels exposés aux pesticides inorganiques (OR = 1,6 [IC95 % = 1,0-2,5]) et organiques (OR = 1,5 [IC95 % = 1,0-2,1]) dans l’étude européenne EPILYMPH
(
Tableau I
)
. Le risque de LLC était d’ailleurs le plus élevé chez ceux exposés aux insecticides organophosphorés (OR = 2,7 [IC 95 % = 1,2-6,0]) [
12
]. Parallèlement, à partir des données du consortium AGRICOH
(
Tableau I
)
, et parmi 14 familles chimiques de pesticides sélectionnées et 33 molécules individuelles, l’insecticide terbufos (un organophosphoré) a été associé au risque de LNH (RR = 1,18 [IC95 % = 1,00-1,39]), l’insecticide deltaméthrine (un pyréthrinoïde) au risque de LLC (RR = 1,48 [IC95 % = 1,06-2,07]) et l’herbicide glyphosate au risque de lymphome diffus à grandes cellules B (LDGCB) (RR = 1,36 [IC95 % = 1,00-1,85]) [
13
].
Exposition aux pesticides et hémopathies malignes : approche biologique
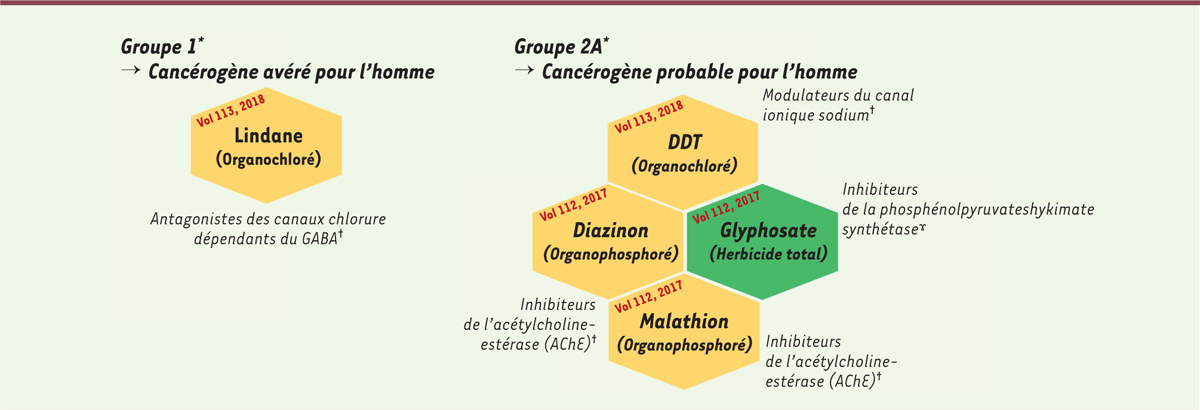
Bien que les études épidémiologiques montrent une association entre HM et pesticides, les approches mécanistiques de biologie cellulaire et moléculaire sont à ce jour peu développées. Le centre international de recherche sur le cancer (CIRC) a évalué la cancérogénicité d’environ 70 pesticides, parmi les plus de 1 000 commercialisés ces dernières décennies. Bien que le niveau de preuve reste insuffisamment documenté pour de nombreuses molécules, essentiellement par manque de données épidémiologiques, cinq pesticides aux modes d’actions différents ont été associés à la survenue spécifique de lymphomes et de leucémies : d’une part, le lindane, classé comme cancérogène avéré (groupe 1) et, d’autre part, le DDT, le diazinon, le malathion et le glyphosate, classés comme cancérogènes probables pour l’Homme (groupe 2A)
(
Figure 1
)
.
 | Figure 1.
Pesticides associés à la survenue d’hémopathies malignes d’après le centre International de recherche sur le cancer (CIRC).
Seuls les volumes des monographies référant aux évaluations les plus récentes des molécules pesticides sont ici mentionnés. DDT : DichloroDiphénylTrichloroéthane.
*
Agents classés par les monographies du CIRC, volumes 1-125 - Monographies du CIRC sur l’identification des dangers cancérogènes pour l’homme. Accès 1
er
juin 2020.
https://monographs.iarc.fr/fr/agents-classes-par-les-monographies-du-circ-2/
;
Insecticide Resistance Action Committee. New IRAC MoA Classification Booklet and Poster now available
, January 6, 2015.
https://irac-online.org/updated-irac-moa-classification-booklet-and-poster-now-available/
;
Herbicide Resistance Action Committee. HRAC Mode of Action Classification 2020 Map
. Accès 1
er
juin 2020.
https://hracglobal.com/tools/hrac-mode-of-action-classification-2020-map
.
|
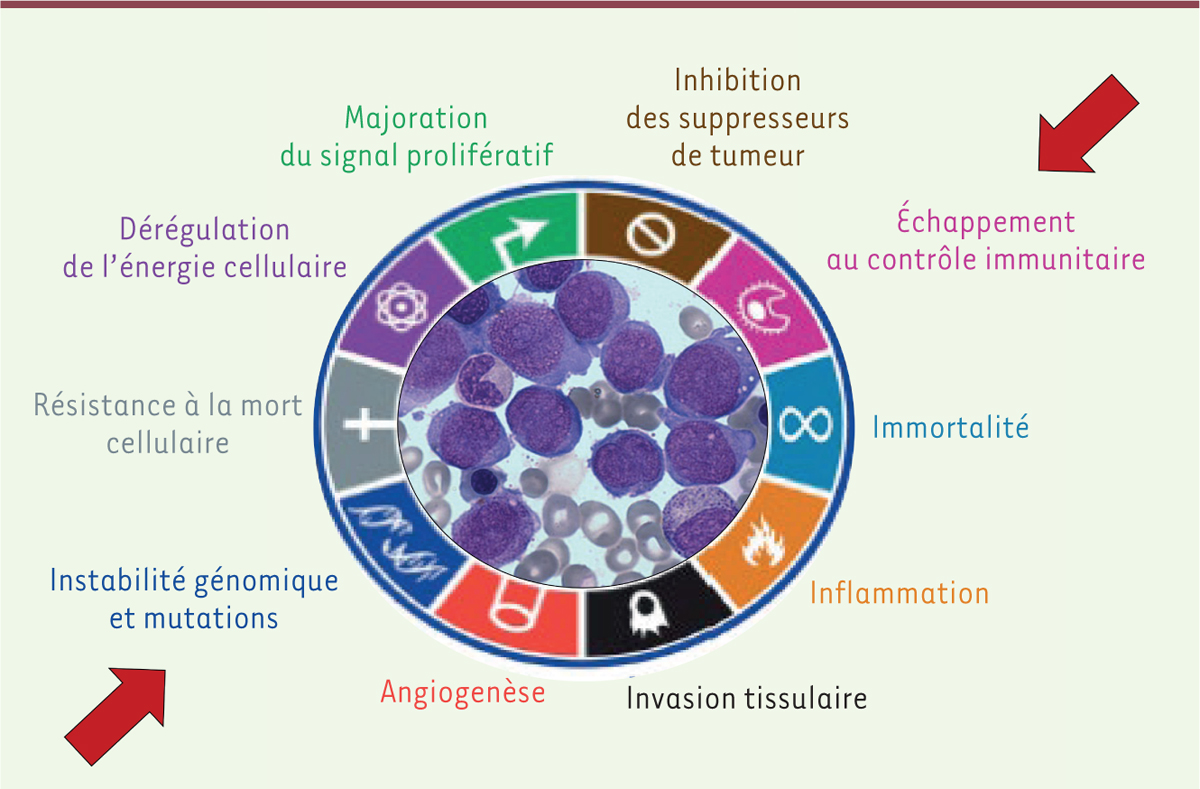
Dix grands mécanismes de cancérogenèse ont été proposés [
15
]. Parmi ces mécanismes, même si tous peuvent être envisagés, deux pourraient être plus particulièrement impliqués dans les mécanismes de cancérogenèse conduisant à des HM liés aux pesticides : il s’agit d’une part de mécanismes génotoxiques et, d’autre part, de mécanismes immunitaires
(
Figure 2
)
. Les mécanismes génotoxiques ont été étudiés en utilisant différentes approches biologiques chez des agriculteurs. De nombreuses études ont documenté une prévalence plus forte d’anomalies cytogénétiques chez les agriculteurs exposés aux pesticides. Par ailleurs, une analyse des bandes G des chromosomes des lymphocytes a montré une augmentation de la fréquence des réarrangements chez des agriculteurs exposés aux pesticides, au niveau de la bande 14q32 notamment et de la bande 18q21, seulement chez les agriculteurs [
16
]. Ces deux régions sont à l’origine de la translocation t(14;18), l’anomalie la plus largement observée dans les lymphomes folliculaires. Cette translocation met le gène codant la molécule anti-apoptotique
Bcl-2
(
B-cell lymphoma 2
) sous le contrôle du promoteur du gène codant la chaine lourde des immunoglobulines, entraînant la surexpression de
Bcl-2
et empêchant ainsi la mort programmée des cellules par apoptose. La prévalence de la t(14 ;18) est augmentée chez les agriculteurs exposés aux pesticides comme cela a été montré en étudiant dans cette population l’évolution clonale des cellules porteuses de cette translocation, précurseurs des cellules des lymphomes folliculaires [
17
]. Par ailleurs, la prévalence des gammapathies monoclonales de signification indéterminée est deux fois supérieure chez des agriculteurs par rapport à celle de la population générale [
18
]. Concernant les hémopathies myéloïdes, une augmentation de la fréquence des anomalies cytogénétiques défavorables a été retrouvée dans les blastes de LAM et de syndromes myélodysplasiques (SMD) des patients exposés aux pesticides [
19
]. Une hypothèse proposée est que les cellules souches hématopoïétiques exposées à certains pesticides pourraient acquérir prématurément des mutations dans les gènes associés à des pathologies myéloïdes, notamment des gènes impliqués dans des mécanismes d’épigénétique tels
DNMT3A
,
TET2
,
ASXL1
, mais également dans des gènes codant des protéines impliquées dans la signalisation de récepteurs de cytokines comme la tyrosine kinase
JAK2
. Cette hématopoïèse clonale de signification indéterminée, appelée CHIP (
clonal hematopoiesis of indeterminate potential
), survient avec une fréquence accrue avec l’âge et témoigne d’une instabilité génomique par déséquilibre entre stress génotoxique et capacité à détecter et réparer les cassures d’ADN ou les erreurs de réplication. La dérégulation du système immunitaire est un autre grand mécanisme de cancérogenèse particulièrement important à explorer dans les HM dont on sait qu’elles sont favorisées par les déficits immunitaires. Il a notamment été montré que les pesticides entrainaient une dérégulation du système immunitaire avec, par exemple, une baisse du taux des immunoglobulines G (IgG) chez des agriculteurs présentant des fortes concentrations sanguines de
p
,
p
′-DDE [
20
]. Des analyses quantitatives et fonctionnelles du système immunitaire humoral et cellulaire d’agriculteurs pour lesquels les expositions aux pesticides seraient très bien documentées pourraient aider à mieux appréhender ce mécanisme de cancérogenèse.
 | Figure 2.
Principaux mécanismes potentiels de cancérogenèse
(adaptée de [
15
]).
|
|
1.
Le Guyader-Peyrou
S
,
Defossez
G
,
Dantony
E
, et al.
Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018.
. Volume 2 - Hémopathies malignes. Étude à partir des registres des cancers du réseau Francim.
Saint-Maurice (France):
:
Santé publique France;
,
2019
.
2.
Inserm (dir.).
.
Pesticides : effets sur la santé.
.
Expertise collective;
.
Paris:
: Inserm,
2013
.
3.
Batista
JL
,
Birmann
BM
,
Epstein
MM
,
Loda
M
,
Mucci
LA
,
Mittelstadt
ML
,
et al.
Epidemiology of hematologic malignancies.
.
Pathology and epidemiology of cancer.
.
Cham:
:
Springer International Publishing;
,
2017
:543.
–
569
.
4.
Fasal
E
,
Jackson
EW
,
Klauber
MR
.
Leukemia and lymphoma mortality and farm residence.
.
Am J Epidemiol.
1968;
;
87
:
:267.
–
274
.
5.
Blair
A
,
Zahm
SH
,
Pearce
NE
,
et al.
Clues to cancer etiology from studies of farmers.
.
Scand J Work Environ Health.
1992;
;
18
:
:209.
–
215
.
6.
Pukkala
E
,
Martinsen
JI
,
Lynge
E
,
et al.
Occupation and cancer - follow-up of 15 million people in five Nordic countries.
.
Acta Oncol.
2009;
;
48
:
:646.
–
790
.
7.
Mannetje
A
,
De Roos
AJ
,
Boffetta
P
,
et al.
Occupation and risk of non-Hodgkin lymphoma and its subtypes: a pooled analysis from the InterLymph consortium.
.
Environ Health Perspect.
2016;
;
124
:
:396.
–
405
.
8.
Tual
S
,
Busson
A
,
Boulanger
M
,
et al.
Occupational exposure to pesticides and multiple myeloma in the AGRICAN cohort.
.
Cancer Causes Control CCC.
2019;
;
30
:
:1243.
–
1250
.
9.
Schinasi
LH
,
Brown
EE
,
Camp
NJ
,
et al.
Multiple myeloma and family history of lymphohaematopoietic cancers: results from the International Multiple Myeloma consortium.
.
Br J Haematol.
2016;
;
175
:
:87.
–
101
.
10.
Alavanja
MCR
,
Hofmann
JN
,
Lynch
CF
,
et al.
Non-Hodgkin Lymphoma Risk and insecticide, fungicide and fumigant use in the agricultural health study.
.
PLoS One.
2014
;
:9.
.
11.
Presutti
R
,
Harris
SA
,
Kachuri
L
,
et al.
Pesticide exposures and the risk of multiple myeloma in men: an analysis of the North American Pooled Project: pesticide exposures and the risk of multiple myeloma.
.
Int J Cancer.
2016;
;
139
:
:1703.
–
1714
.
12.
Cocco
P
,
Satta
G
,
Dubois
S
,
et al.
Lymphoma risk and occupational exposure to pesticides: results of the Epilymph study.
.
Occup Environ Med.
2013;
;
70
:
:91.
–
98
.
13.
Leon
ME
,
Schinasi
LH
,
Lebailly
P
,
et al.
Pesticide use and risk of non-Hodgkin lymphoid malignancies in agricultural cohorts from France, Norway and the USA: a pooled analysis from the AGRICOH consortium.
.
Int J Epidemiol.
2019;
;
48
:
:1519.
–
1535
.
14.
Schinasi
L
,
Leon
ME
.
Non-Hodgkin lymphoma and occupational exposure to agricultural pesticide chemical groups and active ingredients: a systematic review and meta-analysis.
.
Int J Environ Res Public Health.
2014;
;
11
:
:4449.
–
4527
.
15.
Hanahan
D
,
Weinberg
RA
.
Hallmarks of cancer: the next generation.
.
Cell.
2011;
;
144
:
:646.
–
674
.
16.
Garry
VF
,
Kelly
JT
,
Sprafka
JM
,
et al.
Survey of health and use characterization of pesticide appliers in Minnesota.
.
Arch Environ Health Int J.
1994;
;
49
:
:337.
–
343
.
17.
Agopian
J
,
Navarro
JM
,
Gac
AC
,
et al.
Agricultural pesticide exposure and the molecular connection to lymphomagenesis.
.
J Exp Med.
2009;
;
206
:
:1473.
–
1483
.
18.
Lecluse
Y
,
Comby
E
,
Mariotte
D
,
et al.
Prevalence of monoclonal gammopathy of undetermined significance (MGUS) among farmers involved in open field farming and/or cattle breading in France.
.
Leuk Lymphoma.
2016;
;
57
:
:1727.
–
1730
.
19.
Fagioli
F
,
Cuneo
A
,
Piva
N
,
et al.
Distinct cytogenetic and clinicopathologic features in acute myeloid leukemia after occupational exposure to pesticides and organic solvents.
.
Cancer.
1992;
;
70
:
:77.
–
85
.
20.
Cooper Glinda
S
,
Martin Stephen
A
,
Longnecker Matthew
P
, et al.
Associations between plasma DDE levels and immunologic measures in African-American farmers in North Carolina.
.
Environ Health Perspect.
2004;
;
112
:
:1080.
–
4
.
|