| |
| Med Sci (Paris). 36(12): 1225–1232. doi: 10.1051/medsci/2020231.Lutte anti-COVID-19 Panorama du marché et développement des essais en cours Richard Pontremoli,1 Geoffrey Richard,1 Gavin Vuddamalay,1 and Nicolas Groux1* 1MabDesign
,
17 rue Crepet
,
69007Lyon
,
France MeSH keywords: Anticorps, Antiviraux, Recherche biomédicale, COVID-19 , Essais cliniques comme sujet, Commerce, Développement de médicament, Industrie pharmaceutique, France, Secteur des soins de santé, Humains, Coopération internationale, Investissements, Pandémies, SARS-CoV-2 , Vaccins antiviraux, économie, isolation et purification, usage thérapeutique, tendances, épidémiologie, prévention et contrôle, thérapie, méthodes, organisation et administration, physiologie, ressources et distribution |
Pour une présentation de Mabdesign, voir la Nouvelle de Groux N, Pontremoli R, Vuddamalay G,
et al.
Description des acteurs français issus du programme d’investissements d’Avenir. Le rôle de MabDesign.
Med Sci (Paris)
2019 : 35 : 1198-201.
En Chine, dans la région de Wuhan, se sont déclarés en fin d’année 2019 plusieurs cas de pneumonies d’origine virale. Le virus responsable, le SARS-CoV-2 (pour
severe acute respiratory syndrome-corona virus 2
), est alors rapidement isolé et étudié. L’Organisation mondiale de la santé (OMS) déclare officiellement la découverte d’un nouveau coronavirus en début d’année 2020, le SARS-CoV-2 donc, responsable d’une maladie désignée sous le nom de «
corona virus disease
», apparue en 2019 (COVID-19).
Sans vaccins ni traitements disponibles, la propagation de la COVID-19 dans le monde a été extrêmement rapide et est encore responsable à ce jour d’une pandémie mondiale. Dès la fin janvier 2020, des cas sont identifiés en Europe et aux États-Unis. Les gouvernements font le choix d’un confinement de la population pour éviter la propagation du virus. La France se confine le 17 mars jusqu’au 11 mai 2020. La majorité des pays feront le même choix, à l’exception notable en Europe du Royaume-Uni (du moins initialement) et de la Suède. Neuf mois plus tard, à la mi-novembre 2020, le virus est toujours actif : plus de 54 millions de personnes ont été infectées par le SARS-CoV-2 dans le monde et plus de 1,3 million de décès ont été enregistrés.
À travers son histoire, l’humanité a connu plusieurs pandémies. Parmi les plus terribles, nous pouvons citer celle de la peste noire (bubonique) (200 millions de morts lors des trois pandémies) [
1
] ou encore celle de la grippe espagnole (40-50 millions de morts). Concernant celle de la COVID-19, il est encore difficile de mesurer son impact car le virus diffuse toujours. Avec déjà plus d’un million de décès, cet impact est déjà extrêmement important, tant sur le plan humain que sur le plan économique. Pour lutter contre cette pandémie, le monde pharmaceutique et médical s’est mobilisé pour identifier des traitements potentiels et des vaccins efficaces. Cet article dresse un panorama de l’état de la recherche et développement (R&D) contre la COVID-19 (en se focalisant surtout sur notre pays et en présentant principalement les données accessibles jusqu’à début septembre).
|
La réponse de l’industrie pharmaceutique contre la COVID-19
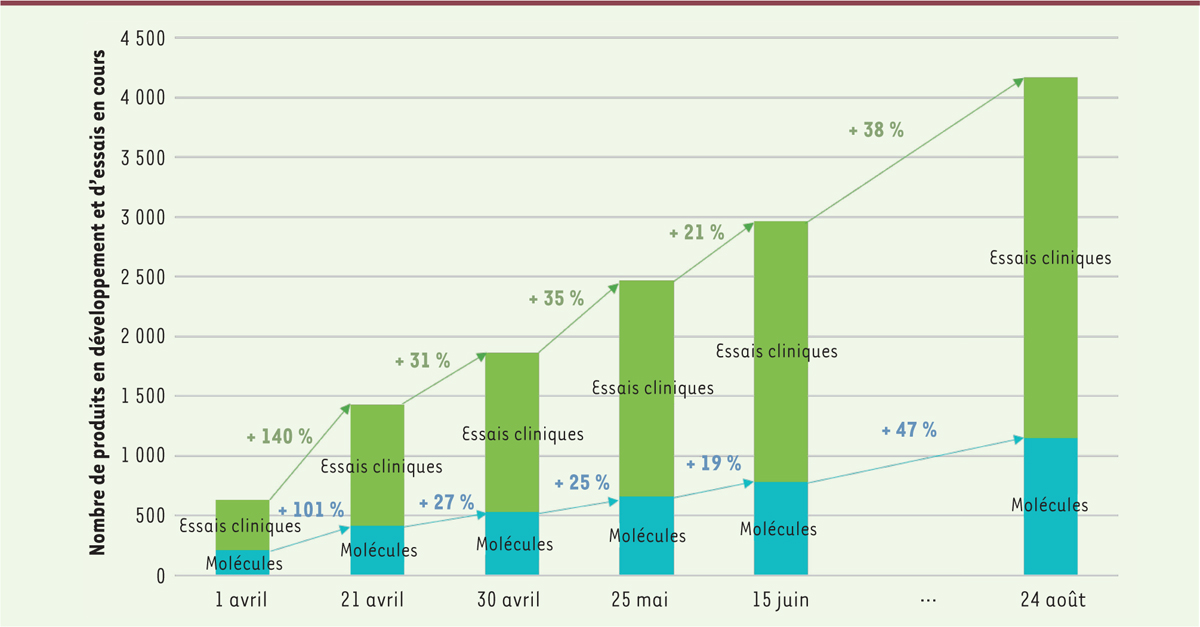
L’impact de la crise sanitaire liée au coronavirus a été gigantesque. Faisant preuve d’une agilité rare, l’industrie pharmaceutique mondiale ainsi que les centres de recherches académiques du monde entier se sont mis en ordre de bataille pour répondre à cette crise de la COVID-19. Début avril 2020, plus de 200 médicaments étaient en cours d’évaluation dans le monde et 400 essais cliniques pouvaient être répertoriés [
2
]. L’effort très important fourni dans le monde entier permettait de dénombrer fin août 2020
(
Figure 1
)
:
 | Figure 1.
Évolution du nombre d’essais cliniques et de produits en développement au cours du temps
(au 31 août 2020).
|
-
1 145 candidats médicaments étaient en cours d’évaluation.
-
31 % de ces candidats étaient des vaccins ayant pour but de prévenir la maladie ;
-
69 % étaient des traitements pour soigner les personnes atteintes de la maladie.
-
3 019 essais cliniques portant sur le SARS-CoV-2 ont été répertoriés dans le monde.
-
43 % de ces essais déjà en cours ;
-
42 % devant débuter dans les mois suivants ;
-
Le reste des essais étant terminé.
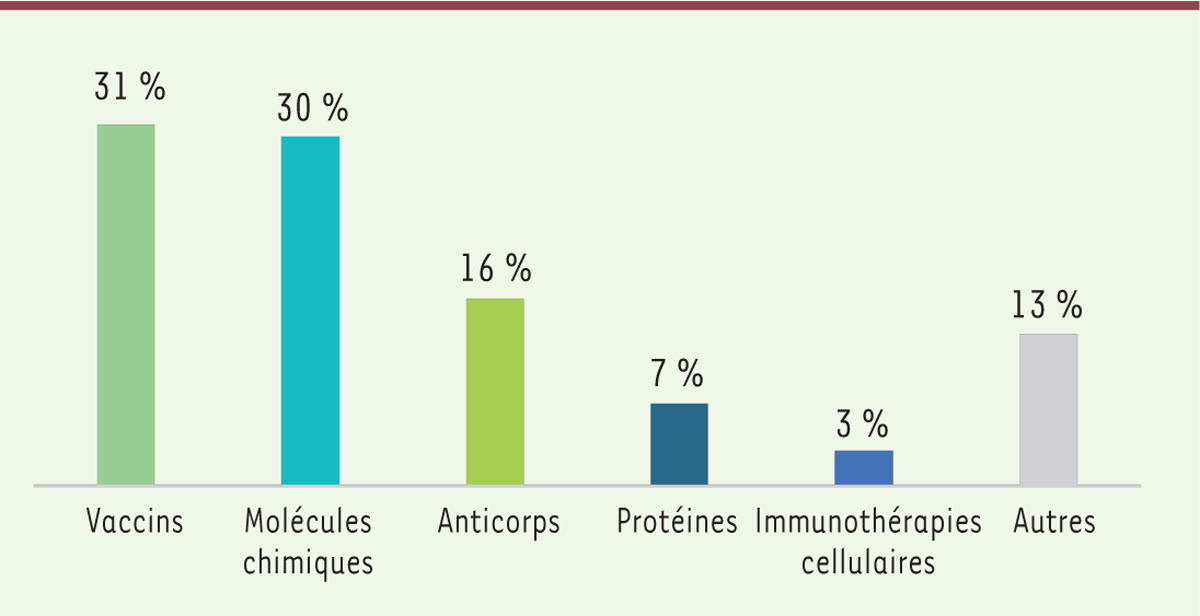
L’efficacité de plusieurs types de molécules est en cours d’évaluation
(
Figure 2
)
:
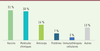 | Figure 2.
Répartition des produits en cours de développement selon le type de molécules.
|
Les molécules chimiques
Trente pour cent des candidats étudiés étaient des petites molécules chimiques. Ces petites molécules sont principalement des antiviraux testés en repositionnement thérapeutique contre la COVID-19. Dans ce cadre, la molécule la plus prometteuse à ce jour était le remdésivir (en Europe, Veklury®, Gilead), un inhibiteur de la réplication virale initialement développé pour le traitement de patients atteints du virus Ebola. Cette molécule a finalement reçu une autorisation d’utilisation pour le traitement de la COVID-19 par l’agence européenne des médicaments (EMA pour
European Medicines Agency
) le 3 juillet 2020 (EMA/197268/2020). Cependant, son effet reste très limité : l’essai américain ayant conduit à cette autorisation montre que les malades traités par remdésivir guérissent en moyenne en 11 jours contre 15 jours pour le groupe de patients ayant reçu un placebo ; cependant, la différence de mortalité entre les deux groupes est trop faible pour être statistiquement significative [
3
].
Les anticorps thérapeutiques Les anticorps sont également prépondérants dans le pipeline des candidats médicaments. Ils ont l’avantage d’être hautement spécifiques d’une cible bien définie. Certains de ces anticorps ciblent spécifiquement une protéine du virus et permettent par exemple d’éviter l’attachement ou la pénétration de ce dernier dans la cellule. D’autres peuvent avoir une action sur la réponse immunitaire du patient pour, par exemple, la renforcer ou la réguler, notamment lorsque cette réponse est associée à une inflammation très importante. Certains de ces anticorps ciblent des molécules (ou leurs récepteurs) directement liées à ce processus inflammatoire. Les vaccins
Plusieurs types de vaccins sont en cours d’évaluation. Les vaccins à sous-unités sont les plus représentés, représentant environ 35 % des essais en cours. Les vaccins à base d’acides nucléiques sont également très représentés (vaccins à ARNm, à ADN, utilisant des vecteurs recombinants contenant des séquences codant des protéines virales). Ils représentent à eux trois 37 % des vaccins en développement. Enfin, les autres types de vaccins (inactivés, atténués, conjugués et autres) complètent ce
pipeline
.
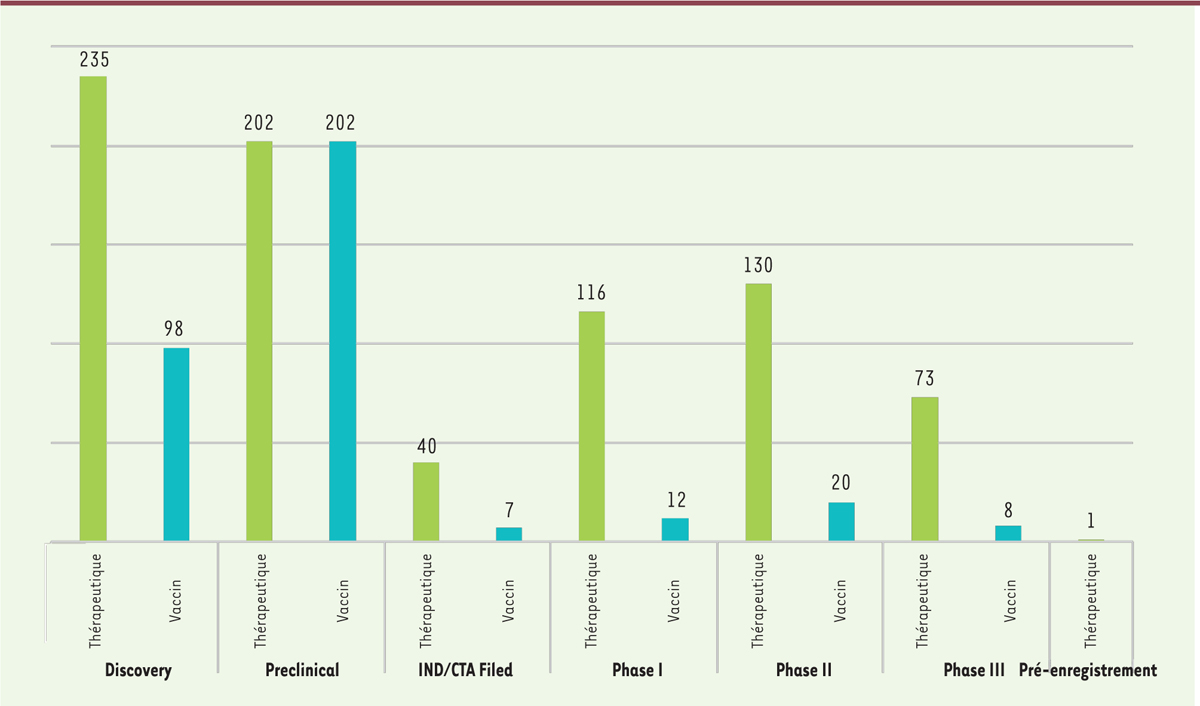
Malgré cette émulation dans la recherche de molécules permettant de faire face à la pandémie, les produits contre la COVID-19 sont encore pour une grande partie d’entre eux dans des phases précoces de développement
(
Figure 3
)
. En effet, même si les techniques de fabrication et de validation clinique de vaccins ou d’anticorps ou de petites molécules de synthèse sont bien maîtrisées, le délai de développement d’une nouvelle thérapie (traitement ou vaccin) n’en reste pas moins très long. Étant donnée la durée d’une campagne vaccinale permettant de valider l’efficacité et la non-toxicité d’un candidat-vaccin, la plus grande prudence est donc de mise quant au développement de ces candidats-vaccins et leur cinétique. Pour pallier à ce problème, les autorités règlementaires ont mis en place des procédures accélérées permettant de réduire le temps de développement. L’agence américaine du médicament
(Food and Drug administration
[FDA]) a développé un programme nommé
Coronavirus Treatment Acceleration Program
(CTAP), permettant d’accélérer l’accès aux soins pour les patients [
4
]. L’EMA a également publié des procédures permettant d’accélérer l’autorisation de mise sur le marché [
5
].
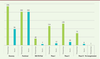 | Figure 3.
Répartition des produits selon la phase de développement et selon le type de molécules
(à la date du 31 août 2020).
|
– De plus, certains produits (surtout thérapeutiques) sont testés en repositionnement de molécules déjà utilisées pour d’autres thérapies. De ce fait, leur toxicité est déjà bien connue, ce qui réduit les tests d’innocuité ou toxicologiques nécessaires et donc la durée de développement. Certains produits ont également obtenu une autorisation de mise sur le marché (AMM)
(
Tableau I
)
. Ces AMM ont été obtenues dans le cadre de procédures locales. Seul le remdésivir a obtenu une AMM communautaire de la part de l’EMA pour le traitement de la COVID-19 (voir ci-dessus).
Tableau I.
| Traitements |
Nom de la molécule |
Entreprise |
Pays |
Cible |
Mécanisme d’action |
|
| Remdesivir |
Gilead Sciences |
UE + Japon |
ARN polymérase |
Inhibiteur de l'ARN polymérase |
|
| Lévilimab |
Biocad |
Russie |
Récepteur de l’interkeukine 6 (IL-6R) |
Antagoniste de l’IL-6R |
|
| Olokizumab |
R Pharm |
Russie |
Interleukine 6 (IL-6) |
Inhibiteur de l’IL-6 |
|
| Favipiravir |
Dr. Reddy’s Laboratories Ltd Kromis R-Pharm |
Russie + Inde |
ARN polymérase |
ARN polymérase |
|
| Vaccins |
Nom de la molécule |
Entreprise |
Pays |
Type de vaccin |
| Coronavirus Disease 2019 (COVID-19) Vaccine Gam-COVID-Vac |
Gamaleya Federal Research Center of Epidemiology and Microbiology |
Russie |
Vaccin recombinant (virus vivant recombinant) |
Les produits actuellement commercialisés contre le SARS-CoV-2. UE : pays de l’Union européenne ; Russie : Fédération de Russie.
|
– Certains produits très prometteurs sont cependant déjà en phase III d’essais cliniques et donc potentiellement aux portes d’une autorisation de mise sur le marché. – 73 essais sont des essais de phase III et concernent des thérapies : 45 % des traitements sont effectués avec des molécules chimiques, 26 % avec des anticorps et 11 % avec des protéines. D’autres types de molécules sont également en phase III et correspondent aux 14 % restants.
– 8 vaccins sont également en phase III
(
Tableau II
)
.
Tableau II.
| Vaccins |
Nom de la molécule |
Entreprise |
Type de vaccin |
| AZD-1222 |
AstraZeneca Plc |
Vaccin recombinant (virus vivant recombinant) |
| BBIBP-CorV |
Sinopharm Group Co Ltd |
Vaccin inactivé |
| BNT-162b2 |
BioNTech SE (développé avec Pfizer) |
Vaccin à ARNm |
| Coronavirus Disease 2019 (COVID-19) vaccine 2 |
Sinopharm Group Co Ltd |
Vaccin inactivé |
| mRNA-1273 |
Moderna Inc |
Vaccin à ARNm |
| MV-130 |
Inmunotek SL |
Vaccin inactivé |
| Picovacc |
Sinovac Biotech Ltd |
Vaccin inactivé |
| VPM-1002 |
Serum Institute of India Ltd |
Vaccin vivant atténué |
Vaccins contre la COVID-19 actuellement en phase III.
|
– Enfin, de multiples partenariats ont été conclus entre les acteurs mondiaux de la lutte contre la COVID-19. À ce jour (fin août 2020), nous avons identifié 253 partenariats au niveau mondial. Cela a permis de mutualiser les compétences et de faire avancer la recherche. Ces partenariats concernent tous les types d’acteurs impliqués dans la lutte contre le SARS-CoV-2 : instituts de recherche, sociétés de biotechnologie déjà bien établies, s
tartup
, compagnies pharmaceutiques (
BigPharma
). Le
Tableau III
résume brièvement quelques-uns de ces partenariats. Soulignons que ces partenariats concernent également des entreprises dont le métier principal n’est pas centré autour du monde pharmaceutique. Cela met en évidence une implication de tous types d’acteurs dans la lutte contre la COVID-19. Ainsi,
Microsoft
travaille avec la
Biotech Adaptative Biotechnologies
sur le traitement des données patient permettant de mettre en évidence la réponse immunitaire au COVID-19.
Tableau III.
| Types d’entreprise |
Sociétés impliquées |
Nature du partenariat |
| Big Pharma & Big Pharma |
GSK / Sanofi |
Vaccin |
| BigPharma & Biotech |
GSK / Vir Biotech |
Anticorps |
| Amgen / Adaptative Biotechnologies |
|
Anticorps |
| Pfizer / BioNtech |
|
Vaccin |
| BigPharma & Recherche académique |
AstraZeneca / Univ Oxford |
Vaccin |
| Merck / Institute for
Systems Biology |
|
Vaccin et thérapie |
| Santé & Autres |
Google / Différentes Biotech |
Autres |
| Microsoft / Adaptative Biotechnologies |
|
Autres |
Principaux partenariats au niveau mondial
(à la date du 31 août 2020).
|
|
La France dans la lutte contre la COVID-19
À la date du 24 août 2020, 903 entreprises ont été identifiées dans le monde comme développant des traitements ou vaccins contre la COVID-19. Plus d’un tiers sont localisées aux États-Unis à la pointe de la recherche et de l’innovation dans ce domaine, avec notamment un appui financier très important de la part du gouvernement fédéral, notamment au travers de la BARDA (
Biomedical Advanced Research and Development Authority
).
D’autres pays sont également impliqués dans la recherche contre ce nouveau virus. La France est très active et compte des projets prometteurs. Le pays se classe à la huitième place dans le monde en termes de nombre de sociétés développant des produits contre la COVID-19. Plusieurs types de produits y sont en cours de développement actuellement :
– Cinq sociétés et un institut développent des vaccins (
Aiova,
Institut Pasteur
, Ose ImmunoTherapeutics, Osivax, Sanofi-Pasteur, Vaxinano
),
– Quatorze sociétés développent des thérapies fondées sur l’utilisation de petites molécules chimiques (
Abivax, AB Science, Biophytis, Genoscience Pharma, Iltoo Pharma, Hemarina, Medesis Pharma, MedinCell, RevImmune
), d’anticorps monoclonaux (
Innate Pharma, Sanofi, Theravectis, Xenothera
), de peptides (
Inotrem
).
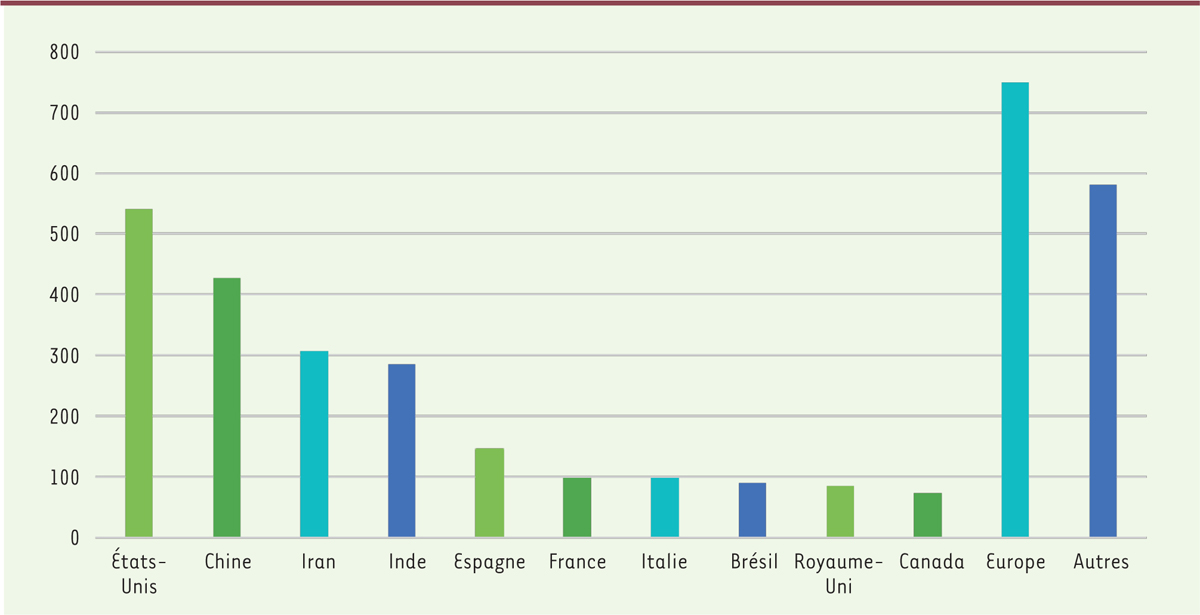
Si l’on considère le nombre d’essais cliniques par pays
(
Figure 4
)
, le constat est le même qu’en ce qui concerne les développements de molécules en cours : les États-Unis dominent cette catégorie avec 18 % du nombre total d’essais cliniques, mais avec un écart plus restreint avec les autres pays. Le second pays est la République populaire de Chine, avec 14 % des essais.
 | Figure 4.
Nombre d’essais cliniques par pays
(source : GlobalData, Analyse MabDesign) (à la date du 31 août 2020).Chine : République populaire de Chine.
|
La France quant à elle est en sixième position. De plus, notre pays a mis ses compétences au service de la recherche internationale, comme en témoigne le nombre de partenariats internationaux et nationaux qui ont été signés. Ces partenariats concernent plusieurs types de compétences ; parmi les plus importants, soulignons ceux concernant :
-
Les capacité de production,
-
Les compétences en Recherche & Innovation,
-
L’expertise technique.
Le
Tableau IV
résume les principaux partenariats dans lesquels des sociétés françaises sont impliquées.
Tableau IV.
| Date du partenariat |
Description du partenariat |
Type de produit |
| 15/06/20 |
Novasep va produire le vaccin d’AstraZeneca en Europe |
Vaccin |
| 08/06/20 |
Cynbiose et le laboratoire universitaire Virpath entrent en collaboration pour un projet lié à la pandémie COVID-19 |
Inconnu |
| 13/05/20 |
Eurobio Scientific SA s’est associée à Hospices Civils de Lyon (HCL) pour développer une bibliothèque d’anticorps anti-SARS-CoV-2 |
Anticorps |
| 11/05/20 |
ABL Europe met son expertise au service du développement du vaccin COVID-19 de la coalition de l’Institut Pasteur et de Themis |
Vaccin |
| 24/04/20 |
Pour lutter contre la pandémie de COVID-19, Owkin lance un Consortium d’IA pour apporter des innovations pour la recherche médicale |
Autres |
| 22/04/20 |
Valneva et Dynavax entrent en collaboration pour le développement de vaccins contre la COVID-19 |
Vaccin |
| 15/04/20 |
Le LFB et la société de biotechnologie Xenothera signent un accord pour la production d’un lot clinique d’un anticorps-candidat médicament |
Anticorps |
| 14/04/20 |
Sanofi et GlaxoSmithKline vont conclure un accord de co-développement pour le vaccin COVID-19 |
Vaccin |
| 06/04/20 |
CSL Behring conclut un accord de co-développement avec Takeda Pharma, Biotest, Bio Products Laboratory, le LFB et Octapharma pour développer un traitement contre la COVID-19 |
Anticorps |
| 27/03/20 |
Sanofi Pasteur conclut un accord de co-développement avec Translate Bio pour développer un candidat vaccin à ARNm contre le COVID-19 |
Vaccin |
| 20/0320 |
Smart-Bioscience a été sélectionnée par la société américaine Ligandal comme entreprise européenne partenaire de son programme de vaccin à base de peptides contre le coronavirus SARS-Cov2 (COVID-19) |
Vaccin |
| 16/03/20 |
Collaboration entre Sanofi et Regeneron pour le développement d’un traitement contre la COVID-19 |
Anticorps |
Liste des principaux partenariats impliquant des entreprises françaises
(à la date du 31 août 2020).
|
Les tests diagnostiques sont également une composante essentielle de la lutte contre la COVID-19. En effet, la faculté de dépister et isoler les malades est apparue rapidement comme une nécessité majeure pour lutter contre la propagation du virus SARS-CoV-2. À l’échelle mondiale, de nombreux tests ont été approuvés par les autorités sanitaires. Il existe aujourd’hui 323 tests disponibles sur le marché. Deux grandes catégories de tests dominent le marché :
-
Les tests de détection du virus par RT-PCR (
reverse transcription-polymerase chain reaction
) permettant de détecter directement la présence du virus (217 tests disponibles) dans les voies aériennes supérieures (prélèvement nasopharyngé), Des tests salivaires permettent désormais une détection plus rapide (30 min) et viennent d’être homologués en France (utilisés aux États-Unis dès l’été dernier). Cette technique permet d’optimiser le délai d’obtention des résultats des tests, facteur limitant actuellement pour suivre et maîtriser la pandémie.
-
Les tests sérologiques permettant de mettre en évidence une réponse immunitaire (anticorps) dirigée contre le virus (83 tests disponibles),
-
D’autres types de tests ont été développés (le test antigénique et l’analyse par spectrométrie de masse étant parmi les plus importants). La France a également développé des tests diagnostiques. Que ce soient des grands groupes internationaux, des
Startup
ou des PME (petites ou moyennes entreprises), les sociétés françaises ont développé des tests de qualité en s’appuyant sur d’excellentes compétences techniques. À titre d’exemples
1
, nous pouvons citer :
-
BioMérieux
qui a développé trois tests diagnostiques :
-
Le test ARGENE SARS-CoV-2 R-GENE® s’appuie sur la technique de RT-PCR en temps réel pour détecter rapidement et spécifiquement le SARS-CoV-2 responsable de la pandémie de COVID-19 (résultats fournis en 4-5 heures)
-
Le test BIOFIRE® COVID-19, développé avec le soutien du département américain de la défense et produit aux États-Unis, est un test entièrement automatisé qui fournit des résultats en 45 minutes à partir d’un échantillon de patient. Il est recommandé pour une utilisation en cas d’urgence pour des patients dont l’état de santé est critique.
-
Le test BIOFIRE® FILMARRAY® est une extension d’un panel de détection déjà existant qui permettait de détecter 21 pathogènes les plus fréquemment responsables d’infections respiratoires, panel auquel a été rajoutée la détection du virus SARS-CoV-2, en environ 45 minutes.
-
NG Biotech
: cette société de biotechnologie bretonne a lancé un test diagnostique sérologique permettant d’évaluer si la personne testée a développé des anticorps anti-SARS-CoV-2 et a donc été infectée par le virus. Un test salivaire est en cours de développement par cette société.
-
AAZ
: La société
AAZ
a développé un test sérologique rapide nommé COVID-PRESTO. Le test sérologique permet de mettre en évidence des anticorps dirigés contre le virus et donc une immunisation suite à une infection par le SARS-CoV-2 de la personne testée.
D’autres sociétés françaises ont travaillé et travaillent également à l’élaboration de tests diagnostiques dont certains sont désormais sur le marché :
Biosynex ; Skigenics ; Innobiochips ; Poly-D-Tech ; Theravectys ; Eurobio Scientific ; C4Diagnostics ; ID Vet ; RD-Biotech ; Eurofins ; Skincell ; SysDiag ; BforCure ; CleanCells ; MobiDiag ; Novacyt ; BioSpeedia.
|
L’industrie pharmaceutique est aujourd’hui contrainte par la pandémie due au SARS-CoV-2 d’apporter une réponse adéquate face à son ampleur. Deux stratégies principales ont été mises en place. La première consiste à faire du « repositionnement de thérapie » (lancements d’essais cliniques pour des molécules déjà sur le marché dans d’autres indications) et la seconde nécessite le développement de thérapies
de novo
. Comme d’autres pays, la France dispose de toutes les compétences, du savoir-faire, de la maîtrise technologique et des infrastructures pour identifier et développer des thérapies efficaces, à haute valeur ajoutée. Ces atouts ont permis la signature de nombreux accords et partenariats nationaux et internationaux impliquant tous les acteurs français,
start-up
, PME, institut de recherche, société de services et industrie pharmaceutique.
D’autres acteurs économiques ne rentrant pas directement dans le cadre de ce panorama sont très importants dans la lutte contre la COVID-19, notamment les sociétés travaillant sur l’intelligence artificielle.
Pour disposer d’informations en temps réel,
MabDesign
publie une lettre de veille «
Immunowatch COVID-19
» qui est régulièrement mise à jour et permet d’informer sur les dernières évolutions de la lutte contre la COVID-19. Sont rassemblées dans cette lettre les dernières données en matière de produits développés (vaccins et molécules thérapeutiques), de partenariats, d’appels à projet, ainsi qu’en matière de propriété intellectuelle et d’articles scientifiques qu’il nous semble important de connaître.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
3.
Beigel
JH
,
Tomashek
MK
,
Dodd
LE
,
Mehta
AK
,
et al.
Remdesivir for the treatment of Covid-19 — Final report.
.
N Engl J Med.
2020
;
NEJMoa2007764. doi:
10.1056/NEJMoa2007764
.
.
|