| |
| Med Sci (Paris). 36(12): 1213–1215. doi: 10.1051/medsci/2020235.La signalisation endosomique impliquant la chaîne ζ du récepteur des lymphocytes T est nécessaire à leur survie dans les organes lymphoïdes secondaires Irini Evnouchidou,1,2 Mathilde Nugue,1 and Loredana Saveanu1* 1Université de Paris, Centre de recherche sur l’inflammation, Inserm U1149
,
16 rue Henri-Huchard
,
75018Paris
,
France 2Inovarion
,
251 rue Saint-Jacques
,
75005Paris
,
France
.
MeSH keywords: Animaux, Survie cellulaire, Endosomes, Humains, Antagoniste du récepteur à l'interleukine-1, Activation des lymphocytes, Protéine tyrosine kinase p56(lck) spécifique des lymphocytes, Tissu lymphoïde, Souris, Récepteurs aux antigènes des cellules T, Transduction du signal, Lymphocytes T, métabolisme, cytologie, immunologie, physiologie |
L’élimination des cellules infectées ou cancéreuses dépend de la réponse immunitaire adaptative, qui est orchestrée par les lymphocytes T CD4
+
et CD8
+
et par les lymphocytes B producteurs d’anticorps. Les lymphocytes T forment une synapse immunologique avec les cellules infectées. Un facteur clé de cette synapse est l’interaction entre le récepteur de l’antigène exprimé à la surface du lymphocyte T (
T cell receptor complex
, ou « complexe TCR ») et les molécules du complexe majeur d’histocompatibilité (CMH) qui présentent des peptides antigéniques à la surface de la cellule infectée. Le TCR déclenche alors une cascade de signaux intracellulaires conduisant à l’activation du lymphocyte T. Le complexe TCR est composé de multiples chaînes polypeptidiques : les hétérodimères αβ, γε et δε, et l’homodimère ζζ. Ces composants, ainsi que les partenaires de signalisation du TCR, sont localisés à l’intérieur du lymphocyte T dans des compartiments vésiculaires séparés, certains de ces composants faisant également partie du complexe TCR exprimé à la surface cellulaire. La
Figure 1
illustre la distribution intracellulaire différente des chaînes ε et ζ du TCR.
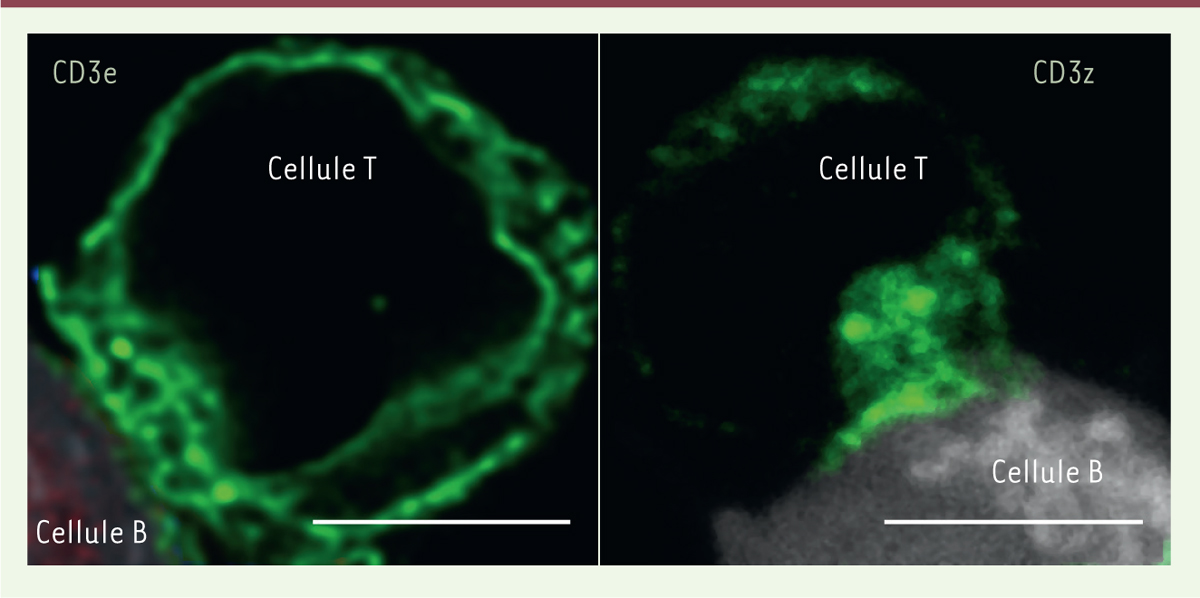
 | Figure 1.
Les chaînes
ζ
et
e
du récepteur des lymphocytes T (TCR) sont localisées dans des compartiments intracellulaires distincts.
Des lymphocytes T Jurkat ont été incubés avec des lymphocytes B Raji (colorés avec le fluorochrome
Cell Trace Violet
), qui présentent le super-antigène
staphylococcal enterotoxin E
(SEE). Après la formation de la synapse immunologique, les cellules ont été fixées, perméabilisées, et les chaînes ζ (CD3ζ) et ε (CD3ε) du complexe TCR ont été visualisées à l’aide d’anticorps spécifiques (fluorescence verte). La chaîne ζ est localisée dans des endosomes qui contiennent aussi les protéines IRAP, Rab4 et la syntaxine 6 [
4
] (voir la
Figure 2
). La chaîne ε est localisée dans le réticulum endoplasmique, où elle est co-localisée avec la calnexine, une protéine résidente du réticulum endoplasmique [
4
]. Barre d’échelle : 5 mm.
|
La chaîne ζ est indispensable à la formation du TCR, car, en son absence, la formation d’un complexe TCR à la surface du lymphocyte T est quasiment supprimée [
1
,
2
]. Il a été montré qu’une forme mutée de la chaîne ζ, incapable d’induire une cascade de signalisation, peut néanmoins restaurer l’expression du TCR à la membrane plasmique [
1
,
3
]. De plus, chaque chaîne ζ contient trois « motifs d’activation des immunorécepteurs dépendant de la phosphorylation des tyrosines » (
immunoreceptor tyrosine-based activation motif
, ITAM), tandis que les chaînes γ, δ et ε n’en contiennent qu’un chacune, ce qui suggère que la chaîne ζ joue un rôle majeur dans la signalisation cellulaire par le TCR. De fait, la signalisation induite par la chaîne ζ s’est révélée cruciale pour l’activation de lymphocytes T en périphérie. Malgré ces études révélant des rôles multiples de la chaîne ζ dans la fonction du TCR, la nature du « compartiment ζ » est longtemps restée inconnue. Nous avons montré que ce compartiment intracellulaire est déterminé par la protéine IRAP (
insulin-responsive aminopeptidase
) [
4
], une aminopeptidase précédemment caractérisée dans les adipocytes et les cellules dendritiques [
5
]. IRAP est une protéine bifonctionnelle : elle possède une activité enzymatique, mais aussi une fonction régulatrice de la motilité des endosomes grâce à son interaction avec le cytosquelette d’actine [
6
].
|
La protéine IRAP est essentielle pour la fonction de la chaîne ζ du TCR
Pour identifier la nature du « compartiment ζ », nous avons étudié la co-localisation de la chaîne ζ du TCR avec d’autres protéines et avons montré que cette chaîne est co-localisée avec IRAP, avec la syntaxine 6 (Stx6) et avec la petite GTPase Rab4. De plus, au cours de l’activation du lymphocyte T par une cellule présentatrice d’antigène, les vésicules contenant IRAP sont recrutées à la synapse immunologique
(
Figure 2
)
. Par ailleurs, nous avons montré que la protéine IRAP interagit bien avec la chaîne ζ du TCR ainsi qu’avec la kinase Lck (
lymphocyte-specific protein tyrosine kinase
), qui joue un rôle primordial dans la cascade de signalisation du TCR. Pour comprendre comment la chaîne ζ est dirigée vers les endosomes contenant IRAP, nous avons étudié les facteurs impliqués dans son endocytose et avons trouvé que celle-là est dépendante de l’adaptateur de clathrine AP-2 et de la dynamine 2. En l’absence d’un de ces deux facteurs d’endocytose ou d’IRAP, l’accumulation de la chaîne ζ à la membrane plasmique du lymphocyte T entraîne celle du complexe TCR entier. Étonnamment, malgré l’abondance du TCR à leur surface, les cellules T Jurkat
1
déficientes pour IRAP ont un défaut de signalisation majeur, illustré par la diminution de la phosphorylation de plusieurs protéines de la cascade de signalisation. Ce défaut de signalisation perturbe une des principales fonctions des lymphocytes T, la sécrétion de l’interleukine 2, comme nous avons pu le constater en activant ces lymphocytes avec un super-antigène ou avec un antigène spécifique du mélanome (le peptide MART-1).
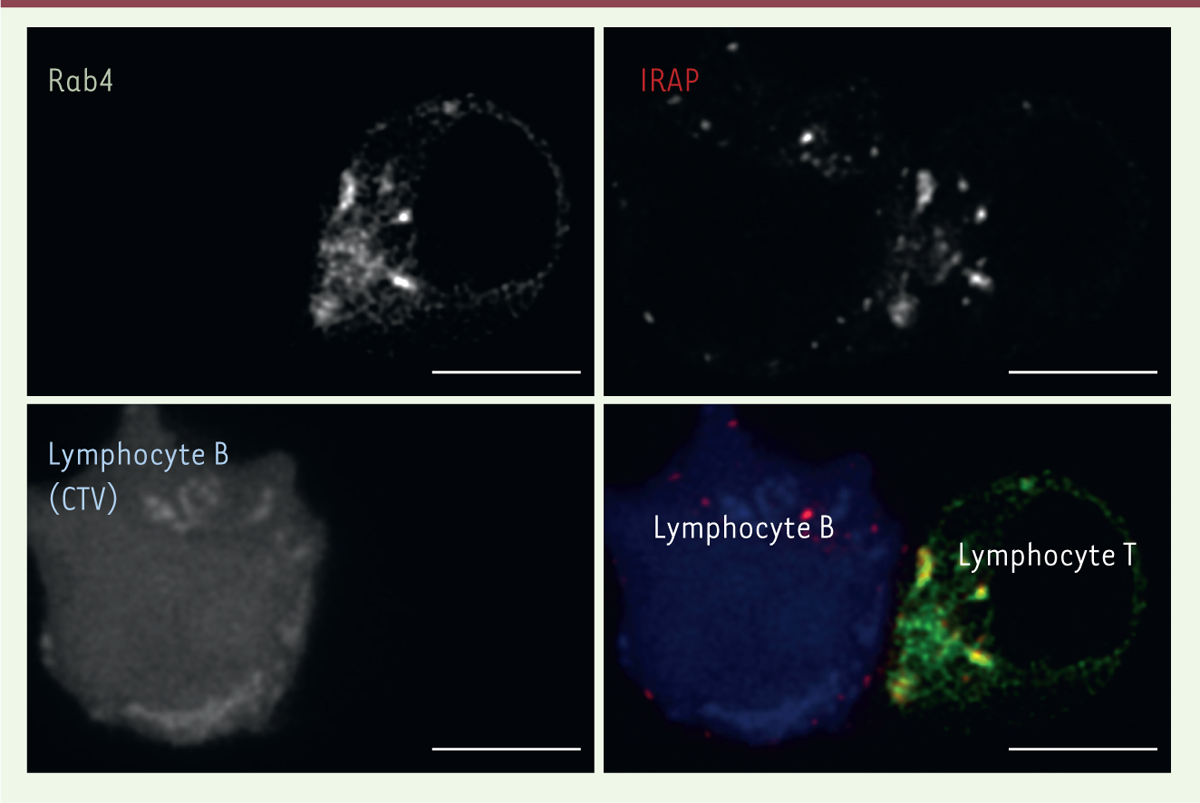
 | Figure 2.
Les vésicules contenant IRAP et Rab4 sont polarisées vers la synapse immunologique.
Des lymphocytes T Jurkat exprimant une protéine de fusion GFP (
green fluorescent protein
) – Rab4 (une petite GTPase) ont été incubés avec des lymphocytes B Raji (colorés avec le fluorochrome
Cell Trace Violet
, CTV), qui présentent le super-antigène
staphylococcal enterotoxin E
(SEE). Après la formation de la synapse immunologique, les cellules ont été fixées, perméabilisées, et les protéines Rab4 et IRAP ont été visualisées par immunofluorescence à l’aide d’anticorps spécifiques. Les endosomes contenant IRAP et Rab4 sont recrutés à la synapse immunologique formée entre les lymphocytes T et B. Ces endosomes contiennent également la chaîne ζ du complexe TCR [
4
]. Barre d’échelle : 5 mm.
|
Pour comprendre les raisons de la signalisation réduite du TCR en l’absence d’IRAP, nous avons étudié les synapses immunologiques entre les lymphocytes T Jurkat déficients pour IRAP et des lymphocytes B présentant le super-antigène
staphylococcal enterotoxin E
(SEE) par microscopie de fluorescence par réflexion totale interne (TIRF) et par microscopie confocale. Nous avons ainsi pu montrer que le recrutement de plusieurs protéines de la voie de signalisation du TCR à la synapse immunologique est défectueux.
En l’absence d’IRAP, en plus du défaut du recrutement de la chaîne ζ du TCR et des protéines de signalisation à la synapse immunologique, la signalisation impliquant la chaîne ζ est également fortement réduite dans l’endosome. Pour le montrer, nous avons utilisé une molécule de fusion entre la chaîne ζ du complexe TCR (CD3ζ) et la kinase ZAP70 et les protéines fluorescentes GFP (
green fluorescent protein
) et mCherry. Cette construction permet de mesurer directement l’activation du TCR par la technique FRET (
fluorescence resonance energy transfer
) – FLIM (
fluorescence-lifetime imaging microscopy
) [
7
]. En utilisant cette technique, nous avons observé, dans les lymphocytes T déficients pour IRAP, une diminution significative de la signalisation impliquant la chaîne ζ à l’intérieur de la cellule, tandis que la signalisation persiste à la membrane plasmique. De plus, une étude en temps réel de la dynamique de recrutement de la chaîne ζ à la synapse immunologique a révélé que le compartiment intracellulaire alimente continuellement cette synapse avec la chaîne ζ dans les cellules normales, tandis que les cellules déficientes pour IRAP ont une synapse immunologique beaucoup plus statique, plutôt alimentée par la chaîne ζ localisée à la surface de la cellule. Par ailleurs, la présence de plusieurs protéines de signalisation dans les vésicules contenant IRAP au cours de l’activation du lymphocyte T renforce l’hypothèse de l’existence d’une signalisation essentielle impliquant la chaîne ζ présente dans les endosomes. Au cours de l’activation de lymphocytes T déficients pour IRAP, ces protéines de signalisation sont localisées à la membrane plasmique plutôt que dans les endosomes. Enfin, la S-acylation de la protéine IRAP s’est révélée cruciale pour l’interaction entre IRAP et la chaîne ζ. Ces résultats indiquent que la protéine IRAP contrôle la dynamique du TCR et la signalisation intracellulaire impliquant sa chaîne ζ.
|
La protéine IRAP est nécessaire à la survie de lymphocytes T dans les organes lymphoïdes secondaires et à la réponse anti-tumorale des lymphocytes T
Nous avons montré que la protéine IRAP était co-localisée avec le TCR, non seulement dans les cellules T Jurkat, mais aussi dans les lymphocytes T primaires de souris. De plus, les lymphocytes T effecteurs provenant de souris rendues génétiquement déficientes pour IRAP ont montré, à l’instar des cellules T Jurkat, une expression élevée du TCR à leur surface, accompagnée d’un défaut de signalisation. Ce défaut s’est révélé plus important quand les lymphocytes T déficients pour IRAP ont été activés avec un antigène de faible affinité pour le TCR. Dans ce cas, malgré un nombre de divisions initiales identique entre les cellules normales et les cellules déficientes pour IRAP, les lymphocytes T activés n’ont pas survécu en l’absence de IRAP. Ces résultats nous ont conduits à analyser les populations cellulaires T chez les souris déficientes en IRAP, et nous avons montré que ces souris ont une lymphopénie. Afin de déterminer si cette lymphopénie provenait d’un défaut de sélection thymique, nous avons d’abord analysé, chez des souris normales, les niveaux d’expression de la protéine IRAP dans les différentes sous-populations de lymphocytes T par cytométrie en flux. Nous avons trouvé que l’expression d’IRAP augmente graduellement au cours de la sélection thymique, et atteint son maximum dans les lymphocytes T matures localisés dans les organes lymphoïdes secondaires. Nous n’avons pas trouvé d’altération des sous-populations thymiques de lymphocytes T chez les souris rendues déficientes pour IRAP, ce qui nous a amenés à conclure que la lymphopénie de ces souris provenait d’un défaut de survie des lymphocytes dans les organes lymphoïdes secondaires, probablement lié à une diminution du signal tonique reçu en permanence par les lymphocytes T lors de leur rencontre avec des antigènes du soi, de très faible affinité pour le récepteur TCR [
8
,
9
].
Enfin, nous avons étudié l’importance de la protéine IRAP dans les lymphocytes T au cours d’une réponse immunitaire anti-tumorale. Les souris mutantes chez lesquelles le gène codant IRAP est invalidé exclusivement dans les lymphocytes T présentent, comparativement aux souris témoins de génotype normal, une plus forte croissance tumorale, ainsi qu’un défaut du recrutement de lymphocytes T CD8
+
dans la tumeur. Ainsi, les résultats de notre étude peuvent non seulement servir de base pour l’étude de la signalisation intracellulaire d’autres immunorécepteurs contenant des motifs ITAM, mais pourraient également être exploités pour renforcer l’efficacité des immunothérapies ciblant les lymphocytes T.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été financé par l’Agence nationale de la recherche (ANR, projets CytoEndoStor et IDEA).
|
Footnotes |
1.
Alcover
A
,
Alarcon
B
,
Di Bartolo
V
.
Cell biology of T cell receptor expression and regulation.
.
Annu Rev Immunol.
2018;
;
36
:
:103.
–
125
.
2.
Soares
H
,
Henriques
R
,
Sachse
M
,
et al.
Regulated vesicle fusion generates signaling nanoterritories that control T cell activation at the immunological synapse.
.
J Exp Med.
2013;
;
210
:
:2415.
–
2433
.
3.
Love
PE
,
Hayes
SM
.
ITAM-mediated signaling by the T-cell antigen receptor.
.
Cold Spring Harb Perspect Biol.
2010;
;
2
:
:a002485.
.
4.
Evnouchidou
I
,
Chappert
P
,
Benadda
S
,
et al.
IRAP-dependent endosomal T cell receptor signalling is essential for T cell responses.
.
Nat Commun.
2020;
;
11
:
:2779.
.
5.
Saveanu
L
,
van Endert
P
.
The role of insulin-regulated aminopeptidase in MHC class I antigen presentation.
.
Front Immunol.
2012;
;
3
:
:57.
.
6.
Babdor
J
,
Descamps
D
,
Adiko
AC
,
et al.
IRAP
+
endosomes restrict TLR9 activation and signaling
.
.
Nat Immunol.
2017;
;
18
:
:509.
–
518
.
7.
Yudushkin
IA
,
Vale
RD
.
Imaging T-cell receptor activation reveals accumulation of tyrosine-phosphorylated CD3z in the endosomal compartment.
.
Proc Natl Acad Sci USA.
2010;
;
107
:
:22128.
–
22133
.
8.
Kirberg
J
,
von Boehmer
H
,
Brocker
T
,
et al.
Class II essential for CD4 survival.
.
Nat Immunol.
2001;
;
2
:
:136.
–
137
.
9.
Martin
B
,
Becourt
C
,
Bienvenu
B
,
Lucas
B
.
Self-recognition is crucial for maintaining the peripheral CD4
+
T-cell pool in a nonlymphopenic environment
.
.
Blood.
2006;
;
108
:
:270.
–
277
.
|