| |
| Med Sci (Paris). 36(12): 1173–1180. doi: 10.1051/medsci/2020224.Vieillissement Une approche globale, multidimensionnelle et préventive Axel Guilbaud,1 Aurélie Mailliez,1,2 and Éric Boulanger1,2,3* 1Univ. Lille, Inserm, CHU Lille, Institut Pasteur de Lille, U1167 - RID-AGE
,
F-59000
,
Lille
,
France 2Pôle de gérontologie, Centre hospitalier universitaire de Lille
,
F-59000
,
Lille
,
France 3Département universitaire de gériatrie et biologie du vieillissement, Faculté de médecine de Lille
,
F-59000
,
Lille
,
France |
Le vieillissement n’est pas une maladie mais une évolution dans le temps qui conduit au dysfonctionnement d’organes, puis à la mort. Il touche à l’ensemble de l’intégrité des organismes, depuis la cellule jusqu’à l’individu, en passant par l’insuffisance d’organes en lien avec les modifications cellulaires et tissulaires liées au temps.
Le vieillissement débute très tôt. La programmation des « 1 000 premiers jours de vie » sur la vie d’adulte et ses maladies « programmées », augure en effet d’un vieillissement qui sera réussi ou non. L’importance de cette période très précoce de la vie a incité l’actuel président de la République Française, Emmanuel Macron, à créer une « commissions des 1 000 premiers jours de la vie de l’enfant » en septembre 2019
1
. Nous verrons néanmoins que la période pré-conceptuelle « influence » également le vieillissement de l’être à venir.
Le vieillissement est physiologique. Il est le résultat d’une réduction progressive des réserves fonctionnelles de l’individu. Il peut cependant être accéléré par nos habitudes de vie et par la survenue des maladies chroniques qui en résultent, et qui sont bien souvent évitables : broncho-pneumopathie chronique obstructive, cancers dus au tabagisme ; cancers, cirrhose, avec la prise d’alcool ; dyslipidémie, obésité, diabète de type 2, hypertension artérielle, accident vasculaire cérébral, etc. qui résultent d’une mauvaise nutrition et de la sédentarité. Des progrès ont été réalisés pour traiter ces différentes pathologies. Mais, pour les problèmes liés au vieillissement, il nous faut oublier les maladies d’organes et aborder une autre vision de la médecine avec la prévention et la prise en charge globale et multidimensionnelle du patient âgé. Le but ultime à atteindre pour ces problématiques n’est donc en effet plus d’éviter telle ou telle maladie, mais d’éviter la dépendance physique et/ou cognitive de la personne âgée, dépendance qui est souvent le résultat des maladies chroniques dont elle souffre. La médecine française d’aujourd’hui est une médecine très spécialisée, de haut niveau, rapide et quasi gratuite. Mais l’on attend encore trop souvent la survenue de l’évènement aigu pour prendre conscience de l’intérêt de sa prévention. Il est alors fréquemment trop tard et la maladie chronique s’est déjà installée : les chances de bien vieillir sont alors fortement diminuées. Le vieillissement peut pourtant être ralenti. Cela repose sur une bonne hygiène de vie, en évitant les facteurs de risques des maladies évitables (par la prévention primaire), en dépistant ces maladies (la prévention secondaire), et en évitant leurs complications (la prévention tertiaire). C’est ici que le vieillissement actif prend toute sa place afin qu’il soit réussi. Mais encore faut-il le décider et que l’éducation en santé soit optimisée et diffusée. Le but est donc de vieillir en bonne santé (« bien vieillir »), en gardant toute son autonomie fonctionnelle et pour cela, il est nécessaire d’être acteur de son vieillissement et non plus le subir. |
Le vieillissement vu sous l’angle de la biologie Dans le contexte biologique, le vieillissement se caractérise par l’accumulation d’évènements qui détériorent les fonctions des organes, et par une augmentation, avec le temps, des risques de décès ou de développer des maladies (cancer, diabète, troubles cardiovasculaires ou cérébraux, etc.). La recherche biologique sur le vieillissement s’intéresse, par définition, à l’étude de cette accumulation d’innombrables évènements inévitables qui apparaissent au cours de la période comprise entre la conception et le décès de l’individu.
Si la définition du vieillissement paraît simple, les différents mécanismes qui en sont à l’origine restent mal définis et sujets à controverses. Qu’est-ce que vieillir ? Quels en sont les mécanismes physiologiques et pathologiques ? Plus de 300 « théories du vieillissement » visant à l’expliquer ont été proposées [
1
]. En 1965, Léonard Hayflick avait montré qu’une cellule « normale » ne pouvait se diviser qu’un nombre limité de fois. La vieillesse cellulaire existait donc avec un certain déterminisme. Il avait ainsi révélé un processus physiologique, appelé sénescence, qui empêche les cellules âgées ou endommagées, de se répliquer [
2
]. Dès lors, de nombreux mécanismes de cette sénescence ont été découverts, chacun permettant de mieux appréhender le processus du vieillissement.
Parmi les théories les plus étudiées, celle dite « des radicaux libres » fait intervenir des espèces réactives de l’oxygène et de l’azote, qui sont issues de réactions métaboliques endogènes (ion superoxyde, peroxyde d’hydrogène, peroxynitrite, etc.) en réponse à des stress cellulaires. Ces produits induisent
in fine
des dommages aux lipides, aux protéines et à l‘ADN de la cellule [
3
]. Une autre théorie fait, elle, intervenir le « déclin mitochondrial ». Elle repose sur une diminution, liée à l’âge, de la capacité respiratoire des mitochondries. Elle est à l’origine de la formation d’ions superoxydes et de peroxyde d’hydrogène [
4
]. La réaction de glycation propose une autre théorie. Ce processus biochimique est caractérisé par la formation de produits issus de réactions non enzymatiques, entre un sucre réducteur et la fonction amine d’un acide aminé, porté par un peptide ou une protéine, impliquant majoritairement une lysine ou une arginine. Cette glycation peut altérer la fonction des protéines qu’elle cible et, par conséquent, induire des processus inflammatoires et oxydatifs lorsque ces protéines glyquées se fixent au récepteur RAGE (
receptor for advanced glycation end-products
) qui leur est spécifique. Avec l’âge, ces protéines modifiées peuvent également s’accumuler dans les organes et altérer leurs fonctions [
5
].
La définition du vieillissement s’est complexifiée au cours du temps. Elle s’est organisée et est devenue évolutive, faisant intervenir différents processus physiologiques. Les mécanismes du vieillissement varient en fonction des espèces. On en distingue deux catégories qui ne s’excluent pas mutuellement : la première rassemble les théories se fondant sur un vieillissement qui serait programmé ; la seconde explique le processus par une accumulation de dommages qui ont diverses origines [
6
].
La première catégorie est relative au temps. Elle regroupe la sénescence cellulaire [
6
], l’instabilité génétique, l’attrition des télomères [
7
], l’influence des cycles hormonaux (par la voie de l’insuline et de l’IGF-1 [
insulin-like growth factor-1
]) [
8
], ou encore un déclin du système immunitaire [
9
].
La seconde catégorie englobe des mécanismes délétères, comme le dysfonctionnement mitochondrial, l’accumulation d’espèces réactives de l’oxygène (ions superoxydes, peroxyde d’hydrogène, etc.) et de l’azote (peroxynitrite, monoxyde d’azote, etc.), les dommages de l’ADN, l’accumulation des produits de glycation (hémoglobine glyquée [HbA1c], fructoseamines, carboxy(méthyl/éthyl)lysine, etc.), ou des perturbations de la détection des nutriments [
6
]. Tous ces processus ont été l’objet de nombreuses études qui ont permis de mieux les comprendre. Néanmoins, il semblerait que le vieillissement s’explique plus par l’accumulation d’altérations résultant d’une multitude de mécanismes, que par une théorie unique.
Chez l’homme, l’étude du vieillissement est difficile, en raison de contraintes éthiques et socioculturelles, et de par son espérance de vie élevée qui rend complexe son suivi. Aussi, ces dernières décennies, de nombreux modèles animaux ont été développés. Ils regroupent des modèles simples, comme la levure, jusqu’à des organismes plus complexes, plus proches de l’homme. L’un des premiers modèles utilisés a été le ver
Caenorhabditis elegans
. Grâce à sa courte durée de vie (17 jours à 20 °C) et au séquençage complet de son génome, il a été, en développant des modèles transgéniques, très utile pour étudier le vieillissement [
10
,
11
] (
→
).
(→) Voir la Synthèse de R. Litke
et al.
,
m/s
n° 6-7, août-septembre 2018, page 571
Les poissons ont été aussi sollicités. Le poisson zèbre (
Danio rerio
), en raison de ses capacités de régénérations tissulaires importantes, a été particulièrement utilisé pour étudier la longévité [
12
]. Les oiseaux, qui ont une espérance de vie relativement élevée, rapportée à leur petite taille
2
[
42
], ont également été de très bons modèles d’étude. Ils ont aussi une particularité : des taux de glycémie importants, comparables à ceux des patients diabétiques (sans doute pour produire l’énergie nécessaire à leur vol), qui sont pourtant associés à un faible niveau d’insuline. Cette observation a ainsi suggéré le rôle important de l’axe insuline/IGF-1 dans le vieillissement [
13
], avec, nous le verrons, des applications potentielles.
Parmi les mammifères, des modèles murins de restriction calorique [
14
], ou des modèles de souris transgéniques [
15
], sont couramment utilisés afin d’étudier les mécanismes du vieillissement, mais aussi afin d’améliorer la compréhension des processus impliqués dans la survenue des syndromes progéroïdes (c’est-à-dire de vieillissement accéléré), comme le syndrome de Werner
3,
ou le syndrome de Hutchinson-Gilford, aussi appelé progéria
4
. Chez le rat, le modèle communément exploité, est le rat-taupe nu (
Heterocephalus glober
). Avec 30 ans d’espérance de vie, ce rat détient le record de longévité chez les rongeurs. Il est particulièrement intéressant puisqu’il développe des altérations physiologiques qui sont similaires à celles observées chez l’homme lors du vieillissement, telles qu’une dégénérescence oculaire ou une ostéoporose, mais paradoxalement sa fertilité s’accroît jusqu’à son décès [
16
]. Le primate non humain (en particulier le macaque rhésus, ou
Macaca mulatta
) est probablement le modèle d’étude du vieillissement et des pathologies associées le plus proche de l’homme. Cependant, bien que différents programmes aient été développés avec ces animaux, des contraintes, telles que leur poids, leur durée de vie relativement longue, les comportements à risque et la transmission possible de pathogènes à l’homme, ainsi que les difficultés d’entretien, ont rendu leur utilisation difficile en laboratoire [
17
].
L’étude du vieillissement reste un axe de recherche encore jeune. Il soulève ainsi sans cesse de nouvelles questions qui restent débattues : ce qui est connu actuellement ne représente en fait qu’une goutte d’eau dans cet océan encore inexploré…
La complexité du vieillissement physiologique repose en fait sur la globalité de son impact : il intéresse l’ensemble des organes ; il est modulé par des facteurs qui peuvent être internes (c’est-à-dire physiologiques) mais aussi externes (environnementaux). Les modèles qui ont été développés ont pour but, chacun, de répondre à des questions très précises qui sont résumées dans le
Tableau I
. Les recherches actuelles, qu’elles soient scientifiques ou cliniques, associées à des techniques toujours plus évoluées, permettent d’améliorer les connaissances sur le vieillissement et les pathologies qui y sont associées. Rappelons néanmoins que cette recherche a pour but non de vivre plus longtemps mais d’appréhender le vieillissement de manière à « vieillir mieux ».
Tableau I.
| Modèles |
Avantages |
Champs d’étude |
| Levure |
– Croissance rapide
– Manipulations génétiques simples
– Criblage rapide
|
– Déterminer des candidats protéiques et géniques en réponse à différents stress |
|
Caenorhabditis elegans
|
– Courte durée de vie (12 à 18 jours à 20 °C)
– Petite taille (1 mm)
– Corps transparent
– Manipulations génétiques simples
– Disponibilité de mutants
|
– Réponses cellulaires à différents stress
– Mécanismes du vieillissement induits par différents stress (radiations, stress oxydant)
– Voies neuronales induites par un stress
|
| Drosophile |
– Bonne fertilité
– Disponibilité de modèles transgéniques
– Stades de développement distincts
– Vieillissement et neuro-dégénération visible sur les facettes des yeux
|
– Analyses des changements phénotypiques induits par différents types de stress
– Analyses du système immunitaire
|
| Zebrafish (poisson-zèbre) |
– Génome conservé avec le temps
– Faible coût
– Forte fécondité
– Manipulations génétiques simples
|
– Études de la sénescence cellulaire
– Études sur la régénération tissulaire
|
|
Killifish (Cyprinodontes)
|
– Courte durée de vie (3 à 9 mois)
– Mécanismes du vieillissement similaires à ceux de nombreux organismes dont l’homme
– Modifications génétiques possibles
|
– Instabilité génomique (cancer, syndromes progéroïdes)
– Dysfonctions mitochondriales, métaboliques, autoimmunes, cardiovasculaires
|
| Souris |
– Génome proche de l’homme
– Transplantations possibles
– Développement de mutants
– Constructions de modèles pathologiques
|
– Études de restriction calorique
– Études des mécanismes impliqués dans les syndromes progéroïdes (syndrome de Werner, Hutchinson-Gilford, etc.)
|
| Rat-taupe nu |
– Record de longévité (30 ans)
– Similitudes physiologiques avec l’homme
– A la particularité de ne pas développer de cancer grâce à des molécules protectrices tel que l’acide hyaluronique
|
– Études du cancer
– Études sur la dégénérescence oculaire
– Études des mécanismes de l’ostéoporose
– Reproduction sexuelle
|
| Oiseaux |
– Grande longévité (plusieurs dizaines d’années)
– Vieillissement lent malgré leur fort métabolisme
– Mécanismes adaptatifs de défense contre le stress oxydant et glycoxydant
|
– Études de la glycémie ainsi que des voies physiologiques induites par l’insuline (axe insuline/ IGF-1)
– Études sur la reproduction et la restriction calorique ou le système cérébral
|
|
Microcèbe
(Lémurien)
|
– Petite taille (12 cm adulte) et longue durée de vie (3 à 4 ans à l’état sauvage et 8 à 14 ans en captivité), avec différents stades de vie distincts
– Changements phénotypiques liés à l’âge : morphologiques, comportementaux, sensoriels, cognitifs
– 20 à 30 % de la population développent un équivalent de la maladie d’Alzheimer avec l’âge
|
– Maladies neurodégénératives
– Évaluations de traitements pour la maladie d’Alzheimer
|
| Macaque Rhésus |
– Partage 95 % d’homologie génétique avec l’homme
– Similitudes physiologiques, anatomiques, métaboliques, endocriniennes, reproductives, immunitaires avec l’homme
|
– Études sur le vieillissement des organes (systèmes cardiovasculaire, pulmonaire, musculaire, oculaire, rénal, reproductif, cérébral)
– Études en lien avec le métabolisme et l’alimentation
|
Modèles utilisés pour l’étude du vieillissement : avantages et champs d’études.
|
|
Le vieillissement vu en gériatrie
À l’échelle mondiale, la proportion de personnes âgées de 60 ans et plus est en constante augmentation depuis plusieurs années. En France, d’après les projections de l’Institut national de la statistique et des études économiques (Insee), un individu sur trois aura 60 ans et plus en 2050 (ils étaient un sur cinq en 2005). Accompagner ce vieillissement de la population est donc devenu un enjeu de santé publique mais aussi socio-économique. Le vieillissement est un processus physiologique qui intervient chez tous les êtres vivants. Il correspond à un déclin qui altère, à l’échelle moléculaire et cellulaire, les capacités fonctionnelles de l’individu et ses possibilités d’adaptation face à un évènement aigu auquel il est confronté (une maladie, un stress) [
18
]. Ce processus qui est complexe et multifactoriel, se déroule lentement et progressivement, rendant l’individu plus vulnérable face au risque de maladies et de décès.
L’âge chronologique (ou âge civil) n’est en fait pas le reflet de l’âge physiologique (ou âge biologique) d’un individu. L’Organisation mondiale de la santé (OMS), dans son rapport mondial sur le vieillissement et la santé
5
, explique qu’il n’existe pas de modèle-type qui puisse définir la personne âgée. En effet, certains sujets âgés de 80 ans présentent, contrairement à d’autres du même âge, des capacités physiques et cognitives conservées et qui sont comparables à celles de sujets plus jeunes. Pour expliquer, en partie, ces différences entre individus, des travaux récents ont montré que le déroulement des 1 000 premiers jours d’un enfant, qui correspondent aux 2 à 3 premières années de vie, et l’environnement qui y est associé, aurait un impact sur la santé du futur adulte qu’il deviendra. Ceci est en fait également vrai dès la période pré-conceptionnelle, c’est-à-dire dès la maturation des gamètes, jusqu’au développement de l’embryon puis du fœtus. Au cours de cette période, le mode de vie des parents peut influencer les risques encourus à long-terme par l’enfant, tant sur les plans cardio-vasculaire, métabolique, immunitaire que neurologique [
19
]. Différents facteurs environnementaux parentaux (dus à leur mode de vie), notamment leur régime alimentaire, leur composition corporelle, leur équilibre métabolique ou le stress qu’ils ont subi, ont en effet un impact sur l’état de santé et le risque de survenue de maladies chroniques de leur enfant, tout au long de sa vie [
19
]. Il est ainsi aujourd’hui admis qu’il existe des interactions permanentes entre l’environnement de l’enfant et ses prédispositions génétiques [
20
]. Ce processus a été appelé « concept des origines de la santé et des maladies » ou DOHad (
developmental origins of health and disease
) (
→
).
(→) Voir numéro thématique DOHaD,
m/s
n° 1, janvier 2016, pages 7-126
La balance entre patrimoine génétique de l’enfant et facteurs extrinsèques qu’il rencontre, repose sur des processus épigénétiques, par lesquels ces facteurs environnementaux qui ont pour origine ses expériences de vie, influencent l’expression de ses gènes. Le fonctionnement optimal de l’organisme On considère généralement que le fonctionnement de l’ensemble des systèmes physiologiques est optimal entre 20 et 30 ans d’âge. En effet, à partir de l’âge de 30 ans, une altération lente et progressive du fonctionnement de chaque organe apparaît.
Ainsi, la composition corporelle se modifie : avec l’âge, on constate une inversion entre masse grasse et masse maigre, avec une augmentation de la masse grasse et une diminution de la masse maigre chez les sujets âgés [
21
].
Au niveau cérébral, le volume de certaines régions diminue : principalement le noyau caudé, le cervelet, les hippocampes et les aires préfrontales et, dans une moindre mesure, le cortex entorhinal [
22
]. Les facultés d’apprentissage et de mémorisation, d’attention, de prise de décision, de perception sensorielle et de coordination motrice déclinent également [
23
]. La vitesse de conduction nerveuse est ralentie, par altération des gaines de myéline. Les capacités de régénération des axones et de restauration des connexions, à la suite d’une lésion nerveuse, sont aussi diminuées [
24
].
Au niveau cardiaque, les parois du cœur s’épaississent, les cardiomyocytes s’hypertrophient et des tissus fibreux se développent [
25
]. Ces modifications structurales peuvent avoir des répercussions fonctionnelles, en altérant le fonctionnement valvulaire, comme la conduction cardiaque
via
le tissu nodal. Les parois des artères de gros calibre s’épaississent également et se rigidifient.
Le système respiratoire, quant à lui, subit une diminution de l’élasticité pulmonaire et de la force des muscles respiratoires [
26
]. Les volumes pulmonaires mobilisables (volume expiratoire maximal seconde, VEMS et capacité vitale forcée, CVF) décroissent [
27
] et les échanges gazeux s’altèrent, avec, au niveau du sang, une diminution progressive de la pression partielle de l’oxygène (PaO
2
) jusqu’à environ 70 ans. La PaCO
2
(pression partielle de dioxyde de carbone) et le pH sanguin ne sont, en revanche, pas modifiés avec l’âge.
Au sein de l’appareil digestif, la surface de l’intestin grêle s’amoindrit, en raison d’une diminution des villosités intestinales, ce qui engendre une réduction de l’absorption des nutriments et un accroissement du risque de carence nutritionnelle pour l’individu. Le nombre de cellules nerveuses du plexus mésentérique diminue également. Cela entraîne une moindre motilité gastro-intestinale avec, comme conséquence, une augmentation des troubles digestifs, dont la constipation [
28
].
Le vieillissement intéresse donc tous les organes et a des conséquences sur l’ensemble de la physiologie de l’individu. Les différentes trajectoires du vieillissement : notion de fragilité
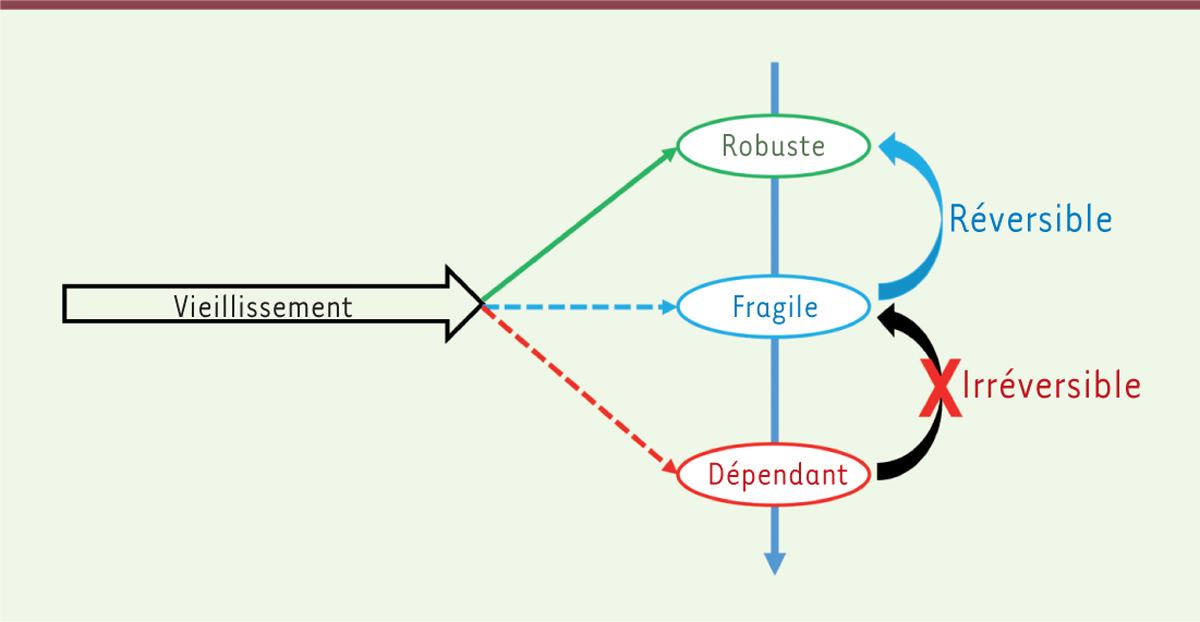
À ce vieillissement différentiel des organes, s’ajoute un différentiel inter-individuel. La trajectoire de vieillissement d’un individu s’oriente en effet selon trois états différents qui ont été identifiés
(
Figure 1
)
. Si son vieillissement est réussi, le sujet sera ainsi qualifié de « robuste ». S’il est pathologique et accéléré, l’individu sera alors appelé « polypathologique » et « dépendant ». Il s’agit d’un stade irréversible. Un état intermédiaire, entre ces deux extrêmes, consiste en un statut qui a la possibilité d’être réversible vers un état de robustesse, si une action précoce et adaptée est mise en place : il s’agit du statut « fragile ». Ce terme de fragilité a vu son utilisation croître exponentiellement depuis la publication de sa principale définition, formulée par Linda Fried, en 2001 [
29
]. Il s’agit d’un syndrome gériatrique multidimensionnel qui est caractérisé par une diminution des réserves fonctionnelles de l’individu, le rendant alors plus vulnérable aux facteurs de stress endogènes et exogènes, et donc à la survenue de maladies [
30
]. Les individus dits « fragiles » sont ainsi à plus haut risque de chutes, d’hospitalisations, de pertes d’autonomie et de mortalité, par rapport aux sujets dits non fragiles et « robustes ».
 | Figure 1.
Différentes trajectoires survenant au cours du vieillissement.
|
Plus de 40 échelles de détermination de la fragilité ont été proposées dans la littérature [
31
]. La plus connue et la plus utilisée est l’échelle élaborée par Linda Fried [
29
]. Elle repose sur un score binaire (vrai ou faux) évaluant cinq critères
(
Tableau II
)
:
-
une perte de poids involontaire ;
-
une faiblesse musculaire ;
-
une fatigue ;
-
la vitesse de marche lente ;
-
la faible activité physique.
Tableau II.
| Critères de fragilité |
Définitions |
| Perte de poids involontaire |
Perte involontaire de 4,5 kg ou ≥ 5 % poids corporel durant l’année qui précède le test |
| Faiblesse musculaire |
Mesurée avec un dynamomètre. Score inférieur au 20
e
percentile, après ajustement sur le sexe et l’indice de masse corporelle (kg/m
2
)
|
| Fatigue |
Fatigue rapportée par le sujet, identifiée par une réponse positive à 2 questions de la CES-D Scale (échelle de dépression) |
| Vitesse de marche lente |
Mesurée pour une distance de 4,6 mètres. Score inférieur au 20
e
percentile, après ajustement sur le sexe et la taille
|
| Faible activité physique |
Dépense calorique hebdomadaire. Score inférieur au 20
e
percentile, après ajustement sur le sexe
|
Critères de fragilité.
Si le sujet a 3 critères présents ou plus, il est fragile. S’il n’a aucun critère présent, il est robuste. Entre les deux, si le sujet présente 1 ou 2 critères, il est défini comme pré-fragile. La fragilité est un état lié à l’avancée en âge. Sa prévalence est estimée à 4 % des sujets entre 65 et 69 ans et jusqu’à 26 % des plus de 85 ans. Environ 10 % des sujets asymptomatiques vivant au domicile sont des sujets fragiles. On note une fréquence plus importante chez les femmes (9,6 % contre 5.2 % chez les hommes) [
32
]. CES-D (
center for epidemiologic studies-depression
) Scale : l’échelle CES-D évalue l’humeur du sujet en lui demandant avec quelle fréquence, durant la semaine écoulée, il a ressenti des symptômes ou des comportements souvent associés à la dépression.
|
Si la réponse à trois de ces critères, ou plus, est positive, le sujet sera dit « fragile ». Si aucun critère n’est vrai, il sera « robuste ». Entre les deux, il sera défini comme « pré-fragile ». L’abord de la personne âgée : rechercher des syndromes gériatriques L’évaluation clinique d’une personne âgée débute par un abord médical standard, complété par la recherche et l’évaluation de syndromes gériatriques. Un syndrome gériatrique est défini par la coexistence de quatre caractéristiques : sa fréquence augmente avec l’âge ; il résulte de multiples facteurs favorisants et précipitants ; il augmente le risque de perte d’indépendance fonctionnelle et donc d’institutionnalisation ; et il nécessite une prise en charge globale et multidisciplinaire du patient.
Parmi les syndromes à examiner, les principaux syndromes gériatriques sont : la polypathologie, la dépendance, la iatrogénie
6,
, la dénutrition, les troubles neuro-sensoriels, cognitifs, sphinctériens ou de la marche, la confusion, la dépression, la douleur, et les complications de décubitus
7
.
Un syndrome gériatrique peut être à l’origine d’autres syndromes. Les troubles neuro-sensoriels et cognitifs peuvent ainsi conduire à une confusion et à la dépendance. Lorsque ces syndromes s’emballent et surviennent consécutivement, on parle alors de cascade gériatrique.
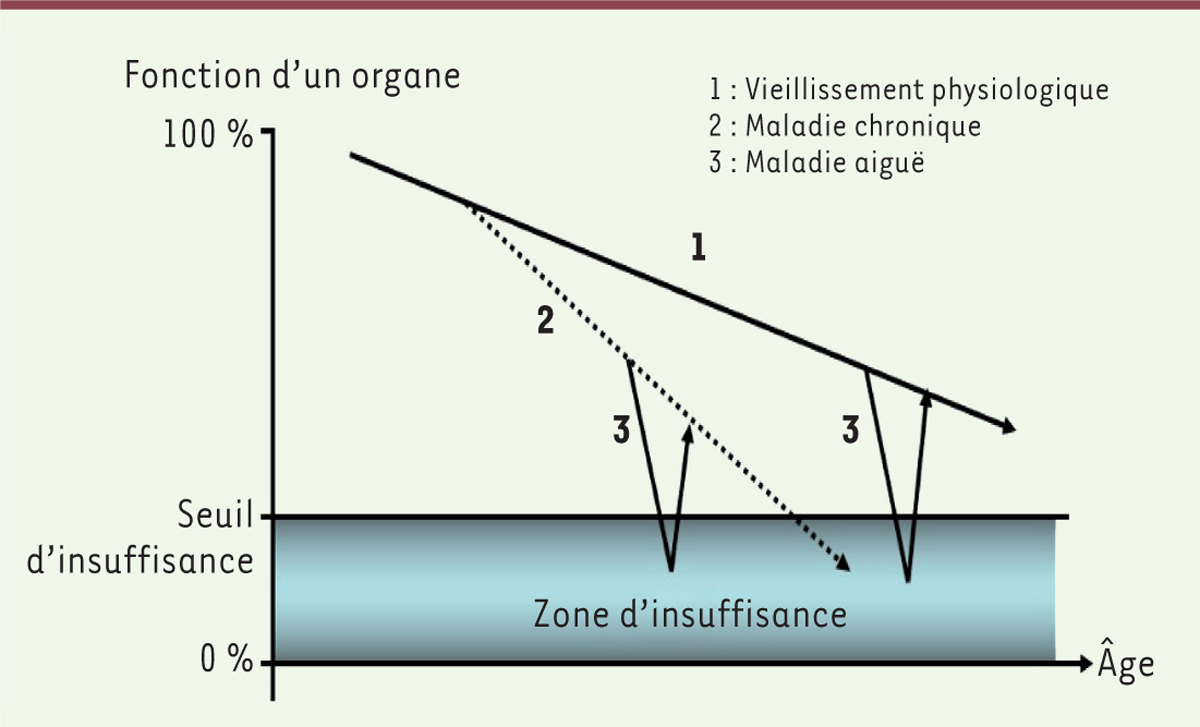
La cascade gériatrique est un phénomène dans lequel une affection aiguë entraîne des décompensations organiques en cascade. Le modèle « 1+2+3 » décrit par Jen-Pierre Bouchon en 1984 [
32
], illustre la diminution de la réserve fonctionnelle d’un organe et l’importance des facteurs intercurrents (qui se surajoutent à la maladie) dans la survenue d’une décompensation aiguë
(
Figure 2
)
. Il repose sur trois notions : la réserve fonctionnelle de l’organe qui diminue avec l’âge (1) ; l’altération de ses fonctions par les affections chroniques (2) ; et l’apparition d’un événement aigu (3). Deux situations peuvent alors survenir :
-
Le schéma 1+2+3 : décompensation d’un organe vieillissant (1) présentant une maladie chronique (2) sous l’effet d’un événement aigu (3).
-
Le schéma 1+3 : décompensation d’un organe vieillissant (1), sous l’effet d’un événement aigu (3), mais en l’absence de maladie chronique.
 | Figure 2.
Modèle du vieillissement 1+2+3. 1.
Effets du vieillissement : ils réduisent progressivement les réserves fonctionnelles, sans jamais à eux seuls entraîner la décompensation (passage du seuil d’insuffisance).
2.
Affections chroniques : elles se surajoutent précipitant l’altération des fonctions jusqu’au seuil d’insuffisance si elles ne sont pas traitées.
3.
Facteurs de décompensation (affections médicales aiguës, pathologie iatrogène et stress psychologique). Ils sont précipitants mais réversibles. Avec l’âge, ces facteurs deviennent plus importants dans la décompensation (selon J.P. Bouchon [
32
]).
|
Plus la maladie chronique de l’organe (2) est sévère, plus celui-ci sera à risque de décompenser à la suite d’un événement aigu (3), pourtant mineur. La prise en charge du patient associera donc le traitement du facteur aigu intercurrent, mais aussi l’optimisation du traitement de la maladie chronique initiale.
Le sujet âgé nécessite ainsi d’être évalué dans sa globalité, afin de mettre en évidence les différents syndromes gériatriques : c’est ce qui définit l’évaluation gériatrique standardisée. Il s’agit d’une approche diagnostique multidimensionnelle et interdisciplinaire, à la fois médicale, psychologique et fonctionnelle, axée sur la détermination des capacités d’une personne âgée fragile, afin de développer un plan de soins coordonné et intégré ainsi qu’un suivi à long terme [
33
-
35
].
|
Conclusion : l’importance de la prévention
La prise en charge spécialisée en gériatrie, ou médecine du vieillissement, ne pourra faire face au «
geriatric-boom »
qui a déjà commencé, avec des conséquences socio-économiques importantes. Afin de faire face à ce défi, il est désormais nécessaire d’orienter nos énergies vers la prévention, un terme qui englobe la prévention primaire, qui conduira à un vieillissement actif, et une prévention secondaire, pour diagnostiquer le plus tôt possible les fragilités encore réversibles, afin que le sujet reste « robuste ». La prévention tertiaire s’efforcera, quant à elle, d’éviter aux maladies chroniques de s’aggraver et au patient de décompenser.
Malgré une recherche active pour découvrir des marqueurs biologiques circulants (CRP [
C-reactive protein
], hémoglobine, albumine, 25-hydroxyvitamine D) [
36
], nous manquons aujourd’hui de critères spécifiques permettant de repérer les sujets dits « fragiles » et il est encore difficile de définir, chez un individu, son âge physiologique. Le rapport de Dominique Libault, remis en mars 2019, faisant suite à la concertation « grand-âge et autonomie » menée entre octobre 2018 et janvier 2019, impliquant personnes âgées, aidants et professionnels de santé
8
, a révélé les défauts de financements de la recherche clinique en gériatrie et de l’éducation en santé, et des efforts sont attendus.
Afin d’éviter la fragilité, le vieillissement actif doit désormais être considéré comme un art de vivre par la population : le vieillissement ne doit pas se subir et l’on doit être acteur de sa santé. L’éducation à la santé est donc primordiale pour un vieillissement réussi. L’activité physique est l’un des fondements du « bien vieillir » : elle permet en effet de prévenir l’ostéoporose, à l’origine des fractures lors des chutes, et la sarcopénie, responsable de la faiblesse musculaire. L’activité physique est également, le plus souvent, associée à des interactions sociales. Elle va aussi de pair avec une nutrition adaptée, une réponse à la dénutrition qui accompagne le vieillissement. Et, pour une activité physique sans risque, il est nécessaire que la vision et l’audition soient optimales…, des atteintes qui conditionnent le « vieillir ensemble » et donc le « bien vieillir ». Tous ces éléments constituent le vieillissement actif. Ils ralentissent le vieillissement cérébral et physique et augmentent ainsi les chances de garder une autonomie fonctionnelle le plus longtemps possible [
37
]. Il suffit donc de le savoir et de décider de le faire.
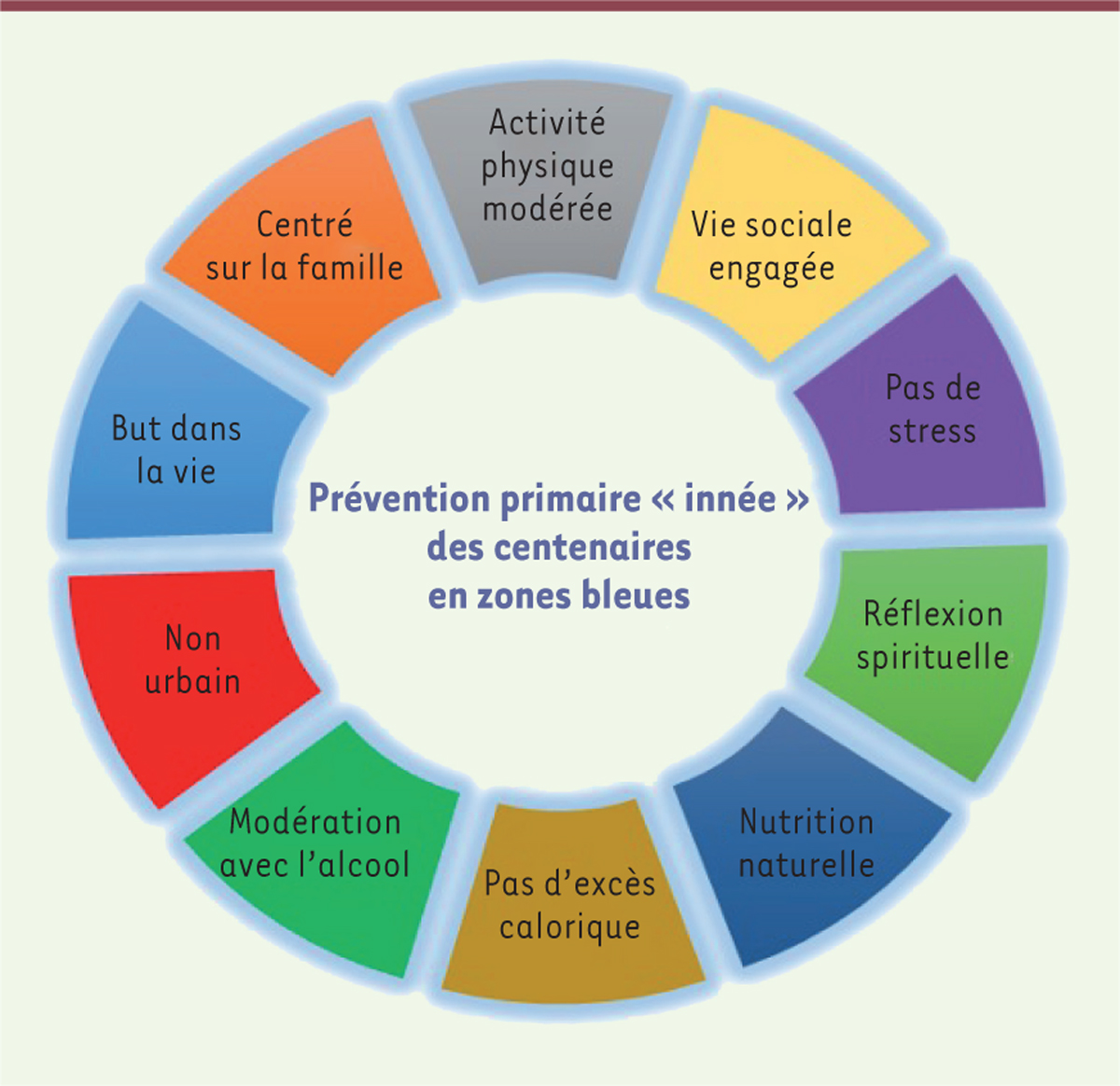
Un modèle de ce « bien vieillir » existe. Bien qu’empirique, il démontre que le vieillissement actif fonctionne. Il s’agit de celui des « zones bleues », des régions qui ont la caractéristique d’abriter une proportion importante de centenaires
9
. Cinq « zones bleues » ont été identifiées à ce jour dans le monde : les villages de la province de Nuoro, en Sardaigne, Italie ; l’île d’Ikaria, en Grèce ; l’île d’Okinawa, au Japon ; la péninsule de Nicoya, au Costa Rica ; et la ville de Loma Linda, en Californie, États-Unis. Les centenaires que l’on trouve dans ces régions particulières ont eu, au cours de leur vie, des comportements dus à leurs habitudes de vie culturelles ou religieuses, qui sont comparables à ceux désormais recommandés par la science et la médecine. Ils ont ainsi réalisé un vieillissement actif qui les a conduits vers un vieillissement réussi [
38
]
(
Figure 3
)
.
 | Figure 3.
Prévention primaire « innée » des centenaires en zones bleues.
Points communs identifiés des centenaires en zones bleues : pratiquent toujours une activité physique modérée ; sont engagés dans la vie sociale ; n’ont pas eu de stress durant leur vie ; ont beaucoup de réflexion spirituelle ; observent des régimes alimentaires semi-végétariens fondés sur des produits naturels ; n’ont pas eu d’excès en apport calorique ; ont une consommation modérée d’alcool ; vivent dans des régions ensoleillées et non polluées ; ont toujours un but dans la vie ; ont une activité centrée sur la famille.
|
Alors qu’ils ont déjà de solides armes entre leurs mains pour bien vieillir, beaucoup de sujets attendent des miracles de la science. Des pistes sérieuses de thérapies permettant le ralentissement du vieillissement sont en effet à l’étude. Les effets anti-vieillissement, voire rajeunissants, de la metformine, un antidiabétique oral utilisé depuis les années 1950 sont ainsi encourageants [
39
]. Des médicaments sénolytiques sont également en cours de développement pour reconditionner les cellules sénescentes, protégées de l’apoptose, soit vers leur mort programmée, soit vers un rajeunissement
10
. La thérapie cellulaire est aussi pleine d’espoir pour la réparation après une agression (une maladie), sans parler d’« antivieillissement », notamment de confort [
40
]. Chez l’animal, la transfusion de sang provenant de jeunes animaux semble être une nouvelle piste, sous réserve de considérations éthiques [
41
].
Les connaissances sur le vieillissement sont récentes et porteuses d’espoir. Le champ des investigations est immense, mais l’essentiel et le plus facile à réaliser aujourd’hui réside dans la prévention. Celle-ci repose sur une éducation en santé. C’est notamment aux plus jeunes que cette éducation doit s’adresser. Ils sauront, sans doute, influencer et éduquer leurs concitoyens les moins jeunes, comme ils savent si bien le faire lorsqu’il est question de préserver notre planète… |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Medvedev
ZA
.
An Attempt at a rational classification of theories of ageing.
.
Biol Rev.
1990;
;
65
:
:375.
–
398
.
2.
McHugh
D
,
Gil
J
.
Senescence and aging: causes, consequences, and therapeutic avenues.
.
J Cell Biol.
2018;
;
217
:
:65.
–
77
.
3.
Piedrafita
G
,
Keller
MA
,
Ralser
M
.
The impact of non-enzymatic reactions and enzyme promiscuity on cellular metabolism during (oxidative) stress conditions.
.
Biomolecules.
2015;
;
5
:
:2101.
–
2122
.
4.
Beckman
KB
,
Ames
BN
.
Mitochondrial aging: open questions.
.
Ann NY Acad Sci.
1998;
;
854
:
:118.
–
127
.
5.
Teissier
T
,
Boulanger
E
.
The receptor for advanced glycation end-products (RAGE) is an important pattern recognition receptor (PRR) for inflammaging.
.
Biogerontology.
2019;
;
20
:
:279.
–
301
.
6.
Sergiev
PV
,
Dontsova
OA
,
Berezkin
GV
.
Theories of aging: an ever-evolving field.
.
Acta Naturae.
2015;
;
7
:
:9.
–
18
.
7.
Ghimire
S
,
Hill
CV
,
Sy
FS
, et
Rodriguez
R
.
Decline in telomere length by age and effect modification by gender, allostatic load and comorbidities in national health and nutrition examination survey (1999–2002).
.
PLoS One.
2019;
;
14
:
:e0221690.
.
8.
Jin
K.
.
Modern biological theories of aging.
.
Aging Dis.
2010;
;
1
:
:72.
–
74
.
9.
Valiathan
R
,
Ashman
M
,
Asthana
D
.
Effects of ageing on the immune system: infants to elderly.
.
Scand J Immunol.
2016;
;
83
:
:255.
–
266
.
10.
Tissenbaum
HA
.
Using C. elegans for aging research.
.
Invertebr Reprod Dev.
2015;
;
59
:
:59.
–
63
.
11.
Litke
R
,
Boulanger
E
,
Fradin
C
.
Caenorhabditis elegans, un modèle d’étude du vieillissement.
.
Med Sci (Paris).
2018;
;
34
:
:571.
–
579
.
12.
Lepilina
A
,
Coon
NA
,
Kikuchi
K
,
et al.
A Dynamic epicardial injury response supports progenitor cell activity during zebrafish heart regeneration.
.
Cell.
2006;
;
127
:
:607.
–
619
.
13.
Hickey
AJR
,
Jüllig
M
,
Aitken
J
,
et al.
Birds and longevity: does flight driven aerobicity provide an oxidative sink?
.
Ageing Res Rev.
2012;
;
11
:
:242.
–
253
.
14.
Swindell
WR
.
Dietary restriction in rats and mice: a meta-analysis and review of the evidence for genotype-dependent effects on lifespan.
.
Ageing Res Rev.
2012;
;
11
:
:254.
–
270
.
15.
Friedberg
EC
,
Meira
LB
.
Database of mouse strains carrying targeted mutations in genes affecting biological responses to DNA damage Version 7.
.
DNA Repair.
2006;
;
5
:
:189.
–
209
.
16.
Edrey
YH
,
Hanes
M
,
Pinto
M
,
et al.
Successful aging and sustained good health in the naked mole rat: a long-lived mammalian model for biogerontology and biomedical research.
.
ILAR J.
2011;
;
52
:
:41.
–
53
.
17.
Mitchell
SJ
,
Scheibye-Knudsen
M
,
Longo
DL
,
de Cabo
R
.
Animal models of aging research: implications for human aging and age-related diseases.
.
Annu Rev Anim Biosci.
2015;
;
3
:
:283.
–
303
.
18.
Carmona
JJ
,
Michan
S
.
Biology of healthy aging and longevity.
.
Rev Investig Clin Organo Hosp Enfermedades Nutr.
2016;
;
68
:
:7.
–
16
.
19.
Fleming
T
,
Watkins
AJ
,
Velazquez
MA
,
et al.
Origins of lifetime health around the time of conception: causes and consequences.
.
Lancet.
2018;
;
391
:
:1842.
–
1852
.
20.
Shonkoff
JP
,
Richter
L
,
van der Gaag
J
,
Bhutta
ZA
.
An integrated scientific framework for child survival and early childhood development.
.
Pediatrics.
2012;
;
129
:
:e460.
–
e472
.
21.
Batsis
JA
,
Villareal
DT
.
Sarcopenic obesity in older adults: aetiology, epidemiology and treatment strategies.
.
Nat Rev Endocrinol.
2018;
;
14
:
:513.
–
537
.
22.
Park
DC
,
Reuter-Lorenz
P
.
The adaptive brain: aging and neurocognitive scaffolding.
.
Annu Rev Psychol.
2009;
;
60
:
:173.
–
196
.
23.
Mattson
MP
,
Arumugam
TV
.
Hallmarks of brain aging: adaptive and pathological modification by metabolic states.
.
Cell Metab.
2018;
;
27
:
:1176.
–
1199
.
24.
Verdú
E
,
Ceballos
D
,
Vilches
JJ
,
Navarro
X
.
Influence of aging on peripheral nerve function and regeneration.
.
J Peripher Nerv Syst.
2000;
;
5
:
:191.
–
208
.
25.
Meschiari
CA
,
Ero
OK
,
Pan
H
,
et al.
The impact of aging on cardiac extracellular matrix.
.
GeroScience.
2017;
;
39
:
:7.
–
18
.
26.
Mahler
DA
,
Rosiello
RA
,
Loke
J
.
The aging lung.
.
Clin Geriatr Med.
1986;
;
2
:
:215.
–
225
.
27.
Griffith
KA
,
Sherrill
DL
,
Siegel
EM
,
et al.
Predictors of loss of lung function in the elderly: the Cardiovascular Health Study.
.
Am J Respir Crit Care Med.
2001;
;
163
:
:61.
–
68
.
28.
Soenen
S
,
Rayner
CK
,
Jones
KL
,
Horowitz
M
.
The ageing gastrointestinal tract.
.
Curr Opin Clin Nutr Metab Care.
2016;
;
19
:
:12.
–
18
.
29.
Fried
LP
,
Tangen
CM
,
Walston
J
,
et al.
Frailty in older adults: evidence for a phenotype.
.
J Gerontol A Biol Sci Med Sci.
2001;
;
56
:
:M146.
–
M156
.
30.
Cesari
M
,
Gambassi
G
,
van Kan
GA
,
Vellas
B
.
The frailty phenotype and the frailty index: different instruments for different purposes.
.
Age Ageing.
2014;
;
43
:
:10.
–
12
.
31.
Theou
O
,
Brothers
TD
,
Mitnitski
A
,
Rockwood
K
.
Operationalization of frailty using eight commonly used scales and comparison of their ability to predict all-cause mortality.
.
J Am Geriatr Soc.
2013;
;
61
:
:1537.
–
1551
.
32.
Bouchon
JP
.
1 + 2 + 3. Comment être efficace en gériatrie.
.
Rev Prat.
1984;
;
34
:
:888.
–
892
.
33.
Collard
RM
,
Boter
H
,
Schoevers
RA
.
Oude Voshaar RC. Prevalence of frailty in community-dwelling older persons: a systematic review.
.
J Am Geriatr Soc.
2012;
;
60
:
:1487.
–
1492
.
34.
Epstein
AM
,
Hall
JA
,
Besdine
R
,
et al.
The emergence of geriatric assessment units. The new technology of geriatrics.
.
Ann Intern Med.
1987;
;
106
:
:299.
–
303
.
35.
Rubenstein
LZ
,
Stuck
AE, A.
Siu
L
,
Wieland
D
.
Impacts of geriatric evaluation and management programs on defined outcomes: overview of the evidence.
.
J Am Geriatr Soc.
1991;
;
39
:
:8S.
–
16S
;
discussion S17–8.
.
36.
Mailliez
A
,
Guibaud
A
,
Puisieux
F
, et al.
Circulating biomarkers characterizing physical frailty: CRP, hemoglobin, albumin, 25OHD and free testosterone as best biomarkers. Results of a meta-analysis.
.
Exp Gerontol.
2020;
;
139
:
:111014.
.
37.
Matyas
N
,
Aschenberger
FK
,
Wagner
G
,
et al.
Continuing education for the prevention of mild cognitive impairment and Alzheimer’s-type dementia: a systematic review and overview of systematic reviews.
.
BMJ Open.
2019;
;
9
:
:e027719.
.
38.
Franceschi
C
,
Passarino
G
,
Mari
D
,
Monti
D
.
Centenarians as a 21
st
century healthy aging model: A legacy of humanity and the need for a world-wide consortium (WWC100
+
)
.
.
Mech Ageing Dev.
2017;
;
165
:
:55.
–
58
.
39.
Barzilai
N
,
Crandall
JP
,
Kritchevsky
SB
,
Espeland
MA
.
Metformin as a tool to target aging.
.
Cell Metab.
2016;
;
23
:
:1060.
–
1065
.
40.
Campisi
J
,
Kapahi
P
,
Lithgow
GJ
,
et al.
From discoveries in ageing research to therapeutics for healthy ageing.
.
Nature.
2019;
;
571
:
:183.
–
192
.
41.
Gan
KJ
,
Südhof
TC
.
Specific factors in blood from young but not old mice directly promote synapse formation and NMDA-receptor recruitment.
.
Proc Natl Acad Sci USA.
2019;
;
116
:
:12524.
–
12533
.
42.
Holmes
DJ
,
Ottinger
MA
.
Birds aslong-lived animal models for the study of aging.
.
Exp Gerontol.
2003;
;
38
:
:1365.
–
1375
.
43.
Lapasset
L
,
Milhavet
O
,
Prieur
A
,
et al.
Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state.
.
Genes Dev.
2011;
;
25
:
:2248.
–
2253
.
|