| |
| Med Sci (Paris). 36(12): 1143–1154. doi: 10.1051/medsci/2020222.Inhibition des caspases De la biologie et thanatologie cellulaires au développement clinique de candidats médicaments Étienne Jacotot1,2* 1
Inserm U1164, Sorbonne Université UMR 8256, équipe Stress neuronal et vieillissement (
Neuronal Stress and Aging
, NSA), Campus Pierre et Marie Curie
,
7 quai Saint Bernard
,
75005Paris
,
France 2Taub Institute for Research on Alzheimer’s Disease and the Aging Brain, Department of Pathology and Cell Biology, Columbia University
,
New York
,
Étas-Unis |
Les caspases (contraction de
cysteine-dependent aspartate-specific proteases
) sont une famille d’endoprotéases à cystéine (famille C14A du clan CD), propre au règne animal, qui clivent les peptides et les protéines spécifiquement après un résidu aspartate [
1
]. Cette spécificité de reconnaissance est rare parmi les protéases, et unique parmi les protéases à cystéine. Les caspases sont des effecteurs et régulateurs centraux de l’apoptose et de l’inflammation [
2
]. Elles sont aussi impliquées dans la régulation de voies de mort cellulaire non apoptotiques, ainsi que dans divers processus physiologiques qui incluent la prolifération, la différenciation, les migrations cellulaires, plusieurs fonctions fines du système nerveux en développement et mature (plasticité synaptique, guidance axonale, potentialisation à long terme, élagage des épines dendritiques), le contrôle du cycle cellulaire, et les réponses aux stress [
3
]. Ces fonctions critiques et leur potentiel rôle comme cible thérapeutique ont déclenché un fort intérêt académique et industriel [
4
,
5
] avec pour conséquence, la caractérisation de la famille des caspases en termes d’expression génique, de structure, d’activation et d’activité catalytique [
6
].
Le premier membre de la famille des caspases, Ced-3, fut découvert chez le nématode
Caenorhabditis elegans
[
7
]. Indispensable pour la mort cellulaire programmée développementale chez ce vers, Ced-3 s’est avéré homologue à l’enzyme humaine de maturation de l’interleukine-1b (ICE), ultérieurement rebaptisée Caspase-1 [
8
]. Parmi les 18 caspases identifiées à ce jour, seules les Caspases-17 et -18 sont absentes chez les mammifères placentaires. Le génome humain code douze caspases (Caspases-1 à -10, Caspase-12 et Caspase-14), tandis que le génome murin en code dix (Caspase-1, 2, 3, 6, 7, 8, 9, 11, 12 et 14). Les gènes
casp-4
et
casp-5
humains proviennent d’une duplication du gène
casp-11
, leur orthologue chez la souris. La Caspase-14 est présente seulement chez les mammifères terrestres, tandis que la Caspase-15 est absente chez les primates et les rongeurs.
Classification des caspases
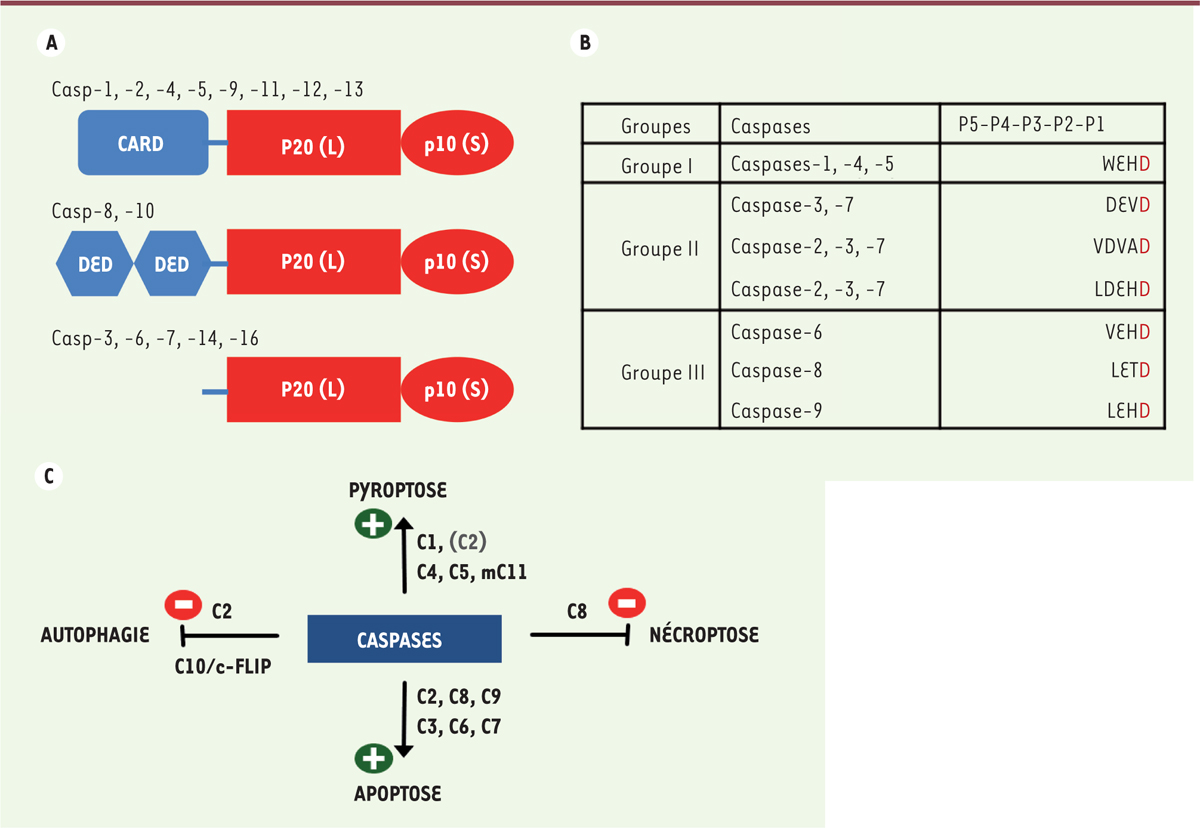
Toutes les caspases contiennent deux sous-unités (p20 et p10) qui forment leur domaine catalytique
(
Figure 1A
)
. Elles sont synthétisées sous forme de zymogènes (enzymes en attente d’activation). Les caspases initiatrices de l’apoptose (Caspase-2, -8, -9, -10) et inflammatoires (Caspase-1, -4, -5, -11, -12) possèdent des prodomaines N-terminaux qui déterminent leur dimérisation et/ou leur interaction homotypique avec des protéines adaptatrices. On distingue les domaines DED (
death effector domain
) que l’on trouve en tandem dans les Caspases -8 et -10, et les domaines CARD (
caspase activation and recrutement domain
) présents unitairement dans toutes les caspases inflammatoires ainsi que dans les Caspases-2 et -9. Ces domaines DED ou CARD servent au recrutement des zymogènes au sein de plates-formes d’activation. Les caspases exécutrices de l’apoptose (Caspase-3, -6, -7) ont un pro-domaine N-terminal court dépourvu de domaine de recrutement [
3
]. Pour être activées, ces caspases doivent être clivées au niveau de leur domaine catalytique. Une série d’événements de clivage, par des caspases initiatrices, séparent d’abord les grandes et les petites sous-unités, puis éliminent le prodomaine. Ce clivage n’est pas indispensable pour l’activation des caspases initiatrices et inflammatoires. La Caspase-14 n’a pas de rôle connu au cours de l’apoptose, ni dans l’inflammation. Elle est exprimée dans l’épiderme et joue un rôle primordial dans la cornification et la protection des couches sous-jacentes de la peau. Le pro-domaine de la Caspase-14 est court, comme celui des caspases exécutrices de l’apoptose avec lesquelles elle partage le mode d’activation par clivage [
3
]. Les caspases ont un spectre de contrôle des voies de mort cellulaire plus large que ce qui a été cru initialement. Parmi les voies de mort cellulaire régulées les mieux décrites, on distingue : l’apoptose, la mort associée à l’autophagie, et des morts par nécrose régulée, telles que la pyroptose (mort inflammatoire) et la nécroptose (qui met en jeu le ripoptosome RIP1K/RIP3K [
receptor-interacting serine/threonine-protein kinase 1/3
] et la pseudo-kinase MLKL [
mixed lineage kinase domain-like
]). Toutes ces voies de mort sont régulées par les caspases
(
Figure 1C
)
.
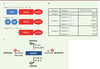 | Figure 1.
Classifications des caspases. A.
Domaines structuraux des caspases des mammifères placentaires. CARD :
caspase recruitment domain
; DED :
death effector domain
; L :
long catalytic domain
; S :
short catalytic domain
.
B.
Spécificités de substrats des caspases 1 à 9 humaines. Il y a une reconnaissance stricte d’un aspartate (D) en position P1. Les trois groupes (I, II, III) se distinguent par la reconnaissance du résidu en position P4.
C.
Les caspases ont un spectre de contrôle des voies de mort cellulaire plus large que ce qui a été cru initialement. Les Caspases -3, -6, -7 exécutent l’apoptose, les Caspases -2, -8, -9 initient l’apoptose, les Caspases -1, -4, -5, -11 déclenchent la pyroptose [
3
]. La Caspase-8 réprime la nécroptose [
36
]. Les Caspases -2 et -10 répriment l’autophagie et/ou la mort autophagique [
18
,
37
].
|
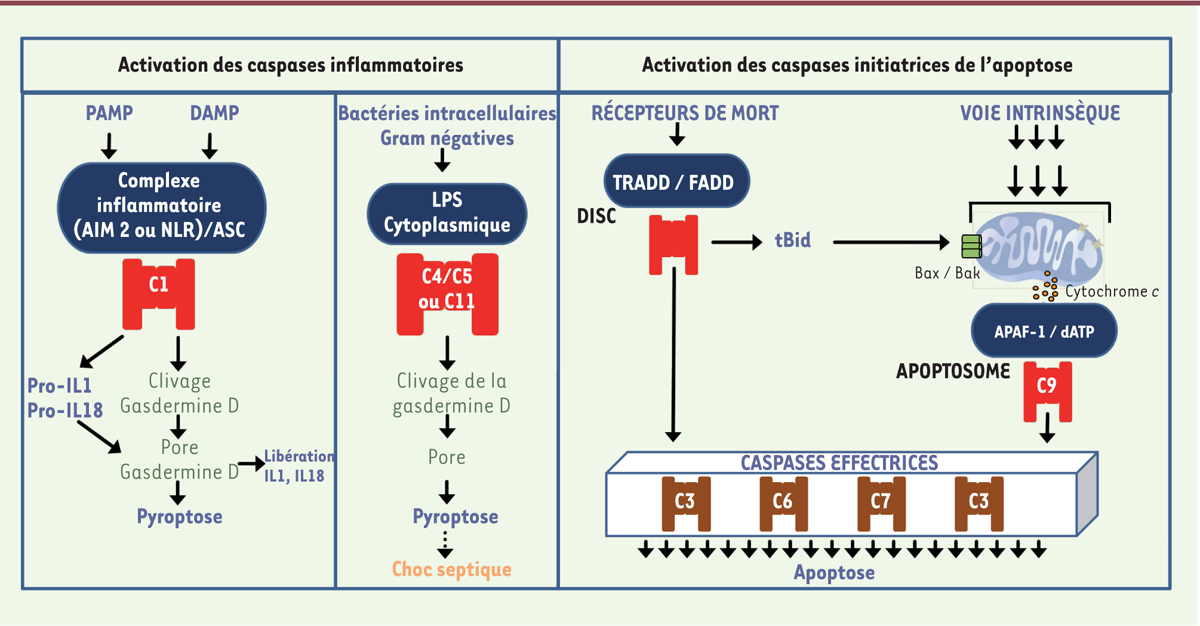
 | Figure 2.
Plates-formes d’activation des caspases. Panneau de gauche :
Les inflammasomes dits canoniques répondent à des signaux de danger (DAMP et PAMP) et sont des plateformes d’activation de la Caspase-1 (C1). Panel du milieu : lorsqu’ils atteignent le cytoplasme, les lipopolysaccharides (LPS) sont des activateurs directs des Caspase-4 (C4) et -5 (C5) humaines, ainsi que de leur équivalent murin, la Caspase-11 (C11).
Panneau de droite :
l’activation des « récepteurs de mort », permet des recrutements cytoplasmiques formant le complexe « DISC » qui est une plate-forme de recrutement et d’activation de la Caspase-8 (C8) et de la Caspase-10. Lors d’évènements de perméabilisation de la membrane externe des mitochondries, la libération cytosolique du cytochrome c conduit à la formation de l’apoptosome qui est la plate-forme d’activation de la Caspase-9 (C9). Les plates-formes d’activation de la Caspase-2 ne sont pas présentées dans ce schéma. La plate-forme la mieux décrite est le PIDDosome qui regroupe les protéines RAIDD, PIDD et la procaspase-2. DAMP :
damage-associated molecular pattern
; PAMP :
pathogen-associated molecular pattern
; DISC :
death-inducing signaling complex
; RAIDD : adaptor molecule which has an unusual bipartite architecture comprising a carboxy-terminal death domain that binds to the homologous domain in RIP, a serine/threonine kinase component of the death pathway ; PIDD :
receptor-interacting protein-associated ICH-1/CED-3 homologous protein with a death domain
.
|
Site actif, structure et substrats
Les peptidases dans lesquelles le groupe thiol d’un résidu de cystéine sert de nucléophile dans la catalyse, sont définies comme des cystéine peptidases. Pour toutes les cystéine peptidases découvertes jusqu’à présent, l’activité dépend d’une dyade catalytique, dont le second membre est un résidu d’histidine jouant le rôle de base générale. Les caspases ont un site actif caractéristique comprenant une triade catalytique, constituée de la fonction thiol de la Cys285 (au sein de la séquence conservée du pentapeptide QA
C
XG), de l’His237, et du squelette carbonyle du résidu 177 (numérotation de la Caspase-1) [
8
]. En utilisant des substrats synthétiques, de nature tétra- ou penta-peptidique (de séquence générale N
ter
-(P
5
-)P
4
-P
3
-P
2
-P
1
-Ct
er
), munis d’un groupement rapporteur en position C-terminale, et la mesure de leur cinétique de clivage par les caspases
in vitro
, il a été possible de classer les caspases en fonction de la préférence de clivage d’une séquence donnée [
9
,
10
]. Les caspases reconnaissent de manière obligatoire un résidu Asp en position P1. La nature du résidu en position P4 permet de distinguer 3 groupes (I, II, III) : les caspases du groupe I (Casp-1, -4, -5, -14) reconnaissent préférentiellement un résidu Trp ou Tyr en position P4 ; les caspases du groupe II (Casp-2, -3, -7) préfèrent très nettement un Asp à cette position ; tandis que les caspases du groupe III s’accommodent de résidus aliphatiques (préférentiellement Val pour la Casp-6 et Leu/Ile pour les Casp-8, -9, -10)
(
Figure 1B
)
. Rappelons ici qu’il existe un problème de réactivité croisée entre les caspases. Il est extrêmement important de réaliser que les substrats peptidiques simples, développés pour examiner l’activité des caspases, manquent de sélectivité pour les caspases individuelles [
11
].
Les plates-formes d’activation des caspases
Les caspases initiatrices et les caspases inflammatoires sont activées par leur recrutement au sein de plates-formes spécialisées. Cinq plates-formes d’activation ont été décrites : les inflammasomes canoniques, pour la Caspase-1 ; le PIDDosome, pour la Caspase-2 ; les lipopolysaccharides bactériens (complexes LPS), pour les Caspases-4, -5, et -11 ; le DISC (
death-inducing signaling complex
), pour la Caspase-8 ; et l’apoptosome, pour la Caspase-9.
Plate-forme d’activation de la Caspase-8
Le DISC est un complexe associé à la membrane plasmique qui regroupe sous l’action d’un ligand extra-cellulaire (par exemple FasL ou TRAIL [
tumor necrosis factor-related apoptosis-inducing ligand
]), des protéines transmembranaires appelées récepteurs de mort (
death receptors
) qui appartiennent à la superfamille de récepteurs du TNF-a
(tumor necrosis factor alpha).
La face cytosolique du complexe inclue la protéine adaptatrice FADD (
Fas-associated protein with death domain
). FADD possède des domaines DED qui permettent le recrutement et la transactivation autocatalytique d’homodimères de la procaspase-8, ou de la procaspase-10 [
12
]. Ce complexe est régulé par les trois isoformes de la protéine cFLIP (
cellular FLICE-like inhibitory protein
) qui ressemblent structurellement à la Caspase-8 mais sont dépourvues d’activité catalytique. Les isoformes R, S et L de cFLIP contrôlent le destin cellulaire, par la formation d’hétérodimères : cFLIP
S
-ProCasp8 (inactif), cFLIP
R
-ProCasp8 (inactif) et cFLIP
L
-ProCasp8 (actif). cFLIP
S
promeut l’assemblage du ripoptosome RIPK1-RIPK3 (et ne peut pas activer la procaspase-8 pour qu’elle inactive RIPK1), un complexe de signalisation amyloïde qui initie la nécroptose, une mort cellulaire régulée et immunogénique au cours de laquelle RIPK1 phosphoryle RIPK3 qui, à son tour, phosphoryle MLKL (
mixed lineage kinase domain-like pseudokinase
), qui s’oligomérise alors, selon une structure de type amyloïde, et,
in fine,
provoque la mort cellulaire par perméabilisation de la membrane plasmique et des organelles intracellulaires.
A contrario
, l’hétérodimère, cFLIP
L
-ProCasp8 est catalytiquement actif, mais avec un champ d’action restreint qui lui permet de cliver RIPK1 et ainsi d’inhiber la nécroptose sans déclencher l’apoptose [
12
].
Plate-forme d’activation de la Caspase-9
L’apoptosome est un complexe hautement organisé, composé de l’adaptateur Apaf-1 (
apoptotic protease-activating factor 1
qui appartient à la famille des AAA-ATPases
1
), du cytochrome
c
, de dATP et de la procaspase-9. La procaspase-9 est monomérique et inactive dans la cellule. Un clivage intra-chaîne est insuffisant pour l’activer. Lorsque la mitochondrie libère du cytochrome
c
dans le cytosol, Apaf-1 se polymérise selon un mécanisme dépendant du dATP, formant un anneau composé de 7 ou 8 monomères, qui recrutent de multiples monomères de procaspase-9 par des interactions CARD-CARD [
13
]. Le modèle le plus communément accepté propose que l’apoptosome soit une holoenzyme
2,
qui régule, selon un mécanisme allostérique, l’homodimérisation et l’activation autocatalytique de la procaspase-9. La Caspase-9 activée interagit avec les caspases exécutrices, en particulier la Caspase-3 (qui est, dans de nombreux tissus, la plus abondante des caspases), et les active par clivage, conduisant à la voie canonique de l’apoptose avec l’activation générale des caspases exécutrices et de DNAses, divers remaniements des organelles intracellulaires, l’exposition à la surface cellulaire de signaux d’appel pour la phagocytose par les macrophages (
eat-me signals
), et la dégradation méthodique du noyau et de l’ADN nucléaire. Une particularité du fonctionnement de cette plate-forme est son auto-régulation : lors de son activation, la Caspase-9 effectue un auto-clivage entre les petites et grandes sous-unités du domaine catalytique qui démasque un néo-épitope auquel se fixe l’inhibiteur XIAP (
X-linked inhibitor of apoptosis
) pour stopper l’activité catalytique, et, en même temps, qui promeut la dissociation de la Caspase-9 de l’apoptosome et son retour à l’état de monomères [
13
]. Ainsi l’apoptosome paraît agir comme un métronome (
molecular timer
) générant des impulsions de signal apoptotique.
Plates-formes d’activation de la Caspase-1
Les inflammasomes sont des plates-formes multiprotéiques de signalisation qui contrôlent la réponse inflammatoire et coordonnent les défenses antimicrobiennes. Ils s’assemblent lorsqu’un récepteur de type PRR (
pattern recognition receptor
) détecte un motif moléculaire d’un microorganisme pathogène (PAMP) ou un signal de danger endogène (DAMP) dans le cytosol de la cellule hôte. Ils activent des caspases inflammatoires pour induire la maturation des cytokines interleukine-1β (IL-1β) et IL-18, et initier la pyroptose, une forme de mort cellulaire régulée nécrotique (du grec pyros : feu ou fièvre ; ptosis : chute) [
3
]. Cinq capteurs-récepteurs capables d’assembler, chacun selon le type de signal reçu, un inflammasome canonique, ont été bien décrits : NLRP1 (
NOD-like receptor (NLR) family
,
pyrin domain-containing protein 1
), NLRP3 [
14
](
→
) NLRC4 (
NOD-, leucin-rich repeat- and CARD-containing 4
), AIM2 (
absent in melanoma 2
), et la Pyrine. Lors de leur activation, ces récepteurs recrutent, par des interactions homotypiques PYD-PYD (domaine Pyrine) ou CARD-CARD, la protéine adaptatrice bipartite ASC (
apoptosis-associated speck-like protein containing a CARD
) qui contient un domaine PYD et un domaine CARD. Le domaine CARD d’ASC est nécessaire pour recruter la procaspase-1 au sein du complexe multimérique. Dans le cas de l’inflammasome NLRP3-ASC-Casp1, il a été récemment découvert que la plate-forme doit impérativement recruter la sérine-thréonine kinase NEK7 (
NIMA-related kinase 7
) pour s’activer correctement [
15
]. Au sein de l’inflammasome canonique, la Caspase-1 s’active selon un mode auto-protéolytique induit par la proximité. S’ensuit la maturation par clivage de la pro-IL-1β et de la pro-IL-18, ainsi qui le clivage de la Gasdermine D (GSDMD). Le fragment N-terminal de GSDMD est l’effecteur final de la pyroptose,
via
la formation de pore dans les membranes, et permet la libération des IL-1β et IL-18 matures [
16
,
17
].
(→) Voir la Synthèse de M. Groslambert et B.F. Py,
m/s
n° 1, janvier 2018, page 47
Plate-forme d’activation de la Caspase-2
La Caspase-2 (Casp2, ou NEDD-2, Ich-1) est hautement conservée chez les vertébrés. Elle est impliquée dans la réponse à un panel varié de stress (endogènes, infectieux, physico-chimiques, xénobiotiques, métaboliques, inflammatoires) en initiant des voies de mort cellulaire apoptotique, en réprimant l’autophagie, ou en activant l’inflammasome [
18
]. Au niveau hépatique, la Caspase-2 joue un rôle essentiel dans la pathogenèse des stéato-hépatites non alcooliques (NASH) [
19
]. Au sein du système nerveux, elle intervient dans la plasticité synaptique et la flexibilité cognitive [
20
], et dans plusieurs mécanismes neuropathologiques, tels que les lésions cérébrales néonatales [
21
], des ischémies rétiniennes [
22
], les effets synaptotoxiques du peptide β-amyloïde et les tauopathies [
23
,
24
]. Il y a plus de 20 ans, une interaction homotypique a été documentée entre les domaines CARD de la Caspase-2 et la protéine adaptatrice RAIDD (
RIP-associated Ich-1/Ced-3-homologue protein with a death domain
) [
25
]. RAIDD peut se lier à PIDD1 (
p53-induced death domain protein 1
). RAIDD et PIDD-CC (un des produits du clivage auto-protéolytique et constitutif de PIDD1) interagissent
via
leurs domaines de mort (DD) pour former un multimère qui libère le domaine CARD de RAIDD, ce qui lui permet de recruter la procaspase-2
via
une interaction CARD-CARD. Le complexe tripartite PIDD1-RAIDD-Caspase-2 est appelé PIDDosome [
26
]. Il s’agit donc d’une plate-forme d’activation de la Caspase-2. Cependant il est peu probable que cela soit la seule. Par exemple, lors de la réponse aux effets neurotoxiques du peptide β-amyloïde, l’activation de la Caspase-2 requiert RAIDD mais est indépendante de PIDD1 [
27
]. Également, lors d’un stress génotoxique, la Caspase-2 est activée selon deux voies : une interaction cytosolique avec RAIDD, indépendante de PIDD1 et un PIDDosome nucléolaire qui requiert PIDD1, RAIDD et une association avec la nucléophosmine (NPM1,
nucleolar phosphoprotein nucleophosmin
) [
28
].
Plate-forme d’activation des Caspases-4/5, et -11
Le LPS (lipopolysaccharide) est la principale endotoxine produite par les bactéries Gram négatives. Il est l’un des plus puissants activateurs du système immunitaire inné. Il est composé de trois domaines : l’antigène O (un polymère de glycane répétitif), le Core (composant oligosaccharide, généralement heptose et acide ulosonique), et le Lipide A (un disaccharide phosphorylé de glucosamine décoré de multiples acides gras). Ce dernier est très conservé et est responsable de la toxicité du LPS. La mise en évidence du récepteur des LPS à la surface cellulaire, le TLR-4 (
Toll-like receptor 4
), avait donné lieu au prix Nobel de physiologie ou médecine de 2011 [
29
]. Quelques années plus tard, la mise en évidence de l’activation directe, dans la cellule, de la Caspase-11 (chez la souris) et des Caspases-4/5 (chez l’homme) par le LPS fut une découverte inattendue et majeure [
30
-
32
]. Le LPS est transporté dans la cellule par des toxines bactériennes de type AB5, telles que la toxine du choléra. Le Lipide A se fixe directement sur le domaine CARD de la Caspase-11, ce qui est suffisant pour déclencher son oligomérisation et son activité catalytique. L’effet du LPS est similaire sur les orthologues humains de la Caspase-11, les Caspases-4 et -5, avec une affinité supérieure. Ainsi les Caspases-4/5/11 n’ont pas besoin d’interagir avec un NLR (
NOD-like receptor
) pour s’activer, et sont plutôt des récepteurs cytosoliques du LPS. Une fois activées, les Caspases-4/5/11, clivent directement la gasdermine D, ce qui déclenche l’insertion de son domaine N-terminal dans la membrane plasmique et conduit à la formation d’un pore (18 nm de diamètre interne) et à la mort cellulaire par pyroptose [
16
,
17
].
On peut donc redéfinir le concept de pyroptose comme une nécrose programmée exécutée par la Gasdermine D [
33
]. Ce mécanisme est opérationnel dans la plupart des types cellulaires. Dans le cas des monocytes/macrophages et des cellules dendritiques, la formation de ces pores peut induire l’activation de l’inflammasome à NLRP3-ASC-proCasp1 pour la maturation de l’IL-1β et de l’IL-18. Ces interleukines peuvent alors utiliser les pores comme conduit pour sortir des cellules. Cette combinaison d’action des inflammasomes canonique et non canonique en réponse au LPS cytosolique est critique pour la défense antibactérienne et le choc septique. La pyroptose survient, par exemple, en réponse à des infections invasives par des bactéries Gram négatives, telles que Salmonella et Shigella [
34
]. L’inflammasome non-canonique humain détecte, par ailleurs, une plus grande diversité de LPS que son équivalent murin [
35
].
|
Les inhibiteurs de caspases comme candidats médicaments
Trois critères sont pris en considération pour la mise au point d’inhibiteurs de caspases à visée thérapeutique : (1) la nature chimique de l’inhibiteur (peptides et dérivés, petits composés organiques, acides nucléiques), (2) le mécanisme d’action (site-actif, allostérique, inhibition génétique), et (3) le spectre d’action au sein de la famille des caspases (pan-caspase
versus
caspase individuelle, apicale
versus
terminale).
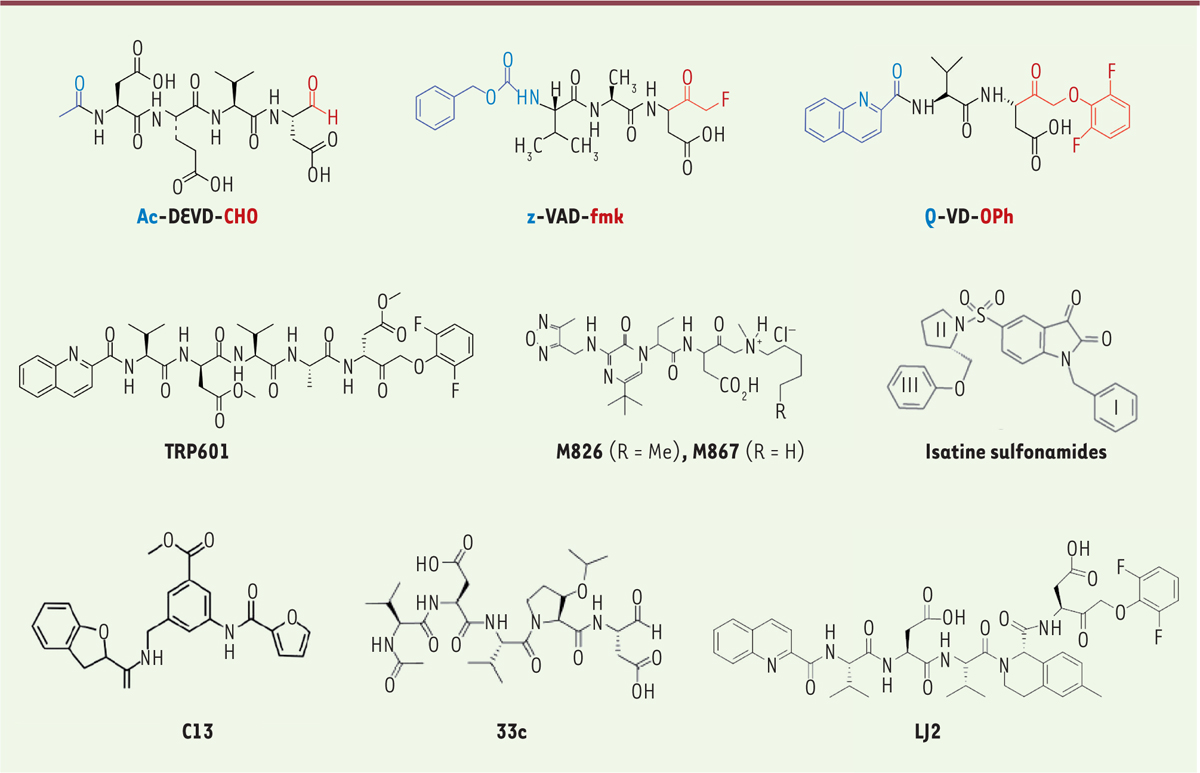
Considérations sur la nature chimique et le mécanisme d’action des inhibiteurs La majorité des développements d’inhibiteurs de caspase ont été fondés sur la mise au point d’inhibiteurs réversibles ou irréversibles du site actif. De nombreux inhibiteurs synthétiques ont été élaborés. Les premiers ont consisté en de courts peptides contenant un acide aspartique modifié avec un groupement électrophile (appelé « groupe partant » ou encore « piège à cystéine ») qui forme une liaison covalente, réversible ou irréversible, avec la fonction thiol (nucléophile) de la cystéine réactive du site actif des caspases. Les peptides et dérivés peptidiques
Trois générations d’inhibiteurs dérivés de peptides se sont succédées
(
Figure 3
)
: (1) des peptides simples, comportant deux à cinq acides aminés, dont l’extrémité C-terminale inclue un aspartate couplé à un groupe partant réversible de type aldéhyde (par exemple, le tetrapeptide Ac-DEVD-CHO), cétone ou nitrile ; (2) des peptides similaires mais dont le groupe partant électrophile est une cétone substituée, telle que la fluorométhyl-cétone (FMK) et la chlorométhyl cétone (CMK), qui inactivent de manière irréversible les caspases par la formation de thiométhylcétone avec le site actif cystéine (par exemple, le tripeptide z-VAD-FMK) ; (3) des inhibiteurs dérivés des précédents, issus d’études structure-fonction (SAR), qui utilisent des groupes partants de type benzoyle halogéno-substitué (par exemple, le 2,6-dichlorobenzoyle) ou phenoxyméthyl-cétone halogèno-substitué (par exemple, le 2,6-fluorophenoxy-méthyl-cétone), et sont des inhibiteurs irréversibles très efficaces. Parmi ces inhibiteurs de troisième génération, l’un des plus utilisés en recherche, en raison de son efficacité, de sa bio-distribution
in vivo
, et de sa faible toxicité, est le Q-VD-OPh (
quinolyl-carbonyl-Val-Asp-difluorophenoxymethyl-ketone
) [
38
], un inhibiteur pan-caspases développé par
ICN/Enzyme Systems Products Inc
.
 | Figure 3.
Structure de quelques inhibiteurs de caspases.
Ac-DEVD-CHO, est un tétrapeptide aldéhyde qui inhibe préférentiellement et de manière réversible les Caspase-3 (Ki = 0,23nM) et Caspase-8 (Ki = 0,92nM). Sa pénétration cellulaire est très mauvaise, comme sa biodisponibilité, ce qui en fait une molécule inenvisageable pour une utilisation comme médicament. z-VAD-fmk est un inhibiteur irréversible qui (sous sa forme déméthylée en P1) présente un spectre large contre des caspases (à l’exception de la Caspase-2) et l’inhibition croisée de plusieurs cathepsines. Le groupe partant CH2F (FMK) génère
in vivo
un fluoroacétate qui est hautement toxique. Q-VD-OPh est un dérivé de dipeptide, inhibiteur irréversible pan-caspase de troisième génération [
38
]. Son extrémité N-ter lui confère une bonne biodisponibilité et son groupe partant est puissant. Il n’inhibe pas d’enzymes hors de la famille des caspases. Un composé proche du Q-VD-OPh, l’emricasan, compatible avec une administration
per os
, a été développé chez l’homme jusqu’en phase III (voir
Figure 4
). TRP601 est un dérivé pentapeptidique du Q-VD-OPh, incluant une séquence VD(Ome)VAD(Ome). Son métabolite actif le Δ2Me-TRP601 (déméthylation des 2 aspartates) est un inhibiteur puissant préférentiel des caspases du groupe II). Il a été développé par la biotech française
Theraptosis
contre les lésions cérébrales néonatales puis cédé à
Chiesi Pharmaceuticals
à la fin de son développement préclinique [64]. M826, M827 sont des inhibiteurs non peptidiques, sélectifs et réversibles de Caspase-3, présentant une très forte activité anti-apoptotique
in vitro
et
in vivo
. Ils proviennent d’une série dans laquelle le squelette peptidique P4-P3-P2 a été remplacé par un module amino-pyrazinone. Les composés M867 et M826 présentent une affinité sub-nanomolaire vis-à-vis de la Caspase-3 (Ki ~ 0,7 nM) et une bonne sélectivité en regard des autres caspases. Les deux composés sont très efficaces dans des modèles cellulaires d’apoptose (20 nM < IC50 < 100 nM). Ces composés et leur dérivé M791 (non montré) sont les inhibiteurs les plus puissants et sélectifs de Caspase-3 découverts à ce jour. Les isatines sulfonamides sont des séries chimiques qui ont été très étudiées pour l’inhibition des caspases. Sur la base de la structure présentée ici, de nombreux variants (modifications des domaines I, II, et III) ont été synthétisés et évalués. Certains sont de très bons inhibiteurs des Capases-3 et -7. L’une des difficultés de ses structures est de combiner efficacité et stabilité chimique. C13 est un inhibiteur allostérique de Caspase-6 (Ki~2 µM), obtenu après criblage virtuel de 57 700 composés pour leur interaction avec la poche allostérique putative de la Caspase-6 [
54
]. 33c est un inhibiteur réversible préférentiel de Caspase-2 (Ki = 122nM) obtenu à partir du pentapeptide VDVAD par le remplacement du résidu en position P2 par un synthon non naturel qui gêne l’interaction avec le site S2 de la Caspase-3 mais reste compatible avec celui de la Caspase-2 [
46
]. Son proche dérivé 33 h présente une affinité améliorée pour la Caspase-2 (Ki = 10,9nM) et est 600 fois moins affin pour la Caspase-3. LJ2 est un peptidomimétique qui combine les propriétés de la série 33c/33 h et du Δ2Me-TRP601. LJ2 inhibe préférentiellement et irréversiblement la Caspase-2 [
47
].
|
Les peptidomimétiques sélectifs de caspases individuelles
Le développement et l’utilisation récents d’inhibiteurs peptidiques contenant des dérivés non naturels d’acides aminés ont montré que cette voie était particulièrement prometteuse en termes de spécificité et de sélectivité, car elle permet d’exploiter un espace chimique radicalement amélioré. Les inhibiteurs réversibles de Caspase-3 développés par
Merck-Frosst
au début des années 2000, ont été des précurseurs dans cette direction, en remplaçant le squelette P2-P3-P4 par une amino-pyrazinone (M826 et M867 ;
Figure 3
) [
39
]. Un autre exemple très intéressant est celui des inhibiteurs de Caspase-2, qui présente un site actif très proche de celui de la Caspase-3. Il était, pour cette raison, extrêmement difficile d’obtenir des inhibiteurs sélectifs de la Caspase-2. Les travaux (par des études structure-fonction) de Maillard
et al.
ont abouti à l’utilisation de résidus non naturels en position P2 sur des pentapeptides synthétiques de type VDVAD et, ainsi, à la mise au point d’inhibiteurs préférentiels de la Caspase-2 [
40
]. Ce type de dérivé (VDV
X
D) combiné à un groupe partant de type OPh (phénoxy), a permis d’obtenir, pour la première fois, des inhibiteurs compétitifs irréversibles de la Caspase-2, à la fois puissants et sélectifs [
41
]. Le « Saint-Graal », l’objectif de réaliser des réactifs hautement sélectifs pour distinguer et contrôler les enzymes individuelles et étroitement apparentées de la famille des caspases, est donc en passe d’être atteint.
Les inhibiteurs non peptidiques des caspases
Plusieurs inhibiteurs de caspases non peptidiques ont été découverts, soit par criblage naïf utilisant une activité enzymatique
in vitro
, soit par des approches dites par fragments, notamment la méthode de «
tethering
», qui utilise la présence d’un résidu cystéine, natif ou après mutagénèse dirigée, à proximité du site d’interaction ciblé
3
[
42
,
43
]. Ainsi des dérivés d’isatine, de pyrrolo-quinolines, d’isoquinoline-triones se sont avérés de puissants inhibiteurs des caspases
in vitro
. Certains, comme l’isoquinoline-1,3,4-trione ont montré des effets chez l’animal, dans des modèles précliniques. Pour ces approches, d’important efforts de recherche et développement ont été réalisés, notamment par
GlaxoSmithKline
[
44
],
Pfizer
[
45
] et
AstraZeneca
[
46
], mais aucun composé n’a atteint l’évaluation clinique.
Les inhibiteurs allostériques des caspases
Des sites de régulation allostérique ont été identifiés au sein des caspases et diverses approches de criblage ont permis d’identifier des ligands réversibles de haute affinité, d’une importante diversité chimique, avec des effets fonctionnels d’activation, d’inhibition ou de stabilisation des protéines. Des inhibiteurs allostériques interagissant, par exemple, avec l’interface de dimérisation des caspases, ont été mis au point contre les Caspases-1,-3/7 [
47
]. Ces approches se sont révélées prometteuses mais encore immatures pour le développement d’un médicament. Récemment, en exploitant la faible conservation de l’exosite E
4
dans la famille des caspases, un nouvel inhibiteur allostérique de la Caspase-6 a été décrit
(
Figure 3
)
[
48
].
Les inhibiteurs génétiques des caspases
La stratégie d’utiliser des acides nucléiques (antisens, siARN) pour inhiber des caspases est très utilisée en recherche, mais très rarement pour le développement d’un médicament actif sur les caspases. Pourtant, le candidat médicament ciblant sélectivement un membre de la famille des caspases dont le développement est le plus avancé (phase clinique II/III), est un siARN dirigé contre la Caspase-2 (QPI-1007) développé par
Quark Pharmaceuticals
pour le traitement des ischémies optiques neuropathiques.
|
Considérations sur le spectre d’action des inhibiteurs au sein de la famille des caspases
Est-il préférable d’inhiber l’ensemble des caspases ou une caspase en particulier, et, dans ce cas, doit-on inhiber une caspase qui intervient en amont de la cascade (initiation), ou une caspase qui intervient lors d’une étape exécutrice terminale ? Ces questions importantes ne sont pas triviales. Dès les années 1995-2000, plusieurs laboratoires pharmaceutiques avaient choisi de cibler des caspases effectrices plutôt qu’initiatrices, notamment la Caspase-3 considérée comme un point de convergence de la plupart des voies apoptotiques. Mais aucun inhibiteur préférentiel ou sélectif de cette caspase n’a atteint le stade de l’évaluation clinique. L’une des explications au manque d’efficacité de ces inhibiteurs serait liée au fait que le point de non-retour dans la cascade d’évènements biochimiques d’exécution de la mort cellulaire, se situe en amont des caspases effectrices. Cet échec pourrait également provenir de l’existence de bifurcations entre les différentes voies de mort : par exemple, la mise en jeu de voies de nécroptose, lorsque des caspases sont inhibées [
36
,
49
]. D’autres groupes biopharmaceutiques avaient estimé plus aisé de concevoir des inhibiteurs agissant de manière large sur la famille des caspases. Cependant, les rôles individuels multiples de chaque caspase, y compris indépendants de la mort cellulaire, ont révélé des effets souvent toxicologiques, particulièrement lors des administrations répétées. Deux peptidomimétiques inhibiteurs de caspases, dits à large spectre (ou pan-caspase), ont pourtant atteint les phases cliniques : l’emricasan (IDN-6556) et le nivocasan (GS-9450). Concernant les inhibiteurs préférentiels des caspases inflammatoires, l’objectif principal des peptidomimétiques visant le groupe I des caspases, a été de restreindre la portion P2-P3 du tétrapeptide, en maintenant l’interaction importante du squelette peptidique, ce qui a pour résultat d’orienter correctement les importantes régions de reconnaissance P1 et P4 de la molécule dans la poche enzymatique. Cette stratégie a été appliquée très tôt et avec succès pour le pralnacasan, dans lequel la région P2-P3 est remplacée par une pyridazinodiazepine. Deux inhibiteurs de Caspase-1 ont été optimisés puis développé jusqu’en phases II cliniques : le pralnacasan (VX-740) et le belnacasan (VX-765).
Compte tenu des découvertes récentes sur le rôle et les mécanismes d’action des caspases inflammatoires [
30
-
35
], il paraît urgent que les communautés scientifiques et biopharmaceutiques développent des inhibiteurs sélectifs de Caspase-4/5, pour des indications couvrant l’inflammation et un large pan des infections bactériennes.
|
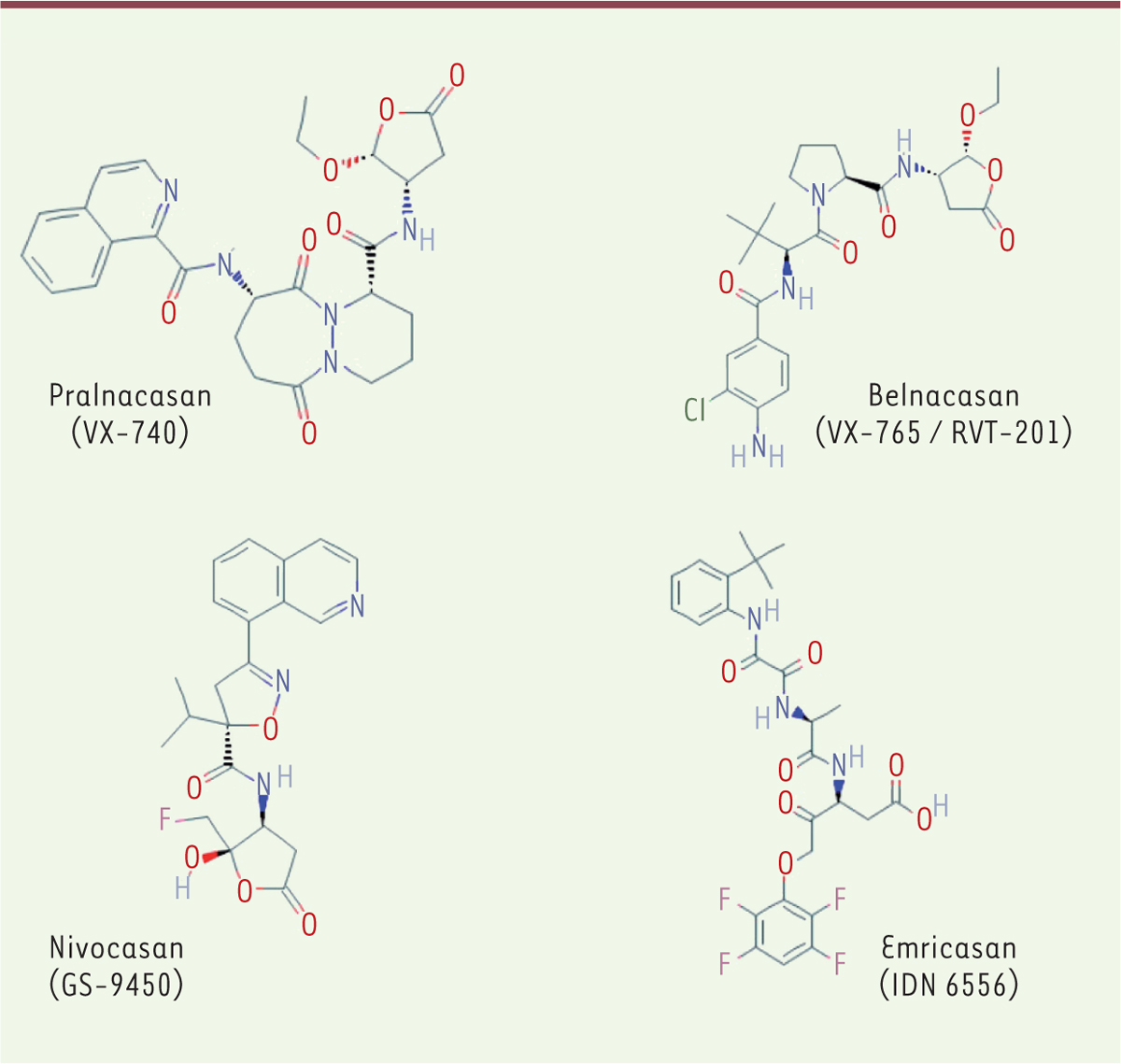
Les inhibiteurs de caspases en phase de développement clinique
Cinq candidats médicaments agissant sur une ou des caspases ont été évalués lors de phases cliniques chez l’homme : deux inhibiteurs peptidomimétiques de Caspase-1 (belnacasan et pralnacasan) ; un siARN, dirigé contre la Caspase-2 (QPI-1007) ; et deux inhibiteurs peptidomimétiques pan-caspases (emricasan et nivocasan) (
Figure 4
et
Tableau I
).
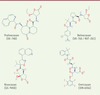 | Figure 4.
Structure des peptidomimétiques inhibiteurs de caspase ayant atteint les phases d’évaluation clinique chez l’homme.
Les informations publiées par
Vertex
indiquent que le pralnacasan inhibe préférentiellement la Caspase-1 (IC
50
= 1,3 nM ; Ki ~ 1,4 nM), et la Caspase-8 (IC
50
= 120 nM) et, à un degré plus faible, la Caspase-3 (IC
50
= 2,3 µM). Cet effet préférentiel est moins flagrant dans les données publiées par Procter & Gamble (Caspase-1 IC
50
= 2 à 3,6 nM ; Caspase-8 IC
50
= 40 nM ; Caspase-3 IC
50
= 1,3 µM). Le belnacasan est un puissant inhibiteur de Caspase 1 (K
i
= 0,8 nM) et de Caspase-4 (K
i
< 0,6 nM) qui présente un effet plus modéré sur la Caspase-8 (K
i
= 100nM), faible sur la Caspase-9 (K
i
= 1 µM), et très faible sur les Caspase-3 (K
i
= 16 µM) et -7 (K
i
= 21,5 µM). L’emricasan inhibe irréversiblement les caspases avec un effet très marqué sur les Caspases-8 (k
3
/K
i
= 2 940 000 M
-1
s
-1
) et -9 (k
3
/K
i
= 2 191 000 M
-1
s
-1
), marqué sur la Caspase-1 (k
3
/K
i
= 689 000 M
-1
s
-1
), et significatif mais plus faible sur les Caspase-3 (k
3
/K
i
= 75 700 M
-1
s
-1
) et -6 (k
3
/K
i
= 58 700 M
-1
s
-1
).
|
Tableau I.
| Nom |
Cible |
Indications |
Phase clinique |
|
Belnacasan (VX-765)
(métabolite actif VRT-043198)
|
Casp-1, -4, -5 |
Épilepsie |
IIb |
| Psoriasis |
II |
| Alzheimer |
Préclinique |
| Sida (pyroptose induite par le VIH) |
Préclinique |
|
| Pralnacasan (VX-740) |
Casp-1 |
Arthrite rhumatoïde |
IIb |
| Ostéoarthrite |
IIa |
|
| Emricasan (IDN-6556) |
Casp-9, -8, > -1, >3 |
NASH /NAFLD |
II |
| NASH cirrhose et hypertension portale sévère |
III (échec) |
| NASH avec fibrose |
IIb (échec) |
| Hépatite C |
IIa |
|
Transplantation d’îlots de Langerhans
(diabète de type I)
|
I/II |
| Transplantation hépatique |
IIa |
|
| Nivocasan (GS-9450) |
Fibrose hépatique (hépatite C) |
IIa (interrompu) |
|
| QPI-1007 |
Casp-2 |
NAION |
III |
| Glaucome |
II |
Études cliniques effectuées avec des inhibiteurs de caspases.
|
Le pralnacasan (VX-740, HMR-3840) est un inhibiteur réversible de la Caspase-1 développé par
Vertex pharmaceuticals
pour le traitement des maladies inflammatoires. Il a été optimisé à partir d’une série de composés chimiques brevetée par
Sterling Winthrop
. Il est dérivé du tétrapeptide YVAD et contient en position P4 un 2-naphthyl hydrophobe, un motif bicyclique (pyridazinodiazepine) qui mime la région Val-Ala (résidus en position P3−P2), et une lactone en position C-terminale. Les études précliniques ont été menées dans le cadre d’un partenariat entre
Vertex
et
Hoechst Marion Roussel
. Les informations publiées par
Vertex
indiquent que le pralnacasan inhibe préférentiellement la Caspase-1 et la Caspase-8 et, à un degré plus faible, la Caspase-3. Cet effet préférentiel est moins flagrant dans les données publiées par
Procter & Gamble
[
50
].
Des résultats très prometteurs ont été obtenus dans différents modèles murins d’inflammation et d’arthrite, avec des preuves d’efficacité, par voie orale (acétyl-prodrogue), et des études de toxicité réalisées pendant une période de six mois chez le rat et le chien, avec des doses répétées, qui n’ont pas révélé de limitations sur la dose. Le pralnacasan a ainsi été, en 1998, le premier inhibiteur de caspase à entrer en phase clinique. La phase I a montré une bonne tolérance chez les volontaires sains. Il a ensuite fait l’objet d’une étude clinique de phase II multicentrique, en double-aveugle, contre placebo, sur 285 patients pour le traitement de l’arthrite rhumatoïde, qui a prouvé qu’il était bien toléré, et actif oralement, avec une action anti-inflammatoire, une amélioration clinique et une réduction significative des biomarqueurs de l’inflammation.
A contrario
, lors d’une autre étude de phase II réalisée chez des patients atteints d’ostéoarthrite, aucune amélioration clinique significative n’a été observée. En 2003,
Aventis
et
Vertex Pharmaceuticals
annonçaient l’arrêt du développement du Pralnacasan, en raison des résultats d’une étude de toxicologie chronique prolongée (sur 9 mois) réalisée chez l’animal, qui avait révélé des anomalies hépatiques après administration de doses élevées. Cette décision, confortée par une consultation de la
Food and drug administration
(FDA) américaine, a été prise bien qu’aucune toxicité du pralnacasan n’ait été mise en évidence lors des essais de phase I et II réalisés chez l’homme.
Vextex
a développé un second inhibiteur de Caspase-1, le belnacasan (VX-765). Comme pour son parent le pralnacasan, il s’agit d’un acétyl-pro-médicament avec un groupe partant réversible (aldéhyde). Sous l’action des estérases, son métabolite actif est produit (VRT-043198). Le belnacasan est un puissant inhibiteur de la Caspase-1 et de la Caspase-4 qui présente un effet plus modéré sur la Caspase-8, faible sur la Caspase-9, et très faible sur les Caspases-3 et -7. Il se révèle plus puissant que le pralnacasan sur la libération d’IL-1β dans des modèles cellulaires traités avec du LPS. Il a également montré une efficacité significative dans des modèles animaux d’ostéoarthrite mais aussi d’épilepsie, et d’infarctus du myocarde (en combinaison avec un inhibiteur de l’agrégation plaquettaire). Le belnacasan est oralement actif et bien toléré chez l’homme. En phase IIb, chez 60 patients épileptiques, le critère primaire de sécurité et tolérance a été atteint. Le critère secondaire (diminution de la fréquence des épisodes épileptiques) a donné une tendance favorable avec 15,6 % de réduction dans le groupe traité contre 8,3 % dans le groupe placebo, mais pas de supériorité statistique. Une autre étude de phase II a été réalisée chez des patients atteints de psoriasis, mais les résultats ne sont pas accessibles. Récemment, des données d’efficacité préclinique ont suggéré que le belnacasan pourrait être utilisé chez les patients séropositifs pour le virus de l’immunodéficience humaine (VIH-1) afin de réduire la pyroptose des lymphocytes T CD4
+
[
51
], ainsi que pour le traitement de la maladie d’Alzheimer [
52
] et d’autres maladies neurodégénératives à composante inflammatoire, comme la sclérose en plaques [
53
]. Enfin, puisque des données émergentes indiquent que l’inflammasome NLRP3/Caspase-1 est activé lors de l’infection par le SARS-CoV-2, le mode d’action du belnacasan sur les caspases inflammatoires et son état de développement clinique en font un candidat attractif pour une évaluation de son efficacité clinique pour le traitement des personnes présentant des formes sévères de COVID-19.
L’emricasan (IDN-6556 / PF-034911390) est le premier inhibiteur pan-caspase ayant été évalué chez l’homme [
54
]. Cette molécule, inventée en 1998 par
Idun Pharmaceuticals
, a été acquise par
Pfizer
en 2005, puis cédée à
Conatus Pharmaceuticals
en 2010, qui ensuite a concédé une licence à
Novartis
en 2017 pour son développement exclusif et sa commercialisation. Il s’agit d’un peptidomimétique dérivé de dipeptide qui inhibe irréversiblement les caspases, avec un effet très marqué sur les Caspases-8 et -9
5,
, ce qui lui confère un puissant effet anti-apoptotique dans de nombreux modèles cellulaires et dans les modèles murins de lésions hépatiques. Développé initialement pour le traitement des lésions hépatiques associée à l’infection chronique par le virus de l’hépatite C et les transplantations d’îlots de Langherans chez les patients atteints de diabète, il présente aussi des effets anti-inflammatoires (en inhibant la Caspase-1)
6
. Son effet a été étudié chez plus de 950 patients dans 19 essais cliniques portant sur un large éventail de maladies du foie (stéatose hépatique, hépatite B, hépatite alcoolique, insuffisance hépatique chronique ou aiguë). Chez les patients atteints d’hépatite C, il a significativement amélioré les marqueurs des lésions hépatiques. Au cours des études de phase IIa chez les patients atteints de stéato-hépatites non alcooliques (NASH) cirrhotiques, il induit des réductions cliniquement significatives de l’hypertension portale sévère, des améliorations des mesures de la fonction hépatique et un effet anti-fibrotique. Des réductions rapides et soutenues des biomarqueurs clés de l’inflammation et de la mort cellulaire ont été observées. Cependant, en juin 2019,
Novartis
et
Conatus
ont annoncé l’échec de l’étude clinique de phase IIb (Encore-LF). Fin décembre 2019, les deux résultats des principales études menées par
Conatus
dans le NASH (phase IIb pour la fibrose associée à la NASH et phase III pour la cirrhose) ont été publiées. L’étude de phase III réalisée chez des patients atteints de cirrhose à la suite d’une NASH n’a pas montré d’amélioration de la pression portale ou des résultats cliniques positifs chez les patients atteints. L’étude a cependant confirmé que le traitement par l’emricasan était sûr et bien toléré [
55
]. L’étude de phase IIb pour la fibrose associée à la NASH a montré que l’emricasan n’améliore pas l’histologie hépatique
7,
malgré l’engagement de la cible
8
et que le traitement est également sûr et bien toléré [
56
].
Le nivocasan (GS-9450 / LB84451) est un inhibiteur irréversible des Caspases-1, -8 et -9 découvert par
LG Life Sciences
et développé par
Gilead Sciences
. Un essai de phase I réalisé chez des volontaires sains a montré qu’il était sûr et bien toléré. Des essais de phase II ont donc été effectués afin d’évaluer son efficacité dans la prévention des lésions hépatiques dues aux cicatrices ou à la fibrose causées par l’infection par le virus de l’hépatite C et par une NASH. Dans ces deux études, le traitement a entraîné une baisse des taux d’alanine aminotransférase (ALAT), une enzyme présente principalement dans le foie et dont le taux sanguin signe des atteintes hépatiques. Néanmoins, bien qu’aucun effet secondaire n’ait été détecté chez les patients atteints de NASH, une étude plus large réalisée chez des sujets atteints d’hépatite C a signalé des épisodes de lésions hépatiques d’origine médicamenteuse. L’essai a donc été interrompu, de même que le développement du nivocasan.
Le QPI-1007 est un siARN ciblant l’ARN messager du gène codant la Caspase-2. Il inhibe temporairement l’expression de la Caspase-2 par interférence ARN (ARNi). Il a été conçu et développé par
Quark Pharmaceuticals
. Les études réalisées sur l’animal ont permis : de montrer son effet sur l’activation de la Caspase-2, dans les cellules ganglionnaires de la rétine (RGC) ; de révéler son absorption dans ces cellules, après administration intravitréenne ; d’identifier son mécanisme d’action, par interférence ARN, dans des tissus oculaires récoltés après administration intravitréenne ; et d’évaluer son efficacité, dans quatre modèles animaux [
22
,
57
]. Ce siARN est en cours de développement comme neuroprotecteur dans le traitement de la neuropathie optique ischémique non artéritique (NAION), et d’autres neuropathies optiques, telles que le glaucome, qui entraînent la mort des RGC. Il a obtenu la désignation de médicament orphelin par la FDA pour l’indication de NAION et a été évalué favorablement lors d’une première étude de phase I/IIa chez l’homme. Il a également été évalué dans un essai de phase IIa chez des sujets atteints de glaucome.
Quark Pharmaceuticals
a lancé en 2016, une étude clinique pivotale de phase II/III mondiale pour le traitement du NAION, en collaboration avec le
RiboQuark
en République populaire de Chine, et
Biocon
en Inde. Les résultats n’ont pas encore été publiés ni annoncés.
|
La recherche sur la biologie des caspases et la mise au point d’inhibiteurs de leur activité sont des champs extrêmement actifs depuis plus de 25 ans. Le développement de médicaments interférant avec cette famille d’enzymes a été semé d’embuches, et beaucoup de projets ont échoué, soit lors des phases précliniques (comme pour les inhibiteurs sélectifs de Caspase-3), soit lors de phases cliniques II et III (pour les inhibiteurs pan-caspases). Ces dernières années, l’élucidation du rôle des caspases inflammatoires (Caspases-1, -4, -5) et des mécanismes de la pyroptose, la compréhension fine des interrelations entre la Caspase-8 et la voie de nécroptose, et les éléments de compréhension sur les rôles physiopathologiques de la Caspase-2, ont ouvert de nombreuses pistes qui permettent désormais d’envisager, soit une meilleure orientation clinique des candidats médicaments existants, soit le développement de nouveaux inhibiteurs qui seront capables d’apporter un bénéfice aux patients. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Rawlings
ND
,
Salvesen
G
.
Handbook of proteolytic enzymes.
, 3
rd
ed (vol. 2, chap. 505–513).
New York:
:
Academic Press;
,
2013
:
:2237.
–
85
.
2.
Van Opdenbosch
N
,
Lamkanfi
M
.
Caspases in cell death, inflammation, and disease.
.
Immunity.
2019;
;
50
:
:1352.
–
1364
.
3.
Shalini
S
,
Dorstyn
L
,
Dawar
S
,
Kumar
S
.
Old, new and emerging functions of caspases.
.
Cell Death Differ.
2015;
;
22
:
:526.
–
539
.
4.
Linton
SD
.
Caspase inhibitors: a pharmaceutical industry perspective.
.
Curr Top Med Chem.
2005;
;
5
:
:1697.
–
1717
.
5.
Lee
H
,
Shin
EA
,
Lee
JH
.
Caspase inhibitors: a review of recently patented compounds (2013–2015).
.
Expert Opin Ther Pat.
2018;
;
28
:
:47.
–
59
.
6.
Pop
C
,
Salvesen
GS
.
Human caspases: activation, specificity, and regulation.
.
J Biol Chem.
2009;
;
284
:
:21777.
–
21781
.
7.
Yuan
J
,
Shaham
S
,
Ledoux
S
,
et al.
The C. elegans cell death gene ced-3 encodes a protein similar to mammalian interleukin-1 beta-converting enzyme.
.
Cell.
1993;
;
75
:
:641.
–
652
.
8.
Degterev
A
,
Boyce
M
,
Yuan
J
.
A decade of caspases.
.
Oncogene.
2003;
;
22
:
:8543.
–
8567
.
9.
Talanian
RV
,
Quinlan
C
,
Trautz
S
,
et al.
Substrate specificities of caspase family proteases.
.
J Biol Chem.
1997;
;
272
:
:9677.
–
9682
.
10.
Thornberry
NA
,
Rano
TA
,
Peterson
EP
,
et al.
A combinatorial approach defines specificities of members of the caspase family and Granzyme B. Functional relationships established for key mediators of apoptosis.
.
J Biol Chem.
1997;
;
272
:
:17907.
–
17911
.
11.
McStay
GP
,
Salvesen
GS
,
Green
DR
.
Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways.
.
Cell Death Differ.
2008;
;
15
:
:322.
–
331
.
12.
Tummers
B
,
Green
DR
.
Caspase-8: regulating life and death.
.
Immunol Rev.
2017;
;
277
:
:76.
–
89
.
13.
Dorstyn
L
,
Akey
CW
,
Kumar
S
.
New insights into apoptosome structure and function.
.
Cell Death Differ.
2018;
;
25
:
:1194.
–
1208
.
14.
Groslambert
M
,
Py
BF
.
NLRP3, un inflammasome sous contrôle.
.
Med Sci (Paris).
2018;
;
34
:
:47.
–
53
.
15.
He
Y
,
Zeng
MY
,
Yang
D
,
et al.
NEK7 is an essential mediator of NLRP3 activation downstream of potassium efflux.
.
Nature.
2016;
;
530
:
:354.
–
357
.
16.
Liu
X
,
Zhang
Z
,
Ruan
J
,
et al.
Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores.
.
Nature.
2016;
;
535
:
:153.
–
158
.
17.
Shi
J
,
Zhao
Y
,
Wang
K
,
et al.
Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death.
.
Nature.
2015;
;
526
:
:660.
–
665
.
18.
Miles
MA
,
Kitevska-Ilioski
T
,
Hawkins
CJ
.
Old and novel functions of caspase-2.
.
Int Rev Cell Mol Biol.
2017;
;
332
:
:155.
–
212
.
19.
Kim
JY
,
Garcia-Carbonell
R
,
Yamachika
S
,
et al.
ER Stress drives lipogenesis and steatohepatitis via caspase-2 activation of S1P.
.
Cell.
2018;
;
175
:
:133.
–
145
.
20.
Xu
ZX
,
Tan
JW
,
Xu
H
,
et al.
Caspase-2 promotes AMPA receptor internalization and cognitive flexibility via mTORC2-AKT-GSK3β signaling.
.
Nat Commun.
2019;
;
10
:
:3622.
.
21.
Carlsson
Y
,
Schwendimann
L
,
Vontell
R
,
et al.
Genetic inhibition of caspase-2 reduces hypoxic-ischemic and excitotoxic neonatal brain injury.
.
Ann Neurol.
2011;
;
70
:
:781.
–
789
.
22.
Ahmed
Z
,
Kalinski
H
,
Berry
M
,
et al.
Ocular neuroprotection by siRNA targeting Caspase-2.
.
Cell Death Disease.
2011;
;
2
:
:e173.
.
23.
Pozueta
J
,
Lefort
R
,
Ribe
EM
,
et al.
Caspase-2 is required for dendritic spine and behavioural alterations in J20 APP transgenic mice.
.
Nat Commun.
2013;
;
4
:
:1939.
.
24.
Zhao
X
,
Kotilinek
LA
,
Smith
B
,
et al.
Caspase-2 cleavage of tau reversibly impairs memory.
.
Nat Med.
2016;
;
22
:
:1268.
–
1276
.
25.
Duan
H
,
Dixit
VM
.
RAIDD is a new death adaptor molecule.
.
Nature.
1997;
;
385
:
:86.
–
89
.
26.
Tinel
A
,
Tschopp
J
.
The PIDDosome, a protein complex implicated in activation of Caspase-2 in response to genotoxic stress.
.
Science.
2004;
;
304
:
:843.
–
846
.
27.
Ribe
EM
,
Jean
YY
,
Goldstein
RL
,
et al.
Neuronal Caspase-2 activity and function requires RAIDD, not PIDD.
.
Biochem J.
2012;
;
444
:
:951.
–
959
.
28.
Ando
K
,
Parsons
MJ
,
Shah
RB
,
et al.
NPM1 directs PIDDosome-dependent caspase-2 activation in the nucleolus.
.
J Cell Biol.
2017;
;
216
:
:1795.
–
1810
.
29.
Poltorak
A
,
He
X
,
Smirnova
I
,
et al.
Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene.
.
Science.
1998;
;
282
:
:2085.
–
2088
.
30.
Kayagaki
N
,
Wong
MT
,
Stowe
IB
,
et al.
Noncanonical inflammasome activation by intracellular LPS independent of TLR4.
.
Science.
2013;
;
341
:
:1246.
–
1249
.
31.
Shi
J
,
Zhao
Y
,
Wang
Y
,
et al.
Inflammatory caspases are innate immune receptors for intracellular LPS.
.
Nature.
2014;
;
514
:
:187.
–
192
.
32.
Rathinam
VAK
,
Zhao
Y
,
Shao
F
.
Innate immunity to intracellular LPS.
.
Nat Immunol.
2019;
;
20
:
:527.
–
533
.
33.
Kayagaki
N
,
Stowe
IB
,
Lee
BL
,
et al.
Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling.
.
Nature.
2015;
;
526
:
:666.
–
671
.
34.
Suzuki
T
,
Franchi
L
,
Toma
C
,
et al.
Differential regulation of caspase-1 activation, pyroptosis, and autophagy via Ipaf and ASC in Shigella-infected macrophages.
.
PLoS Pathog.
2007;
;
3
:
:e111.
.
35.
Lagrange
B
,
Benaoudia
S
,
Wallet
P
,
et al.
Human caspase-4 detects tetra-acylated LPS and cytosolic Francisella and functions differently from murine caspase-11.
.
Nat Commun.
2018;
;
9
:
:242.
.
36.
Galluzzi
L
,
Kepp
O
,
Chan
FK
,
Kroemer
G
.
Necroptosis: mechanisms and relevance to disease.
.
Annu Rev Pathol.
2017;
;
12
:
:103.
–
130
.
37.
Lamy
L
,
Ngo
VN
,
Emre
NC
,
et al.
Control of autophagic cell death by caspase-10 in multiple myeloma.
.
Cancer Cell.
2013;
;
23
:
:435.
–
449
.
38.
Chauvier
D
,
Ankri
S
,
Charriaut-Marlangue
C
,
et al.
Broad-spectrum caspase inhibitors: from myth to reality?
.
Cell Death Differ.
2007;
;
14
:
:387.
–
391
.
39.
Roland
E
,
Dolle
C
,
Prasad
C
,
et al.
Pyridazinodiazepines as a high-affinity, P2–P3 peptidomimetic class of interleukin-1β-converting enzyme inhibitor.
.
J Med Chem.
1997;
;
40
:
:1941.
–
1946
.
40.
Maillard
MC
,
Brookfield
FA
,
Courtney
SM
,
et al.
Exploiting differences in caspase-2 and -3 S2 subsites for selectivity: structure-based design, solid-phase synthesis and in vitro activity of novel substrate-based caspase-2 inhibitors.
.
Bioorg Med Chem.
2011;
;
19
:
:5833.
–
5851
.
41.
Bosc
E
,
Anastasie
J
,
Soulami
F
,
et al.
Selective caspase-2 inhibition and synapse protection with a new irreversible pentapeptide derivative (ECDO 81).
.
Cell Death Discov.
2019;
;
5
((suppl 1))
:
:1.
–
48
.
42.
Erlanson
DA
,
Lam
JW
,
Wiesmann
C
,
et al.
In situ assembly of enzyme inhibitors using extended tethering.
.
Nat Biotechnol.
2003;
;
21
:
:308.
–
314
.
43.
Choong
IC
,
Lew
W
,
Lee
D
,
et al.
Identification of potent and selective small-molecule inhibitors of caspase-3 through the use of extended tethering and structure-based drug design.
.
J Med Chem.
2002;
;
45
:
:5005.
–
5022
.
44.
Chapman
JG
,
Magee
WP
,
Stukenbrok
HA
,
et al.
A novel nonpeptidic caspase-3/7 inhibitor, (S)-(+)-5-[
1
-(2-methoxymethylpyrrolidinyl)sulfonyl]-isatin reduces myocardial ischemic injury
.
.
Eur J Pharmacol.
2002;
;
456
:
:59.
–
68
.
45.
Scott
CW
,
Sobotka-Briner
C
,
Wilkins
DE
,
et al.
Novel small molecule inhibitors of caspase-3 block cellular and biochemical features of apoptosis.
.
J Pharmacol Exp Ther.
2003;
;
304
:
:433.
–
440
.
46.
Nobel
CS
,
Kimland
M
,
Nicholson
DW
,
et al.
Disulfiram is a potent inhibitor of proteases of the caspase family.
.
Chem Res Toxicol.
1997;
;
10
:
:1319.
–
1324
.
47.
Scheer
JM
,
Romanowski
MJ
,
Wells
JA
.
A common allosteric site and mechanism in caspases.
.
Proc Natl Acad Sci USA.
2006;
;
103
:
:7595.
–
7600
.
48.
Tubeleviciute-Aydin
A
,
Beautrait
A
,
Lynham
J
,
et al.
Identification of allosteric inhibitors against active caspase-6.
.
Sci Rep.
2019;
;
9
:
:5504.
.
49.
Degterev
A
,
Huang
Z
,
Boyce
M
,
et al.
Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury.
.
Nat Chem Biol.
2005;
;
1
:
:112.
–
119
.
50.
Oppong
K
,
Ellis
C
,
Laufersweiler
M
,
et al.
Discovery of novel conformationally restricted diazocan peptidomimetics as inhibitors of interleukin-1β synthesis.
.
Med Chem Lett.
2005;
;
15
:
:4291.
–
4294
.
51.
Doitsh
G
,
Galloway
NL
,
Geng
X
,
et al.
Cell death by pyroptosis drives CD4 T-cell depletion in HIV-1 infection.
.
Nature.
2014;
;
505
:
:509.
–
514
.
52.
Flores
J
,
Noël
A
,
Foveau
B
,
et al.
Caspase-1 inhibition alleviates cognitive impairment and neuropathology in an Alzheimer’s disease mouse model.
.
Nat Commun.
2018;
;
9
:
:3916.
.
53.
McKenzie
BA
,
Mamik
MK
,
Saito
LB
,
et al.
Caspase-1 inhibition prevents glial inflammasome activation and pyroptosis in models of multiple sclerosis.
.
Proc Natl Acad Sci USA.
2018;
;
115
:
:E6065.
–
E6074
.
54.
Linton
SD
,
Aja
T
,
Armstrong
RA
,
et al.
First-in-class pan caspase inhibitor developed for the treatment of liver disease.
.
J Med Chem.
2005;
;
48
:
:6779.
–
6782
.
55.
Garcia-Tsao
G
,
Bosch
J
,
Kayali
Z
,
et al.
Randomized placebo-controlled trial of emricasan in non-alcoholic steatohepatitis (NASH) cirrhosis with severe portal hypertension.
.
J Hepatol.
2019;
;
S0168–8278
:
:30724.
.
56.
Harrison
SA
,
Goodman
Z
,
Jabbar
A
,
et al.
A randomized, placebo-controlled trial of emricasan in patients with NASH and F1–F3 fibrosis.
.
J Hepatol.
2019;
;
S0168–8278
:
:30758.
–
30755
.
57.
Vigneswara
V
,
Ahmed
Z
.
Long-term neuroprotection of retinal ganglion cells by inhibiting caspase-2.
.
Cell Death Discovery.
2016;
;
2
:
:16044.
.
58.
Chauvier
D
,
Renolleau
S
,
Holifanjaniaina
S
,
et al.
Targeting neonatal ischemic brain injury with a pentapeptide-based irreversible caspase inhibitor.
.
Cell Death Disease.
2011;
;
2
:
:e203.
.
|