| |
| Med Sci (Paris). 36(12): 1135–1142. doi: 10.1051/medsci/2020220.Sénothérapies Avancées et nouvelles perspectives cliniques Damien Veret1,2 and Jean-Marc Brondello1* 1
Groupe Sénothérapies innovantes en médecine régénératrice, IRMB (
Institute for Regenerative Medicine and Biotherapy
– Cellules souches, plasticité cellulaire, régénération tissulaire et immunothérapie des maladies inflammatoires), Inserm UMR1183, université de Montpellier
,
80 avenue A. Fliche
,
34298Montpellier
,
France 2MedxCell Science, Hôpital universitaire de Montpellier
,
80 avenue A. Fliche
,
34298Montpellier
,
France |
Le vieillissement est accompagné par l’apparition de dégénérescences tissulaires causées par l’accumulation de cellules sénescentes [
1
]. Présentes transitoirement dans de nombreux tissus, tout au long de la vie, ces cellules jouent le rôle d’orchestrateur du développement et de la régénération. Mais avec l’âge, elles finissent par s’accumuler et conduisent progressivement aux déclins de nombreux tissus. La sénescence cellulaire est caractérisée par un arrêt du cycle cellulaire, résultant de l’action des inhibiteurs de kinases dépendantes des cyclines (CKI), tels que p16
INK4a
ou p21
CDKN1a
, par une augmentation de l’activité β-galactosidase lysosomale (SA-β-Gal, pour
senescence-associated
b
-galactosidase
), une résistance à l’apoptose et parfois, l’apparition de foyers d’hétérochomatines (SAHF,
senescence-associated heterochromatin foci
) [
1
]. Les cellules sénescentes, malgré un métabolisme modifié, produisent un sécrétome particulier appelé SASP pour
senescence-associated secretory phenotype
. Il est constitué de facteurs de remodelage tissulaire, de facteurs inflammatoires et d’attraction du système immunitaire (IL[interleukine]-6, CXCL12 [
C-X-C motif chemokine 12
], MMP3 [
matrix metalloproteinase-3
], TNFSF1[
tumor necrosis factor ligand superfamily member 1
]), qui permettent l’élimination rapide de ces cellules [
2
]. La sénescence peut être transmise de proche en proche par ce SASP. L’injection de cellules sénescentes à des souris jeunes provoque ainsi des dégénérescences similaires à celles observées dans les pathologies du sujet âgé [
3
]. Le programme de sénescence se met en place en réponse à des signaux intrinsèques d’altérations du génome ou métaboliques, mais aussi en réponse à des signaux extrinsèques, tels que des agents génotoxiques, des virus, des cytokines inflammatoires ou des facteurs trophiques. Ce processus affecte des cellules en prolifération, mais aussi post-mitotiques ou quiescentes [
1
].
Afin d’étudier les fonctions de la sénescence dans l’organisme, deux principaux modèles murins ont été développés : les souris INK-ATTAC (
INK-linked apoptosis through targeted activation of caspase
)
1,
et les souris p16-3MR
2,
, dans lesquelles le promoteur minimal du gène codant p16
INK4Aa
contrôle l’expression d’une protéine chimérique permettant de détecter et d’éliminer pharmaco-génétiquement les cellules sénescentes. Grâce à ces modèles transgéniques, il a été possible de démontrer que l’élimination des cellules sénescentes protège l’animal de mladies liées à l’âge [
1
]. Leur ciblage offre donc des perspectives intéressantes pour traiter les symptômes de ces maladies chez l’homme.
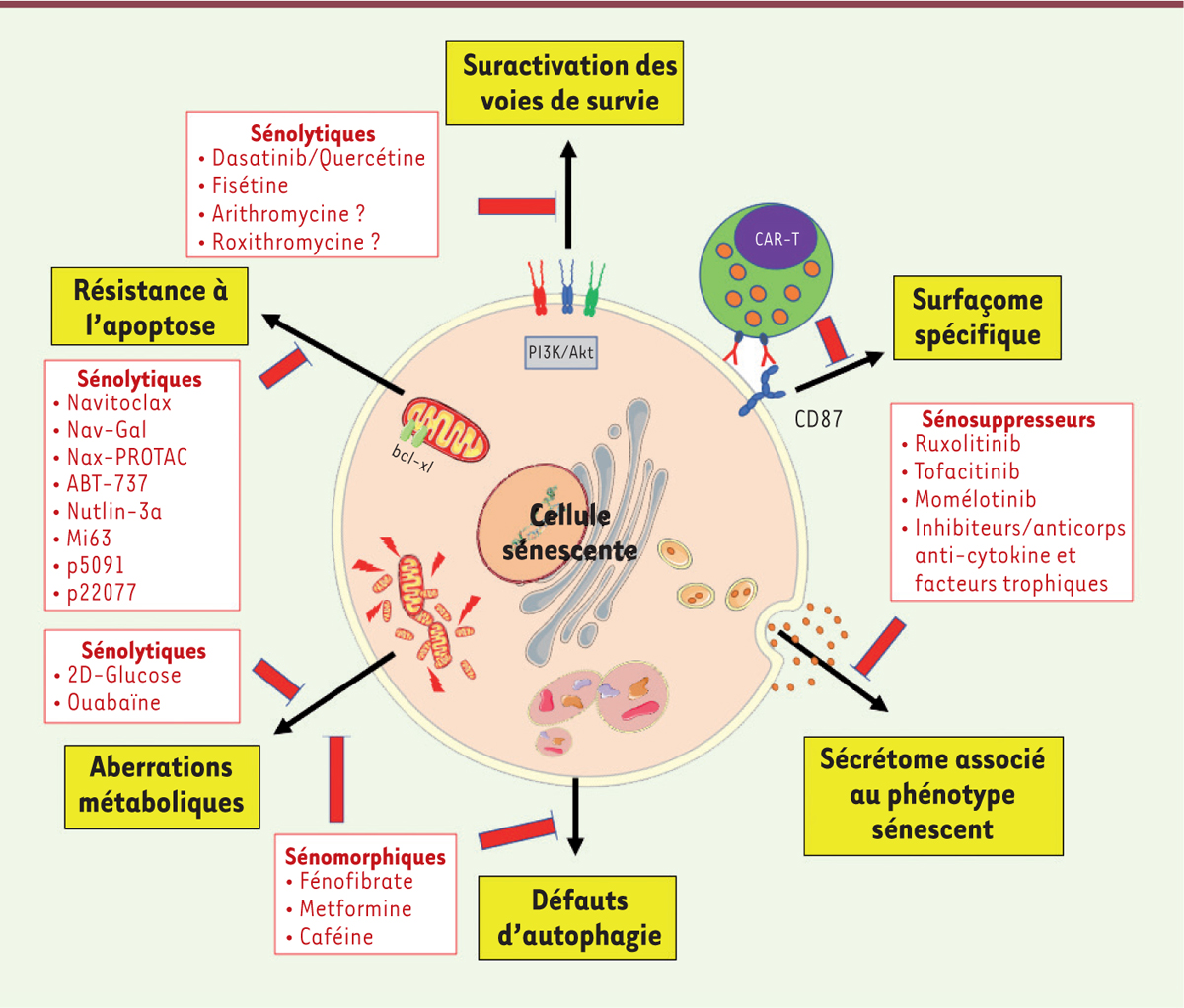
Ces « sénothérapies » se distinguent en 3 grandes catégories : les sénolytiques, les sénomorphiques/sénostatiques et les sénosuppresseurs. Nous proposons ici de faire le point sur ces différentes sénothérapies et de mettre en perspective les premières retombées en médecine régénératrice pour traiter les maladies des sujets âgés
(
Figure 1
)
.
 | Figure 1.
Propriétés acquises par la cellule sénescente et sénothérapies associées.
|
|
Les sénolytiques modulent les voies qui régulent la mort des cellules sénescentes
Les cellules sénescentes, comme les cellules tumorales, activent des voies de signalisation qui favorisent leur survie, notamment la voie des phosphoinositide 3-kinases (PI3K), les protéines anti-apoptotiques de la famille Bcl-2 (
B-cell lymphoma 2
), la balance p53/MDM2 (
murine double minute 2
) et les voies métaboliques auxotrophes. L’inhibition de ces voies rétablit la mort de ces cellules résistantes. C’est pourquoi de nombreux sénolytiques ont d’abord été développés pour des applications en cancérologie.
Bloquer la voie PI3K/Akt impliquée dans la croissance et la survie cellulaire
La PI3K régit la survie cellulaire
via
la protéine Akt (protéine kinase B). Cette action peut être contrecarrée par plusieurs flavonoïdes, des composés phénoliques naturels antioxydants, tels que la quercétine. Ainsi, la première stratégie sénolytique proposée fut le cocktail dasatinib/quercétine (D+Q). Le dasatinib (Sprycel®) est un inhibiteur de tyrosine-kinases cytosoliques de la famille Src qui peuvent activer les PI3K.
In vitro
, le cocktail D+Q permet d’inhiber efficacement la voie PI3K/Akt et provoque la mort de préadipocytes induits en sénescence par irradiation [
4
].
In vivo
, l’administration orale de ce cocktail permet également de contrer les effets délétères dégénératifs d’une transplantation de cellules sénescentes chez des souris jeunes [
3
]. Il élimine également les cardiomyocytes sénescents chez la souris âgée [
5
]. Dans un modèle de glaucome, réalisé chez les souris p16-3MR par induction d’une hypertension oculaire, l’élimination pharmaco-génétique, ou l’injection par voie intra-péritonéale de dasatinib, sont suffisants pour empêcher la perte d’acuité visuelle des animaux [
6
,
7
]. La fisétine, un flavonoïde analogue à la quercétine, possède les mêmes propriétés sénolytiques. Elle induit, en effet, la mort
in vitro
de fibroblastes de souris progériques
3
(souris Ercc1
-/
Δ, qui n’expriment pas l’endonucléase ERCC1) et de myofibroblastes humains sénescents [
8
].
In vivo
, son administration orale chez des souris progériques ou âgées, permet de réduire considérablement la dégénérescence du tissu cérébral et des reins, tout en augmentant la capacités physiques et cognitives des animaux ainsi que leur espérance de vie [
9
]. Outre sa capacité à inhiber la PI3K, la fisétine joue également un rôle antioxydant
in vivo
en protégeant de la lipoperoxydation, et en stimulant la production de glutathion dans le foie [
8
].
Réactiver l’apoptose dans les cellules sénescentes : le développement des mimétiques BH3
Les protéines anti-apoptotiques de la famille Bcl-2 (Bcl-2, Bcl-xL ou Bcl-w), qui bloquent le déclenchement de l’apoptose
via
leur domaine BH3 (
Bcl-2 homology domain 3
)
4,
, et sont impliquées dans les voies SCAP (
senescent cells anti-apoptotic pathways/proteins
), sont communément surexprimées par les cellules tumorales et les cellules sénescentes [
4
, 10,
11
]. Des ARN interférants spécifiques de ces protéines permettent de rétablir une apoptose impliquant la voie mitochondriale dans les cellules sénescentes de certains types cellulaires en culture [
4
,
10
]. Il a donc été proposé que des composés mimant le domaine BH3 de ces protéines pourraient présenter une activité sénolytique. Le Navitoclax
®
(ABT-263), pionnier de ces mimétiques BH3, a ainsi montré des effets sénolytiques sur des cellules endothéliales de cordons ombilicaux humains (HUVEC) et des fibroblastes embryonnaires de souris (MEF), induits en sénescence par irradiation [
10
]. Néanmoins, son utilisation
in vivo
, chez la souris ou chez l’homme, induit de graves effets secondaires, tels qu’une thrombocytopénie [
12
]. Des récentes recherches ont conduit au développement de méthodes de vectorisation du Navitoclax® afin d’améliorer sa sélectivité vis-à-vis des cellules sénescentes, et ainsi empêcher l’atteinte des plaquettes sanguines. Le couplage du Navitoclax® avec le galactose (Nav-Gal) a ainsi permis d’augmenter sa spécificité en termes de cytotoxicité de cellules sénescentes induite par chimiothérapie dans deux modèles cellulaires, et de réduire sa toxicité plaquettaire, seules les cellules sénescentes pouvant libérer un composé actif après clivage du complexe Nav-Gal [
13
,
14
]. Le couplage à des systèmes PROTAC (
proteolysis targeting chimera
), des technologies reposant sur la protéolyse induite par des protéines chimériques, consiste en un couplage covalent de la drogue à un ligand spécifique de protéines à activité E3 ubiquitine ligase qui sont fortement exprimées par les cellules sénescentes et très peu par les plaquettes sanguines. À la manière d’un leurre, le Navitoclax
®
a ainsi pu être ainsi couplé au VH032, le ligand de la von Hippel-Lindau (VHL) E3 ligase [
15
], et au pomalidomide, le ligand de la E3 ligase céréblon [
16
]. Ces Nav-PROTAC conservent leurs propriétés pro-apoptotiques
in vitro
sur des fibroblastes sénescents, non plus en inhibant mais en provoquant la dégradation de Bcl-xL par le protéasome. Ils se montrent moins toxiques pour les plaquettes. Bien que cette conjugaison diminue la solubilité de la drogue en phase aqueuse, une injection intrapéritonéale tous les 3 jours pendant 21 jours chez des souris naturellement âgées, permet de réduire l’expression dans la rate, le foie, les poumons, les reins et le tissu adipeux, des CKI p16
INK4A
et p21
Cdkn1a
et du SASP. L’ABT-737, un analogue du Navitoclax
®
, réduit également le phénotype sénescent dans deux modèles murins de vieillissement accéléré [
17
]. Le premier modèle repose sur les souris prf1
-/-
, déficientes pour le gène codant la perforine responsable de la cytotoxicité des lymphocytes T CD8
+
(LT
CD8
+
) et des cellules NK (
natural killers
). Ces animaux accumulent des cellules sénescentes dans le foie, la rate, les poumons et la peau. En effet, les cellules sénescentes, normalement éliminées par les cellules NK et les LT
CD8
+
, finissent par s’accumuler et conduisent progressivement à l’apparition de pathologies liées à l’âge qui réduisent l’espérance de vie des animaux. Le deuxième modèle utilise des souris haplo-insuffisantes pour la lamine A, une protéine dont les mutations sont associées à la Progéria. Dans ces deux modèles, l’injection intermittente d’ABT-737 permet d’accroître les capacités locomotrices et physiques des animaux tout en réduisant la fibrose dans les tissus. Ces injections permettent de réduire de plus de 50 % le nombre de cellules sénescentes dans les tissus de ces souris progériques, avec pour conséquence, l’accroissement de leur longévité. Enfin l’ABT-737 protège également de la perte de poids liée à l’âge [
17
].
Exacerber la réponse au stress des cellules sénescentes en sur-activant p53
La protéine p53 (TP53) est un suppresseur de tumeurs impliqué dans la réponse cellulaire au stress. Son activation provoque l’arrêt du cycle
via
l’expression de p21
Cip1
et peut, si elle est importante, induire l’expression de protéines pro-apoptotiques, telles que PUMA (
P53 upregulated modulator of apoptosis
). Les niveaux d’activation de p53 régulent donc le choix, pour la cellule, d’entrer en sénescence ou en apoptose [
18
]. Bien que contre-intuitif, le ciblage pharmacologique des voies inhibitrices de p53, comme celle de MDM2, est utilisé en sénolyse.
MDM2 est une E3 ubiquitine ligase qui régule la dégradation de p53 et contrôle, par sa localisation mitochondriale, le métabolisme cellulaire [
19
]. Des antagonistes de MDM2, tels que la nutline-3a ou le MI-63, ont montré des effets anti-inflammatoires en réduisant l’expression de marqueurs du SASP dans des fibroblastes dont la sénescence a été induite par irradiation [
20
]. Néanmoins, après élimination des drogues (par lavage), une sénescence réversible est également induite. Ces résultats ont conduit à l’utilisation de ce type de molécules dans la maladie rhumatismale la plus fréquente qu’est l’arthrose. L’efficacité sénolytique d’un dérivé de la nutline-3a, l’UBX0101
®
, a ainsi pu être démontrée dans les modèles de souris p16-3MR et INK-ATTAC, chez lesquelles une arthrose traumatique a été induite par section du ligament croisé antérieur [
21
]. Des injections intra-articulaires réduisent les marqueurs de sénescence (qui apparaît 28 jours après la chirurgie) dans la synoviale et les couches superficielles du cartilage, et créent un environnement chondro-régénérateur chez la souris jeune, mais pas chez la souris âgée [
21
].
La peptidase USP7 (
ubiquitin-specific peptidase 7
) régule positivement l’activité de MDM2. Elle hydrolyse ses motifs ubiquitines, la protégeant ainsi de sa dégradation par le protéasome. Elle réprime par conséquent p53 de façon indirecte.
In vitro
, l’addition d’inhibiteurs d’USP7, comme le p5091 et le p22077, dans des cultures de fibroblastes pulmonaires humains sénescents, réduit le niveau de MDM2 et augmente celui de p53, provoquant la mort des cellules par apoptose [
22
].
In vivo
, des injections par voie intrapéritonéale de p5091 pendant 14 jours diminuent drastiquement la sénescence induite chez la souris par la doxorubicine, et réduisent l’augmentation des facteurs du SASP dans les reins chez la souris. Les souris ainsi traitées ne montrent aucun changement significatif de leurs poids ou de leurs hémogrammes.
Cibler les voies métaboliques auxotrophes pour induire la mort des cellules sénescentes
L’état sénescent affecte le métabolisme cellulaire. On constate en effet, une accumulation de mitochondries dysfonctionnelles qui est l’un des marqueurs de la sénescence. Chez la souris, cette accumulation participe à l’émergence de plusieurs maladies dégénératives liées à l’âge, lorsqu’elle affecte les lymphocytes T [
23
]. Ces mitochondries déficientes participent à l’augmentation du stress oxydant cellulaire et entraînent le basculement du métabolisme de la cellule sénescente vers un métabolisme glycolytique. L’utilisation du 2-déoxy-glucose, un inhibiteur compétitif du glucose non hydrolysable par glycolyse, induit ainsi la mort de cellules tumorales devenues sénescentes en réponse à la chimiothérapie [
24
]. Les cellules sénescentes sont également très sensibles aux inhibiteurs de l’ATPase Na
+
/K
+
de la famille des glycosides cardiaques, tels que l’ouabaïne, la digoxine et la digitoxine [
25
]. Ces composés, prescrits en clinique pour des dysfonctions cardiaques après fibrillations auriculaires, activent dans les cellules sénescentes les voies des stress kinases et GSK3 (
glycogen synthase kinase-3
), provoquant une apoptose en partie dépendante de la voie impliquant NOXA, un membre de la famille des protéines Bcl-2.
In vivo,
dans des modèles de cancers induits chez la souris, les traitements par l’ouabaïne éliminent les lésions pré-néoplasiques sénescentes exprimant p21
Cdkn1a
et des marqueurs du SASP. L’effet le plus remarquable des glycosides cardiaques est la réduction à la fois des marqueurs de sénescence, des marqueurs sanguins du vieillissement, tels que le niveau d’albumine, mais aussi des modifications de composition des infiltrats immunitaires (cellules myéloïdes et lymphoïdes) dans les tissus de souris femelles âgées (24 mois) qui ont été traitées [
25
]. Par une délivrance intermittente (en 5 périodes), ils améliorent au final l’activité physique des animaux. Néanmoins, cette famille de composés provoque de nombreux effets indésirables chez l’homme [
26
], limitant grandement les applications séno-thérapeutiques chez le patient âgé.
Favoriser l’élimination des cellules sénescentes par le système immunitaire
Les cellules sénescentes attirent par la production du SASP, les cellules immunitaires (cellules NK et lymphocytes T CD8
+
) qui participent à leur élimination [
2
,
17
]. Une hypothèse est qu’avec le vieillissement, l’efficacité de ces mécanismes d’
immuno-clairance
de la sénescence s’amoindrit. L’identification du marqueur de surface uPAR/CD87 (récepteur de l’urokinase, activateur du plasminogène), observé dans trois modèles de sénescence induite chez la souris, a permis d’envisager le développement de CAR (
chimeric antigen receptor
)
-T cells
, des lymphocytes T modifiés génétiquement exprimant un TCR (récepteur de l’antigène) capable de reconnaître spécifiquement la molécule CD87 présente à la surface des cellules sénescentes, et d’induire leur mort [
27
]. La preuve de l’efficacité de cette immunothérapie appliquée à la sénescence a été validée dans les trois modèles murins de sénescence [
27
]. Des injections régulières par voie intraveineuse de Car-T-uPAR ont en effet permis de réduire la présence, au niveau du foie des animaux, des marqueurs de sénescence et de fibrose [
27
]. Ces résultats ouvrent des perspectives thérapeutiques inédites pour les patients atteints de dysfonctions tissulaires induites par la sénescence.
|
Les sénomorphiques : moduler le métabolisme pour inverser les processus pro-sénescents
Bien que la sénolyse soit une stratégie de choix, elle pourrait s’avérer délétère dans certains tissus à faible régénération. Une sénothérapie alternative, dite sénomorphique (ou sénostatique), consiste à bloquer, voire inverser, les mécanismes intracellulaires pro-sénescents tout en maintenant l’arrêt prolifératif. La sénescence est caractérisée par une accumulation intracellulaire de biomolécules et d’organelles endommagés (les mitochondries), qui sont normalement éliminés par autophagie. La capacité autophagique des cellules diminue avec la sénescence réplicative [
28
], ce qui conduit à des dégénérescences tissulaires, comme celles observées dans la maladie d’Alzheimer [
29
]. Une réactivation de l’autophagie dans les cellules sénescentes pourrait donc être bénéfique, en restaurant le recyclage des protéines déficientes [
30
]. mTORC1 (
mammalian target of rapamycin complex
) est le maître régulateur du flux autophagique en servant de point de convergence entre anabolisme et catabolisme cellulaires. Son activation par la voie PI3K/Akt conduit à une augmentation de la protéo/lipogénèse et à une diminution de l’autophagie [
31
]. Elle accroît également la biogénèse et la fission des mitochondries [
32
] et induit une surexpression des complexes de la chaîne respiratoire et, par conséquent, un accroissement de la phosphorylation oxydative [
33
] en partie responsable du stress oxydant. La protéine kinase mTOR, le centre catalytique des deux complexes mTORC1 et mTORC2, est surexprimée et activée progressivement avec la sénescence réplicative de cellules de muscles lisses vasculaires humaines (hVSMC) [
28
]. La rapamycine (Sirolimus
®
) qui inhibe spécifiquement mTORC1, est connue pour augmenter le flux autophagique et accroître l’espérance de vie. Le traitement par la rapamycine protège les hVSMC de la sénescence réplicative, en empêchant l’activation de la voie de stress p53/p21. Récemment, un essai clinique a démontré l’action bénéfique de l’application de rapamycine (sous forme de crème) sur le vieillissement de la peau : elle réduit le nombre de cellules positives pour p16
INK4a
(dans les biopsies de peau), et rétablit l’expression du collagène VII, normalement perdue avec l’âge [
34
]. mTOR peut également être inhibée indirectement en stimulant l’AMPK (adénosine monophosphate kinase) par la Metformine
®
, un agoniste de l’AMPK utilisé pour le traitement du diabète de type 2 depuis plus de 60 ans. En plus des effets anti-diabétiques, la Metformine
®
, en mimant le phénotype associé à la restriction calorique, accroît la longévité de
Caenorhabditis elegans
[
35
] et de la souris. L’activation de l’AMPK par la Metformine
®
provoque une augmentation du rapport ADP/ATP cellulaire – signal, pour la cellule, d’un déficit énergétique – ce qui active la b-oxydation, la glycolyse et l’autophagie, pour pallier le manque d’ATP. Chez le rat, la Metformine
®
protège de la sénescence et de l’apoptose les cellules du
nucleus pulposus
5
qui participent à la dégénérescence des disques intervertébraux liée à l’âge. Dans des fibroblastes humains induits en sénescence par l’oncogène HRAS
G12V
(
oncogene-induced senescence
, OIS), elle possède des effets anti-inflammatoires en modulant négativement la voie pro-inflammatoire impliquant NF-kB (
nuclear factor-kappa B
) [
36
]. Contrairement aux flavonoïdes, son activité d’accepteur d’électrons pour les peroxydes et les superoxydes, notamment produits par la chaîne respiratoire mitochondriale, est faible ; son action antioxydante repose sur l’induction de la production d’oxydoréductases, qui participent à l’élimination des réactifs oxygénés libres [
38
].
La caféine a été initialement décrite pour ces propriétés antioxydantes en protégeant les membranes cellulaires de la lipoperoxydation [
39
]. Elle possède aussi, à des doses de l’ordre du millimolaire, la capacité d’induire l’apoptose et de dépasser le point de contrôle G2/M en réponse à des lésions de l’ADN, en inhibant les protéines kinases ATM/ATR (
ataxia telangectasia mutated, and Rad3-related protein
) [
40
]. Elle présente un potentiel anti-sénescent similaire à celui de la rapamycine [
41
].
In vitro
et
in vivo
, sur des cellules de peau traitées par un initiateur de radicaux libres ou par des rayons ultra-violets, la caféine réduit significativement l’entrée en sénescence associée à la voie p53/p21 [
41
]. À des doses micromolaires, elle est un antagoniste du récepteur de l’adénosine A2aR, qui participe à l’activation de l’adénylate cyclase qui module négativement l’AMPK et la SirT3 (sirtuine 3), une désacétylase mitochondriale associée à la longévité [
42
]. En inhibant A2aR, la caféine accroît ainsi le flux autophagique avec pour effet de favoriser la formation d’autophagosomes et l’élimination des mitochondries défaillantes (par mitophagie), en partie à l’origine du stress oxydant cellulaire [
41
]. De même, le traitement par la caféine empêche l’activation de NF-kB dans des macrophages traités par le lipopolysaccharide [
43
].
Le flux autophagique peut également être accru en activant le catabolisme des lipides par les fibrates. Les fibrates, utilisés dès les années 1970 comme hypolipémiants, sont des ligands synthétiques des PPAR (
peroxysomes proliferator-activated receptors
), des cofacteurs de transcription régulant en particulier l’expression de gènes liés à la dégradation des lipides. Les PPAR ont également une activité anti-inflammatoire en inhibant la voie NF-kB [
44
]. La perte d’expression des PPAR entraîne la fibrose de tissus âgés, comme le cartilage [
45
]. Récemment, le fénofibrate a été sélectionné à partir d’un criblage de molécules capables de restaurer l’autophagie dans des chondrocytes traités par l’interleukine 6 (IL-6), et de réduire les marqueurs de sénescence [
46
]. Comparé à la rapamycine, molécule sénomorphique de référence, il induit l’apoptose sélective des chondrocytes sénescents, révélant également une activité sénolytique.
|
Les sénosuppresseurs : cibler le SASP pour empêcher la propagation de la sénescence
Les stratégies sénolytiques et sénomorphiques sont indiquées pour traiter des cellules sénescentes déjà présentes au sein d’un tissu pathologique. Une autre stratégie sénothérapeutique envisagée serait d’empêcher ou de retarder l’apparition de nouvelles cellules sénescentes dans les tissus vieillissants. La propagation de la sénescence de proche en proche, au sein d’un tissu, repose sur des facteurs paracrines et autocrines qui sont produits initialement par les premières cellules sénescentes (constituant le SASP). Bloquer l’action et/ou les voies à l’origine de la production de ces facteurs permettrait donc de prévenir la propagation de la sénescence. Parmi les stratégies de blocage, les biothérapies anti-inflammatoires constituent un arsenal thérapeutique de sénosuppresseurs. Actuellement, toute une batterie d’inhibiteurs ciblant des cytokines pro-inflammatoires est ainsi largement prescrite en rhumatologie. L’efficacité sénosuppressive de telles biothérapies vient très récemment d’être démontrée dans un modèle de souris transgénique de vieillissement accéléré [
23
]. Chez ces souris, la délétion spécifique dans les lymphocytes T de
TFAM
(
transcription factor A, mitochondrial
), qui code un facteur de transcription indispensable à l’homéostasie mitochondriale, entraîne, dés 6 mois, une rapide propagation de l’état sénescent dans plusieurs organes, tels que les muscles, le tissu adipeux, le foie, les reins [
23
]. Les lymphocytes T sénescents produisent de grandes quantités de radicaux libres mais aussi de
tumor necrosis factor alpha
(TNF-a). L’injection d’un inhibiteur du TNF-a, l’étanercept (Enbrel®)
6,
, réduit la sénescence et les signes cliniques de plusieurs tissus, et augmente la longévité des souris [
23
]. On peut ainsi proposer de classer comme molécules sénosuppressives, de nombreuses biothérapies anti-inflammatoires. Néanmoins, devant la complexité de composition du sécrétome des cellules sénescentes (SASP), il serait plus intéressant de cibler les voies de signalisation responsables de la production des facteurs le constituant, telles que celles impliquant JAK (
Janus kinases
) et STAT (
signal transducers and activators of transcription
). En réponse à des cytokines ou à des facteurs trophiques, les kinases JAK,
via
les signaux activateurs STAT, induisent l’expression de gènes pro-inflammatoires mais régulent également le cycle et la mort cellulaires. Les effets sénosuppresseurs des inhibiteurs de JAK (JAKi), ont été mis en évidence pour la première fois dans des modèles de préadipocytes humains sénescents, et dans des modèles murins de souris âgées de 24 mois [
47
,
48
].
In vitro
, le traitement par le momélotinib (CYT387) (inhibiteur de JAK1 et JAK2) permet en effet de diminuer le nombre de cellules positives pour la SA-b-Gal (
senescence-associated beta-galactosidase
) et de réduire l’expression des facteurs du SASP. De même, le ruxotinilib (Jakavi
®
) (INCB18424) réduit
in vivo
, les facteurs sériques pro-inflammatoires circulants mais aussi l’inflammation dans le tissu adipeux de souris âgées, en relation avec la diminution des marqueurs du SASP. Il améliore également les capacités physiques et la robustesse des souris traitées, notamment en les protégeant de la perte de masse osseuse liée à l’âge, qui peut conduire à l’ostéoporose [
49
]. Le ruxotinilib, comme le baricitinib (Olumiant
®
), présentent des effets similaires sur des fibroblastes embryonnaires humains surexprimant la progérine, et dans des modèles précliniques murins de Progéria, en réduisant l’expression de CKI (
cyclin kinase inhibitor
) et en réprimant le SASP, sans induire la mort cellulaire [
50
].
|
Conclusion et perspectives
Au cours de ces quatre dernières années, les découvertes concernant les sénothérapies se sont accélérées
(
Tableau I
)
. Leur utilisation pour cibler la sénescence dans des modèles précliniques se diversifie et intéresse de nombreuses maladies dégénératives. Néanmoins, parce que la sénescence est un syndrome cellulaire complexe, les sénothérapies ne semblent pas universelles. Le cocktail D+Q, par exemple, induit la mort de préadipocytes irradiés sénescents, mais pas de cellules endothéliales. Inversement, le navitoclax cible les cellules endothéliales mais pas les préadipocytes [
11
].
In vivo
, la fisétine élimine uniquement les cellules stromales mésenchymateuses, les cellules NK et les lymphocytes T, mais elle n’a aucun effet sur les macrophages et les cellules dendritiques sénescents [
8
]. S’ajoutant à cette complexité, la sénescence, une fois induite, est un processus dynamique qui continue de modifier la cellule atteinte au cours du temps, notamment en termes de structures 4D de la chromatine et d’expression génique [
51
]. Nous pouvons donc supposer qu’au sein d’un même tissu vieillissant, coexiste une mosaïque de sous-populations de cellules qui sont à différents stades de sénescence. Une analyse à l’échelle de la « cellule unique » permettrait de le démontrer.
Tableau I.
| Classe |
Nom(s) |
Cible(s) |
Mode(s) d’action |
| Sénolytiques |
Dasatinib/Quercétine |
Antagonistes des PI3K/
Antioxydants
|
Induisent la mort en inhibant les voies de survie. Protègent des radicaux oxygénés libres |
| Fisétine |
| Navitoclax |
Inhibiteurs des protéines anti- apoptotiques de la famille Bcl-2 |
Induit la mort en réactivant l’apoptose |
| Nav-Gal |
| Nav-PROTAC |
| Nutline-3a |
Inhibiteurs de MDM2 |
Suractivation des voies de stress induites par p53 pour provoquer l’apoptose |
| Mi-63 |
| p5091 |
inhibiteurs d’USP7 |
| p22077 |
| CAR-T |
uPAR/CD87 |
Activité cytotoxique |
| 2D-Glucose |
Transporteurs du glucose et glycolyse |
Dépletion compétitive de l’utilisation du glucose par les cellules sénescentes |
| Ouabaïne |
Inhibiteur ATPase Na
+
/K
+
|
Induit la mort en activant la voie de stress NOXA-dépendante |
|
| Sénomorphiques/sénostatiques |
Rapamycine |
Antagoniste mTORC1 |
Favorise le catabolisme cellulaire en réactivant l’autophagie |
| Metformine |
Agoniste de l’AMPK |
| Fénofibrates |
Agoniste des PPAR |
| Caféine |
Antagoniste A2AR |
|
| Sénosuppresseurs |
Ruxolitinib |
Inibiteur JAK1/2 |
Empêche la production du SASP en inhibant la voie JAK/STAT |
| Momélotinib |
| Baricitinib |
|
Anticorps/protéines
(ex. : Étanercept®)
|
Facteurs du SASP
(ex. : TNFa)
|
Inhibition des facteurs pro-sénescents |
Cibles et modes d’action des sénothérapies disponibles.
|
Le classement des différentes catégories de sénothérapie reste encore discuté. En effet, certains sénolytiques ont aussi une activité sénosuppressive [
20
]. À l’inverse, des sénomorphiques comme l’azithromycine ou la roxithromycine, analogues de la rapamycine, peuvent déclencher l’apoptose des cellules sénescentes [
52
].
La sénescence est également un processus physiologique nécessaire qui intervient dans le développement, la régénération, certains stades terminaux cellulaires et comme mécanisme suppresseur de tumeurs. Cibler des voies modulant la sénescence entraînera donc des dysfonctions chez l’homme. Ainsi, en plus des effets secondaires liés aux glycosides cardiaques, les inhibiteurs de MDM2 altèrent l’hématopoïèse et induisent une toxicité gastro-intestinale. Les JAKi peuvent aussi conduire à long terme à une sensibilité accrue aux infections et au développement de lymphomes.
Malgré toutes ces contraintes, les premiers résultats de trois essais cliniques utilisant de telles sénothérapies ont démontré toute leur potentialité chez l’homme. L’injection du cocktail D+Q à 14 patients atteints de fibrose pulmonaire idiopathique, s’est traduite par une amélioration des signes cliniques [
53
]. De même, un second essai clinique, réalisé sur un groupe de patients atteints de sclérodermie, dont la peau a été traitée continuellement par le dasatinib, a montré une amélioration clinique. Dans ces deux études, aucune preuve de causalité directe d’effets des traitements sur le nombre de cellules sénescentes n’a cependant été apportée [
54
]. La démonstration la plus probante de l’effet sénolytique du cocktail D+Q a été faite en 2019 pour la première fois chez l’homme, chez des patients atteints de dégénérescence rénale au stade terminal [
55
] : l’ajout dans l’eau de boisson du cocktail, a permis, après seulement 11 jours de traitement, une réduction significative du nombre de cellules sénescentes p16
INK4A
p21
Cdkn1a
et positives pour la molécule SA-bGal dans le tissu adipeux et dans la peau des patients, ainsi qu’une réduction des marqueurs du SASP dans le sang [
55
]. La demi-vie de ce cocktail dans la circulation sanguine étant de 11 heures, les auteurs de cette étude proposent que les sénothérapies du futur ne nécessiteront pas d’être prescrites en continu au patient âgé souffrant de maladie dégénérative, mais par intermittence. À la différence des cellules tumorales, les cellules sénescentes ne se divisent pas. Elles s’accumulent lentement dans les tissus atteints. Un traitement par intermittence est donc envisageable. Citons encore d’autres essais cliniques en cours : le TAME (
targeting aging with metformin
), menée par la fondation américaine de recherche sur le vieillissement, avec la mise en place d’un essai clinique multicentrique en double aveugle, pour estimer les effets de la Metformine
®
sur la longévité chez l’homme ; l’essai de la fisetine (NCT03325322) sur la fragilité des femmes âgées, qui semble prometteur ; et, enfin, celui utilisant le UBX0101
®
(NCT04349956), de la biotech
Unity
, en phase II, pour le traitement de gonarthrose modérée à sévère en application intra-articulaire.
Les résultats de ces essais permettront de confirmer, nous en sommes certains, tout l’intérêt thérapeutique en « géroscience » de cibler les processus fondamentaux régulant la sénescence cellulaire afin de permettre un vieillissement en bonne santé. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
He
S
,
Sharpless
NE
.
Senescence in health and disease.
.
Cell.
2017;
;
169
:
:1000.
–
11
.
2.
Sagiv
A
,
Burton
DGA
,
Moshayev
Z
,
et al.
NKG2D ligands mediate immunosurveillance of senescent cells.
.
Aging.
2016;
;
8
:
:328.
–
344
.
3.
Xu
M
,
Pirtskhalava
T
,
Farr
JN
,
et al.
Senolytics improve physical function and increase lifespan in old age.
.
Nat Med.
2018;
;
24
:
:1246.
–
1256
.
4.
Zhu
Y
,
Tchkonia
T
,
Pirtskhalava
T
,
et al.
The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs.
.
Aging Cell.
2015;
;
14
:
:644.
–
658
.
5.
Anderson
R
,
Lagnado
A
,
Maggiorani
D
,
et al.
Length-independent telomere damage drives post-mitotic cardiomyocyte senescence.
.
EMBO J.
2019
;
:38.
6.
Skowronska-Krawczyk
D
,
Zhao
L
,
Zhu
J
,
et al.
P16INK4a upregulation mediated by SIX6 defines retinal ganglion cell pathogenesis in glaucoma.
.
Mol Cell.
2015;
;
59
:
:931.
–
940
.
7.
Rocha
LR
,
Huu
VAN
,
Torre
CPL
, et al.
Early removal of senescent cells protects retinal ganglion cells loss in experimental ocular hypertension.
.
Aging Cell.
2020;
;
19
:
:e13089.
.
8.
Yousefzadeh
MJ
,
Zhu
Y
,
McGowan
SJ
,
et al.
Fisetin is a senotherapeutic that extends health and lifespan.
.
EBioMedicine.
2018;
;
36
:
:18.
–
28
.
9.
Currais
A
,
Farrokhi
C
,
Dargusch
R
,
et al.
Fisetin Reduces the impact of aging on behavior and physiology in the rapidly aging SAMP8 mouse.
.
J Gerontol A Biol Sci Med Sci.
2018;
;
73
:
:299.
–
307
.
10.
Zhu
Y
,
Tchkonia
T
,
Fuhrmann-Stroissnigg
H
,
et al.
Identification of a novel senolytic agent, navitoclax, targeting the Bcl-2 family of anti-apoptotic factors.
.
Aging Cell.
2016;
;
15
:
:428.
–
435
.
11.
Kirkland
JL
,
Tchkonia
T
.
Cellular senescence: a translational perspective.
.
EBioMedicine.
2017;
;
21
:
:21.
–
28
.
12.
Cang
S
,
Iragavarapu
C
,
Savooji
J
,
et al.
ABT-199 (venetoclax) and BCL-2 inhibitors in clinical development.
.
J Hematol Oncol.
2015;
;
8
:
:129.
.
13.
Muñoz-Espín
D
,
Rovira
M
,
Galiana
I
,
et al.
A versatile drug delivery system targeting senescent cells.
.
EMBO Mol Med.
2018;
;
10
:
:e9355.
.
14.
González-Gualda
E
,
Pàez-Ribes
M
,
Lozano-Torres
B
, et al.
Galacto-conjugation of Navitoclax as an efficient strategy to increase senolytic specificity and reduce platelet toxicity.
.
Aging Cell.
2020;
;
19
:
:e13142.
.
15.
Khan
S
,
Zhang
X
,
Lv
D
,
et al.
A selective BCL-X L PROTAC degrader achieves safe and potent antitumor activity.
.
Nat Med.
2019;
;
25
:
:1938.
–
1947
.
16.
He
Y
,
Zhang
X
,
Chang
J
, et al.
Using proteolysis-targeting chimera technology to reduce navitoclax platelet toxicity and improve its senolytic activity.
.
Nat Commun.
2020
;
:11.
.
17.
Ovadya
Y
,
Landsberger
T
,
Leins
H
, et al.
Impaired immune surveillance accelerates accumulation of senescent cells and aging.
.
Nat Commun.
2018
;
:9.
.
18.
Feng
Z
,
Hu
W
,
Teresky
AK
,
et al.
Declining p53 function in the aging process: a possible mechanism for the increased tumor incidence in older populations.
.
Proc Natl Acad Sci USA.
2007;
;
104
:
:16633.
–
16638
.
19.
Arena
G
,
Cissé
MY
,
Pyrdziak
S
,
et al.
Mitochondrial MDM2 regulates respiratory complex I activity independently of p53.
.
Mol Cell.
2018;
;
69
:
:594.
–
609.e8
.
20.
Wiley
CD
,
Schaum
N
,
Alimirah
F
,
et al.
Small-molecule MDM2 antagonists attenuate the senescence-associated secretory phenotype.
.
Sci Rep.
2018;
;
8
:
:2410.
.
21.
Jeon
OH
,
Kim
C
,
Laberge
R-M
,
et al.
Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment.
.
Nat Med.
2017;
;
23
:
:775.
–
781
.
22.
He
Y
,
Li
W
,
Lv
D
, et al.
Inhibition of USP7 activity selectively eliminates senescent cells in part via restoration of p53 activity.
.
Aging Cell.
2020;
;
19
:
:e13117.
.
23.
Desdín-Micó
G
,
Soto-Heredero
G
,
Aranda
JF
, et al.
T cells with dysfunctional mitochondria induce multimorbidity and premature senescence.
.
Science.
2020;
;
368
:
:1371.
–
6
.
24.
Yao
G
,
Yang
J
,
Li
X
,
et al.
Blocking the utilization of glucose induces the switch from senescence to apoptosis in pseudolaric acid B-treated human lung cancer cells in vitro.
.
Acta Pharmacol Sin.
2017;
;
38
:
:1401.
–
1411
.
25.
Guerrero
A
,
Herranz
N
,
Sun
B
,
et al.
Cardiac glycosides are broad-spectrum senolytics.
.
Nat Metab.
2019;
;
1
:
:1074.
–
1088
.
26.
Therien
AG
,
Blostein
R
.
Mechanisms of sodium pump regulation.
.
Am J Physiol Cell Physiol.
2000;
;
279
:
:C541.
–
C566
.
27.
Amor
C
,
Feucht
J
,
Leibold
J
, et al.
Senolytic CAR T cells reverse senescence-associated pathologies.
.
Nature.
2020;
;
583
:
:127.
–
32
.
28.
Zhan
J-K
,
Wang
Y-J
,
Li
S
,
et al.
AMPK/TSC2/mTOR pathway regulates replicative senescence of human vascular smooth muscle cells.
.
Exp Ther Med.
2018;
;
16
:
:4853.
–
4858
.
29.
Liu
J
,
Li
L
.
Targeting autophagy for the treatment of alzheimer’s disease: challenges and opportunities.
.
Front Mol Neurosci.
2019
;
:12.
.
30.
Carroll
B
,
Nelson
G
,
Rabanal-Ruiz
Y
,
et al.
Persistent mTORC1 signaling in cell senescence results from defects in amino acid and growth factor sensing.
.
J Cell Biol.
2017;
;
216
:
:1949.
–
1957
.
31.
Saxton
RA
,
Sabatini
DM
.
mTOR Signaling in growth, metabolism, and disease.
.
Cell.
2017;
;
168
:
:960.
–
976
.
32.
Morita
M
,
Prudent
J
,
Basu
K
,
et al.
mTOR controls mitochondrial dynamics and cell survival via MTFP1.
.
Mol Cell.
2017;
;
67
:
:922.
–
35.e5
.
33.
Rosario
FJ
,
Gupta
MB
,
Myatt
L
,
et al.
Mechanistic target of rapamycin complex 1 promotes the expression of genes encoding electron transport chain proteins and stimulates oxidative phosphorylation in primary human trophoblast cells by regulating mitochondrial biogenesis.
.
Sci Rep.
2019;
;
9
:
:246.
.
34.
Chung
CL
,
Lawrence
I
,
Hoffman
M
,
et al.
Topical rapamycin reduces markers of senescence and aging in human skin: an exploratory, prospective, randomized trial.
.
GeroScience.
2019;
;
41
:
:861.
–
869
.
35.
Cabreiro
F
,
Au
C
,
Leung
K-Y
,
et al.
Metformin retards aging in C. elegans by altering microbial folate and methionine metabolism.
.
Cell.
2013;
;
153
:
:228.
–
239
.
36.
Moiseeva
O
,
Deschênes-Simard
X
,
St-Germain
E
,
et al.
Metformin inhibits the senescence-associated secretory phenotype by interfering with IKK/NF-κB activation.
.
Aging Cell.
2013;
;
12
:
:489.
–
498
.
37.
Khouri
H
,
Collin
F
,
Bonnefont-Rousselot
D
,
et al.
Radical-induced oxidation of metformin.
.
Eur J Biochem.
2004;
;
271
:
:4745.
–
4752
.
38.
Fang
J
,
Yang
J
,
Wu
X
,
et al.
Metformin alleviates human cellular aging by upregulating the endoplasmic reticulum glutathione peroxidase 7.
.
Aging Cell.
2018
;
:17.
39.
Devasagayam
TP
,
Kamat
JP
,
Mohan
H
,
et al.
Caffeine as an antioxidant: inhibition of lipid peroxidation induced by reactive oxygen species.
.
Biochim Biophys Acta.
1996;
;
1282
:
:63.
–
70
.
40.
Moser
BA
,
Brondello
JM
,
Baber-Furnari
B
,
et al.
Mechanism of caffeine-induced checkpoint override in fission yeast.
.
Mol Cell Biol.
2000;
;
20
:
:4288.
–
4294
.
41.
Li
YF
,
Ouyang
SH
,
Tu
LF
,
et al.
Caffeine protects skin from oxidative stress-induced senescence through the activation of autophagy.
.
Theranostics.
2018;
;
8
:
:5713.
–
5730
.
42.
Benigni
A
,
Cassis
P
,
Conti
S
,
et al.
Sirt3 deficiency shortens life span and impairs cardiac mitochondrial function rescued by opa1 gene transfer.
.
Antioxid Redox Signal.
2019;
;
31
:
:1255.
–
1271
.
43.
Zhao
W
,
Ma
L
,
Cai
C
,
et al.
Caffeine inhibits NLRP3 inflammasome activation by suppressing MAPK/NF-κB and A2aR signaling in LPS-induced THP-1 macrophages.
.
Int J Biol Sci.
2019;
;
15
:
:1571.
–
1581
.
44.
Zhang
N
,
Chu
ESH
,
Zhang
J
,
et al.
Peroxisome proliferator activated receptor alpha inhibits hepatocarcinogenesis through mediating NF-κB signaling pathway.
.
Oncotarget.
2014;
;
5
:
:8330.
–
8340
.
45.
Vasheghani
F
,
Monemdjou
R
,
Fahmi
H
,
et al.
Adult cartilage-specific peroxisome proliferator-activated receptor gamma knockout mice exhibit the spontaneous osteoarthritis phenotype.
.
Am J Pathol.
2013;
;
182
:
:1099.
–
1106
.
46.
Nogueira-Recalde
U
,
Lorenzo-Gómez
I
,
Blanco
FJ
,
et al.
Fibrates as drugs with senolytic and autophagic activity for osteoarthritis therapy.
.
EBioMedicine.
2019;
;
45
:
:588.
–
605
.
47.
Xu
M
,
Palmer
AK
,
Ding
H
, et al.
Targeting senescent cells enhances adipogenesis and metabolic function in old age.
.
eLife.
2015;
;
4
:
:e12997.
.
48.
Xu
M
,
Tchkonia
T
,
Kirkland
JL
.
Perspective: targeting the JAK/STAT pathway to fight age-related dysfunction.
.
Pharmacol Res.
2016;
;
111
:
:152.
–
154
.
49.
Farr
JN
,
Xu
M
,
Weivoda
MM
,
et al.
Targeting cellular senescence prevents age-related bone loss in mice.
.
Nat Med.
2017;
;
23
:
:1072.
–
1079
.
50.
Liu
C
,
Arnold
R
,
Henriques
G
, et al.
Inhibition of JAK-STAT signaling with baricitinib reduces inflammation and improves cellular homeostasis in progeria cells.
.
Cells.
2019
;
:8.
.
51.
Gatinois
V
,
Desprat
R
,
Pichard
L
, et al.
iPSC reprogramming of fibroblasts from a patient with a Rothmund-Thomson syndrome RTS.
.
Stem Cell Res.
2020;
;
45
:
:101807.
.
52.
Ozsvari
B
,
Nuttall
JR
,
Sotgia
F
,
et al.
Azithromycin and roxithromycin define a new family of senolytic drugs that target senescent human fibroblasts.
.
Aging.
2018;
;
10
:
:3294.
–
3307
.
53.
Justice
JN
,
Nambiar
AM
,
Tchkonia
T
,
et al.
Senolytics in idiopathic pulmonary fibrosis: results from a first-in-human, open-label, pilot study.
.
EBioMedicine.
2019;
;
40
:
:554.
–
563
.
54.
Martyanov
V
,
Whitfield
ML
,
Varga
J
.
Senescence signature in skin biopsies from systemic sclerosis patients treated with senolytic therapy: potential predictor of clinical response?
.
Arthritis Rheumatol.
2019;
;
71
:
:1766.
–
1767
.
55.
Hickson
LJ
,
Prata
LGPL
,
Bobart
SA
,
et al.
Senolytics decrease senescent cells in humans: preliminary report from a clinical trial of dasatinib plus quercetin in individuals with diabetic kidney disease.
.
EBioMedicine.
2019;
;
47
:
:446.
–
456
.
|