Le vieillissement peut être défini comme une défaillance inexorable de l’homéostasie, qui s’exprime généralement après la période reproductive. Cette altération progressive conduit à une susceptibilité accrue à de nombreuses maladies, par exemple le cancer, le diabète de type II, les maladies cardiovasculaires, la neurodégénérescence ainsi qu’une vulnérabilité accrue aux infections [ 1 ]. Cela a évidemment des conséquences sur la qualité de la vie individuelle et le coût global des dépenses de santé, comme en atteste la pandémie de COVID-19 ( coronavirus disease 2019 ) due au SARS-CoV-2 ( severe acute respiratory syndrome coronavirus 2 ) dont les formes graves touchent principalement les personnes âgées. Les avancées socio-économiques et médicales ont allongé considérablement notre espérance de vie et le vieillissement de la population est devenu une caractéristique planétaire. Cependant, l’espérance de vie en bonne santé n’a que très peu progressé au cours de la dernière décennie 1 , impliquant que nous vivons plus vieux, mais souvent en mauvaise santé.
Au niveau des mécanismes, il est généralement admis que le vieillissement est dû à des limitations de l’entretien somatique, entraînant une augmentation graduelle de dommages macromoléculaires, une accumulation de cellules sénescentes, l’épuisement des cellules souches, la détection dérégulée des nutriments, des changements métaboliques et épigénétiques, ainsi que la perte de protéostase et l’altération de la communication intercellulaire avec, entre autres, un déclin des fonctions immunitaires allié à une inflammation chronique de bas grade appelée inflamm’aging [ 2 ].
L’étiologie des mécanismes du vieillissement est complexe et largement inconnue. En particulier, savoir si le vieillissement résulte d’un processus sélectionné au cours de l’évolution reste un débat très controversé, opposant une vision stricte de la sélection naturelle, fondée sur la valeur sélective des individus, déniant tout avantage à un processus post-reproductif, aux données biodémographiques suggérant l’existence de processus de vieillissement qui seraient avantageux, passé la période reproductive, et/ou pour une communauté d’individus [ 3 , 4 ]. Dans ce contexte, il peut sembler plus heuristique de considérer non pas le vieillissement mais la longévité comme programme biologique. Pour adresser ces questions expérimentalement, il est important de pouvoir démêler la séquence temporelle des évènements moléculaires qui provoquent la perte des fonctions corporelles et la dégénérescence des cellules et des tissus avec l’âge, déterminant ainsi la longévité des individus.
L’espérance de vie est très hétérogène selon les espèces [ 5 , 6 ]. S’il existe une relation globale entre masse corporelle et longévité pour beaucoup d’organismes, on observe des exceptions qui résultent de l’adaptation à un environnement extrême. Par exemple, certains poissons de la famille des killi 2 , vivant en Afrique dans des points d’eau asséchés une bonne partie de l’année, ont une longévité extrêmement réduite (environs 6 mois), même maintenus en aquarium. À l’inverse, les rats-taupes nus, vivant en condition de faible concentration d’oxygène, vivent dix fois plus longtemps qu’une souris de même taille [ 7 , 8 ]. La longévité est donc déterminée par des voies moléculaires conservées dont la régulation dépend de facteurs génétiques et environnementaux. Des études menées chez l’homme ont estimé la part non héréditaire de la régulation de la durée de vie à environ 70 %, la part dépendant de facteurs génétiques étant de seulement 30 % [ 9 , 10 ]. Même dans des environnements relativement contrôlés, l’espérance de vie d’individus isogéniques 3 peut être très variable, avec de grandes différences d’âge entre le premier et le dernier décès [ 11 ]. Au-delà d’un effet purement stochastique, ce résultat suggère que des variations environnementales, même infimes, peuvent avoir une influence cumulée sur la durée de vie.
La restriction calorique est probablement la stratégie la mieux caractérisée et la plus reproductible pour prolonger la durée de vie. Des études réalisées sur plusieurs organismes modèles (la levure Saccharomyces cerevisiae , le nématode Caenorhabditis elegans , la drosophile Drosophila melanogaster , ou la souris Mus musculus ), sur des primates non humains et sur les cellules de lignées cellulaires humaines, ont révélé un certain nombre de voies de régulation de la longévité [ 12 , 13 ]. On peut en distinguer trois principales : la stabilité du génome, le métabolisme énergétique et la reconnaissance du soi. Ensemble, ces voies visent à favoriser un maintien somatique via le fonctionnement normal des cellules souches et l’activation, par exemple, de l’autophagie – le processus qui élimine les composants cellulaires dysfonctionnels –, des mécanismes de défense contre les agents infectieux, et des voies de survie, tout en atténuant les médiateurs pro-inflammatoires, la croissance cellulaire dérégulée et la sénescence. Cependant, à l’heure actuelle, plusieurs questions restent posées : comment ces voies de régulation de la longévité sont-elles programmées et interconnectées, voire hiérarchisées, pour déterminer la longévité d’une espèce ; comment sont-elles liées à la santé ; et comment ces mécanismes peuvent-ils être exploités pour développer des stratégies d’intervention rationalisées pour prévenir ou lutter contre les maladies liées à l’âge, y compris le cancer. Une série d’évidences expérimentales (voir plus loin) indiquent qu’une extension de la durée de vie en bonne santé peut être obtenue avec des agents pharmacologiques qui protègent les télomères, qui limitent l’accumulation des cellules sénescentes, ou qui imitent les effets de la restriction calorique.
Ainsi, dans un modèle de souris transgénique, contenant une cassette du promoteur du gène p16 en combinaison avec une expression inductible d’un gène suicide, il a été montré que l’élimination contrôlée de cellules sénescentes pouvait augmenter la durée de vie en bonne santé, suggérant que l’accumulation des cellules sénescentes est un moteur du vieillissement et des maladies associées [ 14 ]. Une proportion élevée de cellules sénescentes est effectivement retrouvée dans les tissus de patients atteints de maladies liées au vieillissement, telles que l’arthrose, la fibrose pulmonaire, l’athérosclérose ou la maladie d’Alzheimer [ 15 ]. Néanmoins, des données récentes obtenues en utilisant un modèle de souris transgéniques où, à la différence du modèle décrit ci-dessous [ 14 ], c’est le gène p16 endogène qui détermine l’expression du gène suicide, montrent que l’élimination des cellules sénescentes peut également avoir des effets délétères liés à l’incapacité de remplacer les cellules endothéliales du foie devenues sénescentes [ 16 ]. Il est donc clair que nous devons approfondir nos connaissances sur la chronologie des évènements aboutissant à la sénescence cellulaire, ses variations en fonction des tissus, et son importance dans le vieillissement.
Parmi les causes connues de la sénescence, seul le raccourcissement des télomères obéit à une horloge développementale clairement établie expérimentalement [ 17 ]. L’« horloge télomérique » commence son compte à rebours lorsque l’expression de la télomérase, l’enzyme qui ajoute les répétitions d’ADN télomérique aux extrémités de chromosome, est réprimée en fin d’embryogenèse dans les tissus somatiques. L’ADN télomérique devient alors progressivement plus court à chaque division cellulaire, ce qui aboutit à la sénescence réplicative.
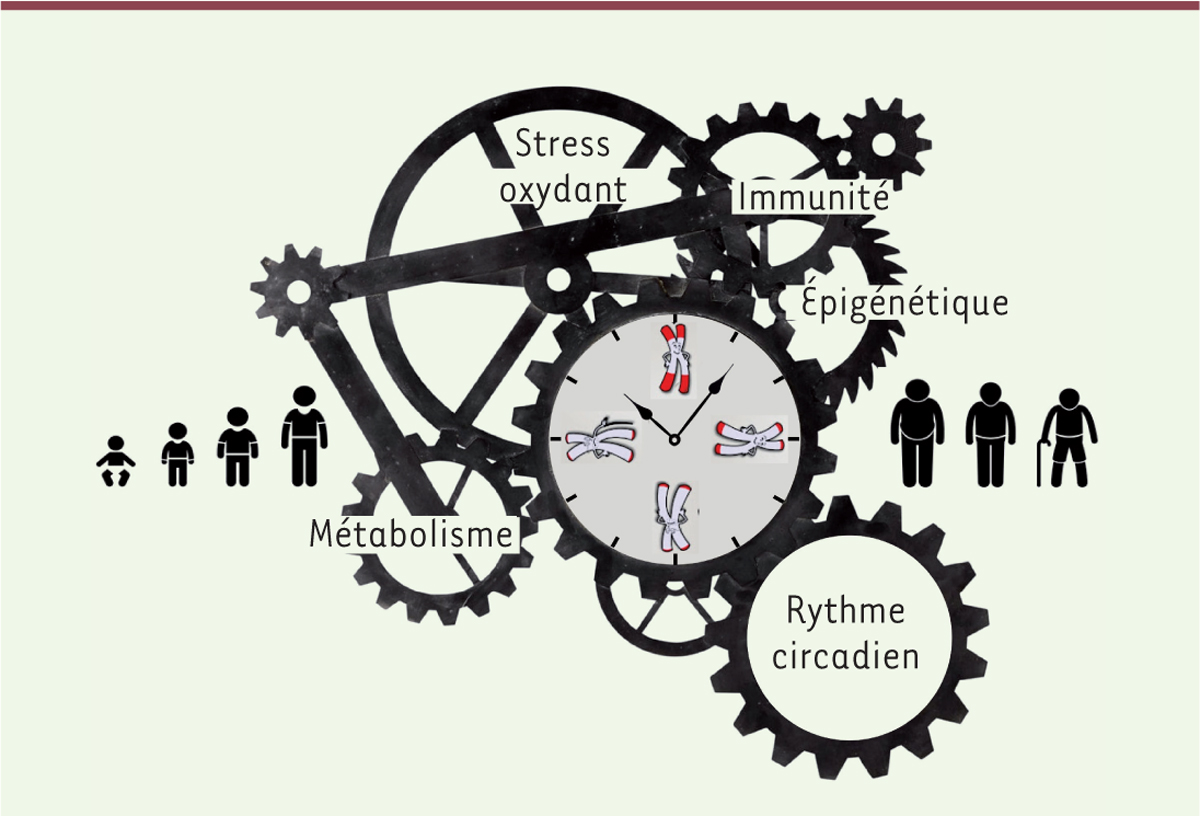
Le stress oxydant peut aussi entraîner la sénescence cellulaire. Cependant, on ne sait pas encore si l’augmentation du niveau de molécules oxydées observée au cours du vieillissement résulte d’un processus régulé par le développement, ou simplement d’un effet cumulatif avec l’âge. Il faut noter que le raccourcissement des télomères et le stress oxydant sont des phénomènes couplés [ 18 ], suggérant que les voies régulant la longévité sont interconnectées. Par exemple, le raccourcissement des télomères peut initier une boucle de rétroaction positive induisant un stress oxydant à l’origine d’une accélération de ce raccourcissement, et donc d’un génome plus instable. On peut donc envisager une relation hiérarchique entre l’horloge télomérique programmée au cours du développement et l’augmentation du stress oxydant observée au cours du vieillissement. De nombreuses autres relations existent entre les régulateurs de la longévité. Par exemple, la voie p53, effectrice de la réponse aux dommages de l’ADN ( DNA damage response , DDR) causés par un dysfonctionnement des télomères et un stress oxydant, est connectée à l’épigénome, au métabolisme, à l’inflammation, à l’autophagie et au rythme circadien [ 19 ].
L’horloge circadienne, qui se dérègle au cours du vieillissement, contrôle de nombreux systèmes physiologiques et comportementaux. Elle est également fortement liée au métabolisme énergétique et à l’épigénome [ 9 ]. Chez des animaux vieillissants, la restauration d’une horloge circadienne fonctionnelle améliore leur espérance de vie [ 9 , 20 ]. Rythme circadien et métabolisme énergétique sont liés au travers de l’expression et de l’activité des sirtuines, des désacétylases dépendantes du nicotinamide adénine dinucléotide (NAD(+)) impliquées dans la maintenance de l’épigénome et l’intégrité des mitochondries. Ainsi, la sirtuine Sirt1 désacétyle les composants de l’horloge circadienne et contrôle la répression des gènes circadiens [ 21 ]. Un autre lien remarquable observé entre rythme circadien et épigénome est l’activité acétyl transférase de la protéine CLOCK ( circadian locomoter output cycles protein kaput ) sur les histones H3K9 et H3K14 4 [ 22 ]. Plusieurs capteurs d’énergie qui servent de médiateurs à la restriction calorique, comme la protéine kinase activée par l’AMP (AMPK), modulent également la machinerie circadienne et l’épigénome [ 23 ].
L’épigénome apparaît donc central dans le contrôle de la longévité. De fait, interférer avec les complexes de régulation de la chromatine affecte la durée de vie [ 9 ]. La séquence d’évènements aboutissant à la sénescence apparaît programmée dans les cellules jeunes, par une empreinte épigénétique ciblant les sites de fixation à l’ADN du facteur de transcription AP-1 [ 24 ]. Les modifications épigénétiques étant transmises au cours des divisions cellulaires, l’état de l’épigénome reflète ainsi l’histoire des cellules et donc leur âge. Des combinatoires spécifiques de sites d’ADN méthylés sont en effet prédictives des âges chronologiques [ 9 , 25 ] et biologiques, et donc de la susceptibilité de développer des maladies liées à l’âge [ 25 ].
Si de nombreuses connections entre les différents régulateurs de la longévité sont désormais bien documentées, leurs relations hiérarchiques au cours du développement et du vieillissement sont encore mal comprises. Une hypothèse séduisante repose sur l’existence d’une ou d’un nombre limité d’horloge(s) qui contrôle(nt) en amont ces régulateurs. Une telle horloge pourrait être le raccourcissement des télomères qui est programmé au cours du développement dans les tissus somatiques. Il est en effet remarquable que des variations de la structure des télomères peuvent affecter la plupart des régulateurs de la longévité, voire tous. En effet, au-delà de l’activation de la voie DDR, en cas de déprotection, la structure des télomères peut moduler les régulateurs de la longévité, comme le métabolisme énergétique. Ainsi, la protéine télomérique RAP1 ( repressor activator protein 1 ) régule directement l’expression de gènes impliqués dans le métabolisme, tant chez la levure que chez les mammifères [ 19 ]. Conséquence du raccourcissement des télomères, p53 réprime le co-activateur transcriptionel PGC-1α ( peroxisome proliferator-activated receptor gamma coactivator 1-alpha ) [ 26 ].
Grâce aux souris invalidées pour le gène codant la télomérase (les souris tert [ telomerase reverse transcriptase ] -/- ), il a été démontré que le raccourcissement des télomères et la voie p53 étaient des régulateurs en amont des sirtuines. En effet, les télomères courts de ces souris induisent la répression des sept sirtuines dans le tissu hépatique [ 27 , 28 ]. Cette répression s’accompagne d’une hyper-acétylation de leurs cibles, notamment FoxO1 (membre O1 de la famille des facteurs de transcription de type Forkhead), PGC-1α, p53 et les histones. Cette répression des sirtuines, induite par le raccourcissement des télomères, dépend de p53 [ 26 ] et est réversible. En effet, la réinduction de la télomérase dans le foie des souris ayant des télomères courts, normalise le niveau d’expression de ces protéines. Il est important de noter que le lien entre télomère, p53, et sirtuines, pourrait être à la base d’une détérioration progressive de la fonction cellulaire et être à l’origine d’un cercle vicieux, par des mécanismes de rétroaction. Il a en effet été démontré que Sirt1 et Sirt7 inactivent p53, et que leur inhibition par p53, au cours d’un dysfonctionnement télomérique, pourrait renforcer l’activité de cette dernière molécule [ 28 ]. Au niveau des télomères, de faibles quantités de Sirt1 et Sirt6 pourraient également davantage déstabiliser ces derniers et activer la réponse aux dommages causés à l’ADN, et donc p53 [ 27 ]. Ces mécanismes de rétroaction sirtuine-télomère et sirtuine-p53 pourraient contribuer ensemble au déclin de cellules déjà endommagées et accélérer celui-ci.
Si les télomères influencent le métabolisme, l’inverse est également vrai. Chez la levure, l’autophagie, qui est essentielle à la survie des cellules pendant les périodes prolongées de restriction calorique, joue un rôle dans la dégradation de la protéine de protection des télomères, Cdc13, par Vms1, le co-facteur de Cdc48 [ 29 ]. En ce qui concerne les sirtuines, Sirt6 se localise aux télomères et régulent leur longueur ainsi que leur capacité à réprimer l’expression des gènes voisins des télomères ( telomeric position effect , TPE) [ 30 ]. Sirt1, quant à elle, est nécessaire pour maintenir la longueur des télomères pendant le vieillissement [ 31 ]. Chez les souris, sa surexpression résulte en l’augmentation de la longueur des télomères. Sirt1 modulerait donc la longueur des télomères en fonction du temps et de son niveau d’expression.
Comprendre comment les télomères, véritables senseurs de stress, peuvent transformer des signaux de stress en réponse cellulaire intégrée est une voie prometteuse pour mieux comprendre les hiérarchies entre les différentes horloges régissant le vieillissement. Par exemple, au-delà de leurs rôles protecteurs des télomères, les protéines télomériques peuvent également s’associer à des séquences d’ADN télomérique présentes à l’intérieur des chromosomes. Des analyses par ChIP-seq ( chromatin immunoprecipitation sequencing ) ont montré que TRF1 ( telomere repeat-binding factor 1 ), TRF2 et RAP1 se lient non seulement à l’ADN télomérique aux extrémités des chromosomes, mais aussi aux sites intra-chromosomiques contenant, dans la plupart des cas, de courtes séquences d’ADN télomérique [ 32 , 33 ]. Ces résultats ont permis de délimiter une voie de signalisation par laquelle les changements télomériques contrôlent la capacité des facteurs qui leur sont associés à réguler la transcription à travers tout le génome [ 34 - 36 ]. Plus précisément, TRF2 se lie et régule l’expression de gènes codant des protéines impliquées dans la formation du glycocalyx ( heparan sulfate proteoglycan , notamment) et dans l’immunosurveillance par les cellules NK ( natural killer ) [ 34 - 36 ]. Il semblerait que cette liaison extratélomérique de TRF2 module un mécanisme épigénétique dépendant de l’acétylation de l’histone H3K27. Cependant, on ignore encore comment précisément TRF2 agit en tant que facteur de transcription. Ainsi, TRF2 couple deux voies de régulation de la longévité. D’une part, intrinsèquement, il régule la voie DDR en inhibant la kinase ATM ( ataxia-telangiectasia mutation ), freinant ainsi la sénescence. D’autre part, extrinsèquement, il régule l’expression de gènes codant des protéines impliquées dans la formation du glycocalyx qui, en retour, réduit la fonctionnalité et le recrutement des cellules NK et favorise un échappement à l’immunosurveillance. Une fois encore, il apparaît que l’horloge télomérique est couplée à la régulation de la reconnaissance du soi, un processus clef de la maintenance somatique et donc de la longévité.
Enfin, des modifications télomériques sont associées à l’ inflamm’aging via la sénescence. En effet, les cellules sénescentes présentent des capacités pro-inflammatoires en sécrétant un ensemble de cytokines et chimiokines appelé SASP ( senescence-associated secretory phenotype ) [ 37 ]. L’accumulation de ces molécules pro-inflammatoires caractérise de multiples maladies liées à l’âge, telles que la sarcopénie, la neurodégénérescence, l’arthrose, l’athérosclérose et l’insulinorésistance. Chez les souris mâles, la simple administration à vie d’anti-inflammatoires, tels que l’aspirine, entraîne une prolongation de leur durée de vie médiane de 8 à 12 %, ce qui met en évidence le potentiel thérapeutique des thérapies anti-inflammatoires [ 38 ]. Si l’inflammation peut résulter en partie d’infections virales et bactériennes persistantes, les cellules sénescentes constituent une autre source importante d’inflammation. Malgré le nombre relativement faible de ces cellules dans les tissus âgés, le SASP pourrait néanmoins avoir un impact important sur le vieillissement de l’organisme, par le biais de régulations endocriniennes ou en stimulant d’autres cellules [ 39 ]. L’ensemble de ces processus révèle l’existence d’un couplage de la sénescence avec l’inflammation et la régulation neuroendocrinienne [ 40 ].
L’idée que les différentes caractéristiques du vieillissement [ 2 ] sont finalement interconnectées et inter-régulées entre elles via une ou un nombre limité d’horloges biologiques s’impose dorénavant de plus en plus. Bien que le contour de ces régulations soit encore assez mal compris, le raccourcissement télomérique programmé au cours du développement apparaît agir en amont, en interconnectant directement ou indirectement plusieurs régulateurs de la longévité ( Figure 1 ) .