| |
| Med Sci (Paris). 36(11): 1095–1097. doi: 10.1051/medsci/2020205.Bénéfice clinique et coût des traitements anticancéreux Bertrand Jordan1 1UMR 7268 ADÉS, Aix-Marseille, Université/EFS/CNRS ; CoReBio PACA, case 901, Parc scientifique de Luminy
,
13288Marseille Cedex 09
,
France MeSH keywords: Antinéoplasiques, Analyse coût-bénéfice, Coûts des médicaments, Industrie pharmaceutique, Déontologie pharmaceutique, Europe, Coûts des soins de santé, économie, Humains, Tumeurs, États-Unis, usage thérapeutique, éthique, normes, statistiques et données numériques, épidémiologie, traitement médicamenteux |
Le coût des nouveaux médicaments anticancéreux fait l’objet de nombreuses discussions, de polémiques et de tentatives de régulation plus au moins réussies. Il faut dire qu’il est très élevé : sans parler des thérapies cellulaires du type « CAR-T » qui peuvent coûter un demi-million de dollars aux États-Unis, la plupart des anticancéreux homologués au cours des dix dernières années correspondent à un coût mensuel de traitement supérieur à dix mille dollars aux États-Unis (nettement moins en Europe). Le problème est général [
1
] (
→
), mais il est particulièrement aigu dans le cas du cancer, maladie fréquente et secteur clef de l’industrie pharmaceutique, avec des chiffres d’affaires de plusieurs milliards de dollars par an pour certains
blockbusters
1,
, comme le Pembrolizumab (Keytruda
®
) ou le Trastuzumab (Herceptin
®
)
2
.
A priori,
tous ces médicaments apportent un bénéfice clinique puisque leur mise sur le marché a été autorisée par la FDA (
Food and Drug Administration
) et l’EMA (
European Medicines Agency
) sur la foi d’essais cliniques menés dans les règles de l’art. Mais on peut se demander si ce bénéfice clinique est bien en rapport avec le prix auquel sont commercialisés ces produits. Des études récentes portant sur quelques dizaines de médicaments récemment approuvés et utilisant des critères de bénéfice clinique reconnus montrent une absence de corrélation [
2
,
4
] ou même une corrélation négative [
3
] : plus un médicament est coûteux, moins il est efficace ! Un article récemment paru [
5
] reprend ces questions de manière plus systématique et en tire un ensemble de conclusions solides.
(→) Voir la Chronique génomique de B. Jordan,
m/s
n° 12, décembre 2017, page 1121
|
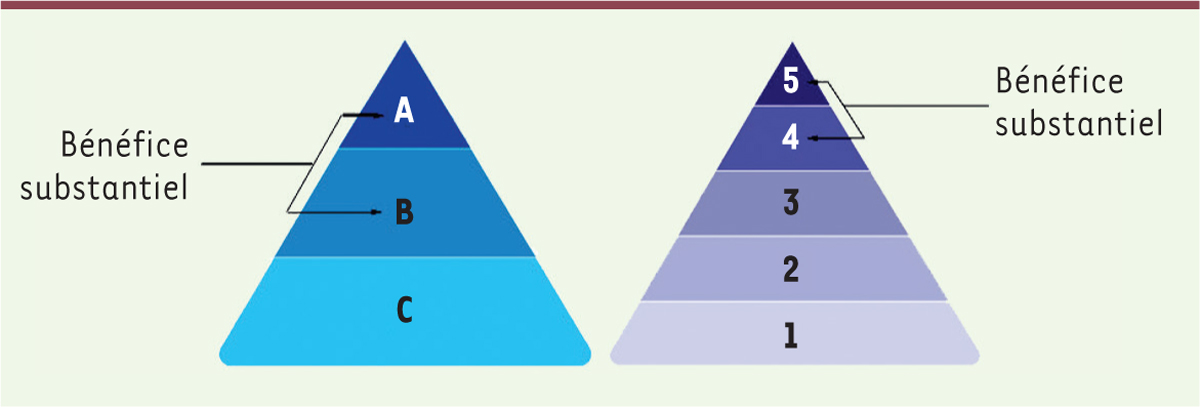
Pour ce travail, les auteurs se sont intéressés à tous les médicaments anticancéreux approuvés par la FDA entre 2009 et 2017, et par l’EMA de 2009 jusqu’à 2019. Cela inclut 47 molécules approuvées pour le traitement de cancers solides et 18 pour les cancers hématologiques. L’évaluation du bénéfice clinique a été faite sur les données des essais cliniques ayant abouti à l’autorisation de mise sur le marché, et a utilisé deux échelles : celle de l’ASCO (
American Society of Clinical Oncology
) [
6
] et celle de l’ESMO (
European Society for Medical Oncology
) [
7
]. Ces échelles indiquent le bénéfice clinique par une valeur numérique comprise entre – 20 et + 180 pour l’ASCO, et par deux classifications pour l’ESMO : pour les traitements à visée curative, de A à C (A étant l’effet le plus fort) et pour ceux d’ordre palliatif, de 1 à 5 (5 étant l’effet le plus fort)
(
Figure 1
)
. Plusieurs publications ont montré que ces deux échelles étaient généralement cohérentes [
8
]. Pour cette étude, un bénéfice substantiel est défini comme un score supérieur à 45 selon l’échelle ASCO, ou appartenant aux catégories A, B ou 4, 5 selon l’échelle ESMO
(
Figure 1
)
. Les coûts de traitement ont étés évalués pour une posologie standard et en prenant les prix indiqués par les organismes officiels. Seuls les médicaments destinés au traitement des cancers solides ont pu faire l’objet d’une évaluation complète, car l’échelle ESMO n’est pas applicable aux cancers hématologiques. Soulignons que le critère de bénéfice clinique est assez large : pour l’échelle ESMO, par exemple
(
Figure 1
)
, il correspond à une augmentation d’au moins 3 % de la survie pour les traitements à visée curative (catégories A et B), à une augmentation de plus de trois mois de la survie et de 10 % de la survie à deux ans pour les traitements à visée palliative (catégories 4 et 5) [
7
]. On ne demande donc pas à ces traitements de faire des merveilles… L’intérêt de l’étude est rehaussé du fait que les prix de tous ces anticancéreux ont également été obtenus pour quatre pays européens (Royaume-Uni, Suisse, Allemagne, France), ce qui permet d’intéressantes comparaisons.
3
 | Figure 1.
Les deux échelles de bénéfice clinique selon l’ESMO, pour les cancers traités en intention curative (à gauche) ou palliative (à droite).
Les catégories apportant un « bénéfice substantiel » sont indiquées (extrait du livret de l’ESMO
Magnitude of clinical benefit scale
3
).
|
|
Les résultats : confirmation du différentiel Europe/États-Unis
Il est de notoriété publique que les prix des nouvelles molécules sont largement inférieurs en Europe par rapport à ceux des États-Unis, et les tableaux présentés dans l’article le confirment [
5
]. Cela tient au fait que les nations européennes ont un système de santé centralisé (
single payor system
) qui négocie le prix de chaque molécule pour l’ensemble des structures de santé nationales. Les prix européens s’établissent ainsi entre le quart et la moitié des prix aux États-Unis, avec relativement peu de différence entre les quatre nations concernées, à part une tendance à des valeurs un peu plus élevées pour la Suisse (qui a peut-être moins de poids dans les négociations tarifaires en raison de la faible taille de son marché). On note, par exemple, que le prix mensuel du traitement du mélanome métastatique par le Nivolumab (Opdivo
®
, un des inhibiteurs de points de contrôle immunitaire les plus utilisés pour traiter différents cancers) passe, en dollars américains, de 14 300 aux États-Unis à 6 870 au Royaume-Uni, 6 800 en Suisse, 5 436 en Allemagne et 3 383 en France. Le différentiel est donc général et majeur : il est encore plus important en réalité pour le Royaume-Uni car les négociations des industriels avec l’organisme
ad hoc
NICE (
National Institute for Health and Care Excellence
) [
9
] (
→
) aboutissent généralement à des rabais très importants mais confidentiels. Ce différentiel États-Unis/Europe fait l’objet de deux interprétations opposées : selon l’administration en place aux États-Unis, ces derniers subventionnent les systèmes de santé européens en les laissant profiter à bas prix de médicaments innovants développés grâce à des prix « domestiques » rétribuant la recherche des
Big Pharma
4
; selon les critiques de l’industrie pharmaceutique, l’ampleur des rabais accordés en Europe atteste l’importance de la marge bénéficiaire de ces entreprises qui peuvent se permettre de diviser leurs prix par trois tout en restant bénéficiaires
(→) Voir la Synthèse de F.J. Kim
et al.
,
m/s
n° 10, octobre 2004, page 876
|
Absence de corrélation entre prix et bénéfice thérapeutique
Mais le résultat le plus important de cet article, qui confirme plusieurs études antérieures [
2
-
4
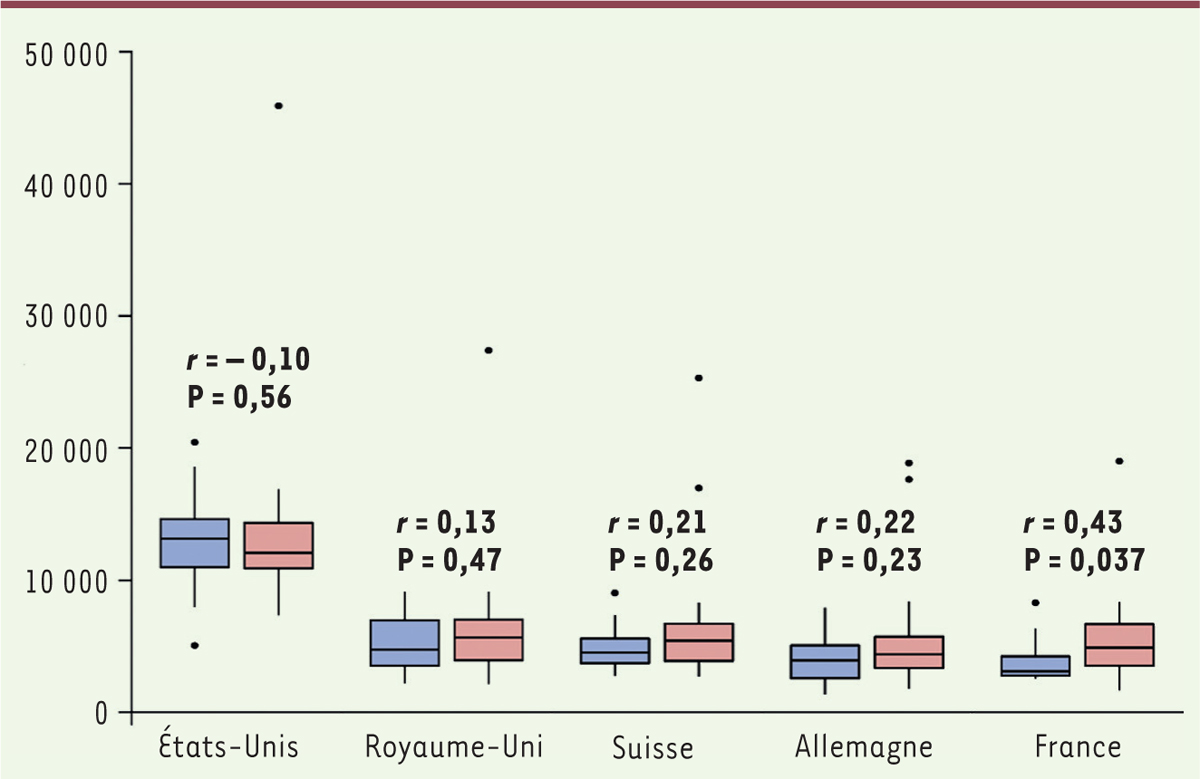
], est l’absence de corrélation entre le coût d’un médicament et le service rendu du point de vue clinique. Cela apparaît clairement sur le graphique de la
Figure 2
, qui compare les coûts de traitements mensuels pour les médicaments apportant un bénéfice clinique notable (en rouge) à ceux des autres médicaments (en bleu), selon l’échelle ASCO. Comme on le voit sur cette figure, les boîtes bleues sont au même niveau que les rouges, c’est-à-dire que les médicaments peu efficaces coûtent aussi cher que ceux qui apportent un bénéfice clinique notable. La seule exception est la France, qui semble payer un peu mieux les bons traitements – mais cette différence n’est plus significative si l’on utilise l’échelle ESMO. Comme indiqué plus haut, les coûts réels au Royaume-Uni sont probablement plus faibles en réalité, ce qui pourrait induire un décalage similaire à celui observé pour la France.
 | Figure 2.
Coût des médicaments apportant un bénéfice clinique élevé (en rose) comparé à celui des médicaments à bénéfice faible (en bleu).
r : corrélation efficacité/coût. Échelle verticale : coût mensuel du traitement en dollars US. Les points isolés correspondent à des valeurs hors échelle : par exemple, le point vers 45 000 dollars pour les États-Unis correspond à l’ipilimumab (Yervoy
®
), un inhibiteur de point de contrôle immunitaire qui a une bonne efficacité (4 dans l’échelle ESMO). Seule la différence observée pour la France est significative (reproduction partielle et modifiée de la figure 2 de [
5
]).
|
On voit donc que globalement le prix (élevé) de ces médicaments n’est pas indicateur de leur efficacité, et cela alors même que les données d’essais cliniques utilisées pour évaluer cette efficacité selon deux échelles différentes sont celles qui ont permis leur homologation et leur mise sur le marché. L’action des agences du médicament des pays européens a certes permis d’abaisser leur coût, proche du tiers de sa valeur aux États-Unis, mais elles n’ont pas réussi (sauf peut-être pour la France, et, si l’on avait accès aux prix réels pratiqués, pour le Royaume-Uni ?) à différencier les prix acceptés selon l’efficacité du produit. |
Un marché décidément très particulier
L’industrie pharmaceutique fonctionne décidément selon des modalités inhabituelles. Le coût de fabrication d’un médicament constitue souvent une part négligeable de son prix sur le marché : la différence est censée financer la recherche et compenser le coût des multiples pistes infructueuses suivies lors de la mise au point d’un traitement. Cette recherche est de plus en plus souvent le fait de
start-up
, entreprises qui développent des stratégies très risquées et font souvent faillite, mais qui en cas de succès sont rachetées par une
Big Pharma
qui acquiert ainsi un nouveau produit commercialisable immédiatement ou à terme. Ces transactions impliquent souvent des sommes considérables : tout récemment une grande entreprise,
Gilead
, a racheté
ImmunoMedics
dont le produit principal, le Troveldy
®
, est actif pour certains cancers du sein. Le chiffre d’affaires éventuel est estimé à 4 milliards de dollars annuels, c’est donc un potentiel
blockbuster
. Mais
Gilead
débourse 21 milliards de dollars pour cet achat, et fait ainsi la fortune des détenteurs d’actions
ImmunoMedics
. De nombreuses transactions de ce type valorisent ainsi des
start-up
à 10 ou 20 fois le total des investissements qu’elles ont reçus au cours de leur (parfois brève) existence. Tout cet argent provient nécessairement de la vente des médicaments : du coup, la fixation de leur prix n’a guère de rapport avec leur coût de fabrication, ni avec les investissements réalisés en recherche, sans parler de leur efficacité, du moment que cette dernière est suffisante pour être agréée par les autorités. Il s’agit plutôt de ce que peut supporter le marché (
what the market can bear
) compte tenu (beaucoup) de la concurrence et (un peu) des possibilités de prise en charge par les assurances-maladies ou les patients eux-mêmes [
10
].
On aimerait donc que, au moins en Europe, les agences réglementaires parviennent à une évaluation plus pointue des bénéfices cliniques apportés par les nouveaux médicaments, et arrivent à imposer une tarification qui en tienne compte. Elles s’y emploient déjà, mais espérons qu’elles pourront affiner leurs approches et, malgré la guerre des prix transatlantique qui s’annonce, imposer des tarifications qui reflètent mieux l’utilité clinique des médicaments dont elles autorisent l’usage. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Fischer
A
,
Dewatripont
M
,
Goldman
M
.
L’innovation thérapeutique, à quel prix ?
Med Sci (Paris).
2020;
;
36
:
:389.
–
93
.
2.
Vivot
A
,
Jacot
J
,
Zeitoun
JD
,
et al.
Clinical benefit, price and approval characteristics of FDA-approved new drugs for treating advanced solid cancer, 2000–2015.
.
Ann Oncol.
2017;
;
28
:
:1111.
–
1116
.
3.
Del Paggio
JC
,
Sullivan
R
,
Schrag
D
,
et al.
Delivery of meaningful cancer care: a retrospective cohort study assessing cost and benefit with the ASCO and ESMO frameworks.
.
Lancet Oncol.
2017;
;
18
:
:887.
–
894
.
4.
Salas-Vega
S
,
Shearer
E
,
Mossialos
E
.
Relationship between costs and clinical benefits of new cancer medicines in Australia, France, the UK, and the US.
.
Soc Sci Med.
2020;
;
258
:
:113042.
.
5.
Vokinger
KN
,
Hwang
TJ
,
Grischott
T
, et al.
Prices and clinical benefit of cancer drugs in the USA and Europe: a cost-benefit analysis.
.
Lancet Oncol.
2020;
;
21
:
:664.
–
70
.
6.
Schnipper
LE
,
Davidson
NE
,
Wollins
DS
,
et al.
Updating the American society of clinical oncology value framework: revisions and reflections in response to comments received.
.
J Clin Oncol.
2016;
;
34
:
:2925.
–
2934
.
8.
Cherny
NI
,
de Vries
EGE
,
Dafni
U
,
et al.
Comparative assessment of clinical benefit using the ESMO-magnitude of clinical benefit scale version 1.1 and the ASCO value framework net health benefit score.
.
J Clin Oncol.
2019;
;
37
:
:336.
–
349
.
9.
Jordan
B.
.
Une approche pragmatique pour gérer les traitements onéreux.
.
Med Sci (Paris).
2017;
;
33
:
:1121.
–
1123
.
10.
Prasad
V
,
De Jesús
K
,
Mailankody
S
.
The high price of anticancer drugs: origins, implications, barriers, solutions.
.
Nat Rev Clin Oncol.
2017;
;
14
:
:381.
–
390
.
|