| |
| Med Sci (Paris). 36(11): 1091–1094. doi: 10.1051/medsci/2020219.
Le coccolithovirus et
Emiliania huxleyi
Un exemple de détournement viral des vésicules extracellulaires Jérémie Marlhens1* 1École normale supérieure de Lyon, Département de biologie, Master biologie
,
Lyon
,
France MeSH keywords: Communication cellulaire, Vésicules extracellulaires, Haptophyta, Interactions hôte-pathogène, Métabolisme lipidique, Phycodnaviridae, physiologie, métabolisme, virologie, pathogénicité |
Les relations intra- et interspécifiques jouent un grand rôle dans les équilibres et cycles écosystémiques. Dans les écosystèmes marins pélagiques par exemple (correspondant à la colonne d’eau de haute mer, par opposition aux côtes et au fond marin), on observe une synchronisation des cycles de vie : c’est le cas des efflorescences algales, ces croissances rapides et massives d’une ou plusieurs espèces d’algues.
Emiliania huxleyi
est une algue unicellulaire de la classe des
Coccolithophyceae
dont le cycle de vie suit des phases d’efflorescence. La dynamique des populations d’
E. huxleyi
est contrôlée par de nombreuses interactions trophiques, comme la prédation. Celle-ci est modulée par des formes de communication interspécifique qui peuvent passer par des métabolites et d’autres composés organiques [
1
]. Par exemple, la prédation d’
E. huxleyi
par le zooplancton induit la synthèse de sulfure de diméthyle, qui induit en retour une diminution de la prédation de l’algue unicellulaire en agissant comme une molécule répulsive pour les prédateurs [
2
]. Un autre facteur important du contrôle de la taille de la population d’
E. huxleyi
est l’infection par les virus [
3
]. Lors des efflorescences, le virus
E. huxleyi virus 86
(EhV), un virus géant à ADN de la famille des
Phycodnaviridae
, se propage rapidement du fait de la forte concentration d’algue, et provoque ainsi la lyse massive de son hôte et la fin de l’efflorescence [
4
]. Récemment, Schatz
et al.
ont exploré les mécanismes par lesquels EhV détournerait certaines fonctions cellulaires de son hôte, et en particulier la communication intercellulaire
via
des vésicules extracellulaires [
5
]. Les résultats de cette étude sont replacés ici dans le contexte plus général des interactions entre ce virus géant et son hôte, et des conséquences écologiques de ces interactions.
|
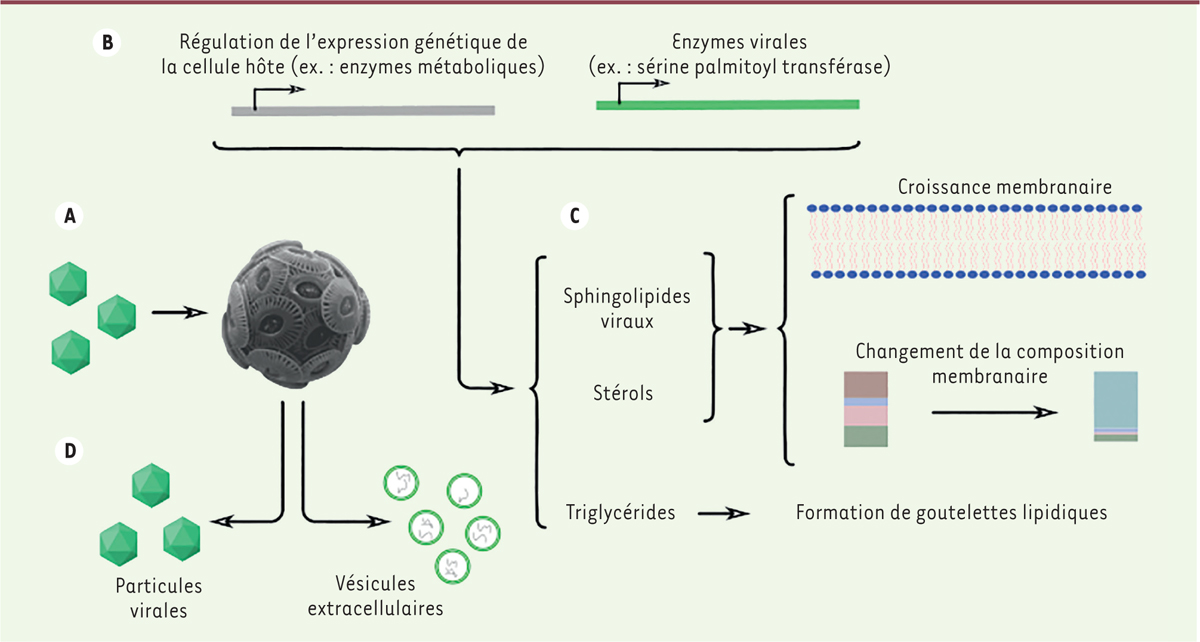
Le détournement du métabolisme lipidique d’E. huxleyi par le virus géant EhV
Les virus géants sont nommés ainsi du fait de la taille importante de leurs particules virales (100-200 nm de diamètre pour EhV) et de leur génome (400 000 paires de bases pour EhV). La taille importante du génome permet aux virus géants de compter de nombreux gènes habituellement considérés comme spécifiques au monde cellulaire, tels que des gènes impliqués dans la traduction, ce qui leur confère un degré d’indépendance par rapport aux gènes de la cellule infectée supérieur aux autres virus. Le génome des virus géants, et en particulier de nombreux virus marins, comporte en outre des gènes auxiliaires qui codent des enzymes modulant le métabolisme cellulaire [
6
]. Les approches globales (-omiques) appliquées à l’infection d’
E. huxleyi
par EhV ont récemment permis une meilleure caractérisation du remaniement viro-induit du métabolisme cellulaire (dont les produits peuvent être analysés par chromatographie en phase liquide couplée à la spectrométrie de masse), en lien avec des variations d’expression génique analysées par séquençage massif des ARN [
7
,
8
]. Les voies métaboliques étant interconnectées, la variation de l’expression des enzymes de l’hôte impliquées dans le métabolisme (comme les enzymes de la glycolyse), couplée à l’expression des enzymes virales, impacte ainsi de nombreuses voies métaboliques telles que la glycolyse, le cycle de Krebs, la voie de synthèse des acides gras, des sphingolipides, ou encore les voies métaboliques de l’azote ou du phosphate. L’infection par EhV module ainsi l’ensemble du métabolisme cellulaire, y compris le métabolisme lipidique, ce qui contribue à générer un environnement cellulaire favorable à la réplication virale et en particulier à la synthèse de l’enveloppe virale [
8
]. En effet, l’infection entraîne la production d’acides gras, suivie de la synthèse en grande quantité de sphingolipides membranaires et gouttelettes de triglycérides
(
Figure 1
)
. Certains lipides synthétisés sont spécifiques de l’infection par EhV. Par exemple, la synthèse
de novo
de sphingolipides dits « viraux » est permise par l’expression de la sérine palmitoyltransférase virale qui catalyse une réaction limitante de la biosynthèse des sphingolipides. La longueur des chaînes carbonées des substrats et des produits n’est pas la même pour les enzymes virales et cellulaires : tandis que l’enzyme cellulaire génère des sphingolipides comportant des chaînes de 18 carbones, l’enzyme virale génère, elle, des sphingolipides comportant des chaînes de 17 carbones [
9
]. Ces sphingolipides viraux sont spécifiquement nécessaires à l’assemblage de nouvelles particules virales. La différence d’un seul carbone confère donc à ces deux lipides des propriétés différentes, qui pourraient être liées à leur hydrophobie ou à leur localisation subcellulaire différentielle. D’autres enzymes virales confèrent des propriétés spécifiques aux lipides viraux néosynthétisés : ils sont par exemple plus hydroxylés [
9
], ce qui confère une meilleure imperméabilité aux membranes alors synthétisées, suggérant que cela pourrait contribuer à la stabilité accrue des particules virales produites.
 | Figure 1.
L’expression de gènes viraux et le contrôle de l’expression génique de la cellule hôte permet un remaniement du métabolisme.
À la suite de l’infection
(A)
, la variation du protéome cellulaire et l’expression de gènes viraux
(B)
aboutit à la variation du métabolisme de l’algue
(C)
, favorisant la synthèse de composants formant les particules virales
(D)
. Les cellules infectées produisent également des vésicules extracellulaires (voir
Figure 2
).
|
Les sphingolipides viraux pourraient également être le support d’une communication intercellulaire au sein de la population algale. En effet, une fois libérés dans le milieu extracellulaire, ils peuvent agir comme signal de mort cellulaire programmée sur les cellules voisines [
10
]. Une hypothèse serait alors que la communication intercellulaire
via
ces sphingolipides viraux pourrait accélérer la fin des efflorescences algales, en synergie avec l’infection virale elle-même.
|
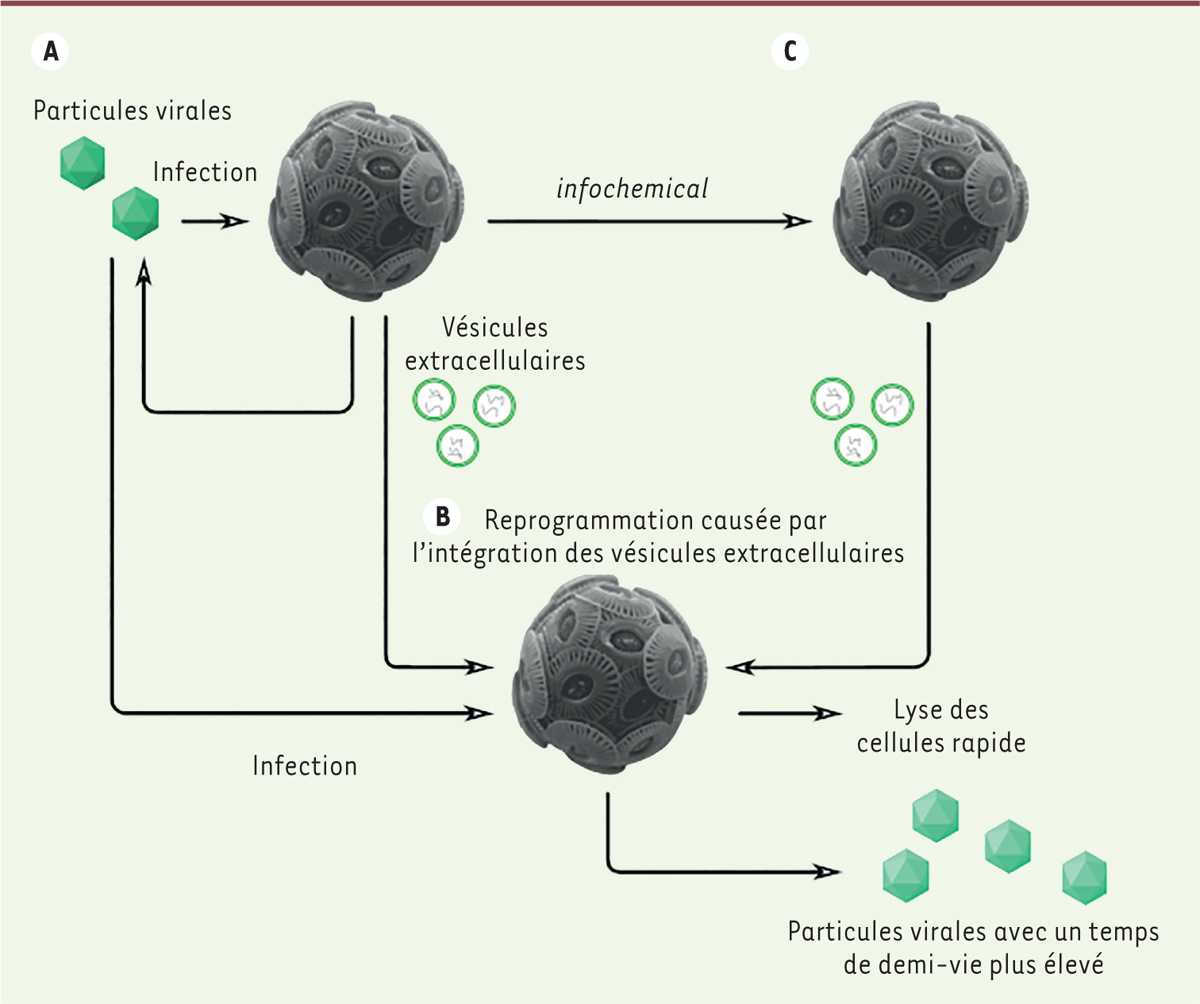
Le détournement de la communication intercellulaire via des vésicules extracellulaires au profit de l’infection virale
Lors de l’infection d’
E. huxleyi
par EhV, Schatz
et al
ont observé, outre la production de particules virales, la production de vésicules extracellulaires [
5
], des structures de communication intercellulaire déjà décrites chez les eucaryotes, les archées et les bactéries [
11
]. De façon intrigante, les auteurs montrent également que l’infection induit la sécrétion d’un messager de nature inconnue (dit
infochemical
en anglais), qui peut, à son tour, induire la production de vésicules extracellulaires par d’autres cellules voisines non infectées. L’infection par EhV induit donc la production de vésicules extracellulaires par
E. huxleyi
de façon directe, et indirectement
via
ce messager
(
Figure 2
)
.
 | Figure 2.
La communication intercellulaire via les vésicules extracellulaires est détournée par le virus et augmente la susceptibilité des cellules cibles à l’infection.
Le virus détourne le métabolisme de la cellule infectée
(A)
. La cellule infectée produit des particules virales et des vésicules extracellulaires qui diffusent ensuite dans le milieu. Les cellules qui ont été exposées aux vésicules extracellulaires avant d’être infectées
(B)
sont lysées plus rapidement et produisent plus de particules virales. Les particules virales, en présence de vésicules extracellulaires, présentent une stabilité accrue. Les cellules infectées produisent également un messager (
infochemical
) qui induit la synthèse de vésicules extracellulaires par les cellules non infectées
(C)
(schéma adapté de [
5
]).
|
Afin de caractériser les molécules transportées par ces vésicules extracellulaires, les auteurs ont analysé leur contenu en acides nucléiques et ont montré que les vésicules extracellulaires contiennent des petits ARN ayant des séquences recouvrant partiellement celles des ARN cellulaires, et en particulier celles de transcrits impliqués dans le métabolisme lipidique. Les auteurs ont alors postulé que ces vésicules extracellulaires sont enrichies en petits ARN interférents qui pourraient réguler l’expression génique des cellules cibles et moduler ainsi leur métabolisme lipidique (entre autres), indépendamment de l’infection virale elle-même.
L’hypothèse formulée par Schatz
et al
. est que ces signaux pourraient moduler la susceptibilité des cellules cibles à l’infection virale. En comparant l’infection de cellules ayant été préalablement mises en présence ou non de vésicules extracellulaires issues de cellules infectées, les auteurs ont remarqué que les cellules exposées à ces vésicules extracellulaires ont un taux de lyse et un rendement viral plus important. Par ailleurs, des particules virales mises en présence de vésicules extracellulaires issues de cellules infectées présentent un temps de demi-vie plus long, et donc une stabilité plus grande. La communication intercellulaire
via
les vésicules extracellulaires semble donc détournée ici en faveur du virus et de sa dissémination efficace au sein de la population hôte
(
Figure 2
)
.
Cette étude illustre ainsi l’importance des vésicules extracellulaires dans la communication intercellulaire au sein de l’écosystème marin, un champ de recherche encore peu exploré malgré ses impacts probables sur la structuration de cet écosystème [
12
,
13
].
|
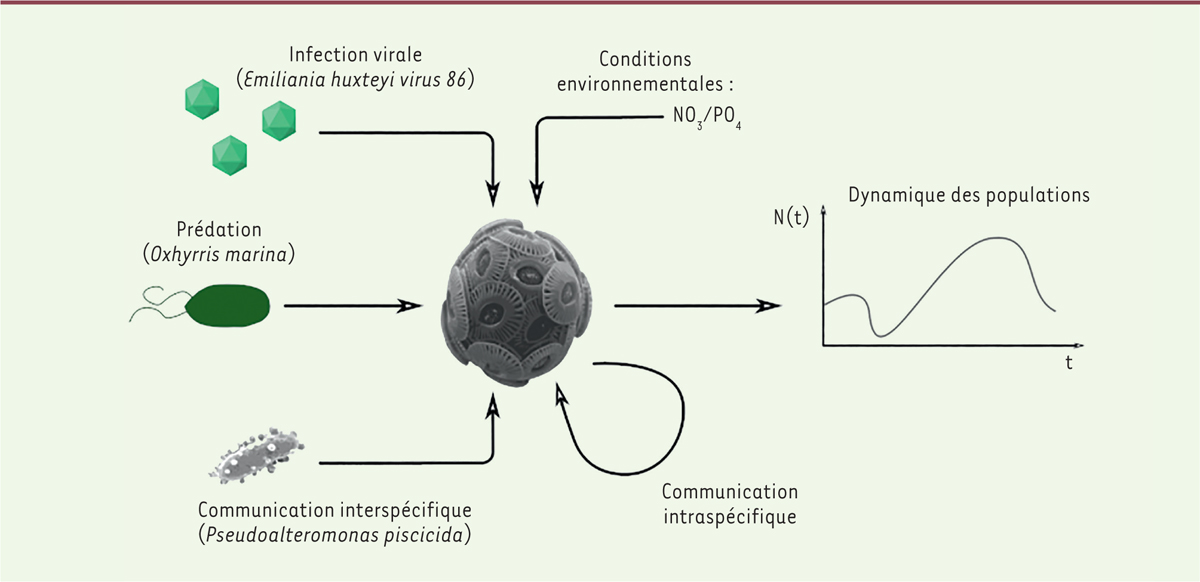
De la description des modalités de communication intercellulaire à la compréhension de la dynamique écosystémique
Le détournement de la communication intercellulaire d’
E. huxleyi
par le virus EhV est donc un élément majeur de la dynamique des populations de l’algue et du contrôle de ses efflorescences. D’autres facteurs sont à prendre en compte pour la compréhension des efflorescences des algues unicellulaires, les plus étudiés étant la prédation et les conditions environnementales. En étudiant séparément les multiples interactions entre l’algue et son écosystème, puis en les intégrant dans un modèle mathématique, on parvient à modéliser la dynamique de la population
(
Figure 3
)
.
 | Figure 3.
De nombreux facteurs sont à prendre en compte pour comprendre la dynamique de population d’
E. huxleyi
. Ces facteurs incluent les conditions environnementales (comme par exemple le ratio nitrate/phosphate [
14
]), les infections virales [
4
], la prédation par les brouteurs [
15
], la communication interspécifique [
16
] et la communication intraspécifique (comme par exemple la diffusion de sphingolipides provoquant la mort cellulaire programmée [
10
]).
|
L’intérêt suscité par la compréhension de la dynamique des populations d’
E. huxleyi
est lié à la position de cette algue à la base des chaînes trophiques au sein de l’écosystème pélagique. En outre, à l’échelle globale, cette algue joue un rôle important dans le cycle du carbone. En effet, comme les autres
Coccolithophyceae
, sa paroi est calcifiée, et constitue donc un puits de carbone vivant important qui peut être stocké dans les sédiments à la mort des individus.
E.huxley
i est par ailleurs une espèce produisant du sulfure de diméthyle, un gaz régulant la formation de nuages, ce qui participe également à son influence potentielle sur le climat. Comprendre la dynamique des populations d’
E. huxleyi
et son contrôle par les infections virales permettrait ainsi de mieux prédire de nombreux phénomènes écologiques locaux et globaux.
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ianora
A
,
Bentley
MG
,
Caldwell
GS
,
et al.
The relevance of marine chemical ecology to plankton and ecosystem function: an emerging field.
.
Marine Drugs.
2011;
;
9
:
:1625.
–
1648
.
2.
Fredrickson
KA
,
Strom
SL
.
The algal osmolyte DMSP as a microzooplankton grazing deterrent in laboratory and field studies.
.
Journal of Plankton Research.
2008;
;
31
:
:135.
–
152
.
3.
Brussaard
CPD
.
Viral control of phytoplankton populations: a review.
.
J Eukaryotic Microbiology.
2004;
;
51
:
:125.
–
138
.
4.
Bratbak
G
,
Egge
J
,
Heldal
M
.
Viral mortality of the marine alga Emiliania huxleyi (Haptophyceae) and termination of algal blooms.
.
Mar Ecol Prog Ser.
1993;
;
93
:
:39.
–
48
.
5.
Schatz
D
,
Rosenwasser
S
,
Malitsky
S
,
et al.
Communication via extracellular vesicles enhances viral infection of a cosmopolitan alga.
.
Nat Microbiol.
2017;
;
2
:
:1485.
–
1492
.
6.
Hurwitz
BL
,
Hallam
SJ
,
Sullivan
MB
.
Metabolic reprogramming by viruses in the sunlit and dark ocean.
.
Genome Biol.
2013;
;
14
:
:R123.
.
7.
Kegel
JU
,
Blaxter
M
,
Allen
MJ
,
et al.
Transcriptional host–virus interaction of Emiliania huxleyi (Haptophyceae) and EhV-86 deduced from combined analysis of expressed sequence tags and microarrays.
.
Eur J Phycol.
2010;
;
45
:
:1.
–
12
.
8.
Rosenwasser
S
,
Mausz
MA
,
Schatz
D
,
et al.
Rewiring host lipid metabolism by large viruses determines the fate of Emiliania huxleyi, a bloom-forming alga in the ocean.
.
Plant Cell.
2014;
;
26
:
:2689.
–
2707
.
9.
Ziv
C
,
Malitsky
S
,
Othman
A
,
et al.
Viral serine palmitoyltransferase induces metabolic switch in sphingolipid biosynthesis and is required for infection of a marine alga.
.
Proc Natl Acad Sci USA.
2016;
;
113
:
:E1907.
–
E1916
.
10.
Vardi
A
,
Van Mooy
BAS
,
Fredricks
HF
,
et al.
Viral glycosphingolipids induce lytic infection and cell death in marine phytoplankton.
.
Science.
2009;
;
326
:
:861.
–
865
.
11.
Yáñez-Mó
M
,
Siljander
PR-M
,
Andreu
Z
,
et al.
Biological properties of extracellular vesicles and their physiological functions.
.
J Extracellular Vesicles.
2015;
;
4
:
:27066.
.
12.
Schatz
D
,
Vardi
A
.
Extracellular vesicles: new players in cell–cell communication in aquatic environments.
.
Curr Op Microbiol.
2018;
;
43
:
:148.
–
154
.
13.
Biller
SJ
,
Schubotz
F
,
Roggensack
SE
,
et al.
Bacterial vesicles in marine ecosystems.
.
Science.
2014;
;
343
:
:183.
–
186
.
14.
Lessard
EJ
,
Merico
A
,
Tyrrell
T
.
Nitrate : phosphate ratios and Emiliania huxleyi blooms.
.
Limnol Oceanogr.
2005;
;
50
:
:1020.
–
1024
.
15.
Hansen
F
,
Witte
H
,
Passarge
J
.
Grazing in the heterotrophic dinoflagellate Oxyrrhis marina: size selectivity and preference for calcified Emiliania huxleyi cells.
.
Aquat Microb Ecol.
1996;
;
10
:
:307.
–
313
.
16.
Harvey
EL
,
Deering
RW
,
Rowley
DC
,
et al.
A bacterial quorum-sensing precursor induces mortality in the marine coccolithophore, Emiliania huxleyi.
.
Front Microbiol.
2016;
;
7
.
|