| |
| Med Sci (Paris). 36(11): 1088–1090. doi: 10.1051/medsci/2020218.La sécrétion de vésicules extracellulaires par les plaquettes activées à l’origine de la létalité de la dengue ? Thomas Duchateau,1a Corentin Morvan,1b and Fiona Steffan1c 1École normale supérieure de Lyon, Département de biologie, Master biologie
,
Lyon
,
France MeSH keywords: Coagulation sanguine, Plaquettes, Vésicules cytoplasmiques, Dengue, Virus de la dengue, Pièges extracellulaires, Humains, Activation plaquettaire, physiologie, métabolisme, sang, mortalité, anatomopathologie, pathogénicité, virologie |
La dengue est une maladie virale endémique des régions tropicales où elle menace jusqu’à quatre milliards de personnes. L’Organisation mondiale de la santé (OMS) l’a reconnue comme un enjeu sanitaire mondial avec 300 millions de nouveaux cas par an, dont 500 000 formes sévères, entraînant 22 000 décès annuels [
1
]. La dengue est causée par un virus de la famille des
Flaviviridae
transmis à l’homme par les moustiques du genre
Aedes
, en particulier
Aedes aegypti
, qui agissent comme les vecteurs du virus. Du fait du réchauffement climatique, la remontée de ces vecteurs vers les zones de plus hautes latitudes entraîne de nouveaux cas européens dits autochtones, c’est-à-dire des individus qui contractent la maladie localement, sans avoir voyagé dans les zones endémiques. À l’automne 2019, deux cas autochtones ont ainsi été recensés à Lyon.
Bien qu’
in vitro
, le virus infecte une grande diversité de types cellulaires (cellules épithéliales, hépatocytes, cellules immunitaires, etc.), ce tropisme se limite
in vivo
aux cellules immunitaires myéloïdes (macrophages, neutrophiles) et à certains lymphocytes. L’exposition des cellules myéloïdes au virus induit leur activation
via
la lectine CLEC5A (
C-Type Lectin Domain Family 5 member A
). Cette activation s’accompagne d’une production massive de cytokines et d’un état physiopathologique d’inflammation généralisée engendrant fièvres, céphalées, nausées et vomissements [
2
].
La physiopathologie de l’infection par le virus de la dengue fait intervenir deux autres acteurs cellulaires : les plaquettes et les neutrophiles. L’infection par le virus de la dengue induit l’activation des plaquettes : celle-ci participe à la forte augmentation de la perméabilité vasculaire qui, dans les cas sévères, peut entraîner des chocs hémorragiques et des hématémèses (vomissements de sang) [
3
]. Plus récemment, la formation de pièges extracellulaires de neutrophiles (
Neutrophil Extracellular Traps
, NET) a été reliée à la présence du virus. Ces pièges extracellulaires sont constitués de longs filaments d’ADN sécrétés par les neutrophiles et recouverts de protéines diverses ayant pour rôle de piéger les pathogènes. Certaines études suggèrent pourtant que ces NET entraineraient une exacerbation de la réponse immunitaire et participeraient ainsi à la physiopathologie de la dengue [
3
]. Dans leur dernier article, Sung
et al.
ont finalement élucidé les mécanismes d’une interaction entre les plaquettes et les neutrophiles mise en place au cours de l’infection par le virus de la dengue, aboutissant à l’induction de NET et, par la suite, à l’augmentation de la perméabilité vasculaire [
4
].
|
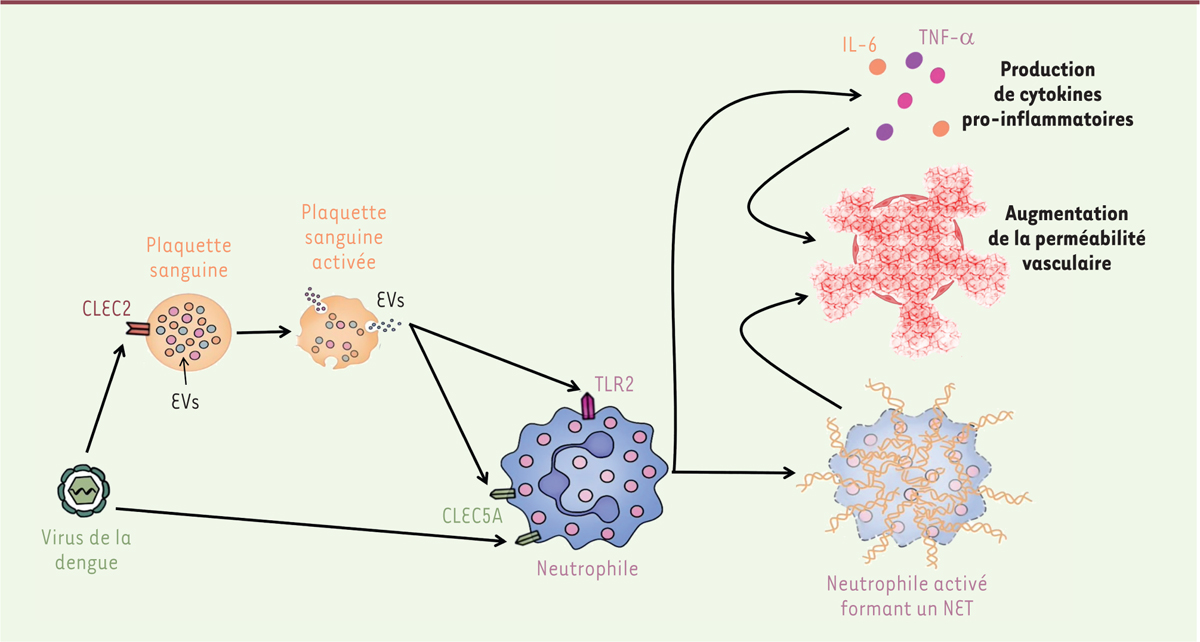
Le virus de la dengue induit la formation de NET par l’intermédiaire du récepteur CLEC5A et active les plaquettes via CLEC2 Dans un premier temps, les auteurs ont cherché à déterminer les récepteurs de surface responsables de l’activation des neutrophiles et des plaquettes au cours de l’infection. Les auteurs ont d’abord quantifié la formation des NET par immunohistochimie, en suivant la libération d’histones citrullinées propres aux NET. La formation de NET est induite par la présence du virus seul, mais peut être abolie par l’inhibition du récepteur CLEC5A présent à la surface des neutrophiles. La formation de ces NET est donc dépendante de CLEC5A.
Les auteurs se sont ensuite intéressés à l’activation des plaquettes exposées au virus et ont testé l’implication du récepteur
C-type Lectin-Like Receptor 2
(CLEC2) présent entre autres sur les plaquettes. L’expression de marqueurs d’activation à la surface des plaquettes augmente en présence du virus mais est inhibée en présence d’anticorps bloquants dirigés contre CLEC2. Ainsi, CLEC2 est nécessaire à l’activation des plaquettes par le virus.
|
Les plaquettes activées participent à l’activation des neutrophiles et à la formation des NET Les auteurs ont alors cherché à déterminer si les plaquettes activées pouvaient elles-mêmes participer à l’activation des neutrophiles. En effet, ils ont observé la formation de NET lorsque les neutrophiles sont cultivés en présence de plaquettes préalablement activées par le virus de la dengue. La formation de NET par les neutrophiles en présence de plaquettes préalablement activées est par ailleurs trois fois plus importante qu’en présence de virus seul. Cet effet des plaquettes sur la formation de NET est annulé par l’inhibition de CLEC2, ce qui démontre le rôle essentiel des plaquettes préalablement activées par le virus.
Ainsi le virus de la dengue provoque la formation des NET d’une manière directe
via
la stimulation de CLEC5A exprimé à la surface des neutrophiles et de manière indirecte, CLEC2-dépendante, en activant les plaquettes sanguines qui peuvent à leur tour stimuler les neutrophiles et contribuer à l’inflammation
(
Figure 1
)
.
 | Figure 1.
Modulation de la communication intercellulaire et réponse immunopathologique lors d’une infection par le virus de la dengue.
Le virus de la dengue active les neutrophiles soit directement via CLEC5A, soit indirectement via l’activation des plaquettes par l’intermédiaire de CLEC2. Ces plaquettes activées produisent alors des vésicules extracellulaires (EV) qui activent les neutrophiles via les récepteurs TLR2 et CLEC5A. L’activation des neutrophiles entraîne une production de cytokines et la formation de «
Neutrophil Extracellular Traps
» (NET) qui participent à l’augmentation de la perméabilité vasculaire, à l’origine des symptômes dans les formes sévères de l’infection.
|
|
L’activation des neutrophiles par les plaquettes se fait via des vésicules extracellulaires
L’activation des neutrophiles par les plaquettes se fait donc
via
des mécanismes de communication intercellulaire. Ayant démontré que l’exposition des plaquettes au virus de la dengue induit la formation de vésicules extracellulaires par ces cellules, les auteurs ont fait l’hypothèse que ces vésicules peuvent avoir un rôle d’intermédiaires dans l’activation et la communication avec les neutrophiles.
Les vésicules extracellulaires peuvent être séparées en plusieurs catégories selon leur taille et leur origine. Ici, les vésicules sont appelées exosomes si elles ont un diamètre inférieur à 100 nm, et microvésicules sinon. Pour déterminer si les vésicules servent d’intermédiaires de communication entre les plaquettes et les neutrophiles en présence de virus, les auteurs ont quantifié la formation de NET par les neutrophiles en présence du virus seul, de plaquettes préalablement activées par le virus, ou des vésicules extracellulaires (exosomes ou microvésicules) sécrétées par les plaquettes activées. Les résultats de ces expériences montrent une induction significative de NET en présence des vésicules extracellulaires isolées, ce qui démontre le rôle de celles-ci dans l’activation des neutrophiles par les plaquettes. Néanmoins, l’induction des NET est plus importante lorsque l’activation se fait par les plaquettes entières plutôt que par les vésicules seules, ce qui suggère la co-existence d’autres voies d’activation.
Afin de déterminer par quel mécanisme les vésicules extracellulaires issues des plaquettes activées induisent la formation de NET, les auteurs ont reproduit ces expériences en présence d’anticorps bloquant CLEC5A. L’inhibition de CLEC5A annule l’induction de NET par le virus seul, mais limite seulement partiellement les NET induits par les vésicules issues des plaquettes. En effet, l’inhibition de CLEC5A empêche la formation de NET induits par les exosomes mais pas par les microvésicules. Certaines bactéries étant connues pour déclencher la formation des NET en co-activant CLEC5A et TLR2 (
Toll-Like Receptor 2
) sur les neutrophiles [
5
], les auteurs ont comparé la formation de NET induite par les vésicules extracellulaires issues des plaquettes en absence ou en présence d’anticorps bloquant CLEC5A et TLR2. Ils ont observé que le blocage simultané de CLEC5A et de TLR2 inhibe la formation de NET par les neutrophiles exposés à tout type de vésicules extracellulaires issues des plaquettes, démontrant que celles-ci activent les neutrophiles via CLEC5A et TLR2.
Ainsi, l’infection par le virus de la dengue provoque l’activation des neutrophiles et la formation de NET par plusieurs voies qui agissent en synergie : le virus active directement les neutrophiles en activant CLEC5A, mais active aussi les plaquettes via CLEC2. Ces plaquettes activées sécrètent alors des vésicules extracellulaires qui permettent la communication entre les plaquettes et les neutrophiles et activent les neutrophiles via CLEC5A et TLR2. On a donc une accumulation des voies d’activation des neutrophiles conduisant à la formation importante de NET
(
Figure 1
)
.
|
La formation des NET et l’activation des cellules myéloïdes par les plaquettes activées sont à l’origine des effets physiopathologiques de l’infection
Les auteurs ont alors cherché à comprendre si les NET pouvaient directement participer à la sévérité de l’infection
in vivo.
Les auteurs ont d’abord analysé l’effet des NET sur l’augmentation de la perméabilité vasculaire au cours de l’infection. Pour cela, ils ont utilisé un modèle murin de l’infection dans lequel ils injectent de la DNAse I, une enzyme capable de détruire les NET. L’augmentation de la perméabilité vasculaire due à l’infection est alors limitée, mettant ainsi en évidence que la formation des NET participe à l’augmentation de la perméabilité vasculaire lors de l’infection.
Comme nous l’avons rappelé dans l’introduction, l’activation des cellules myéloïdes lors de l’infection par le virus de la dengue provoque la libération massive de cytokines pro-inflammatoires. Les auteurs se sont alors intéressés à l’effet des plaquettes et des vésicules extracellulaires qu’elles produisent en réponse au virus, sur la production de ces cytokines par les cellules myéloïdes. La quantification de la production de TNF-α (
Tumor Necrosis Factor
a) et d’IL-6 (
Interleukine 6
) par les neutrophiles et les macrophages en présence de virus seul ou de vésicules extracellulaires issues des plaquettes montre, qu’
in vitro
, l’activation des cellules myéloïdes provoque une production deux fois plus importante de cytokines si elle s’effectue par l’intermédiaire des vésicules extracellulaires issues de plaquettes. De plus, l’inhibition simultanée de CLEC5A et TLR2
in vitro
ou
in vivo,
dans un modèle murin de l’infection, empêche la sécrétion de TNF-α et d’IL-6, ce qui démontre que les mêmes voies d’activation sont impliquées dans la formation des NET et dans la production des cytokines
(
Figure 1
)
.
Les auteurs ayant mis en évidence que l’activation des neutrophiles par le virus et les vésicules extracellulaires issues des plaquettes,
via
CLEC5A et TLR2, participe à tous les symptômes potentiellement létaux de l’infection, ils ont voulu tester l’effet de l’inhibition de ces deux récepteurs sur la sévérité de l’infection
in vivo
. Dans des modèles murins, ils ont ainsi montré que l’inhibition de ces deux récepteurs permet d’augmenter significativement la survie des souris infectées. Ces résultats ouvrent la voie à une nouvelle stratégie thérapeutique visant à limiter l’activation des neutrophiles durant l’infection, et ainsi empêcher un emballement immunitaire potentiellement létal.
|
Le virus de la dengue est donc à l’origine de l’activation de plusieurs voies qui aboutissent à la formation de NET, à l’inflammation et à l’augmentation de la perméabilité vasculaire. Ces voies, qui sont activées
via
les récepteurs tels que CLEC5A et TLR2, agissent en synergie lors d’une infection et conduisent à la physiopathologie de la dengue. Ces découvertes mettent donc en lumière le rôle central des vésicules extracellulaires des plaquettes dans la réponse immunopathologique contre l’infection par la dengue. En effet, les plaquettes sont capables d’activer les neutrophiles via des vésicules extracellulaires même lorsque les neutrophiles ne sont pas directement en présence du virus, mettant en évidence l’importance de la communication intercellulaire dans un contexte d’infection par le virus de la dengue.
La communication intercellulaire par l’intermédiaire de vésicules extracellulaires a déjà été montrée dans d’autres contextes d’infection virale [
6
]. Il est également déjà connu que les vésicules extracellulaires jouent un rôle dans la communication intercellulaire du système immunitaire et permettent de moduler la réponse immunitaire en fonction du type de pathogène en présence [
7
]. Cette forme de communication intercellulaire entre cellules immunitaires découverte récemment pourrait ouvrir la voie à une potentielle utilisation thérapeutique en utilisant ces vésicules pour inhiber ou stimuler le système immunitaire, ou, mieux, diriger la réponse immune vers des mécanismes protecteurs.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Bhatt
S
,
Gething
PW
,
Brady
OJ
,
et al.
The global distribution and burden of dengue.
.
Nature.
2013;
;
496
:
:504.
–
507
.
2.
Chen
,
Lin
,
Y
,
Huang
M
,
et al.
CLEC5A is critical for dengue-virus-induced lethal disease.
.
Nature.
2008;
;
453
:
:672.
–
676
.
3.
Opasawatchai
A
,
Amornsupawat
P
,
Jiravejchakul
N
,
et al.
Neutrophil activation and early features of net formation are associated with dengue virus infection in human.
.
Front Immunol.
2018;
;
9
:
:3007.
.
4.
Sung
PS
,
Huang
TF
,
Hsieh
SL
.
Extracellular vesicles from CLEC2-activated platelets enhance dengue virus-induced lethality via CLEC5A/TLR2.
.
Nat Commun.
2019;
;
10
:
:2402.
.
5.
Chen
ST
,
Li
FJ
,
Hsu
T
,
et al.
CLEC5A is a critical receptor in innate immunity against Listeria infection.
.
Nature Commun.
2017;
;
8
:
:1.
–
13
.
6.
Schorey
JS
,
Harding
CV
.
Extracellular vesicles and infectious diseases: new complexity to an old story.
.
J Clin Invest.
2016;
;
126
:
:1181.
–
1189
.
7.
Zhou
X
,
Xie
F
,
Wang
L
,
et al.
The function and clinical application of extracellular vesicles in innate immune regulation.
.
Cell Mol Immunol.
2020;
;
17
:
:323.
–
34
.
|