| |
| Med Sci (Paris). 36(11): 1078–1080. doi: 10.1051/medsci/2020215.Un bactériophage exploite le système de communication de son hôte bactérien pour entrer en cycle lytique Rasha Alqs Matti,1a Miguel Camacho Rufino,1b Ugo Hirigoyen,1c Élisa Mazenod,1d and Guillaume Seuzaret1e 1École normale supérieure de Lyon, Département de biologie, Master biologie
,
Lyon
,
France MeSH keywords: Bactéries, Phénomènes physiologiques bactériens, Bactériolyse, Bactériophages, Escherichia coli, Interactions hôte-pathogène, Humains, Interactions microbiennes, Phénomènes physiologiques viraux, métabolisme, virologie, physiologie, pathogénicité |
Les bactériophages, plus communément appelés phages, sont des virus infectant les bactéries. Le cycle viral productif aboutit à la formation de nouveaux virions et peut s’accompagner de la lyse de la bactérie hôte (cycle lytique). Dans le cas des phages dits tempérés, le génome viral peut s’intégrer dans le génome de la bactérie hôte sous forme de « prophage » (cycle lysogénique). Intégré dans le génome de l’hôte, le prophage présente le plus souvent peu d’expression génique et n’est donc plus capable de produire des virions. Ce prophage est alors apparenté à un stade de « dormance » dans le cycle viral des bactériophages. Cependant, cette dormance n’est pas définitive : l’insertion du prophage dans le génome bactérien est réversible, et en s’excisant, le phage peut à nouveau passer en cycle productif et aboutir à la lyse de son hôte. Il est intéressant de noter que plusieurs bactéries pathogènes chez l’Homme portent des prophages dans leur génome. En réactivant ces prophages, on peut espérer induire le cycle lytique et éliminer spécifiquement ces bactéries pathogènes. L’étude des signaux pouvant provoquer la transition vers le cycle lytique des bactériophages est donc un domaine de recherche primordial.
Afin de réguler certaines fonctions physiologiques, telles que la production de facteurs de virulence ou la formation de biofilms, les bactéries utilisent un mécanisme de communication intercellulaire très conservé appelé
quorum sensing
[1,2]. Ce système de communication repose sur la sécrétion d’un autoinducteur. Ce terme recouvre une famille de petites molécules de signalisation produites et détectées par les bactéries, dont les changements de concentration dans l’environnement sont le reflet d’un changement de densité bactérienne. Il a été suggéré que le signal que constitue l’autoinducteur pourrait être exploité par des prophages pour induire leur cycle lytique. Ghosh et ses collègues ont ainsi montré en 2009 que la reconnaissance de l’autoinducteur N-Acyl Homoserine Lactone (AHL) par
E. coli
entraîne la production de virions par son phage lysogène l, ce qui suggère que les phages peuvent exploiter le
quorum sensing
de leur hôte pour déclencher la bascule lysogénique-lytique [
3
].
Plus récemment, Silpe et Bassler se sont intéressés au mécanisme utilisé par le phage lysogénique VP882 pour entrer en cycle lytique [
4
]. VP882 est un phage qui infecte des bactéries du genre
Vibrio
, dont
V. cholerae
et
V. parahaemolyticus
, deux bactéries responsables d’infections entériques chez l’Homme. Comprendre les mécanismes qui déclenchent la transition lysogénique-lytique de VP882 est donc crucial car cela pourrait ouvrir des voies thérapeutiques pour faire face à ces deux pathogènes.
|
Le quorum sensing du genre Vibrio est utilisé par VP882 pour déclencher son cycle lytique
La protéine VqmA de
Vibrio cholerae
(VqmA
VC
) est le récepteur de l’autoinducteur 3,5-dimethylpyrazin-2-ol (DPO) sécrété par les bactéries du genre
Vibrio.
En présence de DPO sécrété par les bactéries environnantes, VqmA
VC
active l’expression du gène
vqmR
qui conduit à l’inhibition du biofilm bactérien et à la production de facteurs de virulence
(
Figure 1
)
.
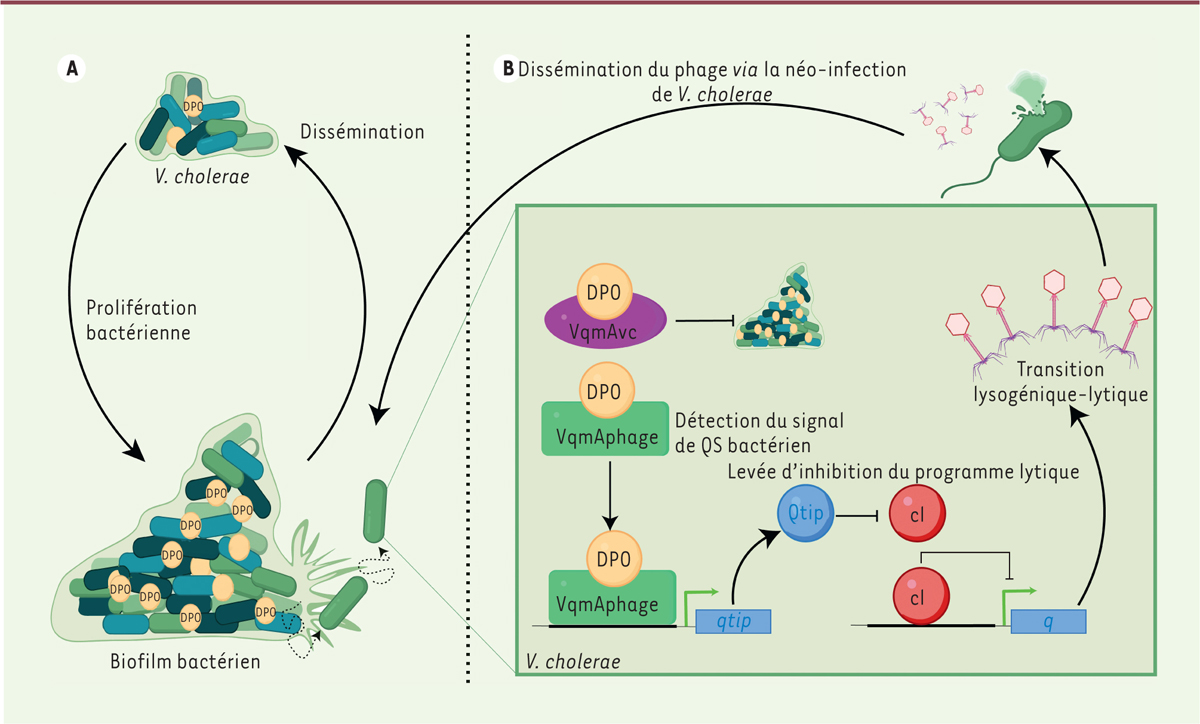
 | Figure 1.
Le
quorum sensing
(QS) du genre
Vibrio
contrôle le cycle lysogénique- lytique du phage VP882. (A)
Schéma du cycle de la bactérie
Vibrio cholerae
. En stade de latence, les bactéries
V. cholerae
restent protégées dans leur biofilm. En milieu favorable, la densité bactérienne augmente, déclenchant le mécanisme de QS dépendant de l’autoinducteur DPO et du récepteur VqmA, qui inhibe la formation du biofilm et favorise la dissémination bactérienne.
(B)
Le phage profite du mécanisme QS pour sa propre dissémination. Le récepteur VqmA
phage
(homologue au récepteur bactérien VqmA
vC
) fixe l’autoinducteur DPO. Le complexe DPO/VqmA
phage
induit l’expression de
qtip
qui lève l’inhibition du programme lytique en bloquant cl, répresseur de la protéine Q.
|
Les auteurs ont d’abord découvert que le génome du phage VP882 code une protéine homologue à VqmA
VC
, nommée VqmA
phage
et montré que VqmA
phage
entraîne la lyse de l’hôte bactérien par VP882, en présence de DPO. Ils ont confirmé ces observations dans des conditions plus physiologiques en montrant que c’est la production de DPO par les bactéries en culture qui déclenche le cycle lytique de VP882 après fixation à VqmA
phage
. En d’autres termes, le
quorum sensing
de
Vibrio cholerae
régule la transition lysogénique-lytique du phage VP882.
|
La lysogénie de VP882 est maintenue par la répression transcriptionnelle d’un activateur du programme lytique
Après avoir découvert que VqmA
phage
induit le cycle lytique en réponse au DPO, les auteurs ont voulu décortiquer les gènes du prophage impliqués dans l’activation de ce programme lytique. Par mutagénèse aléatoire, ils ont généré une banque de phages VP882 mutants, qu’ils ont ensuite utilisés pour infecter des souches de
V. parahaemolyticus
. Ainsi, ils ont identifié un mutant de VP882 qui avait perdu la capacité de lyser son hôte malgré l’expression de
vqmA
phage
, ce qui suggère que le gène touché, nommé
q
, est nécessaire à l’entrée en cycle lytique. L’expression de
q
suffit à provoquer la lyse en l’absence de VqmA
phage
. En revanche, en l’absence de Q (la protéine codée par
q
), l’expression de
vqmA
phage
ne suffit pas à provoquer la lyse. Les auteurs en déduisent donc que
q
est situé en aval de
vqmA
phage
. Par homologie de séquences, ils ont pu apparenter
q
à un régulateur du programme lytique et ont ensuite vérifié que Q active l’expression d’un opéron contenant trois gènes et qui déclenche la lyse chez
E. coli.
Sachant que l’expression de
q
par le prophage suffit à déclencher le cycle lytique, les auteurs se sont demandés comment son expression était inhibée lors du cycle lysogénique. En utilisant un gène rapporteur placé sous la dépendance du promoteur de
q
, ils ont mis en évidence que l’élimination des prophages présents dans
V. parahaemolyticus
permet d’augmenter l’activité du promoteur de
q
d’un facteur 25, ce qui montre que VP882 code un répresseur transcriptionnel de
q
. Ils ont nommé
cI
le gène responsable de cette inhibition. VP882 maintient donc son état de prophage grâce à ce répresseur cI qui bloque l’expression du gène
q
. Les auteurs se sont alors intéressés au mécanisme qui conduit au cycle lytique de VP882 après activation de VqmA
phage
.
|
VqmAphage active l’expression d’un anti-répresseur pour promouvoir la transition lysogénie-lyse de VP882
Les auteurs ont imaginé plusieurs scénarios pour expliquer l’activation du cycle lytique par VqmA
phage
. D’abord, ils ont suggéré que le complexe VqmA
phage
-DPO pourrait activer directement
q
en se fixant à son promoteur, ou réprimer l’expression du répresseur cI, permettant ainsi l’expression de
q
. Pour tester ces hypothèses, ils ont utilisé différents plasmides permettant d’exprimer uniquement
vqmA
phage
,
q
et
cI
chez
E. coli
. Ils n’ont pas remarqué de changements significatifs dans l’expression de
q
lorsque VqmA
phage
est exprimé. Ces résultats infirment donc l’hypothèse que VqmA
phage
active l’expression de
q
, que ce soit directement ou par l’intermédiaire de l’inhibition de
cI
.
Les auteurs ont formulé alors une autre hypothèse : VqmA
phage
pourrait activer l’expression d’un gène de VP882 qui agirait comme un intermédiaire supplémentaire dans la voie menant à l’expression de
q
en inhibant l’expression de
cI
. En criblant une banque de fragments de l’ADN génomique de VP882, les auteurs ont identifié le gène
qtip
, permettant à
q
d’être exprimé malgré la présence du répresseur cI. Qtip n’étant pas capable de se fixer à l’ADN, les auteurs ont fait l’hypothèse qu’il inhiberait cI au niveau post-traductionnel. Ils ont pu vérifier par co-immunoprécipitation que cI et Qtip interagissent physiquement, et leurs analyses en microscopie confocale leur ont permis de montrer que l’induction de l’expression de
qtip
permet de séquestrer cI en agrégats. Les auteurs concluent donc qu’une fois activé grâce à VqmA
phage
, Qtip agit comme un “anti-répresseur”, interagissant physiquement avec cI pour l’empêcher de réprimer l’expression de
q
. Ainsi, la protéine Q est exprimée et active le programme lytique de VP882
(
Figure 1
)
.
Ce mécanisme de régulation de la transition lysogénique-lytique par le
quorum sensing
semble permettre une dissémination optimale des bactériophages, puisque le phage active la formation de virions et la lyse de son hôte lorsque la densité bactérienne est importante. Reste à savoir si cette utilisation du
quorum sensing
, visiblement avantageuse, est répandue chez les bactériophages. Depuis la publication de cet article, Silpe et Bassler ont rapporté l’existence d’autres phages possédant des récepteurs capables de « sentir » le
quorum sensing
de leur hôte [
5
]. Par ailleurs, Laganenka
et al.
ont démontré que le bactériophage T1 utilise également le
quorum sensing
de son hôte pour déclencher son cycle lytique [
6
]. Il est donc possible que le mécanisme étudié ici ne soit pas rare parmi les bactériophages.
La présence dans le génome du phage d’un gène homologue à celui de l’hôte bactérien peut s’expliquer par le fait que le prophage, en s’excisant, peut également récupérer des fragments d’ADN bactérien. Ces fragments peuvent être conservés en étant répliqués lors du cycle viral suivant, en plus de pouvoir être transmis à une autre bactérie en cas d’intégration. Ainsi, les bactériophages et leurs hôtes participent mutuellement à l’évolution de leurs génomes, ce qui conduit à l’existence de protéines virales et bactériennes homologues, avec une potentielle conservation de la fonction, comme ce qu’on observe dans le cas de VqmA
phage
où le phage réutilise une fonction propre à son hôte.
|
Vers l’ingénierie des systèmes de transition lysogénie/lyse pour améliorer la spécificité de la phagothérapie
Les auteurs terminent leur article en s’intéressant au développement d’un phage recombinant dont le cycle lytique pourrait être déclenché par un autoinducteur de la bactérie hôte. Ainsi, ils ont utilisé le phage VP882 porteur d’un gène
q
inactivé et un plasmide contenant le gène
q
sous dépendance d’un promoteur activable par VqmA
VC
. Ainsi, l’expression de
q
est alors activée lorsque
V. cholerae
produit du DPO. Cela entraîne alors l’activation du cycle lytique du phage. Ce système pourrait être exploité en médecine pour lutter contre de nombreuses autres espèces de bactéries. Ainsi, en plaçant le gène
q
sous la dépendance d’un promoteur spécifique à la bactérie hôte et activé par un autoinducteur, il serait possible de créer un système très modulable qui pourrait lyser spécifiquement différentes bactéries, en modifiant uniquement le promoteur d’intérêt.
Ce système pourrait être un très bon moyen d’éliminer spécifiquement certaines bactéries pathogènes, sans affecter excessivement notre microbiote. Ces résultats permettent donc d’envisager la phagothérapie, qui utilise des bactériophages lytiques pour traiter des infections bactériennes et qui était employée en thérapeutique avant l’arrivée massive des antibiotiques, comme une piste thérapeutique pour faire face au défi de santé publique posé par l’antibiorésistance. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Fuqua
C
,
Winans
SC
,
Greenberg
EP
.
Census and consensus in bacterial ecosystems: the LuxR-LuxI family of quorum-sensing transcriptional regulators.
.
Annu Rev Microbiol.
1996;
;
50
:
:727.
–
751
.
2.
Waters
CM
,
Bassler
BL
.
Quorum sensing: cell-to-cell communication in bacteria.
.
Annu Rev Cell Dev Biol.
2005;
;
21
:
:319.
–
346
.
3.
Ghosh
D
,
Roy
K
,
Williamson
KE
,
et al.
Acyl-homoserine lactones can induce virus production in lysogenic bacteria: an alternative paradigm for prophage induction.
.
Appl Environ Microbiol.
2009;
;
75
:
:7142.
–
7152
.
4.
Silpe
JE
,
Bassler
BL
.
A host-produced quorum-sensing autoinducer controls a phage lysis-lysogeny decision.
.
Cell.
2019;
;
176
:
(268–80)
:e13.
.
5.
Silpe
JE
,
Bassler
BL
.
Phage-encoded luxr-type receptors responsive to host-produced bacterial quorum-sensing autoinducers.
.
MBio.
2019;
,
10
.
6.
Laganenka
L
,
Sander
T
,
Lagonenko
A
,
et al.
Quorum sensing and metabolic state of the host control lysogeny-lysis switch of bacteriophage T1.
.
MBio.
2019;
,
10
.
|