Équipe pédagogique
Chloé Journo (maître de conférences, ENS de Lyon). Co-responsable de l’UE microbiologie moléculaire et structurale. Équipe oncogenèse rétrovirale, Centre international de recherche en infectiologie, Inserm U1111 - CNRS UMR5308, École normale supérieure de Lyon, Lyon, France
Théodore Grenier (doctorant moniteur, ENS de Lyon). Équipe génomique fonctionnelle des interactions hôte/bactéries, Institut de génomique fonctionnelle de Lyon, Université de Lyon, École normale supérieure de Lyon, CNRS UMR 5242, Université Claude Bernard Lyon 1, Lyon, France
Renaud Mahieux (professeur, ENS de Lyon). Co-responsable de l’UE microbiologie moléculaire et structurale. Équipe oncogenèse rétrovirale, Centre international de recherche en infectiologie, Inserm U1111 - CNRS UMR5308, École normale supérieure de Lyon, Lyon, France
Les interactions entre un hôte et les microorganismes qu’il héberge prennent la forme d’un continuum allant de la relation commensale à la symbiose ou au parasitisme. L’équilibre de la relation commensale peut parfois être rompu, lors d’une rupture des barrières immunitaires de l’hôte, ou quand l’essor de la virulence de l’espèce commensale la rend pathogène. Cette espèce commensale devient alors un pathogène opportuniste.
Parmi les pathogènes opportunistes bien connus, la bactérie Gram-positive Staphylococcus aureus ( S. aureus ) est une source majeure d’infections. S. aureus est présente au niveau de la peau et des voies respiratoires chez environ un tiers de la population humaine, chez des individus dits porteurs sains. S. aureus peut mettre en place des stratégies d’infection et d’échappement au système immunitaire très variées, ce qui la rend responsable d’infections très diverses, et en particulier d’infections nosocomiales [ 1 ].
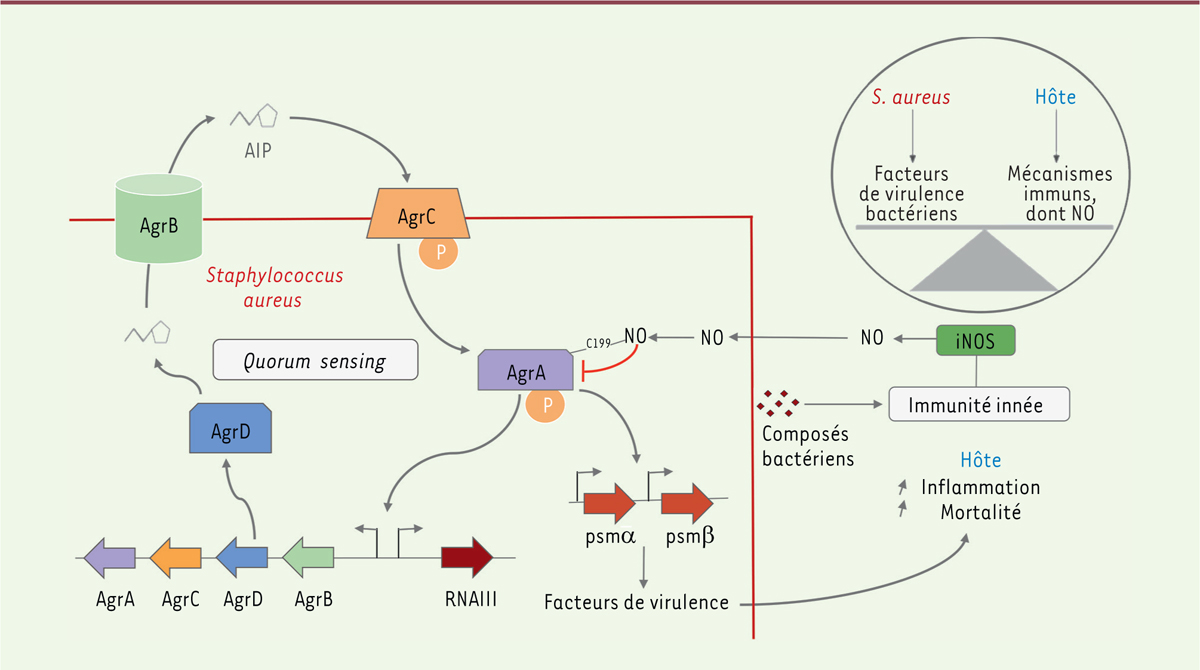
L’émergence des infections nosocomiales à staphylocoque constitue un enjeu scientifique et médical majeur, d’autant plus que certaines souches développent des résistances aux antibiotiques [ 2 ]. Des études ont démontré que le passage d’un état commensal à un état pathogène opportuniste chez S. aureus est modulé par le quorum sensing , une modalité de communication bactérienne permettant l’expression coordonnée des gènes à l’échelle de la population en fonction de sa densité. Ce système est fondé sur la détection de peptides sécrétés par les bactéries, dont la concentration extracellulaire est positivement corrélée à la densité bactérienne. La signalisation intracellulaire induite par la détection de ces peptides est responsable de leur propre production : ces peptides sont appelés « peptides auto-inducteurs » (AIP, pour auto-inducer peptides ). La détection de ces peptides induit également l’expression de facteurs de virulence. Ainsi, la virulence d’une souche initialement commensale peut être déclenchée lorsqu’une certaine densité bactérienne est atteinte. Chez S. aureus , l’opéron agr a été décrit comme le facteur central du quorum sensing , et le facteur de transcription AgrA, comme un activateur majeur des facteurs de virulence [ 3 ].
Maintenir une relation commensale implique que l’hôte assure un certain contrôle de ses commensaux, via des modalités de protection passives (barrières physiques, température, pH, etc.), ou via des mécanismes actifs modulés par le système immunitaire [ 4 ]. Parmi les armes de ce dernier, le monoxyde d’azote (NO, nitric oxide ), une petite molécule diffusible, est, chez les mammifères, un médiateur antibactérien et antiparasitaire bien connu [ 5 ]. Produit par l’enzyme iNOS ( inducible nitric oxide synthase ) en réponse à la perception de motifs microbiens, en particulier dans les cellules du système immunitaire inné, comme les macrophages [ 5 ], le NO peut altérer la fonctionnalité des protéines bactériennes, en se liant à leurs résidus cystéine (nitrosylation), ce qui perturbe la physiologie de la bactérie. L’effet pléiotrope du NO sur l’ensemble du métabolisme bactérien constitue ainsi un stress nitrosatif responsable de l’inhibition globale de la croissance bactérienne [ 6 , 7 ].
Cherchant à caractériser les multiples cibles bactériennes de la nitrosylation, Urbano et al. ont réalisé un crible par spectrométrie de masse de l’ensemble des protéines nitrosylées de S. aureus [ 8 ]. Parmi celles-ci, les auteurs soulignent la prédominance des enzymes à rôle métabolique, ce qui est cohérent avec l’effet bactériostatique du NO précédemment décrit. Mais la nouveauté ici est l’identification, parmi les protéines nitrosylées au niveau de leurs sites fonctionnels, du facteur de transcription AgrA, fondamental au quorum sensing . Cette observation les a conduits à émettre l’hypothèse que le NO, en plus de ses effets bactériostatiques, pourrait également interférer directement avec le quorum sensing , et donc jouer un rôle crucial dans la régulation de la virulence de S. aureus . C’est cette hypothèse que les auteurs s’attachent à démontrer dans cette étude.