| |
| Med Sci (Paris). 36(11): 973–976. doi: 10.1051/medsci/2020179.Effet neuroprotecteur du lactate dans l’hypoxie-ischémie cérébrale néonatale Hélène Roumes,1 Luc Pellerin,2 and Anne-Karine Bouzier-Sore1a 1CRMSB, UMR5534, CNRS/Université de Bordeaux
,
146 rue Léo-Saignat
,
33076Bordeaux cedex
,
France
.
2IRTOMIT (Ischémie reperfusion en transplantation d’organes, mécanismes et innovations thérapeutiques), Inserm U1082, CHU de Poitiers
,
2 rue de la Milétrie
,
86021Poitiers cedex
,
France
.
MeSH keywords: Animaux, Animaux nouveau-nés, Encéphale, Modèles animaux de maladie humaine, Métabolisme énergétique, Humains, Hypoxie-ischémie du cerveau, Nouveau-né, Acide lactique, Neurones, Neuroprotecteurs, effets des médicaments et substances chimiques, métabolisme, anatomopathologie, congénital, prévention et contrôle, pharmacologie |
Le cerveau : un organe énergivore
Le cerveau est considéré comme l’organe le plus actif d’un point de vue métabolique. En effet, les besoins énergétiques du cerveau sont considérables : alors qu’il ne représente que 2 % de la masse totale du corps humain, sa consommation en oxygène et glucose est d’environ 20 %, soit dix fois plus que la valeur prédictive calculée sur la base de sa masse [
1
]. Un décalage similaire est observé pour le flux sanguin cérébral : plus de 10 % du débit cardiaque est dirigé vers le système nerveux central. En plus de ces aspects quantitatifs, le métabolisme cérébral a la particularité d’être différent en fonction de la zone cérébrale. Au niveau macroscopique, cette variation régionale se manifeste de façon importante entre la substance blanche et la substance grise. De façon beaucoup plus fine, les changements spatio-temporels liés à l’activité synaptique entraînent également des variations. La notion d’un couplage entre métabolisme, flux sanguin et activité cérébrale est un des fondements de la physiologie du système nerveux central. Elle apparaît très tôt, dès la fin du
xix
e
siècle, lorsque Sherrington propose une relation entre débit sanguin, approvisionnement énergétique et activité neuronale en affirmant «
… the brain possesses an intrinsic mechanism by which its vascular supply can be varied locally in correspondence with local variations of functional activity
» [
2
]. Plus récemment, dans les années 1970 et 1980, les travaux de Louis Sokoloff mettent clairement en évidence un couplage entre activité neuronale et métabolisme du glucose, grâce à l’utilisation du 2-désoxyglucose (DG) et du 18-fluoro-DG [
3
]. Cette notion d’une relation étroite entre activité neuronale, flux sanguin et métabolisme a été le fondement des techniques d’imagerie fonctionnelle qui sont maintenant couramment utilisées par les neuroscientifiques et les cliniciens [
4
]. Désormais, les changements locaux de l’utilisation de glucose, du flux sanguin et de la consommation d’oxygène, pour la tomographie à émission de positons (TEP), ou la variation locale du niveau d’oxygénation de l’hémoglobine, pour l’imagerie par résonance magnétique (IRM) fonctionnelle (appelée effet BOLD pour
blood oxygen-level-dependent
), sont les paramètres utilisés pour détecter une activation neuronale.
Cependant, bien que le glucose sanguin soit le substrat principal du système nerveux central chez l’adulte, le lien direct entre sa consommation et l’activation neuronale est loin d’être entièrement élucidé. Si on quitte l’échelle des aires cérébrales pour passer à l’échelle cellulaire, on est d’emblée frappé par l’agencement particulièrement intriqué des différents types cellulaires du système nerveux central : les neurones, bien entendu, mais également les différents types de cellules gliales (astrocytes, oligodendrocytes, cellules microgliales), étroitement associées aux neurones. La proportion de dix astrocytes pour un neurone a récemment été remise en question comme étant surévaluée : cette proportion serait de 1:1 dans le cortex cérébral [
5
]. Les astrocytes présentent des prolongements cellulaires terminés par des « pieds » en contact étroit avec les neurones d’une part, et avec les capillaires sanguins d’autre part, formant ainsi une zone privilégiée de capture et d’échanges de métabolites interposée entre les cellules vasculaires endothéliales et les neurones [
6
]. Après avoir longtemps pensé que les astrocytes n’avaient qu’un rôle passif de soutien du tissu nerveux, on sait désormais qu’ils possèdent des fonctions essentielles à la fois dans le développement et le fonctionnement cérébral. Dès 1886, Golgi proposa, à la vue de cet agencement particulier des astrocytes, qu’ils puissent avoir un rôle dans l’acheminement des substrats métaboliques du sang vers les neurones [
7
]. En effet, leur localisation privilégiée les prédispose tout naturellement à un rôle de contrôle métabolique, ce qui a d’ailleurs été suggéré dès la fin du XIX
e
siècle par Andriezen [
8
] et Holmgren [
9
], puis repris en 1958 par Tschirgi [
10
] et en 1969 par Henri Laborit [
11
].
|
Astrocyte-neurone : un couple métabolique soudé
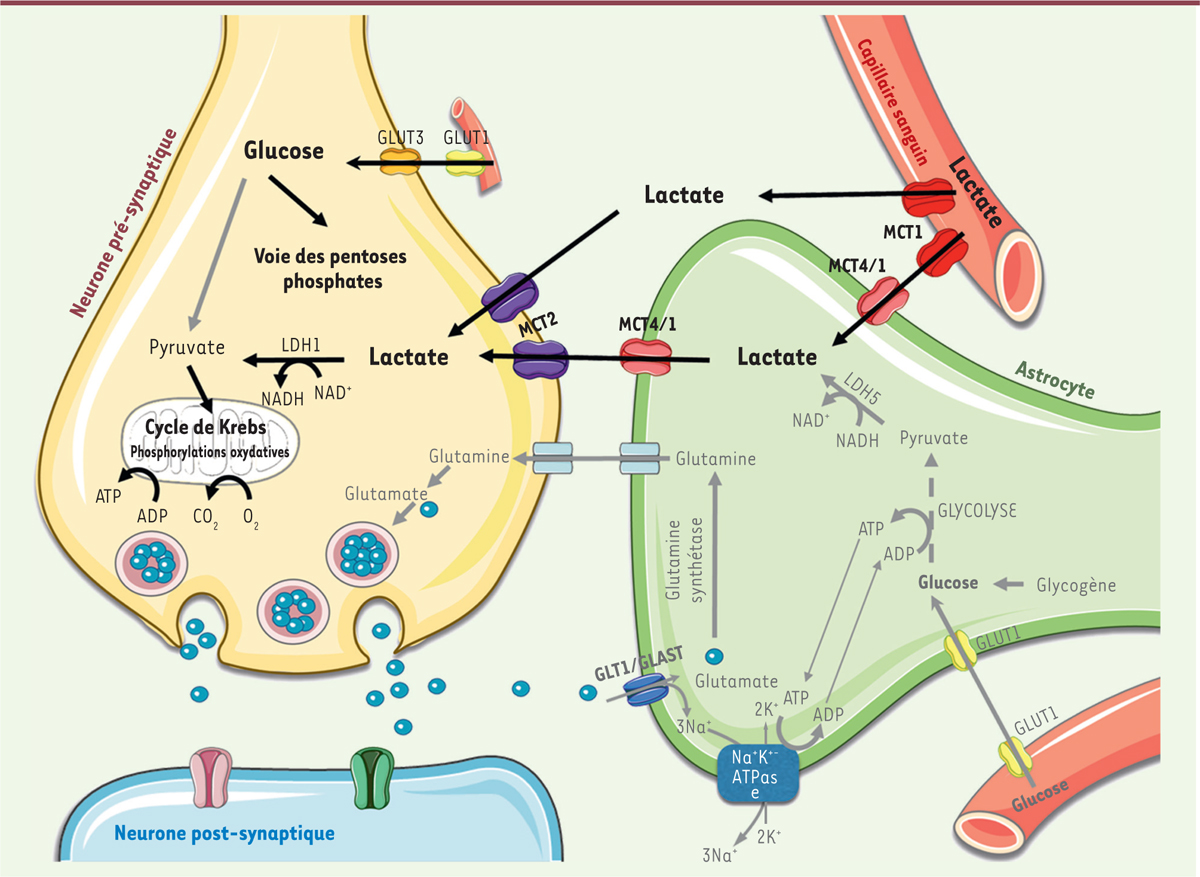
En 1994, une avancée essentielle s’est produite avec la proposition de l’existence d’une navette de lactate entre neurones et astrocytes (
astrocyte-neuron lactate shuttle hypothesis,
ANLSH) [
12
]
(
Figure 1
)
. L’hypothèse est que lors de l’activation cérébrale, le glutamate libéré en tant que neurotransmetteur est capturé par l’astrocyte voisin par un transporteur dépendant du sodium (Na
+
). L’entrée de Na
+
accompagnant le glutamate entraîne alors l’activation de la Na
+
/K
+
ATPase afin de rétablir l’équilibre ionique. L’activation de cette pompe consomme de l’ATP, qui sera régénéré par la glycolyse transformant le glucose en pyruvate. Le pyruvate est ensuite converti en lactate, exporté par l’astrocyte et transféré aux neurones via des transporteurs des acides monocarboxyliques (MCT) [
13
]. Le lactate est finalement utilisé par les neurones comme substrat énergétique. Depuis 1994, notre équipe a cherché à confirmer expérimentalement l’existence d’un tel couplage métabolique entre neurones et astrocytes
in vivo
et à en déterminer les modalités [
14
].
 | Figure 1.
Mécanisme proposé de l’effet neuroprotecteur du lactate administré au nouveau-né fondé sur les échanges métaboliques entre astrocytes et neurones.
La navette lactate entre astrocyte et neurone est représentée en grisé : lors de l’activation cérébrale, le glutamate libéré dans la fente synaptique est recapturé par l’astrocyte (GLT1 ou GLAST, co-transport glutamate/Na
+
). Les ions Na
+
sont ensuite expulsés de la cellule par la Na
+
/K
+
ATPase, qui consomme de l’ATP, ce qui va activer la glycolyse astrocytaire et la production de lactate. Ce lactate sera par la suite sécrété par l’astrocyte et capté par le neurone, grâce à des transporteurs spécifiques (MCT1/4 astrocytaires et MCT2 neuronal), pour y être métabolisé. Bien que ce couplage métabolique entre astrocytes et neurones reste controversé, de plus en plus d’études indiquent que le lactate produit par les astrocytes à partir du glucose sanguin constituerait un très bon substrat énergétique pour les neurones. Après un accident d’hypoxie-ischémie, le lactate administré en perfusion servirait ainsi de substrat énergétique aux neurones. Le glucose serait alors « économisé », et serait dégradé dans la voie des pentoses phosphates plutôt qu’à travers la glycolyse, ce qui permettrait de lutter de façon plus efficace contre les espèces réactives oxygénées (ROS), alors produites en abondance et très délétères pour les neurones.
MCT 1 : monocarboxylate transporter type 1 ; MCT 2 : monocarboxylate transporter type 2 ; MCT 4 : monocarboxylate transporter type 4 ; GLT1 : glial glutamate transporter 1 ; GLAST : glial glutamate/aspartate transporter ; LDH1 : lactate dehydrogenase type 1 ; LDH5 : lactate dehydrogenase type 5 ; GLUT1 : glucose transporter type 1 ; GLUT3 : glucose transporter type 3.
|
|
Le lactate : un substrat énergétique pour les neurones, et plus encore…
Une question se pose alors. Si le lactate est un substrat énergétique essentiel pour les neurones, pourrait-il en plus avoir un rôle neuroprotecteur après un accident ischémique au cours duquel le cerveau est privé d’oxygène et de glucose ? Sachant que la perfusion de glucose après un accident vasculaire cérébral est délétère [
15
] et que le métabolisme cérébral du nouveau-né diffère de celui de l’adulte [
16
] (adaptation nécessaire pour la lactation : consommation plus grande de corps cétoniques, augmentation de l’expression des MCT, etc.), nous avons voulu évaluer si la perfusion de lactate après un accident d’hypoxie-ischémie néonatal permettrait de réduire les lésions cérébrales. L’hypoxie-ischémie néonatale (2 cas pour 1 000 naissances) est une cause majeure de mortalité périnatale et de handicap persistant. Aucun traitement médicamenteux n’existe à l’heure actuelle. Le seul traitement est l’hypothermie modérée, mais près d’un nouveau-né sur deux n’y répond pas favorablement [
17
].
Dans un premier temps, le lactate a été injecté soit avant, soit après un accident d’hypoxie-ischémie chez le raton. Les résultats obtenus indiquent une neuroprotection plus efficace lorsque le lactate est administré après l’accident d’hypoxie-ischémie, ouvrant ainsi une voie thérapeutique encourageante [
18
]. Dans un second temps, les effets d’injections de glucose, pyruvate, et lactate ont été comparés (une seule injection après l’accident d’hypoxie-ischémie). Parmi ces substrats énergétiques, seule l’injection de lactate a entraîné une réduction de la taille des lésions cérébrales évaluées par une IRM effectuée 3 heures après l’accident d’hypoxie-ischémie. Afin de confirmer que l’effet neuroprotecteur du lactate était lié à son utilisation métabolique, nous avons co-injecté du lactate et de l’oxamate, un inhibiteur de la lactate déshydrogénase (LDH), bloquant ainsi son utilisation métabolique. Dans ces conditions, la neuroprotection est complètement perdue. Les lésions cérébrales étaient même plus importantes que chez les ratons témoins non-traités, suggérant un effet protecteur de l’utilisation métabolique du lactate endogène [
18
].
Un suivi longitudinal de ces animaux, à la fois par IRM, pour déterminer la taille des lésions et leur évolution dans le temps, et par des tests comportementaux, pour évaluer les capacités motrices et cognitives de ces ratons, a montré que le meilleur résultat thérapeutique est obtenu après trois injections de lactate (une injection par jour pendant trois jours). Les ratons présentaient une diminution des volumes lésionnels et une préservation de leurs fonctions cognitivo-motrices, à court terme et à long terme [
18
]. Le suivi par IRM a également permis de déterminer que l’œdème cérébral provoqué par l’accident d’hypoxie-ischémie était réduit par ce traitement (mesures par IRM de diffusion) [
18
].
L’hypothèse pour expliquer cet effet neuroprotecteur du lactate administré après l’accident d’hypoxie-ischémie est qu’il est utilisé comme substrat énergétique neuronal après avoir été transformé en pyruvate par la LDH. Le pyruvate entre alors dans le cycle de Krebs, et sa dégradation permettra la synthèse d’ATP. Quant au glucose, il sera préférentiellement utilisé dans la voie des pentoses phosphates : en effet, la conversion du lactate en pyruvate entraîne la formation de NADH, ce qui ne favorisera pas l’entrée du glucose dans la glycolyse car celle-ci nécessite du NAD
+
. Une telle utilisation du glucose produit du NADPH, cofacteur de la glutathion réductase, et permet donc de maintenir un pool élevé de glutathion sous sa forme réduite, un métabolite essentiel pour lutter contre les espèces réactives oxygénées produites en grande quantité lors de l’ischémie cérébrale et très délétères pour les neurones
(
Figure 1
)
.
|
Longtemps considéré comme un métabolite « poubelle », le lactate commence à être réhabilité. Situé au carrefour entre métabolismes glycolytique et oxydatif, sa production ou sa consommation par la LDH, enzyme catalysant une réaction réversible, entraîne une modification du rapport NAD
+
/NADH, et donc du potentiel d’oxydo-réduction de la cellule, qui contrôle de nombreuses réactions enzymatiques. L’administration de lactate est déjà testée en clinique comme thérapie après un traumatisme crânien chez l’adulte [
19
]. Le métabolisme cérébral particulier des nouveau-nés, mieux équipés, d’un point de vue biochimique, que les adultes pour l’utilisation cérébrale du lactate, et les résultats prometteurs obtenus sur le modèle d’hypoxie-ischémie néonatale chez le rongeur, sont deux arguments de poids qui encouragent à poursuivre les recherches sur l’effet neuroprotecteur du lactate. La prochaine étape sera de valider l’efficacité de cette thérapie chez le gros animal, avant d’envisager son utilisation chez le nouveau-né humain.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Magistretti
P.
,
Zigmond
M
,
Bloom
FE
,
Landis
S
,
Roberts
J
,
Squire
L
.
Brain energy metabolism.
.
Fundamental neuroscience.
1999
;
San Diego:
:
Academic Press;
:389.
–
413
.
2.
Roy
CS
,
Sherrington
CS
.
On the regulation of the blood-supply of the brain.
.
J Physiol.
1890;
;
11
:
(85–158)
:17.
.
3.
Sokoloff
L
,
Reivich
M
,
Kennedy
C
,
et al.
The [
14
C]deoxyglucose method for the measurement of local cerebral glucose utilization: theory, procedure, and normal values in the conscious and anesthetized albino rat
.
.
J Neurochem.
1977;
;
28
:
:897.
–
916
.
4.
Mazziotta
JC
.
Imaging: window on the brain.
.
Arch Neurol.
2000;
;
57
:
:1413.
–
1421
.
5.
Herculano-Houzel
S.
.
The glia/neuron ratio: how it varies uniformly across brain structures and species and what that means for brain physiology and evolution.
.
Glia.
2014;
;
62
:
:1377.
–
1391
.
6.
Kacem
K
,
Lacombe
P
,
Seylaz
J
,
Bonvento
G
.
Structural organization of the perivascular astrocyte endfeet and their relationship with the endothelial glucose transporter: a confocal microscopy study.
.
Glia.
1998;
;
23
:
:1.
–
10
.
7.
Golgi
C
.
Sulla fina anatomia degli organi centrali del sistema nervosa.
. In:
Hoepli;
(ed).
Milano:
1886;
:
154
.
8.
Andriezen
WL
.
On a system of fibre-like cells surrounding the blood vessels of the brain of man and mammals, and its physiological significance.
.
Int Monatsschr Anat Physiol.
1893;
;
10
:
:532.
–
540
.
9.
Holmgren
E.
.
Beiträge zur morphologie der zelle.
.
I. Nervenzellen. Anatomische Hefte.
1901;
;
18
:
:267.
–
325
.
10.
Tschirgi
RD
,
Taylor
JL
.
Slowly changing bioelectric potentials associated with the blood-brain barrier.
.
Am J Physiol.
1958;
;
195
:
:7.
–
22
.
11.
Laborit
H.
Neurophysiologie : aspects métaboliques et pharmacologiques.
1969
;
Paris:
:
Masson;
12.
Pellerin
L
,
Magistretti
PJ
.
Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization.
.
Proc Natl Acad Sci USA.
1994;
;
91
:
:10625.
–
10629
.
13.
Pellerin
L
,
Bergersen
LH
,
Halestrap
AP
,
Pierre
K
.
Cellular and subcellular distribution of monocarboxylate transporters in cultured brain cells and in the adult brain.
.
J Neurosci Res.
2005;
;
79
:
:55.
–
64
.
14.
Mazuel
L
,
Blanc
J
,
Repond
C
,
et al.
A neuronal MCT2 knockdown in the rat somatosensory cortex reduces both the NMR lactate signal and the BOLD response during whisker stimulation.
.
PLoS One.
2017;
;
12
:
:e0174990.
.
15.
Gentile
NT
,
Seftchick
MW
,
Huynh
T
,
et al.
Decreased mortality by normalizing blood glucose after acute ischemic stroke.
.
Acad Emerg Med.
2006;
;
13
:
:174.
–
180
.
16.
Vannucci
SJ
,
Vannucci
RC
,
Cowett
RM
.
Brain metabolism in the fetus and neonate.
.
Principles of perinatal-neonatal metabolism.
1998
;
New york:
:
Springer;
:537.
–
550
.
17.
Davidson
JO
,
Wassink
G
,
van den Heuij
LG
,
et al.
Therapeutic hypothermia for neonatal hypoxic-ischemic encephalopathy - Where to from here?
.
Front Neurol.
2015;
;
6
:
:198.
.
18.
Roumes
H
,
Dumont
U
,
Sanchez
S
,
et al.
Neuroprotective role of lactate in rat neonatal hypoxia-ischemia.
.
J Cereb Blood Flow Metab.
2020
:
:271678X20908355.
.
19.
Quintard
H
,
Patet
C
,
Zerlauth
JB
,
et al.
Improvement of neuroenergetics by hypertonic lactate therapy in patients with traumatic brain injury is dependent on baseline cerebral lactate/pyruvate ratio.
.
J Neurotrauma.
2016;
;
33
:
:681.
–
687
.
|