| |
| Med Sci (Paris). 36(10): 935–938. doi: 10.1051/medsci/2020165.Les ARN circulaires, acteurs et biomarqueurs dans le cancer Julien Ladet1* and Franck Mortreux2** 1Master Biologie Moléculaire et Cellulaire M2, Parcours Génétique de la Cellule et Pathologie (Génopath), Université Claude Bernard Lyon 1, Université de Lyon
,
France
.
2Laboratoire de biologie et modélisation de la cellule, ENS Lyon, Université Claude Bernard Lyon 1, CNRS UMR5239, Inserm U1210
,
France
.
|
L’actualité scientifique vue par les étudiants du Master Biologie Moléculaire et Cellulaire – Parcours M2 Génopath – Université Claude Bernard Lyon 1
Équipe pédagogique
Beatrice Horard (Maître de conférence, Université Claude Bernard Lyon 1) beatrice.horard@univ-lyon1.fr
Ludivine Walter (Maître de conférence, Université Claude Bernard Lyon 1) ludivine.walter@univ-lyon1.fr
Tuteurs
Tuteur J. L. : Franck Mortreux (franck.mortreux@ens-lyon.fr), LBMC/UMR5239 CNRS/ENS Lyon/UCB Lyon1
Tuteur L. M. : Jean-François Nicolas (jean-francois.nicolas@chu-lyon.fr), CIRI/Inserm U1111/Université Claude Bernard Lyon 1/Hôpitaux de Lyon
Tutrice M. S. : Florence Solari (florence.solari@univ-lyon1.fr), INMG/CNRS UMR 5310/Inserm U1217/Université Claude Bernard Lyon 1/Faculté de médecine et de pharmacie
Série coordonnée par Sophie Sibéril.
L’épissage alternatif des ARN est au cœur de la diversité du transcriptome et du protéome. Il permet de produire différents transcrits à partir d’un gène unique en joignant alternativement les exons au fil de l’élongation transcriptionnelle [
1
]. Près de la totalité des gènes humains sont concernés par ce mécanisme. Cependant, plus rarement, l’épissage peut s’effectuer de façon rétrograde générant une forme circulaire d’ARN (circRNA)
(
Figure 1
)
[
2
]. Les circRNA sont peu abondants comparés à leurs contreparties linéaires, néanmoins leurs profils d’expression apparaissent spécifiques de certains tissus sains mais également de certaines situations pathologiques, comme le cancer [2-4]. Leurs fonctions dans les processus oncogéniques restent encore mal comprises et sont au cœur des recherches biomédicales actuelles.
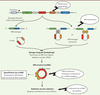 | Figure 1.
Biogenèse des ARN circulaires et développement d’outils cliniques.
L’épissage rétrograde est à l’origine de la circularisation des ARN et est favorisé par des éléments tels que les séquences Alu (IRAlu) et des protéines de liaison à l’ARN (RBP). De la même manière, le lariat peut subir un second évènement d’épissage générant un ARN circulaire (circRNA). Ces ARN circulaires peuvent agir comme des éponges à miRNA et RBP et réguler leur activité sur d’autres transcrits linéaires. Les différentes étapes de biogenèse et d’activité des circRNA sont utilisées pour le développement d’outils cliniques incluant l’analyse de biomarqueurs (cadre blanc) et le ciblage de l’expression des circRNA en thérapie (cercles blancs).
|
|
Biogenèse et propriétés des ARN circulaires Biogenèse des ARN circulaires
La biogenèse des circRNA repose sur 2 modèles principaux de circularisation des ARN. Le premier propose qu’à partir de l’ARN pré-messager (pré-ARNm), la formation d’une structure en boucle facilite un évènement d’épissage entre la partie 3’ de l’exon en aval et la partie 5’ de l’exon en amont aboutissant à la circularisation de l’ARN [
2
,
3
]
(
Figure 1
)
. La longueur des introns et la présence d’éléments répétés inversés, tels que des séquences Alu (IRAlu), sont définies comme des critères majeurs de la biogenèse des circRNA. La dimérisation de protéines de liaison à l’ARN (
RNA-binding protein,
RBP
)
, telles que MBL (
Muscle-Blind
) et QKI (QuaKIng), facilite la formation des circRNA en favorisant le rapprochement des sites d’épissage
(
Figure 1
)
[
2
,
3
]. Le second modèle est proposé à partir d’un produit d’épissage conventionnel, le lariat, qui contient sous une forme circularisée les séquences excisées du pré-mRNA. Longtemps considéré comme un ARN circulaire non fonctionnel, le lariat peut en réalité subir un second évènement d’épissage des introns et des exons embarqués, et former un ARN circulaire fonctionnel
(
Figure 1
)
[
2
,
3
]. On distingue ainsi plusieurs types de circRNA, pouvant être composés d’introns (ciRNA), d’un ou plusieurs exons (circRNA exoniques), ou d’introns et d’exons (EIciRNA).
Principales fonctions des ARN circulaires
Les circRNA sont impliqués dans la régulation de l’expression des gènes. Leur expression impacte par compétition l’expression de leurs contreparties linéaires [
3
]. Par ailleurs, certains circRNA peuvent agir comme des « éponges » à microARN et/ou à RBP, et ainsi moduler indirectement l’action de ces derniers sur les transcrits linéaires [
3
]. Les circRNA peuvent aussi promouvoir la formation de complexes protéiques en agissant comme plateforme de recrutement [
3
]. Certains circRNA, comme par exemple le FECR1
(FLI1 exonic circular RNA 1)
, ont la capacité de fixer certains promoteurs et de recruter des facteurs de transcription, facilitant ainsi l’activation transcriptionnelle [
3
]. Enfin, une minorité de circRNA comportent un cadre ouvert de lecture permettant la synthèse de nouveaux peptides ou de protéines, dont certains sont impliqués dans des perturbations majeures des fonctions cellulaires [
3
].
|
Les ARN circulaires dans le développement des cancers
Les récentes avancées technologiques en biologie moléculaire et en bio-informatique ont permis d’améliorer la détection des circRNA et d’explorer leur niveau d’expression dans les tumeurs. Une étude récente de 17 types de tumeurs montre que la plupart des circRNA sont réprimés dans les cancers. Néanmoins, certains circRNA peuvent être au contraire surexprimés dans les cancers [
5
]. Les mécanismes moléculaires qui sous-tendent ces modifications d’expression sont encore mal compris. Les perturbations d’expression des circRNA peuvent aboutir à des dérégulations de mécanismes post-transcriptionnels qui participent aux processus oncogéniques [
4
]. Par exemple, il a été décrit que le circRNA circPLEKHM3, issu de la circularisation de l’exon 3 du gène PLEKHM3 (
Pleckstrin homology domain containing M3
), agit comme un suppresseur de tumeurs en séquestrant le miRNA miR-9 [
6
]. Dans le cancer de l’ovaire, il a été montré que la répression de l’expression de circPLEKHM3 conduit à lever cette séquestration de miR-9. Ce miRNA inhibe en retour la traduction de ses ARN cibles
(BRCA1, DNAJB6 et KLF4)
impliqués dans le contrôle de la croissance et de la migration cellulaire et favorise la transition épithélio-mésenchymateuse [
6
]. A l’opposé, il a été observé dans les cancers colorectaux que la surexpression du circRNA circHIPK3 issu de la circularisation de l’exon 2 du gène HIPK3 (
homeodomain-interacting protein kinase 3
) est associée à l’activation du facteur de transcription c-Myb [
7
]. CircHIKP3 agit comme un oncogène en séquestrant le suppresseur de tumeur miR-7 et en favorisant l’expression des transcrits FAK (
focal adhesion kinase
) et IGF1R (
insulin-like growth factor 1 receptor
) [
7
]. L’expression de circHIPK3 a été associée à une inhibition de l’apoptose, une intense prolifération tumorale, et un risque accru de métastases dans le cancer colorectal [
7
]. Ensemble, ces exemples témoignent des effets pro- ou anti-tumoraux de la dérégulation des circRNA ; cependant, le rôle exact des circRNA dans les processus précoces de l’oncogenèse n’est pas clairement établi à ce jour.
|
Les ARN circulaires comme outils cliniques Les circRNA comme biomarqueurs
Outre ces aspects fonctionnels qui permettent de comprendre la contribution des circRNA dans le développement des cancers, les profils d’expression de certains circRNA constituent des signatures moléculaires des tumeurs et sont utilisés dans le développement d’outils cliniques. Les circRNA présentent par ailleurs un intérêt particulier car ils sont résistants aux exonucléases et, par conséquent, plus stables que leurs contreparties linéaires [
8
]. Ces propriétés permettent notamment la recherche de biomarqueurs dans le sang sans avoir recours aux pratiques cliniques invasives [
5
,
8
]. Ainsi, dans les cancers gastriques, la répression de l’expression de circ_002059 permet de distinguer le tissu cancéreux de la muqueuse normale. La détection du circ_002059 dans le plasma permet d’évaluer l’efficacité de la résection gastrique [
8
]. Certains circRNA constituent également des marqueurs pronostiques. Par exemple, la faible expression du circPLEKHM3 a été identifiée comme un marqueur de mauvais pronostic dans le cancer de l’ovaire [
6
]. La répression de circPLEKHM3 induirait l’activation d’AKT1 et une résistance aux traitements anti-AKT [
6
]. Dans ce contexte, un des enjeux de la recherche actuelle est de définir des profils d’expression de circRNA spécifiques de la pathologie et de son stade d’évolution [
6
].
Les circRNA comme cibles ou outils thérapeutiques
D’autres applications cliniques concernent l’utilisation des circRNA en thérapie anti-tumorale. On distingue aujourd’hui deux grandes approches incluant le ciblage des circRNA endogènes ou encore l’utilisation de circRNA de synthèse
(
Figure 1
)
. Les stratégies de ciblage visent notamment à réprimer l’expression de circRNA oncogènes. Les méthodes reposent sur des modifications épigénétiques des histones pouvant moduler l’expression des transcrits et l’épissage des circRNA. De multiples régulateurs épigénétiques, tels que DNMT3B
(DNA [cytosine-5]-methyltransferase 3B
), sont capables de modifier les marques épigénétiques dans les gènes et de favoriser l’expression de la contrepartie linéaire au détriment de la forme circulaire [
3
]. Cette approche reste néanmoins peu spécifique en raison de ses effets sur l’environnement épigénétique global.
D’autres stratégies plus ciblées reposent sur des régulations post-transcriptionnelles par ARN interférence (RNAi) utilisant des oligonucléotides spécifiques des circRNA, ou encore via l’utilisation de variants CRISP-Cas9/Cas13 ciblant les sites d’épissages « rétrogrades ». Ces approches ont permis la déplétion
in vivo
de circHIPK3 et circFoxo3 [
9
,
10
]. Pour les circRNA suppresseurs de tumeurs, les stratégies en cours d’études visent à moduler positivement leur expression par des modifications épigénétiques. De plus, des approches de thérapie génique, utilisant des cassettes à ADN conduisant à l’expression de circRNA endogènes, peuvent permettre de restaurer leur expression, par transgénèses ciblées, afin de contrôler les phénomènes de tumorigenèse [
10
].
Enfin, des circRNA de synthèse sont étudiés pour moduler spécifiquement l’activité des miRNA ou des RBP impliqués dans le développement tumoral, ou encore permettre l’expression de peptides [
9
,
10
]. Ces vecteurs peuvent cibler directement des fonctions oncogènes ou pathologiques. Dans ce contexte, une étude récente a montré la capacité d’un circRNA de synthèse à séquestrer et inhiber efficacement le miR-122 cible, un microARN favorisant la traduction du virus de l’hépatite C humaine (HCV)
in vitro
[
9
].
|
Les progrès récents de la recherche sur les circRNA ont permis de découvrir les mécanismes majeurs de la biogenèse et de la biologie de ceux-ci dans les tissus sains et tumoraux. De ces données, il apparait aujourd’hui que ces formes circulaires d’ARN sont d’un grand intérêt pour le développement d’outils cliniques incluant la définition de biomarqueurs, pouvant faciliter le diagnostic, le pronostic et le suivi des traitements, mais également des cibles ou des agents thérapeutiques. Cependant, les modes de régulation et les fonctions des circRNA restent encore mal caractérisés. Une meilleure compréhension des mécanismes moléculaires qui gouvernent la synthèse et l’activité des circRNA dans les situations physiologiques et pathologiques est nécessaire pour améliorer à l’avenir leurs utilisations dans le domaine biomédical. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Song
X
,
Zeng
Z
,
Wei
H
,
et al.
Alternative splicing in cancers: from aberrant regulation to new therapeutics.
.
Semin Cell Dev Biol.
2018;
;
75
:
:13.
–
22
.
2.
Chen
LL
.
The biogenesis and emerging roles of circular RNAs.
.
Nat Rev Mol Cell Biol.
2016;
;
17
:
:205.
–
211
.
3.
Kristensen
LS
,
Andersen
MS
,
Stagsted
LVW
,
et al.
The biogenesis, biology and characterization of circular RNAs.
.
Nat Rev Genet.
2019;
;
20
:
:675.
–
691
.
4.
Zhang
Z
,
Xie
Q
,
He
D
,
et al.
Circular RNA: new star, new hope in cancer.
.
BMC Cancer.
2018;
;
18
:
:834.
.
5.
Vo
JN
,
Cieslik
M
,
Zhang
Y
,
et al.
The landscape of circular RNA in cancer.
.
Cell.
2019;
;
176
:
:869.
–
881
.
6.
Zhang
L
,
Zhou
Q
,
Qiu
Q
,
et al.
CircPLEKHM3 acts as a tumor suppressor through regulation of the miR-9/BRCA1/DNAJB6/KLF4/AKT1 axis in ovarian cancer.
.
Mol Cancer.
2019;
;
18
:
:1.
–
19
.
7.
Zeng
K
,
Chen
X
,
Xu
M
,
et al.
CircHIPK3 promotes colorectal cancer growth and metastasis by sponging miR-7.
.
Cell Death Dis.
2018;
;
9
.
8.
Zhang
Z
,
Yang
T
,
Xiao
J
.
Circular RNAs: promising biomarkers for human diseases.
.
EBioMedicine.
2018;
;
34
:
:267.
–
274
.
9.
Holdt
LM
,
Kohlmaier
A
,
Teupser
D
.
Circular RNAs as therapeutic agents and targets.
.
Front Physiol.
2018;
;
9
:
:1262.
.
10.
Kristensen
,
Hansen
TB
,
Venø
MT
,
et al.
Circular RNAs in cancer: opportunities and challenges in the field.
.
Oncogene.
2018;
;
37
:
:555.
–
65
.
|