| |
| Med Sci (Paris). 36(10): 893–899. doi: 10.1051/medsci/2020160.Les anti-TNF-α pour le traitement des uvéites non infectieuses Florence Hoogewoud,1,2 Laura Kowalczuk,2,3 Elodie Bousquet,1,3 Antoine Brézin,1,3 Elodie Touchard,4 Ronald Buggage,4 Thierry Bordet,4 and Francine Behar-Cohen1,3* 1Ophtalmopole Hôpital Cochin; Assistance Publique-Hôpitaux de Paris; Université de Paris
,
27 rue du Faubourg Saint-Jacques
,
75014Paris
,
France 2Département d’ophtalmologie de l’université de Lausanne, Hôpital Ophtalmologique Jules-Gonin
,
Lausanne
,
Suisse 3Centre de recherches des Cordeliers; Inserm UMR 1138, Physiopathologie des maladies oculaires : innovations thérapeutiques; Université de Paris
,
15 rue de l’École de Médecine
,
75006Paris
,
France 4Eyevensys, SAS
,
Paris
,
France |
Les uvéites : traiter l’inflammation pour préserver la vision
Les uvéites sont un groupe de maladies inflammatoires intraoculaires touchant les différentes parties de l’uvée (iris, corps ciliaire, choroïde) et, par extension, la rétine et le vitré. Les uvéites représentent près de 10 % des cas de cécité évitables dans les pays industrialisés [
1
,
2
]. Leurs causes sont multiples. Elles peuvent être secondaires à des infections, être une manifestation de maladies auto-immunes non spécifiques d’organes, ou résulter d’une auto-immunité dirigée contre un antigène rétinien, ou encore être idiopathique. L’inflammation, quelle qu’en soit l’étiologie, altère la vision et menace l’intégrité des tissus oculaires et donc la récupération fonctionnelle. Lors de la phase aiguë de la maladie, la présence de cellules et de protéines réduit la transparence des milieux oculaires, et l’œdème maculaire perturbe la vision centrale
(
Figure 1
)
[
3
]. À ce stade, le traitement de l’inflammation permet de restaurer la vision. Mais cette inflammation, en particulier si elle est chronique, peut détruire les cellules visuelles et induire des cicatrices gliales et néovasculaires, cause de pertes fonctionnelles définitives. Préserver la transparence et l’intégrité des milieux et des tissus oculaires est donc une urgence. Les traitement anti-inflammatoires et immunosuppresseurs sont essentiels et sont souvent associés à des traitements anti-infectieux spécifiques, quand un agent causal infectieux est identifié. Les corticoïdes ont été utilisés depuis des décennies par voie générale, mais aussi par voie loco-régionale, en injection péri-oculaire, pour augmenter la biodisponibilité intraoculaire qui reste limitée quand les barrières oculaires sont restaurées. Plus récemment, des implants biodégradables libérant localement des glucocorticoïdes ont été approuvés pour le traitement des uvéites non infectieuses [
4
]. Ils améliorent leur biodisponibilité oculaire et limitent leurs effets secondaires généraux, mais n’épargnent pas des effets secondaires oculaires, tels que la cataracte et les hypertonies, parfois sévères. Les immunosuppresseurs et anti-métabolites sont administrés par voie générale. Les biothérapies, et notamment les thérapies anti-TNF-α, qui bloquent le TNF-α (
tumor necrosis factor alpha
), ont d’abord été utilisées hors autorisation de mise sur le marché (AMM). L’adalimumab (Humira
®
,
Abbvie
, États-Unis) administré par voie intraveineuse ou par voie générale, a été approuvé récemment pour le traitement des uvéites non infectieuses, élargissant ainsi l’arsenal thérapeutique.
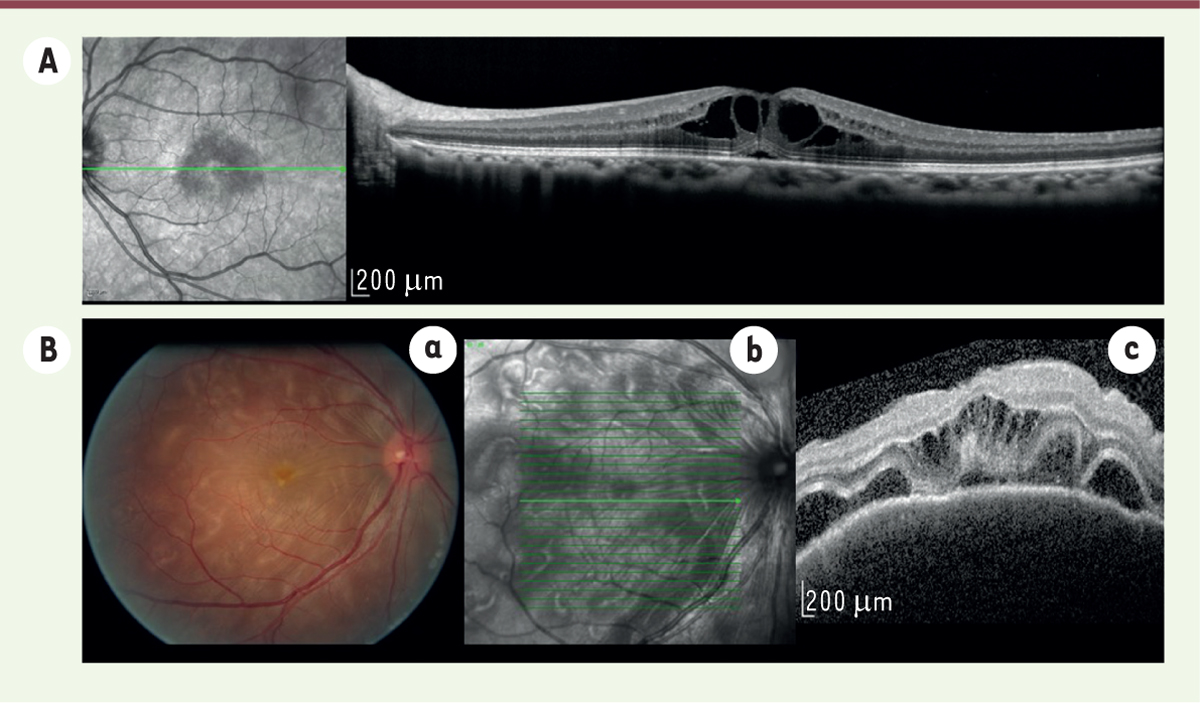
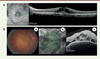 | Figure 1.
A.
Image infrarouge et OCT (
optical coherence tomography
, Spectralis, Heidelberg, Allemagne) d’un œdème maculaire cystoïde.
B. a.
Photo du fond d’œil (Megaplus model 1.4 digital, Canon, San Diego, États-Unis).
b et c
: image infrarouge et OCT d’un patient présentant un syndrome de Vogt-Koyanagi-Harada. Présence de décollement séreux rétinien et d’œdème maculaire cystoïde.
|
|
Le rôle du TNF-α dans l’inflammation oculaire
Le TNF-α, une cytokine aux fonctions pro-inflammatoires et immuno-modulatrices, fait partie de la famille des TNF qui partage des homologies de séquence. Elle comprend 19 membres, dont le TNF-α, le TNF-β (ou lymphotoxine) et les ligands des récepteurs Fas (Fas-L), CD40 ligand (CD40-L) et TRAIL (
tumor necrosis factor-related apoptosis-inducing ligand
). Le TNF-α est produit, entre autres, par les macrophages et les lymphocytes et, dans l’œil, par les cellules microgliales, les cellules de Müller et les cellules de l’épithélium pigmentaire rétinien [
5
]. Il est synthétisé sous une forme transmembranaire (tmTNF-α) puis, par l’action d’une métalloprotéinase membranaire, sa forme soluble (sTNF) est libérée. Le sTNF a une importante activité biologique quand il est sous sa forme trimérique. Mais ce trimère présente une instabilité intrinsèque et se dissocie spontanément pour former des monomères beaucoup moins actifs biologiquement [
6
]. Cette transformation spontanée pourrait avoir un rôle dans la régulation du processus inflammatoire induit par le TNF-α. Une néo-trimérisation à partir des monomères est cependant suspectée. Le taux de réassociation des molécules dépendrait principalement de la concentration en monomères de TNF-α : il est négligeable quand cette concentration est basse mais joue probablement un rôle important dans le maintien de l’activité de la cytokine quand cette concentration est élevée [
7
].
Le tmTNF et le sTNF se lient principalement à deux récepteurs : les récepteurs de type I (TNFR-I ou p55/CD120a) et les récepteur de type II (TNFR-II ou p75). Ces deux récepteurs appartiennent à la famille des TNFR définie par l’homologie de la séquence de leurs domaines de liaison extracellulaire, riche en cystéine [
8
]. Le sTNF se lie aux deux récepteurs alors que le tmTNF ne se lie qu’au TNFR-II [
9
]. L’expression du TNFR-I est ubiquitaire. Selon la voie de signalisation activée, sa stimulation peut induire des signaux pro-inflammatoires, anti-apoptotiques et prolifératifs ou, au contraire, induire l’apoptose. Le TNFR-II, quant à lui, est principalement exprimé à la surface des lymphocytes T régulateurs [
10
]. Son activation joue donc un rôle majeur dans la régulation de l’effet pro-inflammatoire induit par le TNFR-I.
De grandes quantités de TNF-α sont libérées en réponse aux stimulus microbiens et inflammatoires, en particulier les lipopolysaccharides (LPS) bactériens et l’interleukine-1 (IL-1). Au cours des infections sévères, les concentrations élevées de TNF-α produites exercent des effets généraux, tels que la fièvre, la synthèse des protéines de la phase aiguë par le foie, et la cachexie
1
. Ces effets peuvent aller jusqu’au syndrome de choc septique.
Le rôle du TNF-α dans l’auto-immunité, et plus spécifiquement dans les uvéites, reste en partie inexpliqué. La physiopathologie des uvéites combine les mêmes facteurs que les maladies non spécifiques d’organes (susceptibilité génétique, modification de la reconnaissance du soi, mimétisme moléculaire, etc.). Dans les uvéo-rétinites auto-immunes expérimentales (UAE), induites chez les rongeurs par une injection périphérique d’antigènes rétiniens, le rôle du TNF-α a été bien étudié. Il est libéré initialement par les macrophages résidents, la microglie et l’épithélium pigmentaire de la rétine, ainsi que par les mastocytes de la choroïde. Il est ensuite produit par des lymphocytes T infiltrants, qui orchestrent ainsi le déclenchement d’une nouvelle infiltration leucocytaire en stimulant l’expression de molécules d’adhérence, la maturation et la survie des cellules dendritiques, l’activation des macrophages et le déclenchement des réponses des lymphocytes T de type Th1 dans les tissus. Dans l’UAE, les concentrations tissulaires élevées de TNF-α facilitent les réponses effectrices des lymphocytes T et l’activation des macrophages. Le déséquilibre du micro-environnement cytokinique en faveur d’un profil de type Th1 (pro-inflammatoire) conduit à une destruction tissulaire, qui peut être réduite par les thérapies anti-TNF, en particulier celles qui visent le TNFR-I [
5
,
11
].
Chez l’homme, le taux de TNF-α intraoculaire est augmenté dans les uvéites. Mais c’est le cas pour de nombreuses autres cytokines [
12
-
14
], ce qui ne permet pas d’établir un lien de causalité. Par contre, la transposition chez l’homme des résultats expérimentaux apporte des arguments solides sur son rôle pathogénique. Chez les patients uvéitiques, l’efficacité des anti-TNF-α est ainsi associée à une modification du profil des lymphocytes T CD4
+
du sang périphérique, après chaque traitement [
5
].
|
Les thérapies qui neutralisent le TNF-α
Cinq molécules anti-TNF sont actuellement commercialisées
(
Tableau I
)
. Elles se distinguent par leur structure. Alors que l’adalimumab et le golizumab sont des anticorps entièrement humanisés de type IgG1 (immunoglobuline d’isotype G1), l’infliximab est une protéine chimérique associant des domaines constants (CH1, CH2, CH3 pour la chaîne lourde et Ck pour la chaîne légère) humains à des domaines variables VH et Vk murins. L’étanercept est, lui, constitué des deux domaines extracellulaires du TNFR-II fusionnés à la région Fc d’une IgG1 humanisée. Le certolizumab-pegol, est un fragment Fab humanisé couplé à une molécule hydrophile inerte, le polyéthylène glycol (PEG) qui accroît sa demi-vie et la rend similaire à celle d’une IgG1 humaine [
15
]. Le principal mécanisme d’action de ces anti-TNF-α repose sur la neutralisation du sTNF. Cependant, l’affinité pour le sTNF-α sous sa forme trimérique est plus importante pour l’étanercept et le golizumab que pour les autres molécules [
16
-
18
]. Contrairement au golizumab et au certolizumab-pegol, l’adalimumab, l’étanercept et l’infliximab stabilisent le trimère de TNF-α, probablement en raison de leur mode de liaison à la molécule. La dégradation du trimère en monomères est donc inhibée [
7
]. La variabilité des effets des anti-TNF-α s’explique également par leurs capacités différentes de se lier au tmTNF [
19
]. En plus du simple pouvoir inhibiteur des anti-TNF-α sur la cytokine, la présence (en ce qui concerne tous les anti-TNF-α sauf le certolizumab) d’une région Fc d’Ig dans leurs structures leur procure des fonctions supplémentaires : activation du complément, lyse cellulaire dépendante du complément, cytotoxicité dépendante des anticorps ou apoptose [
18
]. Alors que la plupart des anti-TNF-α sont spécifiques du TNF-α, l’étanercept est également capable de neutraliser la lymphotoxine, ce qui est important pour le traitement de la polyarthrite rhumatoïde [
20
]. Les différences de fonctionnement entre anti-TNF-α pourraient expliquer l’efficacité variable de ces molécules en fonction des maladies : alors que dans la polyarthrite rhumatoïde, l’arthrite psoriasique et la spondylarthrite ankylosante, l’efficacité des cinq molécules semble équivalente, le golimumab et l’étanercept sont moins efficaces dans la sarcoïdose [
21
,
22
].
Tableau I.
| Substance |
Nom commercial |
Voie d’administration |
Structure |
Indication selon AMM |
| Étanercept |
Enbrel, Benepali |
SC |
Protéine de fusion entre les ECD du TNF-RII et la région Fc d’IgG1 |
SpA, PR, AJI, Pso |
| Infliximab |
Remicade, Flixabi, Inflectra |
IV |
Anticorps monoclonal chimérique contenant une région Fc d’IgG1 |
SpA, PR, RCH, MC, Pso |
| Adalimumab |
Humira, Amgevita |
SC |
Anticorps monoclonal humain recombinant d’isotype IgG1 |
Uvéite, SpA, PR, RCU, MC, Pso, AJI |
| Golimumab |
Simponi |
SC |
Anticorps monoclonal humain recombinant d’isotype IgG1 |
SpA, PR, RCU, Pso, AJI |
| Certolizumab pégol |
Cimzia |
SC |
Fragment Fab d’IgG4 humanisé recombinant couplé au PEG |
PR, SpA, Pso |
Molécules anti-TNF-
a
, structure et indication.
AMM : autorisation de mise sur le marché ; SC : sous-cutané ; IV : intraveineux ; SpA : spondylathrite ankylosante ; PR : polyarthrite rhumatoïde ; AJI : arthrite juvénile idiopathique ; Pso : psoriasis ; RCH : rectocolite hémorragique, MC : maladie de Crohn ; PEG : polyéthylèneglycol ; ECD : ectodomaine.
|
|
Efficacité des anti-TNF-α dans le traitement des uvéites
L’adalimumab est le seul anticorps pour lequel a été accordée une AMM pour le traitement des uvéites idiopathiques intermédiaires ou postérieures, des panuvéites idiopathiques et des uvéites antérieures chroniques réfractaires de l’enfant. Cette AMM repose sur les études VISUAL I et II, des études prospectives randomisées comparant le traitement par adalimumab à un placébo chez des patients présentant des uvéites actives (VISUAL I) et inactives (VISUAL II) [
23
,
24
]. En accord avec ces études, l’adalimumab est aujourd’hui utilisé comme molécule d’épargne cortisonique, soit seule, soit en association avec un immunosuppresseur conventionnel, tel que le méthotrexate, l’azathioprine ou le mycophénolate mofétil
(
Figure 2
)
. À ce jour, aucun différentiel d’efficacité statistiquement significatif n’a été établi selon le type d’uvéite. Plusieurs travaux suggèrent néanmoins que les uvéites compliquant la maladie de Behçet
2,
pourraient constituer l’une des meilleures indications de traitement par anti-TNF-α, en première ligne ou dans des cas d’uvéites réfractaires aux traitement conventionnels [
23
]. Les preuves d’efficacité des anti-TNF-α dans différents types d’uvéites se fondent sur des études intégrant de nombreuses séries de cas traités essentiellement avec les anticorps monoclonaux [
25
-
29
]. Ainsi, associé au méthotrexate, l’adalimumab a montré un effet spectaculaire pour diminuer la fréquence et la sévérité des uvéites antérieures compliquant les arthrites idiopathiques juvéniles (étude SYCAMORE) [
30
]. Dans le contexte de la spondylarthrite, une diminution de la fréquence des poussées d’uvéite a été observée chez des patients traités par adalimumab ou par infliximab [
31
-
33
]. En revanche, les récidives d’uvéites apparaissant chez les patients porteurs de l’allèle HLA-B27 du complexe majeur d’histocompatibilité associé à la spondylarthrite ankylosante, n’entrent pas, lorsqu’elles sont isolées, dans le champ de l’indication des anti-TNF-α telle que définie dans l’AMM. L’effet de l’étanercept a été étudié chez des patients présentant des uvéites dans le cadre d’arthrites juvéniles infantiles et de spondylarthrites. Bien que son efficacité et son profil de sécurité pour traiter ces maladies soient excellents, son efficacité pour prévenir l’apparition d’uvéites semble légèrement moins bonne que celle de l’adalimumab et de l’infliximab [
34
,
35
]. À noter que les récepteurs solubles du TNF de type II (p75), en se liant au tmTNF, peuvent induire des uvéites paradoxales, avec une fréquence plus élevée que les anti-TNF-α [
36
]. L’étanercept, qui contient les deux domaines extracellulaires du TNFR-II, n’est donc pas une molécule de première intention chez les patients présentant une spondylarthrite ankylosante ou une arthrite juvénile infantile avec atteinte oculaire.
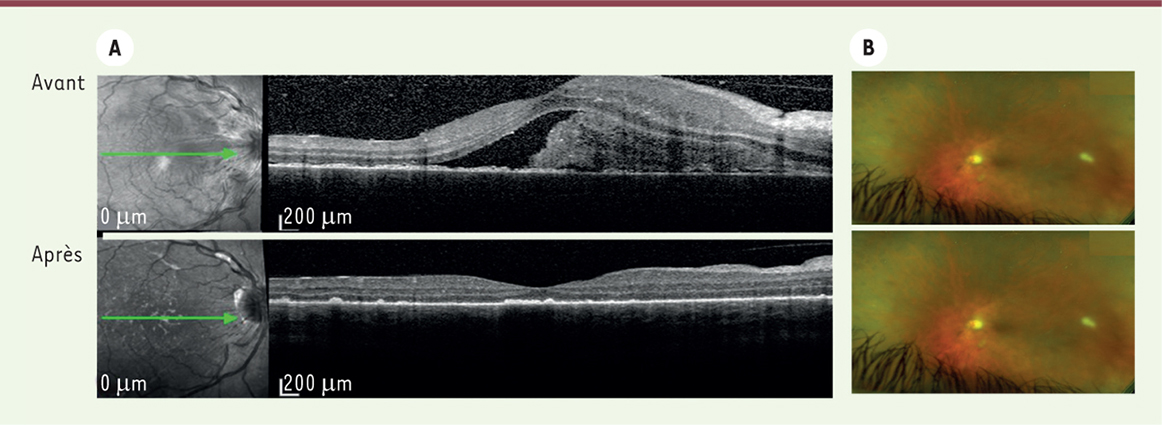
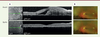 | Figure 2.
Effet des anti-TNF. A.
Image d’une coupe de rétine rélisée en OCT (
optical coherence tomography
) d’un patient présentant un syndrome de Vogt-Koyanagi-Harada. Avant traitement : présence d’un décollement séreux rétinien avec un contenu fibrineux. Après traitement par corticoïdes et adalimumab : résolution du décollement.
B.
Photos du fond d’œil grand champ (Optos California, Royaume-Uni) d’un patient présentant un syndrome de Behçet. Avant traitement : présence de hyalite, rétinite et de vascularite. Après traitement par corticoïdes et infliximab : disparition des signes inflammatoires.
|
|
Méthode de thérapie génique non virale pour la production de protéines neutralisant le TNF-α dans le globe oculaire
Quand l’inflammation est limitée à l’œil et qu’elle n’est pas associée à une maladie inflammatoire générale, ou quand la seule indication aux anti-TNF-α est l’uvéite, l’administration locale intraoculaire d’anti-TNF-α peut être avantageuse. En effet, la pénétration intraoculaire de protéines qui ont été administrées par voie générale est très faible en raison des barrières oculaires, restaurées quand la phase aiguë inflammatoire est passée. La voie intraoculaire est donc non seulement plus efficace, mais elle évite également les effets secondaires généraux, les protéines administrées dans l’œil diffusant très peu ou pas dans la circulation générale, ce qui permet une thérapie locale [
37
]. Néanmoins, le bénéfice thérapeutique ne sera maintenu que par des injections intraoculaires fréquemment répétées, la demi-vie des protéines injectées étant courte, ce qui justifie le recours à des méthodes de thérapie génique permettant de délivrer continuellement des produits
in situ
. Les vecteurs viraux habituellement utilisés en thérapie génique induisent des réactions immunitaires et inflammatoires peu souhaitables dans les cas d’uvéite [
38
] et leur administration sous-rétinienne reste invasive [
39
]. On peut également s’interroger sur la pertinence d’une production permanente et non limitée d’un agent qui neutralise l’une ou l’autre des cytokines, sachant qu’il s’agit de pathologies dont l’évolution peut nécessiter des adaptations de traitement.
Pour contourner les limitations des thérapies géniques par vecteur viral, une thérapie génique non virale, fondée sur l’électrotransfert de plasmide dans le muscle ciliaire, a été développée. L’électrotransfert, également connu sous le nom d’électroporation ou d’électro-perméabilisation, consiste à appliquer un court champ électrique à la cellule pour modifier, de manière transitoire, la perméabilité de la membrane cellulaire à un ADN plasmidique nu, et ainsi favoriser son entrée dans la cellule [
40
]. La preuve d’un tel transfert d’ADN plasmidique a été apportée
in vivo
pour la première fois en 2004, avec le transfert d’un gène dans des cellules musculaires squelettiques. Cette transduction a permis une expression soutenue du transgène pendant au moins 9 mois, avec des niveaux jusqu’à 100 fois supérieurs à ceux obtenus par simple injection d’ADN plasmidique [
40
]. Par la suite, l’électroporation
in vivo
a été appliquée avec succès à une variété de tissus, conduisant à plus de 90 essais cliniques.
Dans l’œil, l’électroporation d’ADN plasmidique a été testée dans différents modèles animaux pour transfecter les cellules rétiniennes. Ainsi, l’électrotransfert, après injection sous-rétinienne de plasmides nus, a permis une transfection assez efficace de la neurorétine
3
, mais uniquement dans la rétine murine en développement [
41
,
42
]. Chez des rongeurs adultes, la transfection a également été efficace, principalement dans les cellules de l’épithélium pigmentaire de la rétine [
43
,
44
]. En effet, l’injection d’un plasmide codant la forme soluble du récepteur 1 du VEGF (sFlt-1) dans l’espace suprachoroïdien du rat, suivie d’un électrotransfert, a permis la transduction de cellules choroïdiennes et de l’épithélium pigmentaire rétinien. Ce traitement par le sFlt-1 a ainsi permis d’assurer une inhibition significative de la croissance de néovaisseaux choroïdiens, pendant plus de 6 mois [
45
]. Bien que ces approches apparaissent intéressantes, elles restent invasives et peu adaptées au traitement d’un nombre important de patients.
Une alternative prometteuse consiste à transfecter les cellules du muscle ciliaire oculaire afin que celui-ci produise et secrète des protéines thérapeutiques de façon durable mais contrôlée [
46
-
48
]. Le muscle ciliaire est un muscle lisse qui permet l’accommodation en déplaçant le cristallin selon l’axe antéro-postérieure. Situé entre les segments oculaires antérieur et postérieur, il est facilement accessible, situé juste sous la sclère, à moins de 1 mm de la surface du globe oculaire. Ce ciblage cellulaire spécifique présente plusieurs avantages : une sécurité accrue, car les cellules visuelles ne sont pas touchées ; une production de produits dans les segments antérieur et postérieur du globe oculaire ; un accès simple sans procédure chirurgicale ; une production de protéines jusqu’à 6 à 12 mois, mais non permanente et aisément arrêtée en cas de nécessité.
Nous avons montré, chez le rat adulte et chez le lapin, que l’électrotransfert du muscle ciliaire était sûr, spécifique et efficace après injection transsclérale de plasmides. Ceci a été réalisé à l’aide d’une électrode sur une plaque externe positionnée sur la sclère recouvrant le muscle ciliaire et une cathode-fil insérée dans le muscle ciliaire, avec des paramètres électriques optimisés [
47
,
48
]. L’expression d’une protéine dont le gène avait été ainsi transduit, a pu être observée jusqu’à 9 mois, en utilisant un plasmide codant une forme monomèrique du récepteur soluble de type I du TNF-α humain (hTNFR-Is) [
49
]. Les taux de protéine produite au niveau intraoculaire étaient en corrélation avec la dose de plasmide injecté et la surface du muscle électroporé. Ceci permettait donc d’adapter le schéma thérapeutique aux besoins cliniques. Cette méthode non virale a été utilisée pour délivrer des plasmides codant différentes protéines thérapeutiques, dont des facteurs neurotrophiques [
50
], sFlt-1, le récepteur du VEGF [
45
], la transferrine [
51
], et des récepteurs du TNF-α [
11
,
47
,
49
] Pour chaque protéine testée, des concentrations thérapeutiquement actives ont pu être obtenues.
Après électrotransfert de plasmides codant les formes monomérique (hTNFR-Is) et chimérique (hTNFR-Is/mIgG1) du récepteur soluble de type I du TNF-α, la neutralisation intra-oculaire de la cytokine a suffi à inhiber l’uvéite aiguë induite par du LPS bactérien, sans que son taux sanguin soit modifié [
49
]. Dans le modèle d’UAE, l’inhibition locale, induite par le récepteur chimérique, a également diminué la sévérité de l’inflammation d’origine auto-immune, et a induit une immuno-modulation locale, avec une bascule vers un profil cytokinique anti-inflammatoire (de type Th2) dans les liquides oculaires [
11
]
(
Figure 3
)
.
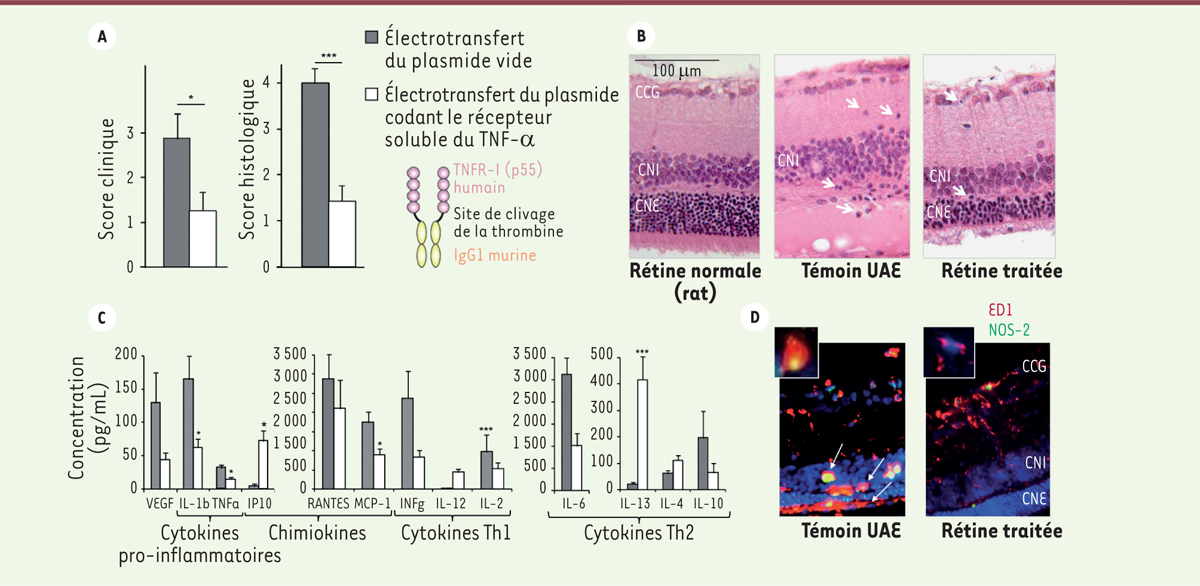
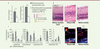 | Figure 3.
Effet de l’électrotransfert d’un plasmide codant un dimère de récepteurs solubles de type 1 du TNF-αlpha (p55) fusionné à une région Fc d’IgG1 humaine, dans le modèle d’uvéite auto-immune experimentale (UAE) chez le rat. A.
Les scores cliniques et histologiques de gravité de l’inflammation ont été réduits par le traitement en comparaison de ceux des animaux contrôles traités par le plasmide vide.
B.
Exemple de coupe histologique transversale de rétine de rat, normale, au 21
e
jour de l’UAE, montrant une destruction complète de la couche des photorécepteurs (CNE) et de celle d’un rat traité montrant une préservation partielle des photorécepteurs.
C.
Modification des taux de cytokines et chimiokines dans les milieux oculaires des animaux traités par rapport à ceux des animaux contrôles montrant une bascule d’un profil Th1 à un profil Th2.
D.
Marquage immunohistochimique de cellules infiltrantes inflammatoire (ED1) et de la NOS-II (NO synthase inductible) sur coupe de rétine d’un rat contrôle montrant de nombreuses cellules qui expriment la NOS-II dans la rétine externe par rapport à une coupe de rat traité sur laquelle on ne voit pas de cellules positive dans la rétine externe (CNE) (d’après [
11
]).
|
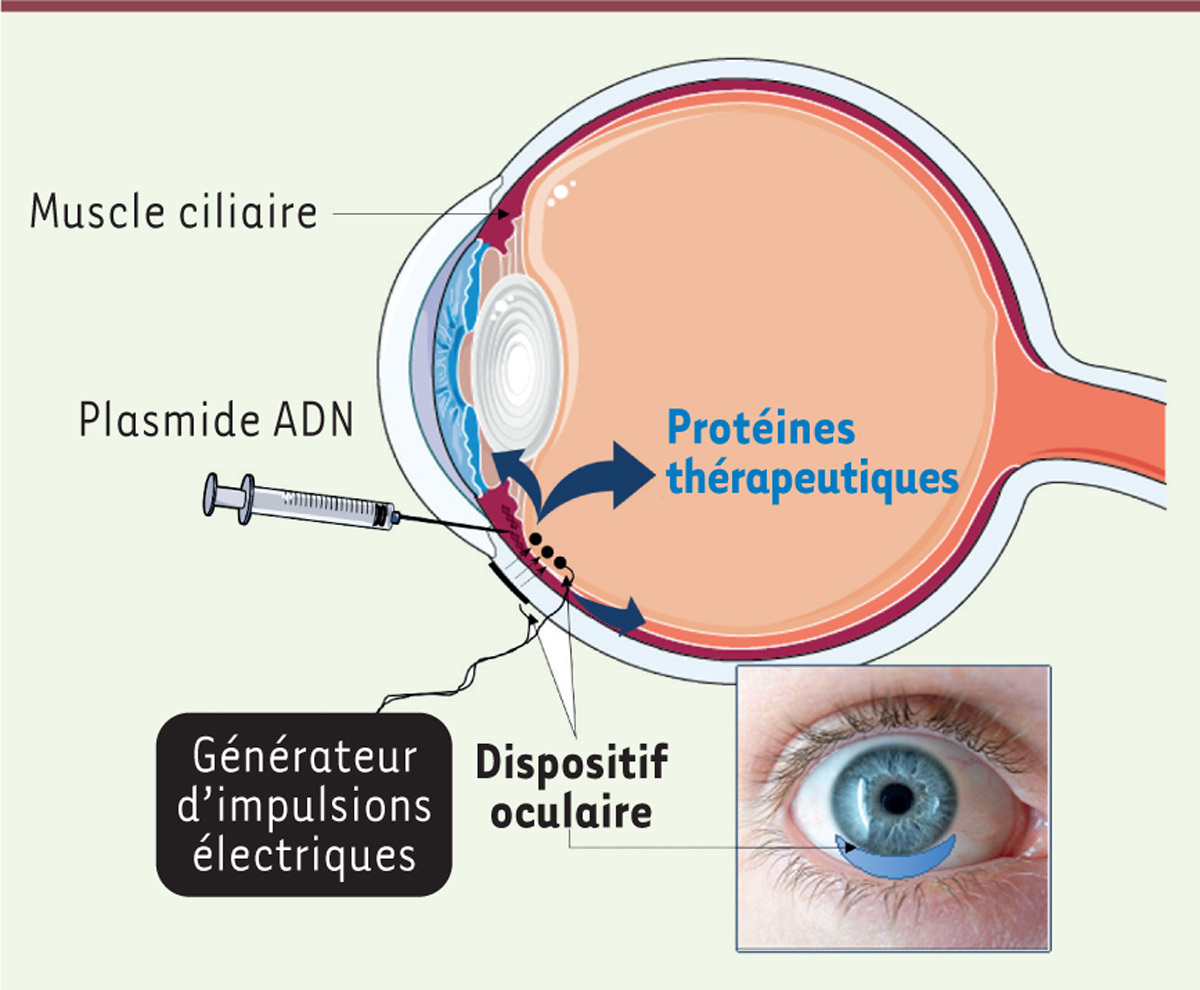
Cette technologie prometteuse est actuellement en développement par la société
Eyevensys
(Paris, France) afin de la conduire à une application clinique. Une première étape importante a été le développement d’un dispositif médical propriétaire constitué d’un générateur d’impulsions électriques délivrant un courant de manière contrôlée, et d’un dispositif oculaire à usage unique pour guider l’injection des plasmides dans le muscle ciliaire, une fois positionné à la surface de l’œil
(
Figure 4
)
[
37
]. Cette technologie est actuellement développée pour la transfection dans le muscle ciliaire d’un plasmide de grade médical, pEYS606. Celui-ci est dépourvu de gène de sélection par un antibiotique et code une protéine de fusion, hTNFR-Is, entièrement humanisée (hTNFR-Is / hIgG1) [
48
]. Les études de toxicité à dose unique et à doses répétées, menées avec l’électrotransfert de pEYS606 chez le lapin, ne montrent aucun effet négatif, histologique ou fonctionnel. Un essai clinique de phase I/II à doses croissantes, évaluant l’innocuité, la tolérance et l’activité clinique de pEYS606 chez des patients en phase avancée d’uvéite postérieure, intermédiaires et de panuvéite est actuellement en cours en France et au Royaume-Uni (
https://clinicaltrials.gov/ct2/show/NCT03308045
). Un essai de phase II a également été initié aux États-Unis, afin d’évaluer l’innocuité de l’administration répétée du plasmide pEYS606 chez des patients en phase active d’uvéites non infectieuses (
https://clinicaltrials.gov/ct2/show/NCT04207983
).
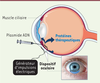 | Figure 4.
Représentation schématique de la technique d’électrotransfert du muscle ciliaire développée dans des essais cliniques.
|
|
Dans les maladies inflammatoires intraoculaires, comme dans les autres pathologies inflammatoires, les biothérapies anti-TNF-α prennent une place importante dans l’arsenal thérapeutique. Quand la maladie est limitée à l’œil, l’administration locale permet de limiter les effets secondaires généraux et d’optimiser l’efficacité locale. Des effets pathogéniques du TNF-α ont également été démontrés dans d’autres maladies oculaires, comme la rétinopathie diabétique [
52
] ou la neuropathie glaucomateuse [
53
,
54
] Si des modalités d’administration locales simplifiées et contrôlées sont validées, les thérapies anti-TNF-α pourraient donc s’étendre à d’autres maladies oculaires cécitantes.
|
Elodie Touchard, Ronald Bugage et Thierry Bordet sont employés d’Eyevensys. Antoine Brézin est consultant pour Eyevensys. Francine Behar-Cohen est fondatrice d’Eyevensys et inventeure de la technologie développée par Eyevensys.
|
Footnotes |
1.
Thorne
JE
,
Suhler
E
,
Skup
M
,
et al.
Prevalence of noninfectious uveitis in the United States: a claims-based analysis.
.
JAMA Ophthalmol.
2016;
;
134
:
:1237.
–
1245
.
2.
Daudin
JB
Épidémiologie. Uvéites. Paris : Masson.
2010
:
:111.
.
3.
Brézin
AP
.
Sémiologie et classification des uvéites.
.
Uvéites. Paris:
:
Masson;
,
2010
.
4.
Massa
H
,
Georgoudis
P
,
Panos
GD
.
Dexamethasone intravitreal implant (Ozurdex
®
) for macular edema secondary to noninfectious uveitis: a review of the literature
.
.
Ther Deliv.
2019;
;
10
:
:343.
–
351
.
5.
Dick
AD
,
Forrester
JV
,
Liversidge
J
,
Cope
AP
.
The role of tumour necrosis factor (TNF-αlpha) in experimental autoimmune uveoretinitis (EAU).
.
Prog Retin Eye Res.
2004;
;
23
:
:617.
–
637
.
6.
Smith
RA
,
Baglioni
C
.
The active form of tumor necrosis factor is a trimer.
.
J Biol Chem.
1987;
;
262
:
:6951.
–
6954
.
7.
van Schie
KA
,
Ooijevaar-de Heer
P
,
Dijk
L
,
et al.
Therapeutic TNF inhibitors can differentially stabilize trimeric TNF by inhibiting monomer exchange.
.
Sci Rep.
2016;
;
6
:
:32747.
.
8.
Smith
CA
,
Farrah
T
,
Goodwin
RG
.
The TNF receptor superfamily of cellular and viral proteins: activation, costimulation, and death.
.
Cell.
1994;
;
76
:
:959.
–
962
.
9.
Grell
M
,
Douni
E
,
Wajant
H
,
et al.
The transmembrane form of tumor necrosis factor is the prime activating ligand of the 80 kDa tumor necrosis factor receptor.
.
Cell.
1995;
;
83
:
:793.
–
802
.
10.
Yang
S
,
Wang
J
,
Brand
DD
,
Zheng
SG
.
Role of TNF-TNF receptor 2 signal in regulatory T cells and its therapeutic implications.
.
Front Immunol.
2018;
;
9
:
:784.
.
11.
Kowalczuk
L
,
Touchard
E
,
Camelo
S
,
et al.
Local ocular immunomodulation resulting from electrotransfer of plasmid encoding soluble TNF receptors in the ciliary muscle.
.
Invest Ophthalmol Vis Sci.
2009;
;
50
:
:1761.
–
1768
.
12.
Horai
R
,
Caspi
RR
.
Cytokines in autoimmune uveitis.
.
J Interferon Cytokine Res.
2011;
;
31
:
:733.
–
744
.
13.
Bauer
D
,
Kasper
M
,
Walscheid
K
,
et al.
Multiplex cytokine analysis of aqueous humor in juvenile idiopathic arthritis-associated anterior uveitis with or without secondary glaucoma.
.
Front Immunol.
2018;
;
9
:
:708.
.
14.
Bonacini
M
,
Soriano
A
,
Cimino
L
, et al.
Cytokine profiling in aqueous humor samples from patients with non-infectious uveitis associated with systemic inflammatory diseases.
.
Front Immunol.
2020;
;
11
:
:358.
.
15.
Lim
H
,
Lee
SH
,
Lee
HT
,
et al.
Structural biology of the TNFα antagonists used in the treatment of rheumatoid arthritis.
.
Int J Mol Sci.
2018;
;
19
:
16.
Scallon
B
,
Cai
A
,
Solowski
N
,
et al.
Binding and functional comparisons of two types of tumor necrosis factor antagonists.
.
J Pharmacol Exp Ther.
2002;
;
301
:
:418.
–
426
.
17.
Tracey
D
,
Klareskog
L
,
Sasso
EH
,
et al.
Tumor necrosis factor antagonist mechanisms of action : a comprehensive review.
.
Pharmacol Ther.
2008;
;
117
:
:244.
–
279
.
18.
Billmeier
U
,
Dieterich
W
,
Neurath
MF
,
Atreya
R
.
Molecular mechanism of action of anti-tumor necrosis factor antibodies in inflammatory bowel diseases.
.
World J Gastroenterol.
2016;
;
22
:
:9300.
–
9313
.
19.
Kaymakcalan
Z
,
Sakorafas
P
,
Bose
S
,
et al.
Comparisons of affinities, avidities, and complement activation of adalimumab, infliximab, and etanercept in binding to soluble and membrane tumor necrosis factor.
.
Clin Immunol.
2009;
;
131
:
:308.
–
316
.
20.
Calmon-Hamaty
F
,
Combe
B
,
Hahne
M
,
Morel
J
.
Lymphotoxin α stimulates proliferation and pro-inflammatory cytokine secretion of rheumatoid arthritis synovial fibroblasts.
.
Cytokine.
2011;
;
53
:
:207.
–
214
.
21.
Adler
BL
,
Wang
CJ
,
Bui
T-L
,
et al.
Anti-tumor necrosis factor agents in sarcoidosis: a systematic review of efficacy and safety.
.
Semin Arthritis Rheum.
2019;
;
48
:
:1093.
–
1104
.
22.
Ramos-Casals
M
,
Brito-Zerón
P
,
Muñoz
S
,
Soto
MJ
.
Biogeas study group. A systematic review of the off-label use of biological therapies in systemic autoimmune diseases.
.
Medicine (Baltimore).
2008;
;
87
:
:345.
–
364
.
23.
Jaffe
GJ
,
Dick
AD
,
Brézin
AP
,
et al.
Adalimumab in patients with active noninfectious uveitis.
.
N Engl J Med.
2016;
;
375
:
:932.
–
943
.
24.
Nguyen
QD
,
Merrill
PT
,
Jaffe
GJ
,
et al.
Adalimumab for prevention of uveitic flare in patients with inactive non-infectious uveitis controlled by corticosteroids (Visual II): a multicentre, double-masked, randomised, placebo-controlled phase 3 trial.
.
Lancet.
2016;
;
388
:
:1183.
–
1192
.
25.
Celiker
H
,
Kazokoglu
H
,
Direskeneli
H
.
Conventional immunosuppressive therapy in severe Behcet’s Uveitis: the switch rate to the biological agents.
.
BMC Ophthalmol.
2018;
;
18
:
:261.
.
26.
Dick
AD
,
Rosenbaum
JT
,
Al-Dhibi
HA
,
et al.
Guidance on noncorticosteroid systemic immunomodulatory therapy in noninfectious uveitis: fundamentals of care for uveitis (Focus) initiative.
.
Ophthalmology.
2018;
;
125
:
:757.
–
773
.
27.
Kahn
P
,
Weiss
M
,
Imundo
LF
,
Levy
DM
.
Favorable response to high-dose infliximab for refractory childhood uveitis.
.
Ophthalmology.
2006;
;
113
:
:860.
–
864.e2
.
28.
Riancho-Zarrabeitia
L
,
Calvo-Río
V
,
Blanco
R
,
et al.
Anti-TNF-α therapy in refractory uveitis associated with sarcoidosis: multicenter study of 17 patients.
.
Semin Arthritis Rheum.
2015;
;
45
:
:361.
–
368
.
29.
Takeuchi
M
,
Kezuka
T
,
Sugita
S
,
et al.
Evaluation of the long-term efficacy and safety of infliximab treatment for uveitis in Behçet’s disease: a multicenter study.
.
Ophthalmology.
2014;
;
121
:
:1877.
–
1884
.
30.
Ramanan
AV
,
Dick
AD
,
Jones
AP
,
et al.
Adalimumab plus methotrexate for uveitis in juvenile idiopathic arthritis.
.
N Engl J Med.
2017;
;
376
:
:1637.
–
1646
.
31.
Frantz
C
,
Portier
A
,
Etcheto
A
,
et al.
Acute anterior uveitis in spondyloarthritis: a monocentric study of 301 patients.
.
Clin Exp Rheumatol.
2019;
;
37
:
:26.
–
31
.
32.
Guignard
S
,
Gossec
L
,
Salliot
C
,
et al.
Efficacy of tumour necrosis factor blockers in reducing uveitis flares in patients with spondylarthropathy: a retrospective study.
.
Ann Rheum Dis.
2006;
;
65
:
:1631.
–
1634
.
33.
Rudwaleit
M
,
Rødevand
E
,
Holck
P
,
et al.
Adalimumab effectively reduces the rate of anterior uveitis flares in patients with active ankylosing spondylitis: results of a prospective open-label study.
.
Ann Rheum Dis.
2009;
;
68
:
:696.
–
701
.
34.
Lie
E
,
Lindström
U
,
Zverkova-Sandström
T
,
et al.
Tumour necrosis factor inhibitor treatment and occurrence of anterior uveitis in ankylosing spondylitis: results from the Swedish biologics register.
.
Ann Rheum Dis.
2017;
;
76
:
:1515.
–
1521
.
35.
Braun
J
,
Baraliakos
X
,
Listing
J
,
Sieper
J
.
Decreased incidence of anterior uveitis in patients with ankylosing spondylitis treated with the anti-tumor necrosis factor agents infliximab and etanercept.
.
Arthritis Rheum.
2005;
;
52
:
:2447.
–
2451
.
36.
Lim
LL
,
Fraunfelder
FW
,
Rosenbaum
JT
.
Do tumor necrosis factor inhibitors cause uveitis?
.
A registry-based study. Arthritis Rheum.
2007;
;
56
:
:3248.
–
3252
.
37.
El Sanharawi
M
,
Kowalczuk
L
,
Touchard
E
,
et al.
Protein delivery for retinal diseases: from basic considerations to clinical applications.
.
Prog Retin Eye Res.
2010;
;
29
:
:443.
–
465
.
38.
Bouquet
C
,
Vignal Clermont
C
,
Galy
A
,
et al.
Immune response and intraocular inflammation in patients with leber hereditary optic neuropathy treated with intravitreal injection of recombinant adeno-associated virus 2 Carrying the ND4 gene: a secondary analysis of a phase 1/2 clinical trial.
.
JAMA Ophthalmol.
2019;
;
137
:
:399.
–
406
.
39.
Davis
JL
.
The blunt end: surgical challenges of gene therapy for inherited retinal diseases.
.
Am J Ophthalmol.
2018;
;
196
:
:xxv.
–
xxix
.
40.
André
F
,
Mir
LM
.
DNA electrotransfer: its principles and an updated review of its therapeutic applications.
.
Gene Ther.
2004;
;
11
(
(suppl 1)
):
:S33.
–
S42
.
41.
Garcia-Frigola
C
,
Carreres
MI
,
Vegar
C
,
Herrera
E
.
Gene delivery into mouse retinal ganglion cells by in utero electroporation.
.
BMC Dev Biol.
2007;
;
7
:
:103.
.
42.
De Melo
J
,
Blackshaw
S
.
In vivo electroporation of developing mouse retina.
.
Methods Mol Biol Clifton NJ.
2018;
;
1715
:
:101.
–
111
.
43.
Latella
MC
,
Di Salvo
MT
,
Cocchiarella
F
,
et al.
In vivo editing of the human mutant rhodopsin gene by electroporation of plasmid-based CRISPR/Cas9 in the mouse retina.
.
Mol Ther Nucleic Acids.
2016;
;
5
:
:e389.
.
44.
Touchard
E
,
Berdugo
M
,
Bigey
P
,
et al.
Suprachoroidal electrotransfer: a nonviral gene delivery method to transfect the choroid and the retina without detaching the retina.
.
Mol Ther J Am Soc Gene Ther.
2012;
;
20
:
:1559.
–
1570
.
45.
El Sanharawi
M
,
Touchard
E
,
Benard
R
,
et al.
Long-term efficacy of ciliary muscle gene transfer of three sFlt-1 variants in a rat model of laser-induced choroidal neovascularization.
.
Gene Ther.
2013;
;
20
:
:1093.
–
1103
.
46.
Bloquel
C
,
Bourges
JL
,
Touchard
E
,
et al.
Non-viral ocular gene therapy: potential ocular therapeutic avenues.
.
Adv Drug Deliv Rev.
2006;
;
58
:
:1224.
–
1242
.
47.
Touchard
E
,
Kowalczuk
L
,
Bloquel
C
,
et al.
The ciliary smooth muscle electrotransfer : basic principles and potential for sustained intraocular production of therapeutic proteins.
.
J Gene Med.
2010;
;
12
:
:904.
–
919
.
48.
Touchard
E
,
Benard
R
,
Bigot
K
,
et al.
Non-viral ocular gene therapy, pEYS606, for the treatment of non-infectious uveitis: preclinical evaluation of the medicinal product.
.
J Control Release.
2018;
;
285
:
:244.
–
251
.
49.
Touchard
E
,
Bloquel
C
,
Bigey
P
,
et al.
Effects of ciliary muscle plasmid electrotransfer of TNF-αlpha soluble receptor variants in experimental uveitis.
.
Gene Ther.
2009;
;
16
:
:862.
–
873
.
50.
Touchard
E
,
Heiduschka
P
,
Berdugo
M
,
et al.
Non-viral gene therapy for GDNF production in RCS rat: the crucial role of the plasmid dose.
.
Gene Ther.
2012;
;
19
:
:886.
–
898
.
51.
Picard
E
,
Le Rouzic
Q
,
Oudar
A
,
et al.
Targeting iron-mediated retinal degeneration by local delivery of transferrin.
.
Free Radic Biol Med.
2015;
;
89
:
:1105.
–
1121
.
52.
Flyvbjerg
A
.
Diabetic angiopathy, the complement system and the tumor necrosis factor superfamily.
.
Nat Rev Endocrinol.
2010;
;
6
:
:94.
–
101
.
53.
Tezel
G
.
TNF-αlpha signaling in glaucomatous neurodegeneration.
.
Prog Brain Res.
2008;
;
173
:
:409.
–
421
.
54.
Wei
X
,
Cho
K-S
,
Thee
EF
,
et al.
Neuroinflammation and microglia in glaucoma: time for a paradigm shift.
.
J Neurosci Res.
2019;
;
97
:
:70.
–
76
.
|