| |
| Med Sci (Paris). 36(10): 859–865. doi: 10.1051/medsci/2020156.Du nouveau dans la génétique des formes monogéniques d’obésité et son impact pour mieux en comprendre la physiopathologie Morgane Baron,1 Philippe Froguel,1,2 and Amélie Bonnefond1,2* 1
Inserm UMR1283, CNRS UMR8199,
European Genomic Institute for Diabetes
(EGID), Institut Pasteur de Lille, Université de Lille, CHU de Lille
,
1 place de Verdun
,
59045
,
France 2Department of Metabolism, Imperial College London
,
Londres
,
W12 0NN
,
Royaume-Uni |
L’obésité et sa composante génétique
L’obésité, définie selon l’Organisation mondiale de la santé (OMS) par « une accumulation anormale ou excessive de graisse corporelle qui peut nuire à la santé », est un enjeu majeur de santé publique et sa prévalence dans le monde a doublé au cours des 30 dernières années. Elle est caractérisée par un indice de masse corporelle (IMC) supérieur à 30. Dans la cohorte française Constances
1
, incluant 200 000 adultes, la prévalence de l’obésité était en 2013 d’environ 16 %, suggérant une stabilisation de la prévalence de l’obésité, comme c’est le cas dans d’autres pays industrialisés, tels que les États-Unis ou l’Angleterre [
1
]. D’importantes disparités entre régions ont été néanmoins mises en évidence, passant de 10,7 % en région parisienne à 25,6 % dans le département du Nord [
1
]. Des inégalités en fonction de la situation socio-professionnelle ont également été retrouvées [
1
]. Le surpoids et l’obésité sont responsables en Europe de 14 % de la mortalité [
2
] et le coût des dépenses liées à l’obésité est estimé, dans le monde, entre 0,7 et 2,8 % des dépenses globales de santé selon les pays, atteignant 2 000 milliards de dollars par an selon l’OMS et l’Institut McKinsey
2,
. En France, selon une étude réalisée par un autre cabinet de conseil, IMS Health, l’impact économique de l’obésité est évalué à 2,6 % du produit intérieur brut (PIB), soit plus de 50 milliards d’euros, avec un surcoût de 5 milliards pour l’Assurance maladie
3
.
L’obésité est un facteur de risque majeur de nombreuses pathologies, comme le diabète de type 2, les maladies cardiovasculaires et certains types de maladies respiratoires (dont les signes sévères de la Covid-19 [
3
]) et de cancers. Le développement de l’obésité résulte d’une combinaison de facteurs environnementaux (alimentation inadaptée, manque d’activité physique, etc.) et génétiques. Les preuves d’une contribution génétique à cette maladie sont très fortes et proviennent d’études réalisées à partir de familles, de jumeaux et d’enfants adoptés, mais aussi d’analyses pangénomiques d’association (
genome wide association studies
, GWAS), qui ont permis d’estimer une héritabilité élevée de la maladie, entre 40 et 70 % [
4
]. Les approches pangénomiques d’association fondées sur l’utilisation de puces ADN permettant d’analyser des millions de variants génétiques fréquents (
single nucleotide polymorphisms
, SNP) dans de larges cohortes, ont identifié près de 1 000 locus associés à une augmentation de l’IMC [
5
]. Cependant, malgré leur nombre important, ces locus n’ont, collectivement, qu’un effet modeste sur le risque de maladie, et contribuent pour seulement 6 % de la variance de l’IMC [
5
]. Leur contribution à la physiopathologie de l’obésité reste mystérieuse. Néanmoins, l’expression des gènes situés à proximité de locus associés à l’obésité est augmentée dans des régions du cerveau qui jouent un rôle clé dans l’addiction et la récompense : la substance noire et le cortex insulaire [
6
].
À côté des formes communes, il existe des formes plus rares d’obésité, appelées monogéniques ou monofactorielles. Dans ces formes qui concernent environ 5 % des sujets obèses dans les pays occidentaux (beaucoup plus dans des populations consanguines), une seule mutation rare, ou un seul évènement génétique (par exemple une anomalie chromosomique), est suffisante pour entraîner la maladie, le plus souvent à un âge précoce. Elle est généralement associée à une hyperphagie (faim exagérée). Ces formes rares sont parfois retrouvées dans des syndromes dans lesquels l’obésité est associée à une déficience intellectuelle (syndrome de Prader-Willi, syndrome de Bardet-Biedl). Il existe également des obésités monogéniques isolées, sans autre signe associé, bien que cette distinction peut parfois être ténue. Des mutations touchant dix gènes (
LEP
,
LEPR
,
POMC
,
PCSK1
,
MC4R
,
BDNF
,
NTKR2
,
SIM1
,
SH2B1
,
MRAP2
)
(
Tableau I
)
ont été identifiées ou fortement suspectées d’être responsables de ces obésités monogéniques isolées. Tous ces gènes codent des protéines impliquées dans la voie leptine/mélanocortine, principalement active au niveau de l’hypothalamus, et qui régule l’appétit.
|
L’impact des gènes de l’obésité monogénique dans les mécanismes régissant l’appétit La leptine et son récepteur
La leptine (codée par le gène
LEP
) est une hormone anorexigène décrite pour la première fois en 1994 [
7
]. Sécrétée par les adipocytes, sa concentration dans le sang est corrélée à la quantité de tissu adipeux blanc
(
Figure 1
)
[
8
]. Son rôle majeur consiste en la régulation de l’appétit, notamment pour protéger l’organisme contre la famine, en signalant au niveau cérébral la quantité de tissu adipeux blanc dans l’organisme, ce qui reflète l’état de ses réserves énergétiques. Les souris ob/ob, un modèle murin de déficience congénitale en leptine, présentent une obésité sévère, associant hyperphagie et diminution de la dépense énergétique [
7
]. À partir de la fin des années 1990, des mutations homozygotes, à l’origine d’une perte de fonction de la leptine ou une réduction de sa production, ou une altération de la signalisation induite par son récepteur, le LEPR,
(
Figure 1
)
, ont été identifiées chez des patients sévèrement obèses, issus de familles consanguines [
9
,
10
]. Le tableau clinique de ces patients, déficients pour les gènes
LEP
ou
LEPR
, est très semblable : il associe une hyperphagie, une réduction du tonus nerveux sympathique, un hypogonadisme, une légère hypothyroïdie et une immunité lymphocytaire altérée
(
Tableau I
)
.
Tableau I.
| Gène |
Locus |
Mode d’héritabilité |
Nombres de mutations, indels ou CNV pathogènes rapportés* |
Principaux traits phénotypiques associés |
|
ADCY3
(
Adenylyl-cyclase 3
)
|
2p23.3 |
AR |
1-10 |
Obésité sévère
Hyperphagie
Anosmie |
|
BDNF
(
Brain-derived neurotrophic factor
)
|
11p13 |
AD |
11-20 |
Obésité sévère
Hyperphagie
Retard de développement
Altération de la nociception |
|
LEP
(
Leptin
)
|
7q32.1 |
AR |
11-20 |
Obésité sévère
Hyperphagie
Hypogonadisme
Hypothyroïdie
Désordres immunitaires |
|
LEPR
(
Leptin receptor
)
|
1p31.3 |
AR |
31-40 |
Obésité sévère
Hyperphagie
Hypogonadisme
Hypothyroïdie
Désordres immunitaires |
|
MC4R
(
Melanocortin 4 receptor
)
|
18q21.32 |
AD/AR |
131-140 |
Obésité sévère (AR) ou inexistante, modérée ou sévère (AD)
Hyperphagie
Grande taille |
|
MRAP2
(
Melanocortin 2 receptor accessory protein 2
)
|
6q14.2 |
AD |
11-20 |
Obésité ou surpoids
Hyperglycémie
Hypertension |
|
NTRK2
(
Neurotrophic tyrosine kinase receptor 2
)
|
9q22.1 |
AD |
1-10 |
Obésité sévère
Hyperphagie
Retard de développement
Altération de la nociception |
|
PCSK1
(
Proconvertase 1
)
|
5q15 |
AD/AR |
31-40 |
Obésité sévère
Hyperphagie
Hypoglycémie postprandiale (AR)
Déficience en glucocorticoïdes (AR)
Malabsorption intestinale (AR) |
|
POMC
(
Pro-opiomelanocortin
)
|
2p23.3 |
AR |
21-30 |
Obésité sévère
Hyperphagie
Défaut de pigmentation |
|
SH2B1
(
Src homology 2 [SH2] B adaptator protein 1
)
|
16p11.2 |
AD |
11-20 |
Obésité sévère
Hyperphagie
Petite taille |
|
SIM1
(
SIM bHLH transcription factor 1
)
|
6q16.3 |
AD |
31-40 |
Obésité
Hyperphagie
Prader-Willi-
like
|
Vue d’ensemble des gènes impliqués dans les formes monogéniques d’obésité.
AD
: autosomique dominant (impliquant des mutations hétérozygotes) ;
AR
: autosomique récessif (impliquant des mutations homozygotes ou des mutations hétérozygotes composites) ;
CNV
:
copy number variant.
*
D’après la base HGMD-Pro (
Human Gene Mutation Database
).
|
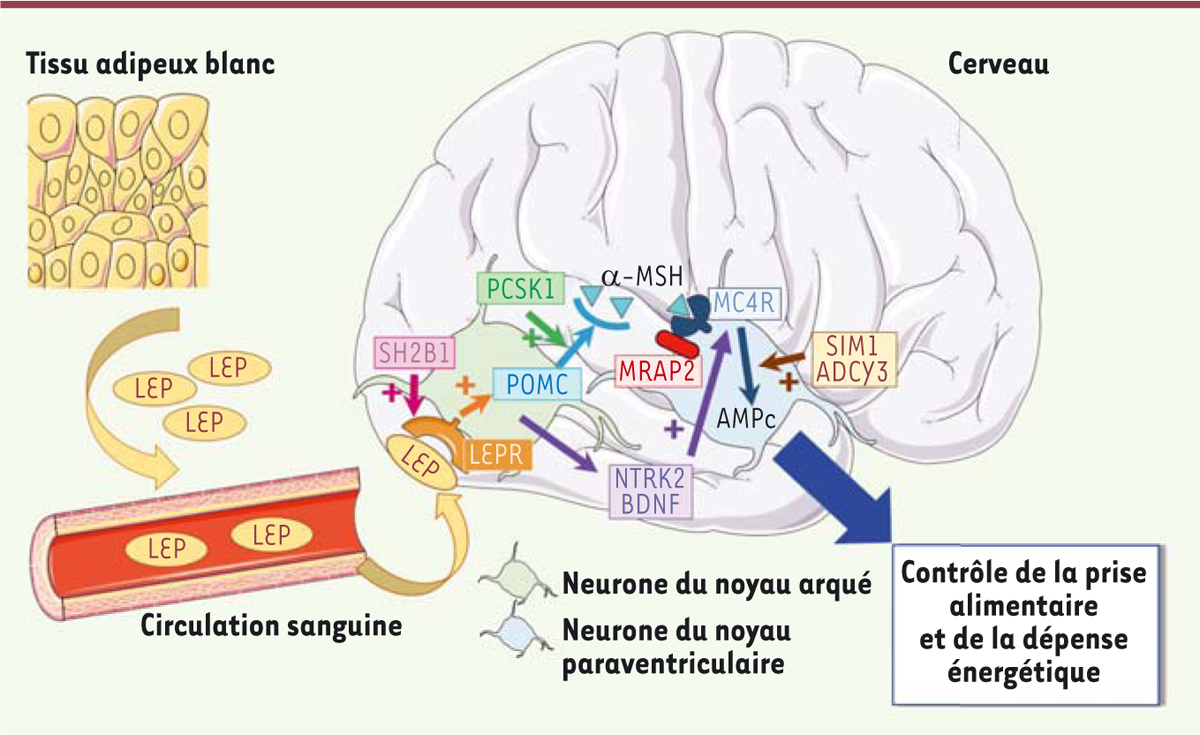
 | Figure 1.
Gènes impliqués dans la voie de la leptine-mélanocortine dont les mutations pathogènes entraînent des formes monogéniques d’obésité.
|
POMC et MC4R
La voie de la mélanocortine est un des mécanismes effecteurs clé de la signalisation induite par la leptine au niveau du cerveau
(
Figure 1
)
[
11
]. L’hypothalamus est le centre de régulation énergétique à long terme du cerveau. Il intègre en permanence des informations d’origines centrale et périphérique sur le statut nutritionnel, énergétique et environnemental du corps. Le noyau arqué, situé à la base de l’hypothalamus, est le relais principal de l’action centrale de la leptine [
12
]. Il renferme, entre autres, les corps cellulaires des neurones NPY/AgRP (neuropeptide Y/
Agouti-Related protein
) et POMC/CART (proopiomélanocortine/
cocaine and amphetamine-related transcript
), dont les axones projettent vers les centres de second ordre, noyau paraventriculaire (PVN) et aire hypothalamique latérale (LH) [
13
]. Les neurones POMC sont stimulés par la leptine et inhibés par les neurones NPY/AgRP voisins. Des modifications post-traductionnelles de la POMC, qui est une pro-hormone, conduisent à la production d’agonistes (α-, β- et g-MSH) de cinq récepteurs de la mélanocortine (MC1R-MC5R), entraînant diverses fonctions biologiques. Parmi celles-ci, la signalisation induite par l’activation du récepteur MC4R joue un rôle clé dans la balance énergétique
(
Figure 1
)
.
Chez l’homme, la découverte de mutations des gènes
LEP
et
LEPR
a permis d’identifier, il y a une vingtaine d’années, le rôle central de la voie leptine/mélanocortine dans la régulation de la satiété. Les recherches se sont alors naturellement orientées sur l’étude d’autres molécules impliquées dans cette voie. Le gène
MC4R
étant petit et constitué d’un seul exon codant, il était l’un des plus faciles à séquencer et donc l’un des premiers à avoir été étudié. En 1998, notre équipe et celle dirigée par Stephen O’Rahilly ont décrit pour la première fois deux familles différentes, dont les apparentés obèses étaient porteurs à l’état hétérozygote de mutations du gène
MC4R
[
14
,
15
]. Depuis, plus d’une centaine de mutations de ce gène ont été décrites dans des cohortes d’adultes et d’enfants obèses, faisant de
MC4R
la première cause connue d’obésité génétique, avec une prévalence d’environ 5 % dans les cohortes d’enfants obèses et de 2 % chez les adultes obèses [
16
]. Les sujets porteurs de mutations à l’état homozygote sont rares en Europe mais plus fréquents dans des populations consanguines, comme au Pakistan [
17
]. Ces patients présentent une obésité très sévère, dès les premiers mois de vie, ainsi qu’une hyperphagie [
18
]. Les individus hétérozygotes présentent des phénotypes plus variables
(
Tableau I
)
.
Des mutations homozygotes du gène
POMC
ont été décrites chez les patients pour la première fois en 1998 [
19
]
(
Tableau I
)
. Identifiées depuis chez d’autres individus, ces mutations résultent en une obésité sévère associée à une insuffisance surrénalienne et, le plus souvent, à des cheveux roux et une peau pâle
(
Tableau I
)
. Par contre, si l’identification de mutations hétérozygotes du gène a été parfois abordée dans la littérature, leur réel impact sur l’obésité (avec une transmission autosomique dominante) n’a jamais réellement été démontré à grande échelle.
Autres formes d’obésité monogénique
La protéine PCSK1 (prohormone convertase 1) intervient dans les mécanismes de modifications post-traductionnelles de POMC responsables de son clivage en adrénocorticotrophine (ACTH)
(
Figure 1
)
. Les mutations homozygotes du gène
PCSK1
entraînent une obésité associée à une hyperphagie, une hypoglycémie post-prandiale, une déficience en glucocorticoïdes, un hypogonadisme et une malabsorption intestinale
(
Tableau I
)
[
20
]. Les porteurs de mutations tronquantes hétérozygotes ont, quant à eux, un phénotype moins sévère, avec une obésité ou un surpoids isolé [
21
].
La protéine SIM1 (
single-minded family basic helix-loop-helix [bHLH] transcription factor 1
) est un facteur de transcription impliqué dans la voie leptine/mélanocortine. Elle régule l’expression du récepteur MC4R
(
Figure 1
)
[
22
]. Les mutations hétérozygotes du gène
SIM1,
induisant une perte de fonction de la protéine, sont la cause d’une obésité sévère, associées ou non à une déficience intellectuelle
(
Tableau I
)
[
23
,
24
].
Des mutations d’autres gènes impliqués dans la voie leptine/mélanocortine sont suspectées d’être à l’origine d’obésités monogéniques. Les noyaux arqués de l’hypothalamus qui produisent la POMC, sont activés par la leptine qui module la prise énergétique, notamment par la voie impliquant la mélanocortine, en favorisant la libération des facteurs anorexigènes BDNF (
brain-derived neurotrophic factor
) et NTRK2 (
neurotrophic tyrosine kinase receptor 2
)
(
Figure 1
)
. Une mutation perte de fonction hétérozygote du gène
NTRK2
a ainsi été décrite chez un petit garçon présentant une obésité précoce et sévère, associée à d’autres signes
(
Tableau I
)
[
25
]. D’autres variants de
NTRK2
ont été identifiés chez des patients avec une obésité sévère associée à un retard de développement, mais sans significativité établie [
26
]. De même, une haploinsuffisance du gène
BDNF,
par inversion chromosomique
de novo
, a été observée chez une patiente présentant une obésité sévère et précoce, également associée à d’autres phénotypes
(
Tableau I
)
[
27
]. Une étude récente a décrit deux mutations ponctuelles du gène
BDNF
chez trois patients obèses mais le lien fonctionnel entre ces mutations et l’apparition de l’obésité n’a pas été clairement établi [
28
].
SH2B1
(
Src homology 2 B adaptor protein 1
) code une protéine adaptatrice de la voie de signalisation intracellulaire de nombreuses hormones, dont l’insuline, la leptine, l’hormone de croissance et le NGF (
nerve growth factor
). Des mutations hétérozygotes et perte de fonction dans ce gène ont été décrites chez des patients présentant une obésité sévère et précoce, également associée à d’autres signes
(
Tableau I
)
[
29
].
Très récemment, des mutations du gène
ADCY3
qui entraînent une obésité sévère ont été mises en évidence. Ce gène code une adénylate cyclase localisée dans les cils primaires cérébraux, notamment ceux de l’hypothalamus
(
Figure 1
)
[
30
,
31
]. Cette protéine se localise conjointement avec MC4R au niveau des cils primaires hypothalamiques. Son absence, due à des mutations récessives du gène, entraîne une obésité
via
un défaut de signalisation de l’AMP cyclique (AMPc) dans la voie initiée par MC4R [
30
,
31
]. Les patients déficients pour le gène
ADCY3
présentent, en plus de leur obésité sévère, une anosmie (perte de l’odorat)
(
Tableau I
)
[
31
].
Médecine de précision dans les formes monogéniques d’obésité
L’identification des causes génétiques des formes monogéniques d’obésité a permis de développer plusieurs applications de médecine de précision. Chez les patients déficients en leptine, l’hyperphagie sévère et les phénotypes associés, par exemple, les dysfonctions neuroendocrines, peuvent être restaurés par l’administration de leptine recombinante (métréleptine [Myalept®],
Amylin Pharmaceuticals
), qui a été le premier exemple de médecine de précision dans l’obésité extrême [
32
]
4
. Plus récemment, deux patientes sévèrement obèses et déficientes en POMC ont été traitées avec succès lors d’un essai clinique de phase II par la setmélanotide (RM-493), un peptide cyclique de huit acides aminés se liant au récepteur MC4R [
33
]. Ce traitement a également été efficace chez trois patients, dont une adolescente, sévèrement obèses, porteurs d’une mutation du gène
LEPR
[
34
]. Etant donné l’importance de ce récepteur dans la voie leptine/mélanocortine, ce traitement apparaît comme très prometteur dans le traitement de l’obésité monogénique, notamment dans le cas de mutations de gènes codant des protéines participant à la voie leptine/mélanocortine, tels que
PCSK1
,
MC4R
et
SH2B1
, en plus de
POMC
et
LEPR
. Un essai clinique de phase II, mené par
Rhythm Pharmaceuticals Inc
, est actuellement en cours, incluant 80 patients porteurs de ces formes d’obésité, ainsi que de syndromes d’obésité associés à une déficience intellectuelle (ClinicalTrials.gov Identifier : NCT03013543). Les résultats de cette étude, prévus pour le milieu de l’année 2021, permettront d’évaluer l’effet de la setmélanotide, un agoniste du MC4R, sur la perte de poids et la sensation de faim chez les patients sévèrement obèses. Une étude a d’ores et déjà démontré
in vitro
que cette molécule permettait de reconstituer le signal activé par l’αMSH (l’un des agonistes du MC4R), mais uniquement pour certains variants du gène
MC4R
[
35
]. La description de l’impact fonctionnel des variants des gènes sera sûrement une condition
sine qua non
avant d’indiquer le traitement chez l’homme.
Le traitement spécifique de ces formes monogéniques d’obésité montre le caractère essentiel du dépistage génétique de chaque patient obèse (notamment par des protocoles adaptés de séquençage de nouvelle génération [
36
]), surtout lorsque l’obésité est apparue très précocement, afin de permettre une prise en charge personnalisée.
|
Découverte récente d’un gène de l’obésité monogénique (MRAP2) altérant, outre l’appétit, la glycémie et la tension artérielle
Le gène
MRAP2
code une protéine, découverte à la fin des années 2000, accessoire des récepteurs couplés aux protéines G (RCPG) [
37
]. Les protéines accessoires de RCPG sont des protéines transmembranaires à passage unique, qui, en se fixant à ces récepteurs, régulent leur transport à la membrane et/ou les voies de signalisation qu’ils induisent. Dans l’étude princeps portant sur MRAP2, les auteurs avaient montré que la protéine était exprimée dans le cerveau humain (principalement l’hypothalamus) et la glande surrénale, et qu’elle pouvait interagir avec les cinq récepteurs de la mélanocortine, dont MC4R [
37
]. Deux articles, publiés dans
Science
, ont, par la suite, montré que MRAP2 se fixait
in vivo
sur MC4R chez le poisson zèbre et la souris, et qu’elle stimulait la génération d’AMPc induite par MC4R en réponse à l’αMSH
(
Figure 1
)
[
38
,
39
]. Il fut également montré que des souris déficientes en
Mrap2
dans tout le corps ou spécifiquement au niveau du cerveau, développaient une obésité sévère précoce [
38
]. Cependant, bien que quelques mutations du gène
MRAP2
aient été décrites dans la littérature chez des patients obèses, le lien de causalité entre la perte de fonction de la protéine et l’obésité n’avait jamais été clairement démontré chez l’homme [
40
].
Par un séquençage de nouvelle génération réalisé chez 9 418 participants, incluant 1 991 adultes obèses et 1 137 adolescents obèses, nous avons identifié 23 mutations rares de
MRAP2
(avec une fréquence allélique inférieure à 1 % chez les participants), qui étaient associées à une augmentation du risque d’obésité, à la fois chez les adultes et chez les enfants [
40
]. Nous avons analysé l’impact fonctionnel de chacune de ces mutations dans les cellules de la lignée cellulaire CHO (
chinese hamster ovary
), qui n’expriment pas de manière native les gènes de la voie de la mélanocortine. Nous avons transfecté ces cellules avec une construction plasmidique incluant le gène
MC4R
, un plasmide exprimant le gène
MRAP2
sauvage ou portant l’une des 23 mutations identifiées dans notre étude, un plasmide contenant le gène de la luciférase sous le contrôle d’un promoteur activé par l’AMPc, et un plasmide de normalisation, contenant le gène de la b-galactosidase. Après 48 heures, les cellules ont été traitées avec un agoniste du récepteur MC4R. Dans ces conditions, si la protéine MRAP2 était fonctionnelle, l’agoniste pouvait se fixer au récepteur MC4R, ce qui entraînait la production d’AMPc et donc l’expression de la luciférase. Nous avons pu ainsi déterminer quelles mutations du gène
MRAP2
induisaient une perte de fonction biologique de la protéine
via
une diminution de la production d’AMPc [
40
]. Nous avons ensuite utilisé les critères de l’ACMG (
american college of medical genetics and genomics
) pour évaluer la pathogénicité de chaque mutation (« pathogène », « probablement pathogène » ou « de signification incertaine ») en prenant en compte nos explorations
in vitro
. Ces critères sont devenus une référence dans les diagnostics génétiques de maladies rares car l’établissement d’un rapport de causalité entre la présence d’une mutation et une maladie est difficile à établir et nécessite l’utilisation de critères génétiques et fonctionnels complémentaires. Sept mutations pathogènes inhibant l’activité de MRAP2, qui étaient totalement pénétrantes pour le surpoids ou l’obésité, ont ainsi été identifiées chez les adultes et les enfants [
40
]. Étonnamment, les porteurs de ces mutations présentaient un syndrome métabolique lié à une hyperglycémie et une hypertension, en plus d’une adiposité anormale [
40
]. Le phénotype des patients porteurs d’une mutation pathogène de
MRAP2
est donc très différent des autres formes d’obésité monogénique qui avaient été préalablement décrites
(
Tableau I
)
. En effet, l’obésité des patients porteurs d’une mutation de
MRAP2
était en moyenne plutôt modérée [
40
]. Les formes d’obésité monogénique dues à une dysfonction de la voie leptine/mélanocortine, en dehors de la déficience en
MRAP2
, ne sont généralement pas associées à une hyperglycémie ou même à une hypertension
(
Tableau I
)
[
40
]. Ainsi, contrairement aux autres gènes de la voie leptine/mélanocortine,
MRAP2
pourrait être exprimé et jouer un rôle biologique dans des organes métaboliques, en dehors du cerveau. Grâce à la technologie NanoString, qui permet d’évaluer les niveaux d’ARN messagers produits sans étape d’amplification par PCR, il nous a été possible de montrer, chez l’homme, une forte expression de
MRAP2
dans les îlots de Langerhans et les cellules bêta-pancréatiques, dans plusieurs régions cérébrales, dont l’hypothalamus, et, dans une moindre mesure, dans d’autres tissus métaboliques [
40
]. Parallèlement, la diminution d’expression de
MRAP2
, par l’utilisation de siARN, réduit la sécrétion d’insuline en réponse à des niveaux élevés de glucose dans les cellules bêta humaines de la lignée EndoC-βH1 [
40
]. Deux études réalisées chez la souris ont, par ailleurs, montré que des animaux n’exprimant plus
Mrap2
présentent une altération de l’homéostasie glucidique à jeun ou après un test de tolérance à l’insuline ou au glucose [
40
]. De même, chez ces souris, l’intolérance au glucose se produit avant qu’elles ne développent une obésité, suggérant un effet direct de MRAP2 dans la sécrétion d’insuline au niveau des cellules bêta pancréatiques. Étant donnée son expression relativement pléiotrope, il semble que MRAP2 serait une protéine accessoire de multiples RCPG, distribués dans divers tissus métaboliques. Comme la déficience en
MRAP2
altère la fonction de MC4R, l’hyperphagie des patients déficients pour
MRAP2
pourrait néanmoins être traitée par la setmélanotide, l’agoniste de MC4R [
33
,
34
].
|
Les investigations génétiques des formes monogéniques d’obésité ont démontré le rôle majeur de la voie leptine/mélanocortine dans le contrôle de la prise alimentaire et de la dépense énergétique chez l’homme. De multiples acteurs de cette voie sont mutés dans les formes les plus sévères et précoces de l’obésité, touchant moins de 5 % des patients obèses. Dernièrement, un nouvel acteur de cette voie, MRAP2, dont la déficience entraîne une obésité monogénique accompagnée d’hyperglycémie et d’hypertension, a été identifié. Nous pensons que ces phénotypes additionnels sont liés à une action pléiotropique de MRAP2, notamment au niveau des cellules bêta pancréatiques. Ces découvertes démontrent l’impact des études de génétique humaine dans la compréhension de la physiopathologie de l’obésité. Il est, par ailleurs, à noter que l’étude de ces formes monogéniques d’obésité a vu naître des applications directes de médecine de précision, démontrant le caractère essentiel du dépistage génétique des patients atteints d’une obésité précoce. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Matta
J
,
Zins
M
,
Feral-Pierssens
A
,
et al.
Prévalence du surpoids, de l’obésité et des facteurs de risque cardio-métaboliques dans la cohorte Constances.
.
Bull Epidémiol Hebd.
2016;
;
35–36
:
:640.
–
646
.
2.
Global BMI Mortality Collaboration.
,
Di Angelantonio
E
,
Bhupathiraju
SN
,
Wormser
D
,
et al.
Body-mass index and all-cause mortality: individual-participant-data meta-analysis of 239 prospective studies in four continents.
.
Lancet.
2016;
;
388
:
:776.
–
786
.
3.
Simonnet
A
,
Chetboun
M
,
Poissy
J
, et al.
High prevalence of obesity in severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) requiring invasive mechanical ventilation.
.
Obesity (Silver Spring).
2020;
;
28
(
(7)
) :
:1195.
–
9
.
4.
Wardle
J
,
Carnell
S
,
Haworth
CM
,
et al.
Evidence for a strong genetic influence on childhood adiposity despite the force of the obesogenic environment.
.
Am J Clin Nutr.
2008;
;
87
:
:398.
–
404
.
5.
Yengo
L
,
Sidorenko
J
,
Kemper
KE
,
et al.
Meta-analysis of genome-wide association studies for height and body mass index in ≈700000 individuals of European ancestry.
.
Hum Mol Genet.
2018;
;
27
:
:3641.
–
3649
.
6.
Ndiaye
FK
,
Huyvaert
M
,
Ortalli
A
, et al.
The expression of genes in top obesity-associated loci is enriched in insula and substantia nigra brain regions involved in addiction and reward.
.
Int J Obes (Lond).
2020;
;
44
:
:539.
–
43
.
7.
Zhang
Y
,
Proenca
R
,
Maffei
M
,
et al.
Positional cloning of the mouse obese gene and its human homologue.
.
Nature.
1994;
;
372
:
:425.
–
432
.
8.
Maffei
M
,
Halaas
J
,
Ravussin
E
,
et al.
Leptin levels in human and rodent: measurement of plasma leptin and ob RNA in obese and weight-reduced subjects.
.
Nat Med.
1995;
;
1
:
:1155.
–
1161
.
9.
Montague
CT
,
Farooqi
IS
,
Whitehead
JP
,
et al.
Congenital leptin deficiency is associated with severe early-onset obesity in humans.
.
Nature.
1997;
;
387
:
:903.
–
908
.
10.
Clément
K
,
Vaisse
C
,
Lahlou
N
,
et al.
A mutation in the human leptin receptor gene causes obesity and pituitary dysfunction.
.
Nature.
1998;
;
392
:
:398.
–
401
.
11.
Ellacott
KLJ
,
Cone
RD
The role of the central melanocortin system in the regulation of food intake and energy homeostasis: lessons from mouse models.
.
Philos Trans R Soc Lond, B, Biol Sc.
2006;
;
361
:
:1265.
–
1274
.
12.
Morton
GJ
,
Cummings
DE
,
Baskin
DG
,
et al.
Central nervous system control of food intake and body weight.
.
Nature.
2006;
;
443
:
:289.
–
295
.
13.
Arora
S
Anubhuti null. Role of neuropeptides in appetite regulation and obesity: a review.
.
Neuropeptides.
2006;
;
40
:
:375.
–
401
.
14.
Vaisse
C
,
Clement
K
,
Guy-Grand
B
,
et al.
A frameshift mutation in human MC4R is associated with a dominant form of obesity.
.
Nat Genet.
1998;
;
20
:
:113.
–
114
.
15.
Yeo
GS
,
Farooqi
IS
,
Aminian
S
,
et al.
A frameshift mutation in MC4R associated with dominantly inherited human obesity.
.
Nat Genet.
1998;
;
20
:
:111.
–
112
.
16.
Stutzmann
F
,
Tan
K
,
Vatin
V
,
et al.
Prevalence of melanocortin-4 receptor deficiency in Europeans and their age-dependent penetrance in multigenerational pedigrees.
.
Diabetes.
2008;
;
57
:
:2511.
–
2518
.
17.
Saeed
S
,
Arslan
M
,
Froguel
P
Genetics of obesity in consanguineous populations: toward precision medicine and the discovery of novel obesity genes.
.
Obesity (Silver Spring).
2018;
;
26
:
:474.
–
484
.
18.
Dubern
B
,
Bisbis
S
,
Talbaoui
H
, et al.
Homozygous null mutation of the melanocortin-4 receptor and severe early-onset obesity.
.
J Pediatr.
2007;
;
150
:
:6137.
,
617.e1
.
19.
Krude
H
,
Biebermann
H
,
Luck
W
,
et al.
Severe early-onset obesity, adrenal insufficiency and red hair pigmentation caused by POMC mutations in humans.
.
Nat Genet.
1998;
;
19
:
:155.
–
157
.
20.
O’Rahilly
S
,
Gray
H
,
Humphreys
PJ
,
et al.
Brief report: impaired processing of prohormones associated with abnormalities of glucose homeostasis and adrenal function.
.
N Engl J Med.
1995;
;
333
:
:1386.
–
1390
.
21.
Philippe
J
,
Stijnen
P
,
Meyre
D
,
et al.
A nonsense loss-of-function mutation in PCSK1 contributes to dominantly inherited human obesity.
.
Int J Obes.
2015;
;
39
:
:295.
–
302
.
22.
Tolson
KP
,
Gemelli
T
,
Gautron
L
,
et al.
Postnatal Sim1 deficiency causes hyperphagic obesity and reduced Mc4r and oxytocin expression.
.
J Neurosc.
2010;
;
30
:
:3803.
–
3812
.
23.
Bonnefond
A
,
Raimondo
A
,
Stutzmann
F
,
et al.
Loss-of-function mutations in SIM1 contribute to obesity and Prader-Willi-like features.
.
J Clin Invest.
2013;
;
123
:
:3037.
–
3041
.
24.
Ramachandrappa
S
,
Raimondo
A
,
Cali
AMG
,
et al.
Rare variants in single-minded 1 (SIM1) are associated with severe obesity.
.
J Clin Invest.
2013;
;
123
:
:3042.
–
3050
.
25.
Yeo
GSH
,
Connie Hung
CC
,
Rochford
J
,
et al.
A de novo mutation affecting human TrkB associated with severe obesity and developmental delay.
.
Nat Neurosci.
2004;
;
7
:
:1187.
–
1189
.
26.
Gray
J
,
Yeo
G
,
Hung
C
,
et al.
Functional characterization of human NTRK2 mutations identified in patients with severe early-onset obesity.
.
Int J Obes (Lond).
2007;
;
31
:
:359.
–
364
.
27.
Gray
J
,
Yeo
GSH
,
Cox
JJ
,
et al.
Hyperphagia, severe obesity, impaired cognitive function, and hyperactivity associated with functional loss of one copy of the brain-derived neurotrophic factor (BDNF) gene.
.
Diabetes.
2006;
;
55
:
:3366.
–
3371
.
28.
Serra-Juhé
C
,
Martos-Moreno
GÁ
,
Bou de Pieri
F
, et al.
Heterozygous rare genetic variants in non-syndromic early-onset obesity.
.
Int J Obes (Lond).
2020;
;
44
:
:830.
–
41
.
29.
Doche
ME
,
Bochukova
EG
,
Su
H-W
,
et al.
Human SH2B1 mutations are associated with maladaptive behaviors and obesity.
.
J Clin Invest.
2012;
;
122
:
:4732.
–
4736
.
30.
Siljee
JE
,
Wang
Y
,
Bernard
AA
,
et al.
Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity.
.
Nat Genet.
2018;
;
50
:
:180.
–
185
.
31.
Saeed
S
,
Bonnefond
A
,
Tamanini
F
,
et al.
Loss-of-function mutations in ADCY3 cause monogenic severe obesity.
.
Nat Genet.
2018;
;
50
:
:175.
–
179
.
32.
Farooqi
IS
,
Jebb
SA
,
Langmack
G
,
et al.
Effects of recombinant leptin therapy in a child with congenital leptin deficiency.
.
N Engl J Med.
1999;
;
341
:
:879.
–
884
.
33.
Kühnen
P
,
Clément
K
,
Wiegand
S
,
et al.
Proopiomelanocortin deficiency treated with a melanocortin-4 receptor agonist.
.
N Engl J Med.
2016;
;
375
:
:240.
–
246
.
34.
Clément
K
,
Biebermann
H
,
Farooqi
IS
,
et al.
MC4R agonism promotes durable weight loss in patients with leptin receptor deficiency.
.
Nat Med.
2018;
;
24
:
:551.
–
555
.
35.
Collet
TH
,
Dubern
B
,
Mokrosinski
J
,
et al.
Evaluation of a melanocortin-4 receptor (MC4R) agonist (Setmelanotide) in MC4R deficiency.
.
Mol Metab.
2017;
;
6
:
:1321.
–
1329
.
36.
Montagne
L
,
Derhourhi
M
,
Piton
A
,
et al.
CoDE-seq, an augmented whole-exome sequencing, enables the accurate detection of CNVs and mutations in Mendelian obesity and intellectual disability.
.
Mol Metab.
2018;
;
13
:
:1.
–
9
.
37.
Chan
LF
,
Webb
TR
,
Chung
TT
,
et al.
MRAP and MRAP2 are bidirectional regulators of the melanocortin receptor family.
.
Proc Natl Acad Sci USA.
2009;
;
106
:
:6146.
–
6151
.
38.
Asai
M
,
Ramachandrappa
S
,
Joachim
M
,
et al.
Loss of function of the melanocortin 2 receptor accessory protein 2 is associated with mammalian obesity.
.
Science.
2013;
;
341
:
:275.
–
278
.
39.
Sebag
JA
,
Zhang
C
,
Hinkle
PM
,
et al.
Developmental control of the melanocortin-4 receptor by MRAP2 proteins in zebrafish.
.
Science.
2013;
;
341
:
:278.
–
281
.
40.
Baron
M
,
Maillet
J
,
Huyvaert
M
,
et al.
Loss-of-function mutations in MRAP2 are pathogenic in hyperphagic obesity with hyperglycemia and hypertension.
.
Nat Med.
2019;
;
25
:
:1733.
–
1738
.
|