| |
| Med Sci (Paris). 36(10): 847–851. doi: 10.1051/medsci/2020153.Un rôle pour les astrocytes dans les déficiences intellectuelles ? Noémie Cresto,1,2 Pierre Billuart,2*# and Nathalie Rouach1**# 1Interactions neurogliales dans la physiologie et pathologies cérébrales, Centre interdisciplinaire de recherche en biologie, Collège de France, CNRS UMR 7241, Inserm U1050, Labex Memolife, Université PSL
,
75005Paris
,
France
.
2Institut de psychiatrie et de neurosciences de Paris, Inserm U1266, université de Paris
,
75014Paris
,
France
.
MeSH keywords: Astrocytes, Humains, Déficience intellectuelle, Synapses, Transmission synaptique, anatomopathologie, physiologie, étiologie, psychologie |
Les troubles du neurodéveloppement, qui incluent les déficiences intellectuelles, se caractérisent par des anomalies dans la formation et le fonctionnement des circuits synaptiques. Bien que la plupart des recherches sur la synapse dans le domaine de la santé et des maladies soient restreintes à l’étude des neurones, un nombre croissant de travaux souligne l’importance des astrocytes dans la mise en place et la fonction des synapses. Ainsi, quelques études portant sur les déficiences intellectuelles ont récemment mis en évidence les contributions potentielles des astrocytes dans la pathogenèse de ces affections. Dans cet article, nous analysons comment les altérations des fonctions astrogliales dans la maladie peuvent affecter la formation ou le fonctionnement des synapses et l’excitabilité neuronale, et ainsi contribuer à la déficience intellectuelle. |
La neuropathie : une vision restrictive des déficiences intellectuelles
La déficience intellectuelle (également appelée trouble d’apprentissage, retard mental, ou déficit cognitif) est définie par un quotient intellectuel (QI) inférieur à 70, associé à un déficit des capacités d’adaptation conceptuelle, sociale et pratique se manifestant avant l’âge de 18 ans. Les causes de la déficience intellectuelle sont hétérogènes et incluent des facteurs génétiques et environnementaux (infections, intoxications,
etc.
), qui interfèrent avec le développement et le fonctionnement du système nerveux central durant la période périnatale. Les causes génétiques sont responsables de 40 % à 50 % des déficiences intellectuelles modérées à sévères (quotient intellectuel < 50), les plus connues étant la trisomie 21, le syndrome de Rett (mutations du gène
MECP2
codant la
methyl-CpG-binding protein 2
), et le syndrome du chromosome X fragile (mutations du gène
FMR1
codant la
FMRP translational regulator 1
). La plupart des gènes impliqués dans les déficiences intellectuelles codent des protéines enrichies dans les compartiments synaptiques, et qui sont impliquées dans le développement des circuits neuronaux [
1
]. L’expression de ces gènes, initialement considérée comme restreinte aux neurones, a récemment été décrite dans les astrocytes, suggérant que ces cellules gliales pourraient également contribuer à la déficience intellectuelle [
2
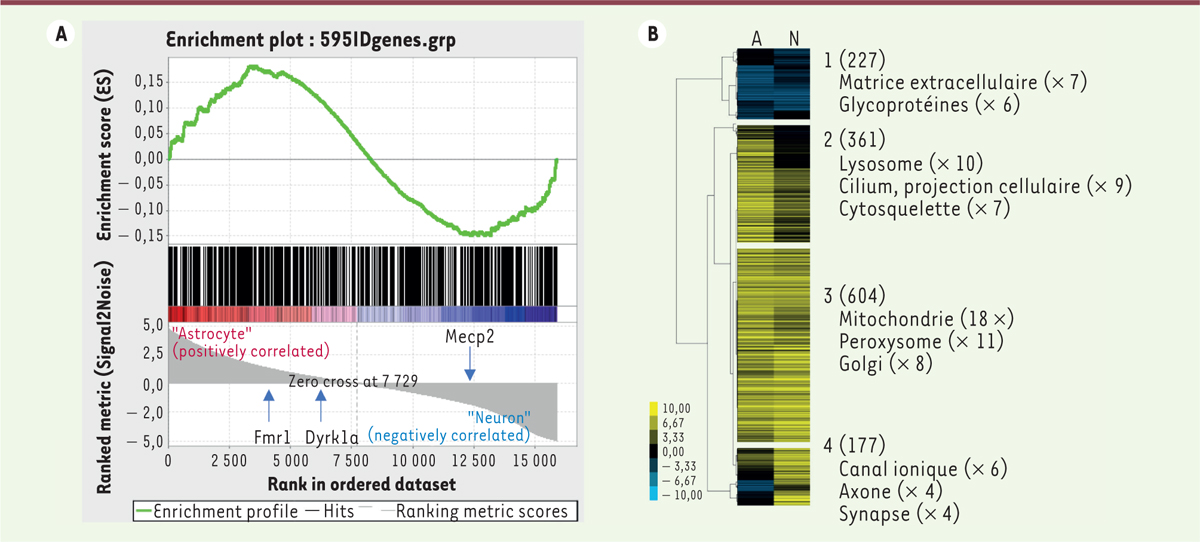
]. Notre analyse récente de l’expression de quelque 600 gènes impliqués dans la déficience intellectuelle ne montre en effet pas d’enrichissement global dans un type cellulaire donné
(
Figure 1A
)
. Une analyse approfondie portant sur 1 370 gènes impliqués dans la déficience intellectuelle révèle même que 361 d’entre eux (groupe 2 de la
Figure 1B
) sont plus exprimés dans les astrocytes que dans les neurones [
3
,
4
]. Il convient de noter que les orthologues murins de
FMR1
ou
MECP2
, ainsi que ceux de plusieurs gènes impliqués dans la trisomie 21 (
SOD1, DYRK1a, S100
b
et OLIG2
), sont également exprimés dans les astrocytes
(
Figure 1A
)
.
 | Figure 1.
Expression astrocytaire des gènes impliqués dans la déficience intellectuelle. A.
Les analyses d’expression d’environ 600 gènes impliqués dans la déficience intellectuelle [
3
] dans les astrocytes (en rouge) ou dans les neurones (en bleu) ne montrent pas globalement d’expression préférentielle dans un type cellulaire donné (score d’enrichissement normalisé = 1 ;
p
= 0,4). Les expressions de
Fmr1
,
Dyrk1a
et de
Mecp2
sont mises en surbrillance dans la liste classée (partie inférieure).
B.
Les analyses de classification hiérarchique (logiciel Cluster 3) d’environ 1 370 gènes impliqués dans la déficience intellectuelle [
3
], fondées sur leur profil d’expression dans les astrocytes (A) et les neurones (N), ont permis d’identifier quatre groupes (numérotés de 1 à 4) visualisés à l’aide du logiciel Java Treeview. L’analyse informatique ontologique des gènes de chaque
cluster
(outil d’annotation fonctionnelle David) a révélé des enrichissements de fonctionnalité ou d’expression dans différents compartiments cellulaires.
|
|
Perturbations du développement et du phénotype des astrocytes dans la déficience intellectuelle
Alors que la plupart des déficiences intellectuelles et des troubles du spectre autistique sont présentés comme des anomalies du développement neuronal, le développement des astrocytes y est également affecté. Des études portant sur la trisomie 21 ont notamment montré une augmentation du nombre d’astrocytes et de leur complexité morphologique, ainsi que du nombre de cellules gliales radiales dans le lobe frontal du fœtus à différents stades de développement [
5
]. De même, une augmentation de la différenciation astrocytaire à partir de cellules souches pluripotentes a été observée dans le syndrome de Rett [
6
].
De plus, dans la plupart des déficiences intellectuelles, les astrocytes présentent un phénotype altéré (
Tableau I
et
Figure 2
), avec une modification de l’expression de plusieurs marqueurs astrocytaires, tels que la protéine acide fibrillaire gliale (
glial fibrillary acidic protein
, GFAP) et la protéine S100b, et une forme moins complexe, caractérisée par des prolongements épais, suggérant une réactivité astrocytaire anormale [
2
]. Une augmentation de l’expression de
Gfap
a ainsi été rapportée dans des astrocytes issus de souris déficientes pour
Mecp2
, ainsi que chez des patients atteints du syndrome de Rett. De même, dans la trisomie 21, des anomalies des astrocytes consistant en des taux élevés de S100b (x75) et de GFAP (x5) ont été observées, aussi bien dans des cellules différenciées à partir de cellules souches pluripotentes induites (CSPi) que dans le tissu cérébral humain [
5
]. Il est à noter que le chromosome 21 humain porte le gène codant S100b, mais pas celui codant la GFAP, suggérant que la réactivité anormale des astrocytes n’est pas directement liée à la triplication de ce gène. Cependant, dans le cas du syndrome « X fragile », les études de l’expression de
GFAP
conduisent à des résultats discordants, questionnant la réalité d’une réactivité astrocytaire anormale [
7
].
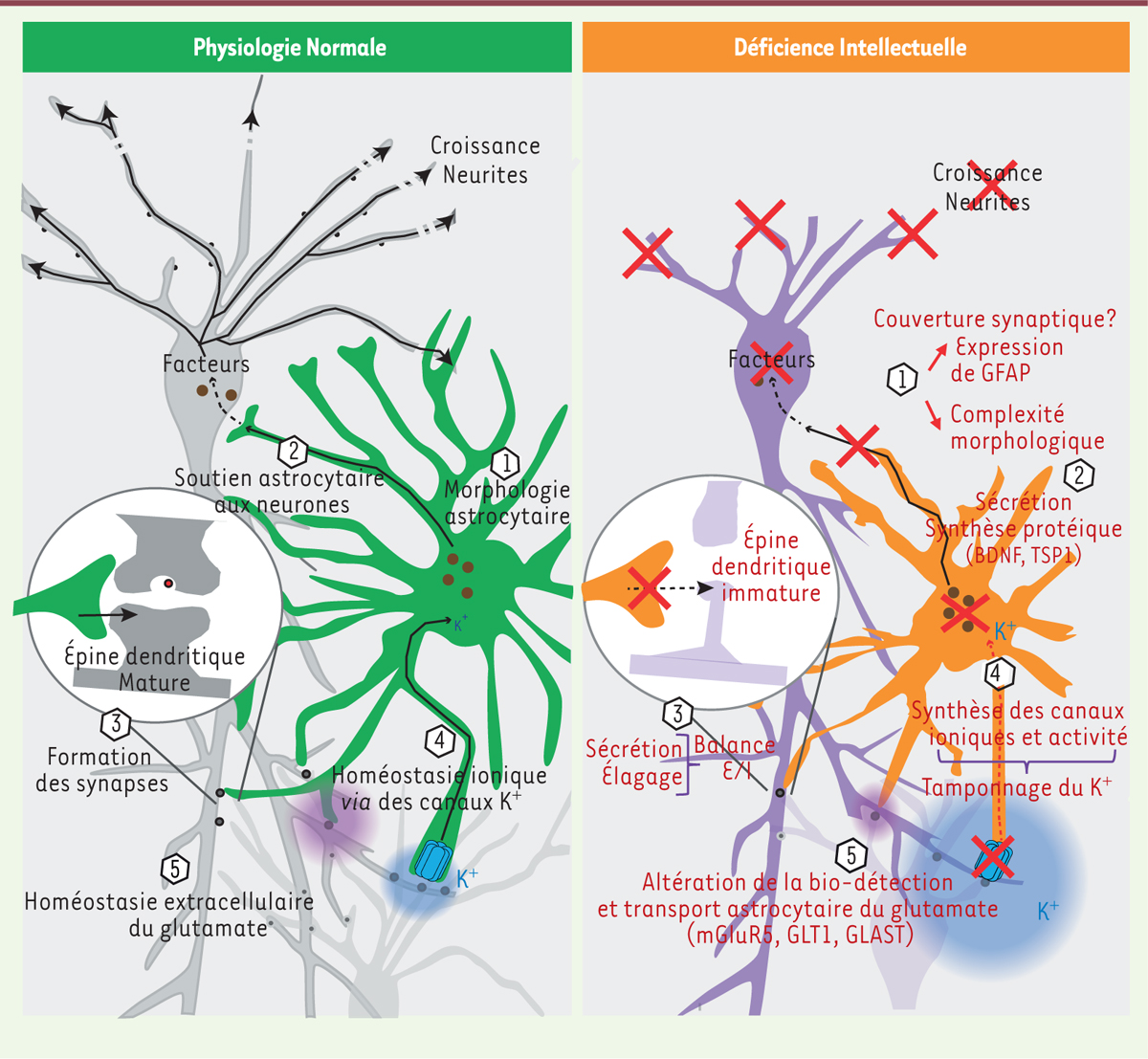
 | Figure 2.
Astrocytes et synapse tripartite en conditions physiologiques et dans la déficience intellectuelle.
Représentation schématique de la condition physiologique (panneau de gauche) et de la condition physiopathologique de déficience intellectuelle (panneau de droite), à partir des principales altérations trouvées dans la trisomie 21, le syndrome du chromosome X fragile, et le syndrome de Rett. Un certain nombre de caractéristiques communes sont modifiées dans les astrocytes des individus atteints de déficience intellectuelle, incluant des changements : (1) de la complexité et de la réactivité astrogliale ; (2) de la synthèse et de la sécrétion de facteurs astrogliaux qui soutiennent la croissance neuronale ; (3) de l’élagage des synapses par les astrocytes, conduisant à la formation d’épines dendritiques immatures ; (4) de la synthèse et de l’activité des canaux ioniques astrocytaires (Kir4.1) permettant de « tamponner » le K
+
extracellulaire, ce qui prévient l’hyperexcitabilité du réseau neuronal ; (5) de l’expression de récepteurs (mGluR5) et de transporteurs (GLT1, GLAST) permettant la détection et la clairance du glutamate. E/I : excitateur/inhibiteur.
|
Tableau I.
| Changements astrocytaires impliqués |
Syndrome de Rett |
Trisomie 21 |
Syndrome de l’X fragile |
|
Profil phénotypique anormal des astrocytes
|
Signalisation
|
La déficience de MECP2 favorise la différenciation de cellules souches neurales multipotentes en astrocytes |
Dérégulation astrocytaire de MiR-146 et MiR-155, qui contrôlent la réponse immunitaire innée |
|
| Gènes candidats exprimés dans les astrocytes qui peuvent contribuer aux signes cliniques (ApoC2, Cdon, Csrp, Nrep) |
|
|
|
Réactivité
|
Augmentation de GFAP |
Surexpression de GFAP |
Augmentation de l’expression de TNFR2, LIF, S100b et GFAP chez les souris invalidées pour Fmr1 |
| Régulation de l’expression de GFAP par MECP2 |
Augmentation de l’expression de S100b |
Absence de consensus sur la modulation de l’expression de GFAP chez les patients |
| |
Augmentation des espèces réactives de l’oxygène induite par une augmentation de S100b |
Astrocytes réactifs en l’absence d’activation du système immunitaire périphérique |
|
Récepteurs membranaires et canaux ioniques
|
Altération de la régulation transcriptionnelle de GLT-1 dans les astrocytes déficients en MECP2 conduisant à une clairance anormale du glutamate |
Augmentation de l’expression de mGluR5 dans les astrocytes humains |
Régulation négative de mGluR5 et dérégulation de GLT-1 |
| Régulation négative des gènes codant des récepteurs membranaires impliqués dans la signalisation calcique (mGluR et SUPIR) |
Concentration plus élevée de la protéine GLAST dans les astrocytes mutés conduisant à un taux plus élevé de recapture du glutamate |
Déséquilibre entre glutamate et GABA dans les astrocytes |
|
Régulation négative des gènes codant des protéines impliquées dans la recapture de l’ion K
+
|
Augmentation des fluctuations spontanées de l’ion Ca
2+
dans les astrocytes
|
|
|
|
Anomalies de la maturation neuronale d’origine astrocytaire
|
|
Réduction des branchements des dendrites et de la densité des synapses excitatrices |
Diminution de la densité des épines dendritiques dans les neurones de génotype « sauvage » co-cultivés avec des astrocytes mutés |
Inhibition de la croissance neuronale in vitro et formation retardée des synapses excitatrices dans un modèle murin d’invalidation astrocytaire de Fmr1 |
| Altération de la sécrétion protéique dans les astrocytes déficients en MECP2 induisant une anomalie morphologique des dendrites |
Déficits dans la libération de TSP-1 conduisant à un dysfonctionnement synaptique |
Déficit de libération de TSP-1 conduisant au dysfonctionnement synaptique |
| Dérégulation astrocytaire de BDNF, de la production de cytokines et de la voie des p38MAPK, induisant des anomalies morphologiques des neurones |
Réduction de la concentration intracellulaire astrocytairede Zn
2+
, impliqué dans les processus de croissance neuritique et de différenciation neuronale
|
Altération de la prolifération neuronale par des facteurs libérés par les astrocytes |
| Anomalies morphologiques des neurones de génotype « sauvage » co-cultivés avec des astrocytes déficients en MECP2 issus de CSPi |
Dérégulation de la voie mTOR contrôlant la taille des neurones et la synaptogenèse |
Augmentation de la densité des épines dendritiques et anomalie du développement dendritique dans un modèle murin d’invalidation astrocytaire de Fmr1 |
| Anomalies morphologiques des dendrites via une dérégulation des protéines sécrétées par les astrocytes (chromogranine B et lipocaline-2) |
|
Développement dendritique anormal dû à un excès de neurotrophine-3 astrocytaire |
Implication des astrocytes dans trois formes génétiques de déficience intellectuelle
[
2
].
|
|
Altération des circuits synaptiques par dysfonctionnement astroglial ?
Dans les modèles de déficience intellectuelle, la plupart des neurones ont une structure anormale, avec des ramifications dendritiques réduites et des épines dendritiques fines et longues caractérisées par une faible motilité, suggérant que les réseaux synaptiques restent dans un état immature [
2
]. Les astrocytes ont été récemment impliqués dans la formation et la maturation des réseaux neuronaux, par leurs rôles dans la croissance dendritique, la synaptogenèse, la maturation, le maintien et l’élimination des synapses [
8
]. Une perturbation de ces fonctions des cellules astrogliales dans les déficiences intellectuelles pourrait ainsi contribuer à l’immaturité morphologique et fonctionnelle des réseaux synaptiques
(
Tableau I
)
. En effet, les astrocytes déficients pour
Fmr1
, non seulement inhibent la croissance neuronale et retardent la formation de l’arborisation dendritique et des synapses excitatrices
in vitro
, mais également augmentent la densité des épines dendritiques immatures
in vivo
[
9
]. De même, dans le syndrome de Rett, les astrocytes provenant de la différenciation de CSPi issues de patients altèrent la morphologie neuronale, tandis que la réexpression conditionnelle de
Mecp2
dans les astrocytes de souris déficientes pour ce gène par une approche génétique (système cre/lox) rétablit une ramification des dendrites et un nombre de synapses excitatrices normaux
in vivo
[
6
]. Enfin dans la trisomie 21, la co-culture d’astrocytes porteurs de la trisomie avec des neurones euploïdes entraîne une diminution de la densité des épines dendritiques de ces neurones [
10
]. Ces effets structuraux des astrocytes sur les synapses dans le syndrome de l’X fragile, le syndrome de Rett et la trisomie 21 se traduiraient par des altérations de la transmission synaptique. Cela pourrait également modifier l’équilibre excitation/inhibition de différentes populations neuronales, connu pour être affecté dans ces trois syndromes [
2
], bien que dans le contexte de la déficience intellectuelle, peu de données soient disponibles concernant le rôle des astrocytes dans le fonctionnement des synapses inhibitrices. Enfin, les mécanismes moléculaires et cellulaires qui sous-tendent le contrôle astroglial des synapses dans la déficience intellectuelle restent à élucider.
|
Altération de l’excitabilité neuronale par une dérégulation astrogliale de l’homéostasie extracellulaire ?
Les astrocytes sont impliqués dans l’homéostasie extracellulaire de neurotransmetteurs, tels que le glutamate, et d’ions, tels que l’ion potassium,
via
des transporteurs, récepteurs ou canaux ioniques, dont l’expression est altérée dans les déficiences intellectuelles
(
Tableau I
)
[
2
]. Bien que la clairance astrogliale du glutamate soit modifiée dans la plupart des déficiences intellectuelles
(
Tableau I
)
, les altérations de l’expression des protéines impliquées dans l’homéostasie des neurotransmetteurs et d’ions diffèrent selon les formes de déficience intellectuelle, et ne semblent donc pas sous-tendre les déficits cognitifs communs associés. Les astrocytes possèdent une capacité élevée de recapture des ions potassium extracellulaires (par leurs canaux potassiques Kir4.1 à rectification entrante), et sont capables de dissiper l’excès local de potassium synaptique par leurs jonctions communicantes avec les astrocytes voisins, limitant ainsi la dépolarisation des neurones et l’hyperactivité du réseau neuronal. Il est intéressant de noter que plusieurs déficiences intellectuelles, telles que celles du syndrome de l’X fragile et de la trisomie 21, sont associées à des modifications de l’excitabilité neuronale résultant de l’altération de l’expression ou de l’activité de plusieurs canaux potassiques neuronaux [
2
]. Certains de ces canaux, notamment les canaux BK, KCNJ6 et KCNJ15, sont également présents dans les astrocytes [
4
], et leur expression pourrait donc également y être dérégulée dans le syndrome de l’X fragile et dans la trisomie 21. De plus, l’expression d’autres canaux potassiques spécifiquement exprimés dans les astrocytes peut également être dérégulée dans certaines déficiences intellectuelles comme le syndrome de Rett
(
Figure 2
)
. En effet, le gène qui code KCNJ10, la protéine du canal Kir4.1, est régulé par MECP2, et son expression est considérablement réduite dans les astrocytes déficients en MECP2, ce qui perturbe l’homéostasie extracellulaire du potassium [
6
]. L’hyperexcitabilité neuronale qui en résulte pourrait contribuer à l’activité épileptique observée chez environ 70 % des patients atteints de ce syndrome [
6
]. Ce type de canaux potassiques astrogliaux pourrait donc fournir de nouvelles cibles thérapeutiques dans la déficience intellectuelle.
|
Les déficiences intellectuelles d’origine génétique, comme celles de la trisomie 21, du syndrome de l’X fragile, ou du syndrome de Rett, sont associées à une altération du fonctionnement synaptique. Plus récemment, des dysfonctionnements astrogliaux ont également été rapportés dans ces maladies, mais leur contribution physiopathologique reste mal comprise. Dans quelques cas seulement, comme le syndrome « X fragile », ou le syndrome de Rett, la contribution de ces dysfonctionnements astrogliaux aux défauts synaptiques est démontrée. Ces défauts concernent notamment la formation de synapses excitatrices, la ramification dendritique et la densité des épines dendritiques. Cependant, les mécanismes sous-jacents doivent encore être élucidés. En particulier, les mutations dans les gènes impliqués dans la déficience intellectuelle induisent-elles des altérations du contrôle astrocytaire sur la formation, le maintien ou l’élimination des synapses [
8
], ou activent-elles sélectivement d’autres voies astrogliales non mises en jeu en conditions physiologiques et qui régulent différentiellement le fonctionnement synaptique ? Enfin, on ne sait pas encore si ces dysfonctionnements astrocytaires contribuent au déclin cognitif et aux changements de comportement associés aux défauts synaptiques constatés dans les déficiences intellectuelles.
Dans les déficiences intellectuelles, les dysfonctionnements ont généralement été étudiés soit dans les neurones, soit dans les astrocytes, mais on sait peu de choses sur les altérations structurales et fonctionnelles des interactions neuro-gliales dans ces maladies. L’étude de la couverture astrogliale des synapses par imagerie super-résolutive, et celle de la signalisation calcique neuro-gliale bidirectionnelle dans la synapse tripartite grâce à des techniques résolutives à l’échelle cellulaire, sont susceptibles d’apporter de nouvelles informations sur l’impact de la perturbation des interactions neuro-gliales dans les déficiences intellectuelles. Ainsi, le ciblage d’autres acteurs impliqués dans les interactions neuro-gliales, tels que les molécules de la matrice extracellulaire, pourrait ouvrir la voie au développement de nouvelles approches thérapeutiques des déficiences intellectuelles. De plus, étant donné que l’astrogliogenèse se produit principalement pendant la période post-natale du développement du système nerveux central, il existerait une opportunité temporelle d’intervention thérapeutique pour améliorer ces interactions neuro-gliales et compenser certains déficits neuronaux acquis avant la naissance. Enfin, comprendre comment le dysfonctionnement des astrocytes modifie le développement des circuits synaptiques devrait fournir un nouveau cadre conceptuel pour la compréhension mécanistique de troubles neuro-développementaux tels que ceux conduisant à la déficience intellectuelle, ouvrant ainsi la voie à des investigations cliniques plus performantes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Pavlowsky
A
,
Chelly
J
,
Billuart
P
.
Emerging major synaptic signaling pathways involved in intellectual disability.
.
Mol Psychiatry.
2012;
;
17
:
:682.
–
693
.
2.
Cresto
N
,
Pillet
LE
,
Billuart
P
,
Rouach
N
.
Do astrocytes play a role in intellectual disabilities?
.
Trends Neurosci.
2019;
;
42
:
:518.
–
527
.
3.
Lelieveld
SH
,
Reijnders
MR
,
Pfundt
R
,
et al.
Meta-analysis of 2,104 trios provides support for 10 new genes for intellectual disability.
.
Nat Neurosci.
2016;
;
19
:
:1194.
–
1196
.
4.
Zhang
Y
,
Chen
K
,
Sloan
SA
,
et al.
An RNA-sequencing transcriptome and splicing database of glia, neurons, and vascular cells of the cerebral cortex.
.
J Neurosci.
2014;
;
34
:
:11929.
–
11947
.
5.
Dossi
E
,
Vasile
F
,
Rouach
N
.
Human astrocytes in the diseased brain.
.
Brain Res Bull.
2018;
;
136
:
:139.
–
156
.
6.
Kahanovitch
U
,
Patterson
KC
,
Hernandez
R
,
Olsen
ML
.
Glial dysfunction in MeCP2 deficiency models: Implications for Rett syndrome.
.
Int J Mol Sci.
2019;
;
20
:
7.
Hodges
JL
,
Yu
X
,
Gilmore
A
,
et al.
Astrocytic contributions to synaptic and learning abnormalities in a mouse model of fragile X syndrome.
.
Biol Psychiatry.
2017;
;
82
:
:139.
–
149
.
8.
Allen
NJ
,
Lyons
DA
.
Glia as architects of central nervous system formation and function.
.
Science.
2018;
;
362
:
:181.
–
185
.
9.
Cheng
C
,
Sourial
M
,
Doering
LC
.
Astrocytes and developmental plasticity in fragile X.
.
Neural Plasticity.
2012;
;
2012
:
:197491.
.
10.
Garcia
O
,
Torres
M
,
Helguera
P
,
et al.
A role for thrombospondin-1 deficits in astrocyte-mediated spine and synaptic pathology in Down’s syndrome.
.
PLoS One.
2010;
;
5
:
:e14200.
.
|