| |
| Med Sci (Paris). 36(10): 841–844. doi: 10.1051/medsci/2020150.Modifications ondulantes du protéome du plasma humain au long de la vie Ida Chiara Guerrera1* 1Plateforme protéomique Necker, Université de Paris - Structure fédérative de recherche Necker, Inserm US24/CNRS UMS3633
,
160 rue de Vaugirard
,
75015Paris
,
France MeSH keywords: Vieillissement, Horloges biologiques, Protéines du sang, Humains, Longévité, Protéome, Protéomique, sang, métabolisme, physiologie, analyse |
Le rôle du plasma dans le vieillissement Le vieillissement est un facteur de risque prédominant pour plusieurs maladies chroniques qui altèrent notre santé et notre longévité. La composition protéique des cellules, des fluides corporels et des tissus change avec l’âge, et peut donner un aperçu des processus biologiques complexes liés au vieillissement de l’organisme car les protéines sont souvent des acteurs directs du fonctionnement cellulaire.
Plusieurs études suggèrent que certains changements protéomiques dans le sang reflètent le vieillissement de différents tissus. La preuve la plus convaincante que le sang peut être utilisé pour étudier le vieillissement provient peut-être d’expériences de parabiose hétérochronique, un état induit chirurgicalement en reliant les systèmes circulatoires de souris jeunes et âgées. Ces expériences montrent que le plasma sanguin des souris âgées suffit à accélérer le vieillissement du cerveau lorsqu’il est perfusé à de jeunes souris [
1
]. Réciproquement, le plasma de souris jeunes peut inverser certains aspects du vieillissement du cerveau [
2
,
3
] et de plusieurs tissus (os, muscles, cœur, foie, pancréas, reins) chez des souris âgées. L’ensemble de ces études soutient la notion que le protéome plasmatique contient des protéines clés du vieillissement de l’organisme, et que l’identification de telles signatures protéiques peut aider à comprendre les mécanismes du vieillissement.
Dans l’étude décrite dans cet article [
4
], le sang de nombreux individus est analysé pour découvrir des biomarqueurs du vieillissement et obtenir des informations pertinentes pour la biologie du vieillissement et la physiopathologie. L’analyse protéomique du plasma par spectrométrie de masse présente plusieurs défis liés à la gamme dynamique des concentrations des protéines plasmatiques, pouvant limiter le nombre de protéines quantifiées. En outre, une analyse de très grands groupes d’individus (correspondant à plusieurs milliers de prélèvements) avec plus de 500 protéines quantifiées reste au-delà des capacités de la plupart des laboratoires d’analyse protéomique. Dans cet article, les auteurs ont choisi une technique fondée sur des aptamères
1
(SOMAscan), qui permet de quantifier près de 3 000 protéines plasmatiques chez de très nombreux individus.
|
Interconnexion entre les signatures plasmatiques relatives au sexe et au vieillissement
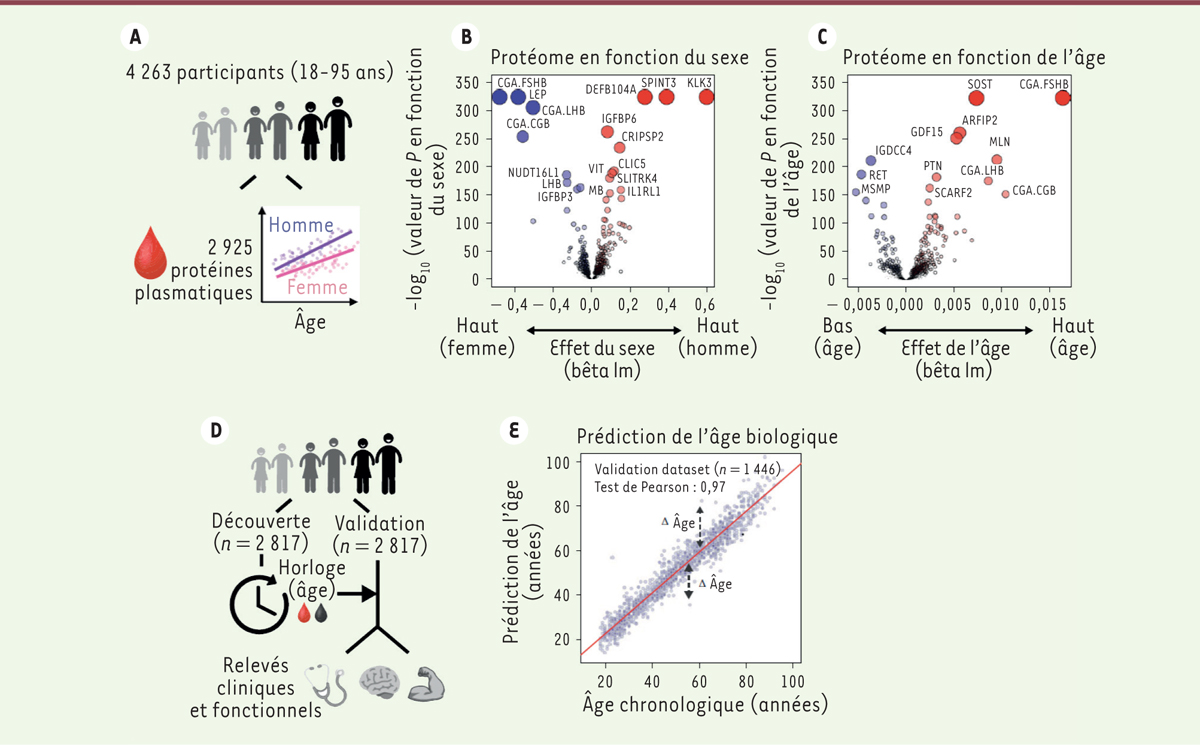
Les auteurs ont ainsi mesuré 2 925 protéines plasmatiques chez 4 263 individus (dont 51 % de femmes) âgés de 18 à 95 ans (cohortes LonGenity et INTERVAL). Les protéines dont la concentration est la plus fortement modifiée selon le sexe comprennent l’hormone folliculo-stimulante (CGA FSHB), la gonadotrophine chorionique humaine (CGA CGB), et l’antigène spécifique de la prostate (KLK3). Avec l’âge, les changements globaux les plus importants sont observés pour la sclérostine (SOST) et pour le facteur de différenciation de croissance 15 (GDF15), en plus de plusieurs protéines dont la concentration diffère selon le sexe, comme la CGA FSHB
(
Figure 1A
–
C
)
. Remarquablement, l’expression des protéines les plus fortement associées à l’âge varie également de manière significative en fonction du sexe. Ces résultats ont été confirmés sur quatre cohortes d’individus indépendantes (provenant des États-Unis et d’Europe), et concordent avec ceux de plusieurs études qui montrent que les hommes et les femmes vieillissent différemment [
5
].
 | Figure 1.
Interconnexion entre les signatures plasmatiques relatives au sexe et au vieillissement et prédiction de l’âge biologique. A.
Représentation schématique de l’analyse du protéome plasmatique.
B, C.
Volcano plots
représentant les changements du protéome plasmatique (n = 4 263) en fonction du sexe
(B)
et de l’âge
(C)
. Les modèles linéaires, ajustés pour l’âge, le sexe et la sous-cohorte, ont été testés à l’aide du test statistique F.
D.
Représentation schématique de la modélisation de l’âge biologique à l’aide du protéome plasmatique.
E.
Prédiction de l’âge dans la cohorte de validation (n = 1 446) en utilisant 373 protéines plasmatiques.
|
|
Prédiction de l’âge biologique grâce à la signature plasmatique du vieillissement
Pour déterminer si le protéome plasmatique peut permettre de prédire l’âge biologique et servir d’horloge protéomique, les auteurs ont utilisé 2 817 individus sélectionnés au hasard pour affiner un modèle prédictif. Ce modèle, qui a ensuite été testé sur les 1 446 individus restants, a conduit à l’identification d’une signature protéomique plasmatique indépendante du sexe, composée de 373 protéines permettant de prédire l’âge des individus testés
(
Figure 1D
, E)
. Remarquablement, les individus pour lesquels on prévoit qu’ils sont plus jeunes que leur âge chronologique obtiennent de meilleurs résultats aux tests cognitifs et physiques que les autres. Cet ensemble de 373 protéines pourrait donc être utilisé pour évaluer la santé relative d’un individu et pour estimer son âge biologique, de manière analogue aux horloges épigénétiques fondées sur la méthylation de l’ADN.
Comme la plupart des processus cellulaires liés au vieillissement (notamment, certaines voies de signalisation, comme mTOR et IGF-1, le stress oxydant, l’inflammation) ont été conservés au cours de l’évolution [
6
], les auteurs ont ensuite identifié 46 protéines liées au vieillissement (comprenant notamment GDF15 et IGF1-INSR) qui sont conservées entre la souris et l’homme. Plusieurs de ces protéines sont également modulées par la parabiose hétérochronique : les jeunes souris exposées au plasma de souris âgées (jeunes souris hétérochroniques) montrent une signature plasmatique plus ancienne que leur âge chronologique, tandis que les souris âgées exposées au plasma de jeunes souris (souris âgées hétérochroniques) montrent une signature de souris plus jeunes.
|
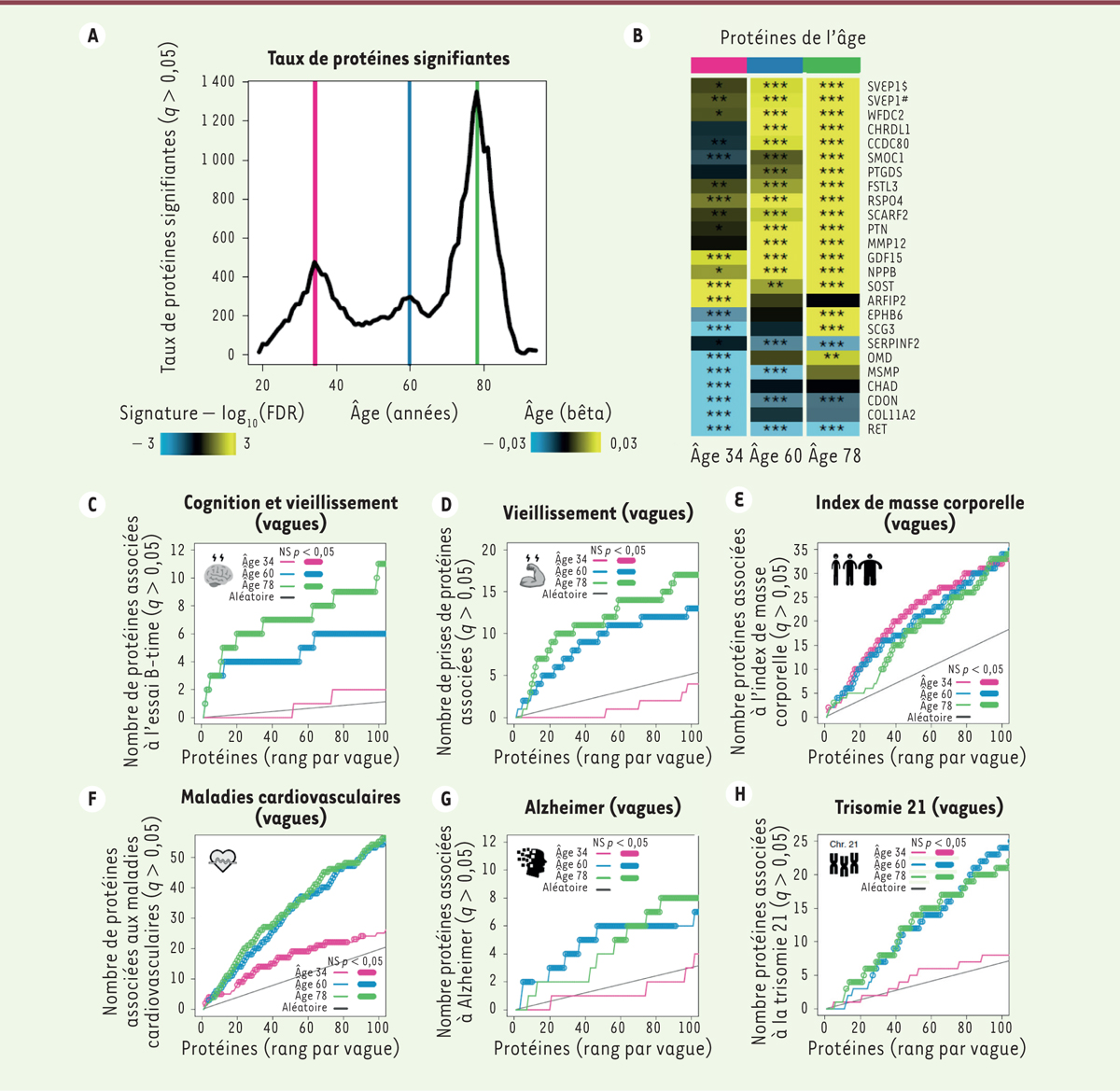
Fluctuations ondulatoires des signatures de vieillissement au cours de la vie
Une analyse approfondie des données par une nouvelle approche bioinformatique révèle que les changements du protéome plasmatique sont complexes et non linéaires au cours de la vie humaine. On peut ainsi identifier trois vagues de vieillissement, avec des « crêtes », au cours des quatrième, septième et huitième décennies
(
Figure 2A
, B)
. Les trois crêtes liées à l’âge sont en grande partie constituées de protéines différentes, mais certaines protéines (comme GDF15) sont exprimées de manière différentielle dans chaque crête. Une analyse des voies cellulaires activées à chaque crête de vieillissement a révélé : 1) à 34 ans, une diminution de l’expression des protéines de la matrice extracellulaire ; 2) à 60 ans, une augmentation de protéines liées à l’activité hormonale et aux voies de signalisation impliquant des récepteurs couplés aux protéines G ; 3) à 78 ans, une augmentation des protéines de la signalisation par les protéines morphogénétiques osseuses.
 | Figure 2.
Fluctuations ondulatoires des signatures du vieillissement et leur corrélation avec les maladies chroniques liées à l’âge. A.
Nombre de protéines plasmatiques exprimées de manière différentielle au cours du vieillissement. DE-SWAN a identifié trois pics aux âges de 34, 60 et 78 ans.
B.
Profil d’expression différentielle des protéines plasmatiques les plus perturbées à 34, 60 et 78 ans (n = 4 263). Des modèles linéaires ajustés pour l’âge, le sexe et la sous-cohorte ont été utilisés, et la significativité statistique a été testée à l’aide du test F. Le bleu et le jaune représentent respectivement une diminution et une augmentation d’expression. $ et
#
indiquent deux aptamères différents ciblant la même protéine (SVEP1). * q < 0,05, ** q < 0,01, *** q < 0,001.
C, D.
Enrichissement des protéines impliquées dans les performance cognitives
(C)
et physiques
(D)
dans les vagues de protéines liées au vieillissement.
E-H.
Enrichissement des protéines associées à la maladie dans les vagues de protéines associées au vieillissement en relation avec l’indice de masse corporelle (IMC)
(E)
, les maladies cardiovasculaires
(F)
, la maladie d’Alzheimer
(G)
, et la trisomie 21 (
Down syndrome
) (H).
|
|
Corrélation des signatures protéomiques du vieillissement avec les maladies chroniques liées à l’âge
Les auteurs ont ensuite cherché à déterminer si les protéines qui caractérisaient les trois vagues de vieillissement étaient liées à des maladies et des traits phénotypiques liés à l’âge, en croisant les données obtenues avec les données disponibles dans la littérature. Cette analyse fait apparaître que le protéome associé à la fonction cognitive et à la force dans les mains chevauche le protéome définissant l’âge avancé et la vieillesse, lorsque ces fonctions déclinent le plus
(
Figure 2C
, D)
. De même, les protéines associées à la maladie d’Alzheimer [
7
] ou à la trisomie 21 [
8
] se recoupent avec les protéines définissant l’âge avancé et la vieillesse
(
Figure 2G
, H).
Une étude protéomique plasmatique prédisant l’indice de masse corporelle [
9
] a été utilisée comme témoin car le gain de poids est très variable et n’est pas strictement corrélé avec l’âge. Comme prévu, le protéome lié à l’indice de masse corporelle n’est pas enrichi sélectivement en protéines définissant les vagues de vieillissement
(
Figure 2E
)
. En revanche, le protéome associé aux maladies cardiovasculaires [
10
] est fortement enrichi en protéines caractérisant l’âge avancé et la vieillesse
(
Figure 2F
)
. Cet enrichissement correspond à une incidence accrue de maladies cardiovasculaires après 55 ans. Le fait que le protéome définissant la trisomie 21 ou la maladie d’Alzheimer change également chez les personnes âgées d’une cohorte d’individus indemnes de ces maladies soutient la notion de vieillissement accéléré chez les individus qui en sont atteints [
5
,
11
]. Dans l’ensemble, ces résultats montrent que les vagues du « vieillissement protéomique » sont liées de manière différentielle aux caractéristiques protéomiques de diverses maladies.
|
Cette analyse du protéome plasmatique révèle des changements complexes et non linéaires au cours de la vie humaine. La nature ondulante du protéome plasmatique vieillissant et ses interactions avec les maladies doivent être prises en compte pour la caractérisation de signatures protéomiques à des fins diagnostiques et pronostiques. Les résultats présentés ici ouvrent des perspectives particulièrement intéressantes dans le cadre de l’utilisation de sang ou de produits sanguins pour traiter le vieillissement et les maladies liées à l’âge. Ainsi, l’identification des protéines plasmatiques qui favorisent ou antagonisent le vieillissement à différents stades de la vie pourrait conduire à des thérapies curatives ou préventives plus ciblées. |
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Villeda
SA
,
Luo
J
,
Mosher
KI
,
et al.
The ageing systemic milieu negatively regulates neurogenesis and cognitive function.
.
Nature.
2011;
;
477
:
:90.
–
94
.
2.
Villeda
SA
,
Plambeck
KE
,
Middeldorp
J
,
et al.
Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice.
.
Nat Med.
2014;
;
20
:
:659.
–
663
.
3.
Castellano
JM
,
Mosher
KI
,
Abbey
RJ
,
et al.
Human umbilical cord plasma proteins revitalize hippocampal function in aged mice.
.
Nature.
2017;
;
544
:
:488.
–
492
.
4.
Lehallier
B
,
Gate
D
,
Schaum
N
,
et al.
Undulating changes in human plasma proteome profiles across the lifespan.
.
Nat Med.
2019;
;
25
:
:1843.
–
1850
.
5.
Ostan
R
,
Monti
D
,
Gueresi
P
,
et al.
Gender, aging and longevity in humans: an update of an intriguing/neglected scenario paving the way to a gender-specific medicine.
.
Clin Sci.
2016;
;
130
:
:1711.
–
1725
.
6.
Cohen
AA
.
Aging across the tree of life: the importance of a comparative perspective for the use of animal models in aging.
.
Biochim Biophys Acta Mol Basis Dis.
2018;
;
1864
(
(9 Pt A)
) :
:2680.
–
9
.
7.
Sattlecker
M
,
Kiddle
SJ
,
Newhouse
S
,
et al.
Alzheimer’s disease biomarker discovery using SOMAscan multiplexed protein technology.
.
Alzheimers Dement.
2014;
;
10
:
:724.
–
734
.
8.
Sullivan
KD
,
Evans
D
,
Pandey
A
,
et al.
Trisomy 21 causes changes in the circulating proteome indicative of chronic autoinflammation.
.
Sci Rep.
2017;
;
7
:
:14818.
.
9.
Carayol
J
,
Chabert
C
,
Di Cara
A
,
et al.
Protein quantitative trait locus study in obesity during weight-loss identifies a leptin regulator.
.
Nat Commun.
2017;
;
8
:
:2084.
.
10.
Ganz
P
,
Heidecker
B
,
Hveem
K
,
et al.
Development and validation of a protein-based risk score for cardiovascular outcomes among patients with stable coronary heart disease.
.
JAMA.
2016;
;
315
:
:2532.
–
2541
.
11.
Franceschi
C
,
Garagnani
P
,
Morsiani
C
,
et al.
The continuum of aging and age-related diseases: Common mechanisms but different rates.
.
Front Med (Lausanne).
2018;
;
5
:
:61.
.
|