| |
| Med Sci (Paris). 36(8-9): 769–773. doi: 10.1051/medsci/2020133.Les nouveaux éclairages et nos yeux Alicia Torriglia,1* Frédéric Mascarelli,1 and Francine Behar-Cohen1 1Centre de Recherche des Cordeliers, Inserm, Sorbonne Université, USPC, université de Paris Descartes, équipe « Physiopathologie des maladies oculaires : innovations thérapeutiques »
,
15 rue de l’Ecole de Médecine
,
F-75006Paris
,
France |
L’œil concentre tous les éléments d’une chambre noire photographique : une lentille frontale (la cornée), un diaphragme (l’iris), une lentille de focalisation (le cristallin) et une pellicule photosensible (la rétine). La lumière arrivant dans l’œil traverse ainsi ces différents milieux transparents pour atteindre la rétine. À ce niveau, les protéines photosensibles (la rhodopsine des bâtonnets, les opsines des cônes) sont activées, initiant la phototransduction et le déclenchement d’un influx nerveux qui va atteindre le cerveau pour construire une image. Ce processus nécessite de la lumière en quantité suffisante mais sans excès. Elle doit être polychromatique pour nous permettre de distinguer les couleurs, et être stable pour éviter le papillotement et les effets stroboscopiques. Les constituants de l’œil qui absorbent la lumière
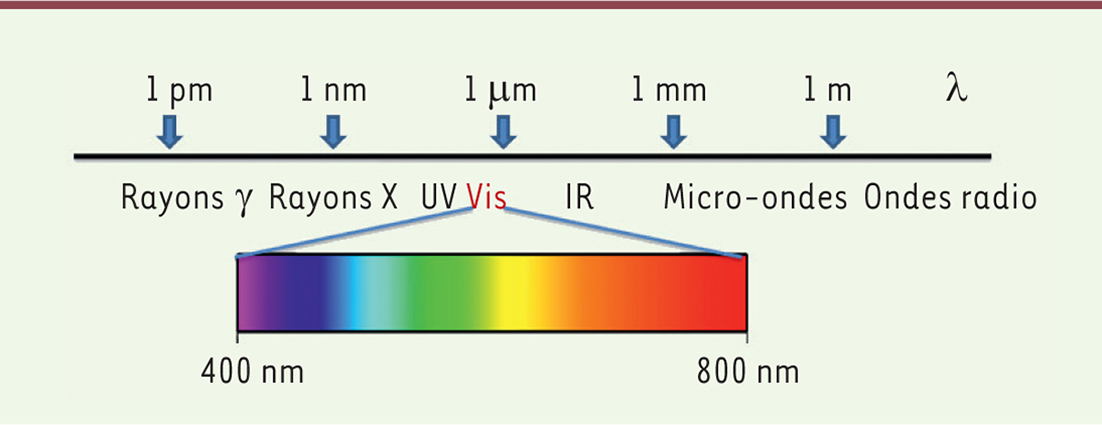
Les ondes électromagnétiques qui nous entourent se répartissent dans un large spectre de longueurs d’onde
(
Figure 1
)
. Celles comprises entre 400 et 700 nm constituent le « spectre visible ». La capacité de l’œil à capter ces longueurs d’onde dépend des photorécepteurs présents dans la rétine, mais aussi des structures oculaires situées en avant d’elle, qui absorbent une partie des radiations reçues. Ainsi, chez l’homme, la cornée absorbe les ondes de longueur inférieure à 360 nm [
1
] et le cristallin, celles inférieures à 400 nm et supérieures à 800 nm [
2
]. Le cristallin jaunissant avec l’âge, son spectre d’absorption évolue au cours du vieillissement avec, à 25 ans, un pic d’absorption à 365 nm et, à 60 ans, à 400 nm [
3
].
 | Figure 1.
Distribution des ondes électromagnétiques selon leur longueur d’onde. Place du spectre visible. Vis : visible ; UV : ultra-violet ; IR : infra-rouge
|
Les pigments visuels contenus dans les photorécepteurs sont les principaux responsables de l’absorption lumineuse par la rétine, avec des longueurs d’onde comprises entre 400 et 600 nm. Les bâtonnets (nécessaires à la vision nocturne) présentent ainsi un pic d’absorption à 507 nm. Les cônes (intervenant dans la vision des couleurs) présentent selon leur type leur pic d’absorption : 450 nm pour les cônes bleus, 530 nm pour les verts et 580 nm pour les rouges. L’iris, un tissu pigmenté par la présence de mélanine (qui absorbe la lumière aux longueurs d’onde comprises entre 400 et 1 400 nm) filtre les rayons lumineux et protège la rétine. Sa capacité à contracter la pupille augmente son efficacité. |
La phototoxicité rétinienne et la protection naturelle contre la lumière Lorsqu’un photon, particule élémentaire de la lumière, atteint un système biologique, son énergie est transférée vers les molécules qui composent celui-ci. Selon la lumière incidente, le type de molécule et le milieu dans lequel elle se trouve, une émission de fluorescence ou la production d’espèces réactives de l’oxygène (ROS) (effet photo-dynamique) peuvent avoir lieu. Les ROS génèrent un stress oxydant qui, dans les tissus, induit des altérations moléculaires différentes selon le radical produit et les cibles atteintes. Trois dommages induits par les radicaux libres sont à considérer : la peroxydation des lipides insaturés, l’oxydation d’acides aminés, à l’origine de modifications des protéines, et l’altération des acides nucléiques avec la production de lésions de l’ADN/ARN et, éventuellement l’activation d’oncogènes. La production de ROS peut entraîner la sénescence cellulaire prématurée ou la mort cellulaire. Dans la rétine, la mort cellulaire induite par la lumière est appelée phototoxicité rétinienne.
La rétine intègre tous les systèmes cellulaires de défense ubiquitaires contre le stress oxydant : enzymatiques, comme les superoxydes dismutases et la glutathion peroxydase, ou non enzymatiques, tels que les vitamines A, C et E. Elle dispose par ailleurs, au niveau de la macula, de pigments xanthophylles (la lutéine et la zéaxanthine) qui la protègent en absorbant la lumière (pic du spectre d’absorption à 460 nm). Ces pigments, abondants chez l’enfant, diminuent avec l’âge [
4
] et leur concentration est plus faible chez les sujets atteints de dégénérescence maculaire liée à l’âge (DMLA), une maladie de la macula (zone de la vision précise de la rétine), qui se développe avec l’âge et qui entraîne une perte de la vision centrale et donc l’incapacité à voir les détails et à lire [
5
,
6
]. À noter que les sujets ayant un taux sérique élevé de zéaxanthine et de lutéine ont un moindre risque de développer une DMLA [
7
].
Un élément essentiel de protection de la rétine, et en particulier des photorécepteurs, est l’épithélium pigmentaire de la rétine (EPR)
(
Figure 2
)
. Cet épithélium monostratifié se situe entre les segments des photorécepteurs et la membrane de Bruch, qui le sépare de la choroïde [
34
] (
→
).
(→) Voir la Synthèse de F. Behar-Cohen
et al.
,
m/s
n° 6-7, juin-juillet 2020, page 594
 | Figure 2.
Micrographie électronique de l’EPR.
Les pointes de flèche rouges encadrent une cellule de l’EPR. Les flèches jaunes indiquent les segments externes des bâtonnets. Les flèches vertes montrent les franges des cellules de l’EPR qui englobent les segments externes des photorécepteurs. La tête de flèche bleue indique un vaisseau choroïdien.
|
Les cellules de l’EPR contiennent des granules de lipofuscine et de mélanine. La mélanine, par sa forte capacité d’absorption, évite la réflexion de la lumière vers la rétine. Elle possède aussi une forte activité anti-oxydante. Ainsi, au cours de la DMLA, les plages d’hypopigmentation, dues à une diminution de la concentration de mélanine dans l’EPR, peuvent évoluer et constituer des zones d’atrophie [
8
,
9
]. La lipofuscine, un mélange de pigments, absorbe la lumière à des longueurs d’ondes comprises entre 300 et 700 nm. L’action des courtes longueurs d’onde sur son principal constituant, le fluorophore A2-E (
N-retinylidene-N-retinylethanolamime
), qui s’accumule dans les cellules de l’EPR avec l’âge et surtout au cours de la DMLA, induit la libération de ROS à l’origine d’un stress oxydant dans la rétine [
10
,
11
].
|
Lumière naturelle et pathologies oculaires L’exposition excessive à la lumière solaire (éclipses solaires, forte réverbération sur des plans de neige, de sable ou d’eau) peut engendrer des pathologies oculaires. Au niveau du sol, nous recevons du soleil un rayonnement constitué de 5 % de rayons ultra-violets (UV), 39 % de rayons visibles et 56 % d’infra-rouge (IR). Le rayonnement UV augmente de 10 % tous les 700 mètres : à 1 500 m d’altitude, il est ainsi 20 % plus intense qu’au niveau de la mer. À la différence des rayons IR, dont les dommages se ressentent quasi-instantanément (chaleur et brûlures), les altérations induites par les rayons UV se manifestent tardivement. Elles touchent principalement la surface oculaire et le cristallin. Les rayons UV sont les principaux responsables des inflammations de la cornée (photokératite) et de la conjonctive (photoconjonctivite) photo-induites. Ces affections, qui peuvent être très douloureuses, apparaissent dans les heures qui suivent l’exposition mais, en général, n’entraînent pas d’altérations de la vision à long terme. L’ophtalmie des neiges est une forme extrême de photokératite. L’exposition prolongée aux rayons UV peut néanmoins induire un ptérygium, une tumeur bénigne de la surface oculaire souvent localisée dans le coin interne de l’œil. Dans les cas sévères, le ptérygium peut s’étendre jusqu’au centre de la cornée et réduire la vision. Il peut devenir cancéreux dans 10 % des cas.
Même si la cataracte, qui est une opacification du cristallin, apparaît à différents degrés chez la plupart des sujets lorsqu’ils vieillissent, l’exposition aux rayons UV-B et IR-A à long terme favorise son apparition par l’accumulation de photoproduits [
12
] qui jaunissent le cristallin, provoquant des troubles de la vision pouvant aller jusqu’à la cécité. D’après l’Organisation mondiale de la santé (OMS), 20 % des cataractes seraient dues à une surexposition aux rayons UV et pourraient être évitables.
Chez l’adulte, l’absorption des rayons UV par le segment antérieur de l’œil (cornée et cristallin), réduit jusqu’à seulement 1 à 2 % la quantité de rayons UV qui atteignent la rétine. Malgré cela, une forte exposition ponctuelle peut donner lieu à une photorétinite, aussi appelée lésion par lumière bleue. Celle-ci peut se produire lors de l’observation d’une éclipse solaire sans protection, de l’exposition à des arcs à souder, ou à l’utilisation de microscopes opératoires. Elle peut entraîner une altération définitive de la vision. Chez l’enfant, avant l’âge de 6 ans, une proportion plus importante de ces rayons (jusqu’à 5 %) atteint la rétine. À noter que chez les personnes dont le cristallin a été chirurgicalement réséqué sans pose d’implant (patients aphakes), les rayons UV présentent un risque pour la rétine.
Des études réalisées sur des sujets volontaires, nécessitant une ablation chirurgicale de leur œil, à qui on demandait de fixer le soleil pendant quelques minutes, ont montré que les cellules les plus affectées dans ces conditions étaient les cellules de l’EPR [
13
]. Peu d’altérations étaient observées au niveau des photorécepteurs, lieu de la phototransduction, expliquant la vision intacte des sujets, juste après l’exposition [
14
].
Les risques des effets à long terme des expositions lumineuses sont difficiles à évaluer, essentiellement en raison de la difficulté de mesurer précisément une telle exposition. Ainsi, le lien entre exposition au soleil et développement de la DMLA a été, en particulier, largement débattu. De nombreuses études ont identifié la lumière comme étant un facteur potentiellement impliqué dans cette maladie. Les études fondées sur la cohorte
The Beaver Dam Eye Study
, initiée dans les années 1990 et incluant plus de 3 000 personnes suivies durant 5 ans, ont montré que l’exposition à la lumière du soleil dans le jeune âge pouvait être un facteur de risque pour les stades précoces de DMLA [
15
,
16
]. Plus récemment, une méta-analyse regroupant 14 études a identifié un lien de cause à effet entre l’historique d’exposition au soleil des patients atteints de DMLA et le développement de la pathologie [
17
]. Douze de ces études montrent une augmentation du risque de développer une DMLA lorsque la durée de l’exposition au soleil augmente. Une étude portant sur les risques de dommages rétiniens induits par l’exposition à la lumière des yeux de patients aphakes soutient cette conclusion. Mais d’autres études montrent un effet contraire, ce qui a ainsi conduit à une polémique sur ce sujet [
18
].
Nous avons essentiellement décrit les lésions et les affections provoquées par les rayonnements UV. Il est néanmoins important de noter qu’il n’existe pas de frontière entre les radiations UV et celles de la lumière bleue visible, le spectre de radiations électromagnétiques étant un continuum
(
Figure 1
)
. Il est donc vraisemblable que les radiations bleues, présentant un contenu énergétique voisin des rayons UV, puissent déclencher des lésions et des pathologies analogues à celles observées avec les rayons UV, en, par exemple, augmentant le temps d’exposition.
|
Les nouveaux éclairages. LED et spectre
Une LED (
light-emitting diode
) est un dispositif semi-conducteur qui émet une lumière monochromatique. Selon le matériau utilisé, cette diode peut émettre dans l’ultraviolet, le visible ou l’infrarouge. Un des atouts majeurs de cette technologie est son efficacité énergétique : ces ampoules dispersent 15 % de l’énergie en chaleur, tandis que les ampoules fluorescentes en dispersent 40 % et les incandescentes 90 %. Une LED atteint également une efficacité lumineuse beaucoup plus importante qu’une ampoule incandescente (200 lumens par watt [lm/W] contre 10 à 15). La plupart des LED disponibles dans le commerce émettant une lumière blanche utilisent une diode bleue associée à une couverture jaune de phosphore. Cette lumière jaune stimulant les photorécepteurs à cônes rouges et verts, la couleur de la lumière émise par la diode émettrice bleue sera ainsi perçue comme blanche. C’est pour cela que l’on parle de LED blanche.
L’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) a relevé récemment plusieurs points concernant les risques sanitaires liés à l’utilisation des LED blanches, leur émission en lumière étant potentiellement délétère pour la rétine [
19
-
21
]. Des études réalisées
in vitro
[
22
,
23
] et chez l’animal [
24
] montrent en effet une mortalité accrue de photorécepteurs à la suite d’une exposition aux LED blanches disponibles dans le commerce. Dans notre laboratoire, nous avons comparé les effets sur la rétine de l’exposition aux LED avec ceux d’autres sources d’éclairage, telles que les ampoules fluo-compactes et les tubes fluorescents. En utilisant des animaux albinos (dépourvus de pigmentation) ou des animaux pigmentés, et différents protocoles d’éclairement
1
, nous avons montré que l’exposition aux LED blanches induisait, chez tous les animaux testés, plus d’altérations rétiniennes que les autres sources lumineuses [
25
], et que ces effets dépendaient de la composante bleue de leur spectre [
26
]. Ces études ont été réalisées à court terme (sur un mois maximum). Il est donc nécessaire de réaliser d’autres études permettant d’évaluer les effets d’une exposition chronique aux LED blanches à des doses plus faibles (et donc plus faibles en lumière bleue) et à plus long terme.
|
Comment protège-t-on nos yeux ?
Les premières normes de sécurité photobiologique utilisaient des valeurs limites d’exposition (VLE) journalière admissible, calculées pour une exposition à une source de lumière dans le champ de vision pendant 8 heures [
27
]. Les lésions oculaires induites étaient évaluées en recherchant le blanchiment de la rétine, conséquence très tardive de l’œdème résultant de la rupture des barrières hémato-rétiniennes. Les signes précoces de souffrance cellulaire, telles que la modification des protéines ou les effets sur les couches profondes de la rétine (EPR et choroïde) n’étaient pas pris en compte. Plus récemment, la Commission internationale de protection contre les rayonnements non ionisants (ICNIRP) a fixé des doses rétiniennes limites (en Joules par cm² [J/cm
2
]) d’exposition à la lumière. Fondée sur une phototoxicité évaluée chez le primate avec une dose de 22 J/cm² [
28
], la VLE humaine a été fixée à 2,2 J/cm² et des groupes de risque pour les ampoules d’éclairage domestique ont été déterminés. Les ampoules utilisées en sont ainsi régies par la norme de sécurité photobiologique NF EN 62741 qui définit 4 groupes de risques pour les ampoules destinées au public en fonction du temps d’exposition maximal : 0 : aucun risque, 1 : pas de risque en conditions d’utilisation normale ; 2 : risque modéré, il y a réponse d’aversion à la lumière, 3 : l’ampoule présente un risque même pour des expositions momentanées. Ainsi, une ampoule de groupe de risque 0 atteint la valeur limite d’exposition après plus de 10 000 secondes d’exposition.
|
Sommes-nous assez protégés ? Les études de phototoxicité réalisées chez les animaux ne permettent pas de prédire avec certitude les effets toxiques chez l’homme et les études épidémiologiques sont particulièrement difficiles à mener, l’appréciation de l’éclairement rétinien cumulé pour un individu donné étant pratiquement impossible à déterminer.
Les conditions de laboratoire sont difficilement transposables à l’environnement humain quotidien. Des différences existent également au niveau de la structure oculaire et de la sensibilité à la lumière entre espèces. L’équipe de van Norren a ainsi montré que le seuil de toxicité pour la lumière bleue chez le rat était de 11 J/cm², tandis que chez le macaque, il est de 22 J/cm² [
28
]. Exprimer en « dose rétinienne » la quantité d’énergie atteignant la rétine présente l’avantage d’intégrer la luminosité et le temps d’exposition mais aussi la géométrie de l’œil, rendant comparables les mesures d’expositions sur différentes espèces. La différence de sensibilité entre le rat et le macaque résulte donc de la différence de sensibilité de la rétine entre les deux espèces. Nous avons constaté que lors de l’exposition aux LED blanches, les dommages de la rétine neurale, décrits précédemment, s’accompagnent d’altérations de l’EPR. Chez le rat, l’exposition aux LED à 0,4 J/cm² (lumière bleue) provoque en effet une mort des cellules de l’EPR associée à une diminution de la spécificité de transport de la barrière hémato-rétinienne à laquelle l’EPR participe [
29
]. Ainsi, pour des doses d’exposition qui sont très inférieures à celle considérée comme seuil de toxicité chez cet animal (11 J/cm²), les LED se révèlent phototoxiques. À noter que dans des conditions d’éclairement similaires, l’exposition des rats à la lumière de tubes fluorescents n’induit aucun signe de toxicité dans l’EPR [
25
].
L’inadéquation de ces derniers résultats avec ceux sur lesquels reposent les normes de sécurité photobiologique, s’explique par la différence de sensibilité des méthodes utilisées pour détecter les lésions rétiniennes. Les effets de l’exposition lumineuse des rats et des macaques ont été évalués en utilisant des méthodes similaires pour les deux animaux ; il est donc possible que les valeurs de seuil de phototoxicité obtenues chez le macaque aient été surestimées. Cette hypothèse est renforcée par les résultats de Hunter
et al.
[
30
] montrant que, chez le macaque, le seuil de toxicité a été surévalué.
Rappelons que si les rétines humaine et de rat présentent certaines différences structurales, celles-ci sont moins importantes en ce qui concerne l’EPR qui est constitué d’une monocouche de cellules post-mitotiques et qui ne se renouvellent donc pas. Or, lorsque l’exposition aux LED induit la mort des cellules de l’EPR, celles qui survivent doivent assister et renouveler d’avantage de photorécepteurs, dont l’homéostasie et les fonctions dépendent de l’EPR. Cette surcharge d’activité métabolique et fonctionnelle accélère le processus de vieillissement de l’EPR. Or, le dysfonctionnement de cet épithélium participe au développement de pathologies liées à l’âge, telles que la DMLA [
28
] (
→
). Hormis les problèmes de seuil et de dose d’exposition, d’autres questions se posent. La législation s’appuie sur la notion que les lésions induites par l’exposition à la lumière n’évoluent pas au cours du temps, et qu’une dose sub-toxique le restera indépendamment du nombre d’expositions. Il a pourtant été montré que des expositions répétées à des énergies lumineuses en dessous des seuils capables d’induire immédiatement des lésions observables macroscopiquement, provoquaient des lésions irréversibles après deux et trois semaines d’exposition [
25
,
32
].
(→) Voir la Nouvelle de F. Sennlaub et C. Combadière,
m/s
n° 4, avril 2008, page 365
|
Le développement technologique des lampes et appareils utilisant des LED et la rapidité de son évolution laissent les évaluateurs de risques démunis, car les effets sanitaires peuvent advenir à long terme : il est donc difficile de les identifier avec justesse et de convaincre les organismes de normalisation d’être prudents dans l’information quant à l’utilisation de cette technologie, et dans la mise en place de normes appropriées.
Dans le cas des LED, la question se pose avec encore plus d’acuité et d’urgence, puisque la crise énergétique que le monde subit laisse peu de place aux arguments contraires à leur utilisation et qui préconisent ce principe de précaution, insuffisamment soutenu par des données expérimentales. Deux solutions s’offrent ainsi à nous : ou nous attendons les résultats de futures et nécessaires études épidémiologiques, qui, en cas de vérification des craintes, ne feront que constater
a posteriori
les effets délétères sur la vision d’une grande partie de la population mondiale (les LED devraient atteindre prochainement 75 % du marché mondial), ou nous décidons dès maintenant de lancer des études pour comprendre les mécanismes cellulaires et moléculaires impliquées dans la phototoxicité rétinienne.
Cela est d’autant plus important que la faible consommation énergétique des LED pousse à un emploi privé de plus en plus répandu et dans des lieux publics de plus en plus étendus. La durée quotidienne de notre exposition à ces diodes s’accroît, augmentant peut-être les risques phototoxiques. L’utilisation toujours croissante de ces lampes induit également une augmentation de la pollution du ciel nocturne [
33
]. Les effets bénéfiques pour l’environnement dus à une faible consommation énergétique se voient ainsi contrecarrés par une action négative sur la biodiversité et, en conséquence, sur la santé humaine.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Sliney
DH
.
How light reaches the eye and its components.
.
Int J Toxicol.
2002;
;
21
:
:501.
–
509
.
2.
Norren
DV
,
Vos
JJ
.
Spectral transmission of the human ocular media.
.
Vision Res.
1974;
;
14
:
:1237.
–
1244
.
3.
Margrain
TH
,
Boulton
M
,
Marshall
J
,
Sliney
DH
.
Do blue light filters confer protection against age-related macular degeneration?
.
Prog Retin Eye Res.
2004;
;
23
:
:523.
–
531
.
4.
Davies
NP
,
Morland
AB
.
Macular pigments : their characteristics and putative role.
.
Prog Retin Eye Res.
2004;
;
23
:
:533.
–
559
.
5.
Bone
RA
,
Landrum
JT
,
Mayne
ST
,
et al.
Macular pigment in donor eyes with and without AMD: a case-control study.
.
Invest Ophthalmol Vis Sci.
2001;
;
42
:
:235.
–
240
.
6.
Beatty
S
,
Murray
IJ
,
Henson
DB
,
et al.
Macular pigment and risk for age-related macular degeneration in subjects from a Northern European population.
.
Invest Ophthalmol Vis Sci.
2001;
;
42
:
:439.
–
446
.
7.
Delcourt
C
,
Carriere
I
,
Delage
M
,
et al.
Plasma lutein and zeaxanthin and other carotenoids as modifiable risk factors for age-related maculopathy and cataract : the POLA Study.
.
Invest Ophthalmol Vis Sci.
2006;
;
47
:
:2329.
–
2335
.
8.
Klein
R
,
Davis
MD
,
Magli
YL
,
et al.
The Wisconsin age-related maculopathy grading system.
.
Ophthalmology.
1991;
;
98
:
:1128.
–
1134
.
9.
Bressler
SB
,
Maguire
MG
,
Bressler
NM
,
Fine
SL
.
Relationship of drusen and abnormalities of the retinal pigment epithelium to the prognosis of neovascular macular degeneration. The macular photocoagulation study group.
.
Arch Ophthalmol.
1990;
;
108
:
:1442.
–
1447
.
10.
Sparrow
JR
,
Boulton
M
.
RPE lipofuscin and its role in retinal pathobiology.
.
Exp Eye Res.
2005;
;
80
:
:595.
–
606
.
11.
Wang
Z
,
Keller
LM
,
Dillon
J
,
Gaillard
ER
.
Oxidation of A2E results in the formation of highly reactive aldehydes and ketones.
.
Photochem Photobiol.
2006;
;
82
:
:1251.
–
1257
.
12.
Torriglia
A
,
Zigman
S
.
The effect of near-UV light on Na-K-ATPase of the rat lens.
.
Curr Eye Res.
1988;
;
7
:
:539.
–
548
.
13.
Young
RW
.
Solar radiation and age-related macular degeneration.
.
Surv Ophthalmol.
1988;
;
32
:
:252.
–
269
.
14.
Tso
MO
,
La Piana
FG
.
The human fovea after sungazing.
.
Trans Sect Ophthalmol Am Acad Ophthalmol Otolaryngol.
1975;
;
79
:
:OP788-95.
.
15.
Klein
R
,
Meuer
SM
,
Knudtson
MD
,
Klein
BE
.
The epidemiology of progression of pure geographic atrophy: the Beaver dam eye study.
.
Am J Ophthalmol.
2008;
;
146
:
:692.
–
699
.
16.
Knudtson
MD
,
Klein
BE
,
Klein
R
.
Biomarkers of aging and falling : the Beaver Dam eye study.
.
Arch Gerontol Geriatr.
2009;
;
49
:
:22.
–
26
.
17.
Sui
GY
,
Liu
GC
,
Liu
GY
,
et al.
Is sunlight exposure a risk factor for age-related macular degeneration? A systematic review and meta-analysis.
.
Br J Ophthalmol.
2013;
;
97
:
:389.
–
394
.
18.
Vojnikovic
B
,
Vojnikovic
D
.
Chromotherapy of macular degeneration with transitions lenses and green-yellow medical filters and special programme for psychoorganic disturbances.
.
Coll Antropol.
2010;
;
34
:
(suppl 2)
:89.
–
93
.
22.
Chamorro
E
,
Bonnin-Arias
C
,
Perez-Carrasco
MJ
,
et al.
Effects of light-emitting diode radiations on human retinal pigment epithelial cells in vitro.
.
Photochem Photobiol.
2013;
;
89
:
:468.
–
473
.
23.
Kuse
Y
,
Ogawa
K
,
Tsuruma
K
,
et al.
Damage of photoreceptor-derived cells in culture induced by light emitting diode-derived blue light.
.
Sci Rep.
2014;
;
4
:
:5223.
.
24.
Shang
YM
,
Wang
GS
,
Sliney
DH
,
et al.
Light-emitting-diode induced retinal damage and its wavelength dependency in vivo.
.
Int J Ophthalmol.
2017;
;
10
:
:191.
–
202
.
25.
Krigel
A
,
Berdugo
M
,
Picard
E
,
et al.
Light-induced retinal damage using different light sources, protocols and rat strains reveals LED phototoxicity.
.
Neuroscience.
2016;
;
339
:
:296.
–
307
.
26.
Jaadane
I
,
Boulenguez
P
,
Chahory
S
,
et al.
Retinal damage induced by commercial light emitting diodes (LEDs).
.
Free Radic Biol Med.
2015;
;
84
:
:373.
–
384
.
27.
Sliney
DH
.
Eye hazards of environmental lighting.
.
Ann NY Acad Sci.
1985;
;
453
:
:114.
–
120
.
28.
van Norren
D
,
Gorgels
TG
.
The action spectrum of photochemical damage to the retina: a review of monochromatic threshold data.
.
Photochem Photobiol.
2011;
;
87
:
:747.
–
753
.
29.
Jaadane
I
,
Villalpando Rodriguez
GE
,
Boulenguez
P
,
et al.
Effects of white light-emitting diode (LED) exposure on retinal pigment epithelium in vivo.
.
J Cell Mol Med.
2017;
;
21
:
:3453.
–
3466
.
30.
Hunter
JJ
,
Morgan
JI
,
Merigan
WH
,
et al.
The susceptibility of the retina to photochemical damage from visible light.
.
Prog Retin Eye Res.
2012;
;
31
:
:28.
–
42
.
31.
Sennlaub
F
,
Combadière
C
.
La cellule microgliale rétinienne : un suspect inattendu dans la dégénérescence maculaire liée à l’âge.
.
Med Sci (Paris).
2008;
;
24
:
:365.
–
367
.
32.
Wolbarsht
ML
,
Welch
AJ
.
Evaluation of ocular protection filters in field situations.
.
Health Phys.
1989;
;
56
:
:729.
–
739
.
33.
Kyba
CCM
,
Kuester
T
,
Sanchez de Miguel
A
,
et al.
Artificially lit surface of earth at night increasing in radiance and extent.
.
Sci Adv.
2017;
;
3
:
:e1701528.
.
34.
Behar-Cohen
F
.
Anatomie de la rétine.
.
Med Sci (Paris).
2020;
;
36
:
:594.
–
9
.
|