| |
| Med Sci (Paris). 36(8-9): 763–768. doi: 10.1051/medsci/2020131.Myopie de l’enfant Dominique Bremond-Gignac1,2,3* 1
Service d’ophtalmologie de l’hôpital universitaire Necker Enfants-Malades, APHP, Centre de maladies rares OPHTARA
1
,
149, rue de Sèvres
,
75015Paris
,
France 2Faculté de Médecine, université de Paris
,
Paris75015
,
France 3Unité Inserm UMRS 1138, équipe 17, Université Paris V Sorbonne Paris Cité
,
Paris
,
France |

Vignette (Photo © Centre de maladies rares OPHTARA).
Dans le monde, en 2000, un enfant est devenu aveugle chaque minute, ce qui correspond à 1,4 million d’enfants aveugles [
1
]. La myopie est un enjeu mondial de santé publique. Cette pathologie (dont le nom dérive du grec « je ferme » « l’œil ») est le trouble de la vue le plus répandu dans le monde. De nos jours, une augmentation majeure, à type « d’épidémie mondiale de myopie », est observée, initialement dans les pays asiatiques. Selon les prévisions de Holden
et al.
[
2
], près de 50 % de la population serait myope en 2050. La myopie affecte en effet jusqu’à 85 à 90 % des jeunes adultes dans certains pays asiatiques, tels que Singapour et Taiwan, mais aussi entre 25 % et 50 % des adultes plus âgés aux États-Unis et en Europe. Les facteurs de risque semblent liés à l’environnement, en particulier la lumière et les écrans. Il s’agit d’une anomalie
1,
réfractive
2
qui se traduit par une vision de loin abaissée, dont l’étiologie est le plus souvent due à une augmentation de longueur axiale de l’œil. Le foyer de l’image formée dans l’œil est placé alors en avant de la rétine entraînant le flou de l’objet observé. La myopie ne se traduit pas seulement par une anomalie réfractive par augmentation de longueur axiale oculaire, mais elle entraîne aussi des complications potentiellement cécitantes. L’objectif est donc de dépister précocement la myopie évolutive de façon à mettre en place des stratégies de freination afin de limiter l’augmentation de longueur axiale de l’œil. Des verres correcteurs ou des lentilles permettent de rétablir une bonne vision.
|
Plusieurs expertises françaises réalisées sous l’égide de l’Agence nationale d’accréditation et d’évaluation de la santé (ANAES) et de l’Inserm ont permis de rassembler des données épidémiologiques et ainsi d’évaluer à 20 % la prévalence des troubles visuels avant l’âge de 6 ans, dont les anomalies réfractives sont les plus fréquentes [
3
,
4
]. L’épidémie de myopie chez l’enfant et l’adulte jeune se caractérise par une apparition de plus en plus précoce, combinée à des taux de progression élevés de la maladie. L’étude de Holden
et al.
, fait état dans le monde, en 2000, de près de 1 406 millions de myopes (soit 23 % de la population) avec près de 163 millions de myopes forts (correction optique inférieure à -5 dioptries [D]), (soit 2,7 % de la population). En 2050, l’évaluation projetée compte 4 758 millions de myopes (soit 49,8 % de la population) et 938 millions de myopes forts (< -5D), (soit 9,8 % de la population), soit près de 5 milliards de myopes dans le monde. L’augmentation de la prévalence des myopies fortes est associée à des complications oculaires. Ces pathologies représentent les principales causes de basse vision et de cécité résultant de la myopie. Considérant que dans les pays occidentaux, la population vieillit, la myopie pourrait diminuer l’espérance de vie et augmenter la perte d’autonomie précoce. Elle représente également une charge financière majeure pour la société : ce fardeau socio-économique a été estimé à 268 milliards de dollars par an dans le monde, renforçant la considération de la pathologie myopique comme une préoccupation mondiale de santé publique.
|
Lors du développement visuel, les facteurs d’augmentation de la myopie sont multiples [
5
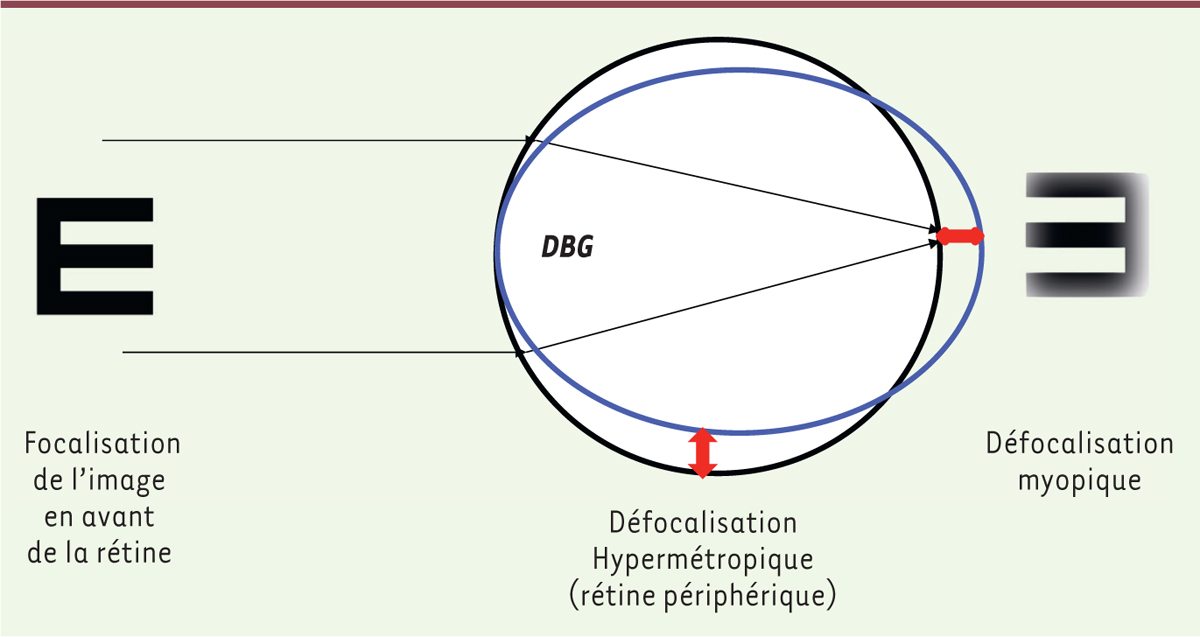
]. Ils sont le résultat d’une interaction complexe entre prédisposition génétique et exposition environnementale. Les facteurs génétiques impliqués sont multifactoriels. Pour mieux comprendre les facteurs de risque de la myopie, il est nécessaire d’intégrer les facteurs environnementaux, le phénomène de déprivation visuelle et de défocalisation hypermétropique périphérique, dont les concepts sont récents. La vision floue d’un certain type, comme lors d’une myopie non corrigée, produit un allongement du globe oculaire (myopisation) correspondant au phénomène de déprivation visuelle. Dans la myopie, le point de focalisation des objets est situé au niveau de la macula en central, en avant de la rétine du fait d’un globe oculaire trop long (défocalisation myopique). En revanche, en périphérie de la rétine, le point de focalisation est situé en arrière de la rétine (défocalisation hypermétropique). Parmi les facteurs environnementaux, les phénomènes de stimulation lumineuse, variable selon les longueurs d’ondes, avec libération de la dopamine au niveau de la rétine et l’inhibition de l’augmentation de longueur axiale par des agonistes dopaminergiques, sont probablement une des bases des mécanismes d’apparition et de progression de la myopie.
L’apparition de la myopie peut être associée aux activités accrues en vision rapprochée. Certaines études démontrent ainsi que les étudiants ont une prévalence plus élevée de la myopie. Des études expérimentales ont également montré que la myopie pouvait être déclenchée chez les animaux qui portent des verres concaves, ce qui simule le travail en vision de près. Il semble ainsi vraisemblable que l’accroissement du travail en vision de près, au cours de la vie moderne récente, ait provoqué l’augmentation de la myopie dans le monde.
Un autre facteur environnemental suspecté pour l’apparition de la myopie est le type de spectre lumineux auquel les enfants sont exposés. Une controverse existe sur la lumière bleue et la lumière violette. Des études réalisées chez le primate indiquent que la défocalisation (le point de focalisation des objets en arrière/hypermétropique ou en avant/myopique de la rétine) au niveau de la périphérie rétinienne induit une myopie axiale, alors que la vision fovéale n’a pas d’influence sur le processus d’emmétropisation (lors du développement oculaire, processus de normalisation de la puissance réfractive du globe oculaire)
3
. Ces phénomènes de compensation entraînent une augmentation de longueur axiale du globe lorsque la vision est floue ou lors d’une défocalisation hypermétropique périphérique (le point de focalisation est dans ce cas situé en arrière de la rétine), en créant une myopie induite. Des preuves récentes fournies par des études électrophysiologiques chez l’homme ont indiqué la contribution de la rétine au décodage des images défocalisées par défocalisations hypermétropiques et myopiques par modification de la signalisation des cellules ganglionnaires rétiniennes.
|
Présentation clinique et complications
Au-delà du port de lunettes, la myopie peut engendrer des complications parfois sévères, ce qui nous a conduits à proposer une prévention de façon à limiter l’évolution de la myopie et pour prévenir le handicap visuel de l’adulte. Chez l’enfant, il est ainsi important d’identifier le début de la myopie, qui se caractérise par une réfraction supérieure à -0,5D avec une augmentation de longueur axiale. La cycloplégie
4
est impérative pour le diagnostic. L’évaluation de la longueur axiale par biométrie optique est importante pour le bilan initial et l’évolution de la myopie. La myopie est considérée évolutive si elle augmente de -0,5D par an.
Bilan ophtalmique
Le développement visuel de l’enfant s’effectue par étapes. Le dépistage visuel est réalisé selon les recommandations du carnet de santé et un examen ophtalmologique complet est réalisé s’il existe une anomalie [
6
,
7
]. Dès le premier âge verbal, une mesure de l’acuité visuelle de près et de loin peut être tentée avec des tests directionnels, des dessins et/ou des lettres en utilisant si nécessaire une méthode d’appariement des objets pour mettre en évidence un trouble de la réfraction. L’examen ophtalmologique complet avec réfraction sous cycloplégiques
2
est alors essentielle pour confirmer l’anomalie réfractive. Chez l’enfant plus âgé, l’acuité visuelle est essentielle pour dépister les anomalies réfractives telles la myopie, ce dépistage réfractif étant un enjeu important étant donné l’augmentation de la prévalence de la myopie en Europe. Des examens électrophysiologiques pourront compléter les examens réalisés et préciser les dystrophies rétiniennes ou de transmission des voies visuelles.
Les données prospectives des essais cliniques suggèrent que, chez l’homme, une sous-correction augmente ou n’a aucun effet sur la progression de la myopie. La sous-correction myopique ne doit donc pas être préconisée. Il est également systématiquement nécessaire d’éliminer la présence d’un glaucome congénital, d’autant plus que la myopie est unilatérale, et qu’un glaucome provoque initialement un allongement du globe oculaire en parallèle de l’augmentation de pression intra-oculaire. Bilan pédiatrique Devant une myopie forte de l’enfant ou rapidement progressive, un bilan pédiatrique approfondi et systémique est important pour rechercher les pathologies associées et le diagnostic d’un éventuel syndrome associé. En plus du phénotypage clinique oculaire et général, une étude génétique orientée lors de myopies syndromique permettra d’affiner le diagnostic. Complications Les complications oculaires de la myopie sont en partie la conséquence de l’allongement du globe oculaire. Elles sont potentiellement cécitantes, comme le décollement de la rétine, la dégénérescence chorio-rétinienne myopique, les complications néovasculaires sous-rétiniennes, la cataracte précoce ou le glaucome. Elles sont d’autant plus fréquentes que la myopie est sévère. Ces complications génératrices de basse vision, ou même de cécité, justifient la freination de l’évolution myopique. |
Myopie multigénique
La myopie présente des étiologiques multifactorielles qui restent incomplètement identifiées. La composante génétique est prouvée dans des familles de myopes forts chez lesquelles certains gènes ont été décrits (18p11.31, 12q21-31 ou 7q36) [
8
]. Certaines populations présentent un œil naturellement myope, comme les populations asiatiques. Récemment, les études d’association à grande échelle (GWAS,
genome-wide association studies
) ont tenté d’identifier les liaisons de certains gènes au risque myopique : près de 200 gènes semblent associés seuls ou conjointement à la myopie.
Myopie syndromique
Selon le phénotype observé, une étude génétique permettra d’en préciser le diagnostic. Certaines myopies résultent en effet de pathologies oculaires qui sont éventuellement associées à un syndrome génétique comme, par exemple, le syndrome de Marfan
5,
ou le syndrome de Stickler
6
et syndromes apparentés. Des manifestations oculaires ou systémiques sont alors associées, résultant d’une anomalie de structure du globe oculaire conséquence d’une anomalie génétique. Devant une myopie forte de l’enfant ou rapidement progressive, un bilan pédiatrique et systémique est donc important afin de définir les pathologies associées et le diagnostic du syndrome.
De nombreux syndromes cliniques ont une origine génétique avec transmission mendélienne et les gènes responsables ont été identifiés. Flitcroft
et al
. ont ainsi analysé, à partir de la base de données OMIM (
online mendelian inheritance in man
)
7,
, les gènes impliqués dans les formes de myopie syndromique ainsi que les voies de signalisation associées [
8
].
Un certain nombre de syndromes présentent une myopie forte associée. Une liste non exhaustive qui correspond à une aide au diagnostic devant une association clinique retrouvée avec la myopie est présentée dans le
Tableau I
. Le syndrome de Stickler regroupe des maladies hétérogènes présentant des signes cliniques communs. Il s’agit d’une anomalie autosomique dominante affectant les gènes codant certains des différents types de collagène et dont la prévalence est estimée entre 1/7 500 et 1/9 000. Il se caractérise par des anomalies oculaires, des anomalies orofaciales, une surdité, une ostéo-arthropathie et un prolapsus de la valve mitrale. Sur le plan oculaire, le syndrome comporte d’emblée une myopie forte congénitale mais non progressive.
Tableau I.
| Myopies syndromiques les plus fréquentes |
| Syndrome |
Tableau clinique |
Gènes |
| Syndrome de Stickler |
Myopie forte congénitale, vitréorétinopathie, décollement de rétine, dysmorphie faciale, surdité, articulations hypermobiles |
COL2A1, COL11A1, COL11A2, COL9A1, COL9A2, COL9A3
|
| Syndrome de Wagner et vitréorétinopathies VCAN |
Myopie, vitréorétinopathie, autosomique dominant, vitré optiquement vide, cataracte précoce, cécité nocturne avec atrophie choriorétinienne progressive, décollement de rétine, pas d’anomalies systémiques |
VCAN
|
| Autres vitréorétinopathies |
Myopie évolutive, anomalies choriorétiniennes variables selon la forme |
VCAN
|
|
Dystrophies rétiniennes héréditaires y compris
Congenital Stationnary Night Blindness
(CSNB)
|
Myopie, héméralopie, nystagmus, strabisme |
Multiples gènes |
| Syndrome de Marfan |
Ectopie cristallinienne, myopie, dilatation aortique, anomalies squelettiques, anomalies durales, hyperélasticité |
FBN1
|
| Syndrome de Weill-Marchesani |
Ectopie cristallinienne, microsphérophakie, glaucome, petite taille, brachydactylie, raideur articulaire |
FBN1
|
| Syndrome d’Ehlers-Danlos (SED) |
Présentations cliniques hétérogènes, 6 sous-types, taches sclérales bleutées, hyperlaxité articulaire, fragilité des tissus mous |
ADAMTS2
|
| Syndrome de la cornée fragile |
Type de SED, cornée amincie et fragile |
ZNF469
|
| Syndrome de Cohen |
Myopie progressive, dystrophie chorio-rétinienne, obésité du tronc, retard de croissance, hypotonie, retard psycho-moteur, neutropénie |
VPS13B
|
| Albinisme |
Hypopigmentation cutanée et des cheveux, iris transilluminable, hypoplasie maculaire |
OCA2
, autres gènes
|
| Aniridie |
Atteinte panoculaire, aniridie, insuffisance limbique, glaucome, cataracte, hypoplasie maculaire |
PAX6
|
| Cutis laxa |
Myopie forte inconstante, peau ridée, luxation de hanche, hernie unguinale, retard psycho-moteur sévère |
ALDH18A1
|
| Syndrome de Bohring-Opitz |
Dysmorphie faciale et posturale, retard mental, microcéphalie, déficit de croissance |
ASXL1
|
| Syndrome de Knobloch |
Myopie forte évolutive, décollement de rétine sévère, encéphalocèle occipital, retard psycho-moteur |
COL18A1
|
Myopies syndromiques et principaux gènes impliqués.
|
|
L’augmentation de la prévalence de la myopie nécessite un dépistage pour envisager un traitement freinatoire si nécessaire. Contrecarrer le phénomène sensoriel de défocalisation hypermétropique apparaît comme un enjeu important, en donnant la meilleure acuité visuelle par une correction précise de l’anomalie réfractive myopique [
9
].
Il existe deux voies de contrôle de la myopie : d’une part, pour prévenir son apparition et, d’autre part, pour réduire, empêcher ou freiner sa progression une fois qu’elle est présente et évolutive. Chez l’enfant, plusieurs techniques permettent de freiner la progression quand la myopie s’accélère. Les actions potentielles pour prévenir son développement ou ralentir sa progression regroupent : le temps passé à l’extérieur, les verres correcteurs bifocaux ou défocalisants, les lentilles de contact défocalisantes ou non, l’orthokératologie, les traitements pharmacologiques et la chirurgie de renfort scléral. L’environnement
De nombreuses études ont montré que l’augmentation du temps passé à l’extérieur et la diminution du temps de travail passé en vision rapprochée peuvent diminuer l’apparition de la myopie ou la différer dans le temps. Dans une cohorte de 863 enfants australiens (âgés de 6 ans en moyenne), il a ainsi été observé que le temps passé à l’extérieur était de 16,3 h par semaine pour les enfants myopes alors qu’il était de 21,0 h pour les enfants non myopes [
10
]. De même, une étude réalisée en Chine, en 2013, auprès de 681 enfants, montre une prévalence plus faible de la myopie associée à plus de temps passé à l’extérieur [
11
]. Enfin, une méta-analyse regroupant 7 études a montré une probabilité de myopie réduite de 2 % par heure supplémentaire de temps passé à l’extérieur par semaine [
12
].
Verres bifocaux, progressifs et défocalisants
En l’absence d’étude randomisée, l’utilisation de verres correcteurs de plusieurs types, monofocaux, bifocaux ou progressifs, ne semble pas avoir une efficacité significative. Cependant, une étude récente, randomisée et en double aveugle, réalisée sur 2 ans et utilisant des nouveaux verres correcteurs défocalisants (verres DIMS,
defocus incorporated multiple segments
)
8
a montré sur 79 enfants porteurs de ces verres et 81 enfants portant des verres simples, une variation de la longueur axiale diminuée de 0,55 mm, soit une réduction de 52 %, chez les enfants porteurs par rapport au groupe témoin [
13
]. Ce port de verres correcteurs défocalisants pourrait être envisagé en association avec d’autres traitements.
Lentilles de contact défocalisantes
Les lentilles de contact souples et les lentilles rigides perméables aux gaz ne sont pas efficaces pour retarder la progression de la myopie. En revanche, une étude randomisée réalisée en double aveugle sur 53 patients porteurs de nouvelles lentilles souples défocalisantes,
versus
56 patients contrôles, a montré que la variation de la longueur axiale chez les patients porteurs était diminuée de 0,32 mm (soit 52 % par rapport au groupe témoin) [
14
]. Ce port de lentilles défocalisantes pourrait donc être également envisagé en association avec d’autres traitements.
L’orthokératologie
L’objectif de l’orthokératologie est d’appliquer une compression sur la cornée qui permet d’aplanir temporairement son rayon de courbure en appliquant une lentille rigide ayant une géométrie particulière portée la nuit. Le matin, la lentille est retirée sans que le patient ne porte aucune correction optique le jour. La cornée reprend alors progressivement sa forme initiale. La réduction de la myopie, dans la limite de 6 dioptries, est obtenue par un amincissement épithélial de la cornée centrale, de l’épithélium en moyenne périphérie et par épaississement stromal [
15
]. L’orthokératologie a un impact sur la prévention de la myopie, mais les études randomisées sur de grands échantillons font défaut. Cette technique présente par contre les risques infectieux liés au port de lentilles et, de surcroît, le port de nuit réduit l’oxygénation cornéenne.
Les traitements : l’atropine faiblement dosée
L’instillation quotidienne d’atropine constitue une des options thérapeutiques. L’atropine bloque les récepteurs muscariniques de manière non sélective. Chez l’homme, ces récepteurs sont présents dans le muscle ciliorétinien, la rétine et la sclère. Bien que le mécanisme exact de l’atropine dans le contrôle de la myopie ne soit pas connu, il semble qu’elle agisse directement, ou indirectement, sur la rétine ou la sclère, inhibant l’amincissement ou l’étirement scléral, et la croissance oculaire. Plusieurs méta-analyses suggèrent que les collyres d’atropine confèrent la meilleure efficacité parmi toutes les méthodes de freination de la myopie [
16
]. Plusieurs dosages (entre 0,01 % et 0,5 %) ont été utilisés pour ralentir la progression de la myopie. Chez les patients pédiatriques avec une myopie progressive, le traitement par 0,01 % inhibe la progression de la myopie sans effets secondaires notables affectant la qualité de vie des enfants. Dans des études cliniques randomisées en double aveugle (
atropine in the treatment of myopia
, ATOM 1 et ATOM 2) réalisées à Singapour, impliquant chacune 400 enfants, des effets significatifs ont été observés. L’étude ATOM 1 a utilisé l’atropine à 1 %, et a révélé une bonne efficacité mais des effets secondaires. Dans l’étude ATOM 2, des doses plus faibles d’atropine ont été utilisées. Les résultats obtenus ont montré un effet sur la progression de la myopie dépendant de la dose d’atropine appliquée : -0,30 ± 0,60 D (longueur axiale 0,27 ± 0,25) pour la dose 0,5 % ; -0,38 ± 0,60 D (longueur axiale 0,28 ± 0,28) pour 0,1 % ; et -0,49 ± 0,63 D (longueur axiale 0,41 ± 0,32) avec 0,01 % d’atropine. L’atropine à la dose de 0,01 % offre donc un rapport bénéfice/risque approprié, sans effets secondaires visuels cliniquement significatifs, et une réduction significative globale de 50 % de la progression de la myopie.
L’étude LAMP (
low-concentration atropine for myopia progression
) [
17
] est le premier essai randomisé en double aveugle (contre placebo), utilisant l’atropine à faible concentration, permettant de fournir des preuves solides pour étayer son rôle dans le contrôle de la myopie. Il a résolu la controverse sur le dosage de l’atropine en démontrant une réponse dépendante de la concentration d’atropine (0,05 %, 0,025 % et 0,01 %) dans le profil d’efficacité et d’effets secondaires. Il a aussi suggéré que la concentration de 0,05 % était la plus efficace et restait bien tolérée. Quel que soit le dosage utilisé (0,01 % ou 0,05 %), il est nécessaire de prendre garde à l’effet rebond à l’arrêt du traitement [
18
].
Le renforcement scléral
Au fur et à mesure que la sévérité de la myopie augmente, un allongement axial excessif du globe exerce un étirement biomécanique sur son pôle postérieur, suivi de complications rétiniennes pouvant entraîner une déficience visuelle majeure. Le renforcement scléral postérieur consiste en un traitement chirurgical pouvant empêcher la progression de l’allongement axial. La chirurgie de renforcement scléral postérieur, proposée pour la première fois par Igor Shevelev en 1930, utilise des matériaux biologiques ou non biologiques pour renforcer le pôle postérieur de la zone sclérale affaiblie et bloquer ainsi l’allongement de la longueur axiale. La technique chirurgicale à une seule bande est recommandée. Depuis, la technique a été modifiée dans les années 1970, mais elle reste assez invasive [
19
].
|
Avec une prévalence mondiale en constante augmentation de la myopie et des myopies fortes, il est crucial de contrôler l’apparition et la progression de la myopie de l’enfant. Le contrôle de la myopie peut donc être obtenu en ralentissant son apparition, ce qui semble désormais possible en augmentant le temps passé à l’extérieur, et en ralentissant sa progression, grâce à des traitements comme l’atropine faiblement dosée et l’orthokératologie. à ce jour, le traitement par atropine faiblement dosée a démontré, dans des études randomisées en double aveugle, l’efficacité la plus probante. Il existe aussi des verres correcteurs comportant un système défocalisant et des lentilles de contact défocalisantes qui ont démontré une certaine efficacité sur la freination de la myopie et qui pourraient être combinés à d’autres traitements. Une attention particulière doit être portée au bilan pédiatrique, devant une myopie forte ou évolutive, ainsi qu’aux myopies syndromiques.
 | Figure 1.
Physiopathologie de l’œil myope ; effets sur le globe oculaire.
|
|
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Maida
JM
,
Mathers
K
,
Alley
CL
.
Pediatric ophthalmology in the developing world.
.
Curr Opin Ophthalmol.
2008;
;
19
:
:403.
–
408
.
2.
Holden
BA
,
Fricke
TR
,
Wilson
DA
,
et al.
Global prevalence of myopia and high myopia and temporal trends from 2000 through 2050.
.
Ophthalmology.
2016;
;
123
:
:1036.
–
1042
.
3.
Inserm.
.
Déficits visuels : dépistage et prise en charge chez le jeune enfant.
.
Collection Expertise collective.
.
Paris:
:
Inserm;
,
2002
.
4.
Haute Autorité de Santé.
Propositions portant sur le dépistage individuel chez l’enfant de 28 jours à 6 ans, destinées aux médecins généralistes, pédiatres, médecins de PMI et médecins scolaires.
.
Paris:
:
HAS;
,
2005
.
5.
Bremond-Gignac
D
,
Copin
H
,
Lapillonne
A
,
et al.
Visual development in infants: physiological and pathological mechanisms.
.
Curr Opin Ophthalmol.
2011;
;
22
:
:S1.
–
S8
.
6.
Haute Autorité de Santé.
.
Dépistage des troubles visuels chez l’enfant.
.
Guide pratique HAS juin 2009.
.
Paris:
:
HAS;
,
2009
:
:22.
p.
https://solidarites-sante.gouv.fr
› IMG › pdf.
7.
Bois
C
,
Binot
MC
,
Jonqua
F
,
et al.
Dépistage précoce des troubles visuels : expérience du service départemental de la Protection maternelle et infantile dans les Hauts-de-Seine.
.
J Fr Ophtalmol.
2009;
;
32
:
:629.
–
639
.
8.
Flitcroft
DI
,
Loughman
J
,
Wildsoet
CF
, et al.
for the CREAM consortium.
.
Novel myopia genes and pathways identified from syndromic forms of myopia.
.
Invest Ophthalmol Vis Sci.
2018;
;
59
:
:338.
–
48
.
9.
Chassine
T
,
Villain
M
,
Hamel
CP
,
Daien
V
.
How can we prevent myopia progression?
.
Eur J Ophthalmol.
2015;
;
25
:
:280.
–
285
.
10.
French
AN
,
Morgan
IG
,
Mitchell
P
,
Rose
KA
.
Risk factors for incident myopia in Australian schoolchildren: the Sydney adolescent vascular and eye study.
.
Ophthalmology.
2013;
;
120
:
:2100.
–
2108
.
11.
Guo
Y
,
Liu
LJ
,
Xu
L
,
et al.
Outdoor activity and myopia among primary students in rural and urban regions of Beijing.
.
Ophthalmology.
2013;
;
120
:
:277.
–
283
.
12.
Sherwin
JC
,
Reacher
MH
,
Keogh
RH
,
et al.
The association between time spent outdoors and myopia in children and adolescents: a systematic review and meta-analysis.
.
Ophthalmology.
2012;
;
119
:
:2141.
–
2151
.
13.
Lam
CSY
,
Tang
WC
,
Tse
DY
, et al.
Defocus incorporated multiple segments (DIMS) spectacle lenses slow myopia progression: a 2-year randomised clinical trial.
.
Br J Ophthalmol.
2020;
;
104
:
:363.
–
8
.
14.
Chamberlain
P
,
Peixoto-de-Matos
SC
,
Logan
NS
,
et al.
A 3-year randomized clinical trial of MiSight lenses for myopia control.
.
Optom Vis Sci.
2019;
;
96
:
:556.
–
567
.
15.
Cho
P
,
Cheung
SW
.
Retardation of myopia in orthokeratology (ROMIO) study: a 2-year randomized clinical trial.
.
Invest Ophthalmol Vis Sci.
2012;
;
53
:
:7077.
–
7085
.
16.
Huang
J
,
Wen
D
,
Wang
Q
,
et al.
Efficacy comparison of 16 interventions for myopia control in children: a network meta-analysis.
.
Ophthalmology.
2016;
;
123
:
:697.
–
708
.
17.
Yam
JC
,
Jiang
Y
,
Tang
SM
,
et al.
Low-concentration atropine for myopia progression (LAMP) study: a randomized double-blinded, placebo-controlled trial of 0.05 %, 0.025 %, 0.01 % atropine eye drops in myopia control.
.
Ophthalmology.
2019;
;
126
:
:113.
–
124
.
18.
Pineles
SL
,
Kraker
RT
,
VanderVeen
DK
,
et al.
Atropine for the prevention of myopia progression in children: a report by the American academy of ophthalmology.
.
Ophthalmology.
2017;
;
124
:
:1857.
–
1866
.
19.
Huang
W
,
Duan
A
,
Qi
Y
.
Posterior scleral reinforcement to prevent progression of high myopia.
.
Asia Pac J Ophthalmol (Phila).
2019;
;
8
:
:366.
–
370
.
|