| |
| Med Sci (Paris). 36(8-9): 753–762. doi: 10.1051/medsci/2020130.Les œdèmes maculaires Mieux comprendre leurs mécanismes pour mieux les traiter Francine Behar-Cohen,1,2* Min Zhao,1 Emmanuelle Gelize,1 Elodie Bousquet,3 Alejandra Daruich,1,3 Matet Alexandre,1,4 Kimberley Delaunay,1 Alicia Torriglia,1 Marianne Berdugo-Polak,1 Frédéric Jaisser, Yvonne de Kozak,1 and Patricia Lassiaz1 1Centre de Recherche des Cordeliers, Inserm, UMRS1138, équipe 17, Université de Paris, Université Sorbonne Paris Cité
,
15 rue de l’École de Médecine
,
75006Paris
,
France 2Ophtalmopole, Hôpital Cochin, Assistance Publique-Hôpitaux de Paris, Université de Paris
,
24 rue du Faubourg Saint-Jacques
,
75014Paris
,
France 3Service d’Ophtalmologie, Hôpital Necker-Enfants Malades, Assistance Publique Hôpitaux de Paris, Université de Paris
,
149 rue de Sèvres
,
75015Paris
,
France 4Service d’Ophtalmologie, Institut Curie, Université de Paris
,
75005Paris
,
France |
L’œdème maculaire : un problème de santé publique sous-estimé
L’œdème maculaire (OM) est une cause majeure de déficience visuelle. Plus de 10 millions de patients atteints de rétinopathie diabétique ou d’occlusions veineuses sont atteint d’OM [
1
]. Dans les pays industrialisés, 5 % des individus de plus de 60 ans souffrent d’OM dû à une dégénérescence maculaire liée à l’âge (DMLA) néovasculaire.
|
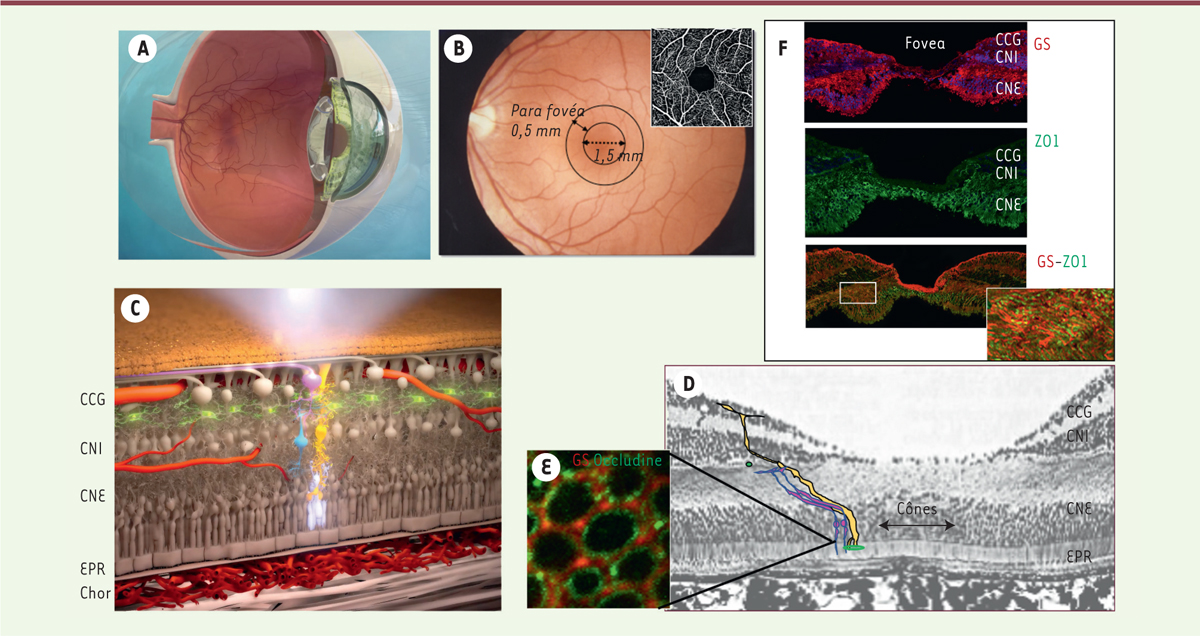
La macula est une zone de la rétine de 5,5 à 6 mm de diamètre située dans l’axe visuel, avasculaire au centre et orangée (couleurs due aux pigments lutéaux)
(
Figure 1
)
. Au centre de la macula, la fovéa est formée uniquement de cônes et de cellules gliales liées par des jonctions
tight-like
(ou de type zonula occludens ou jonctions serrées) [
2
], les autres couches rétiniennes étant déplacées latéralement
(
Figure 1
C, D)
. La macula, qui occupe moins de 5 % de la surface rétinienne totale, assure l’acuité visuelle, la vision de jour (photopique) et la vision colorée [
46
] (
→
).
(→) Voir la Synthèse de F. Behar-Cohen
et al.
,
m/s
n° 6-7, juin-juillet 2020, page 594
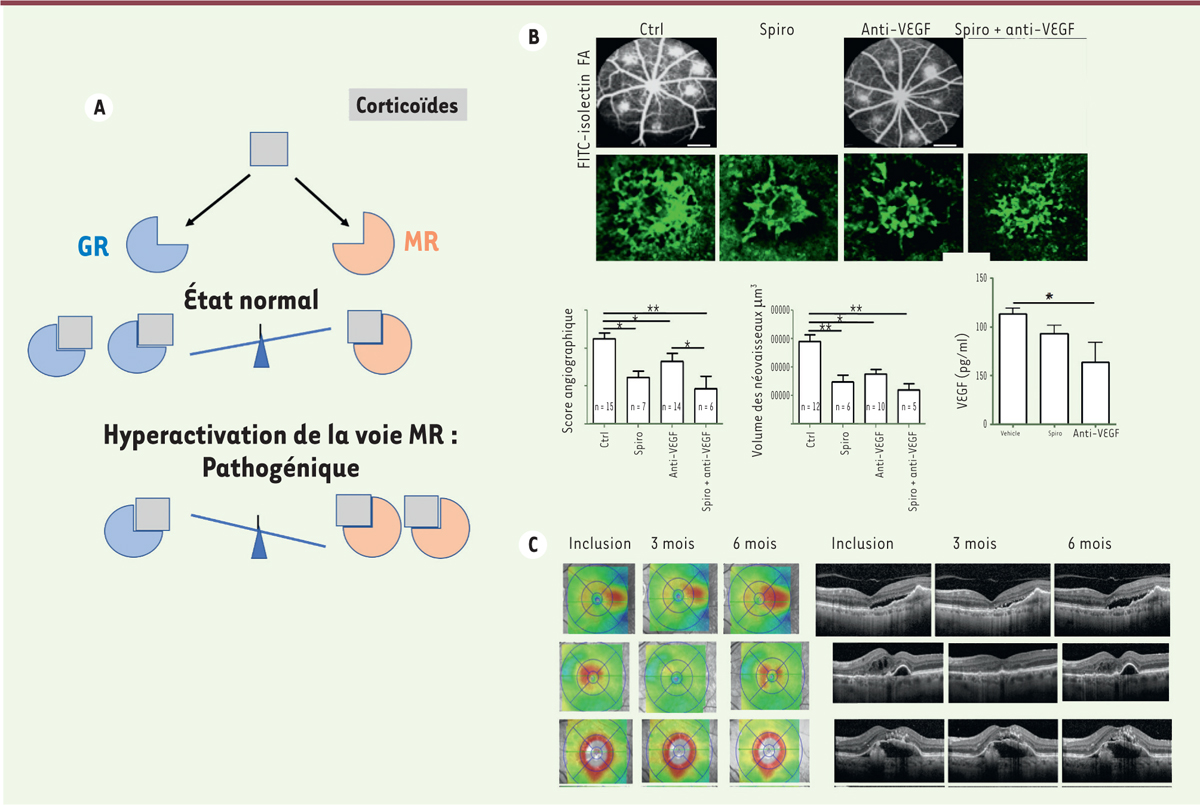
 | Figure 1.
Structure de la rétine et de la macula. A.
Représentation schématique d’un globe oculaire en coupe.
B.
Rétinophotographie en couleur d’un fond d’œil montrant les aires de la macula et la zone avasculaire centrale en angiographie.
C.
Représentation schématique de la rétine en coupe transversale (en blanc, les cônes ; en jaune, les cellules gliales de Müller (CGM) ; en vert, les cellules microgliales ; en rouge, les vaisseaux rétiniens et choroïdiens. CCG : couche cellules ganglionnaires ; CNI : couche nucléaire interne ; CNE : couche nucléaire externe ; EPR : épithélium pigmentaire rétinien ; chor : choroïde.
D.
Coupe histologique de la macula humaine montrant les cônes (rose) et les CGM en « Z », formant des jonctions serrées au niveau de la limitante externe.
E.
Montage à plat d’une rétine humaine montrant l’organisation de la limitante externe formée par des jonctions contenant de l’occludine (en vert) entre les prolongements de CGM (détectées en rouge par marquage de la glutamine synthétase [GS] avec un anticorps couplé à un fluorochrome) et les cônes (non marqués).
F.
Immunohistochimie d’une macula humaine montrant les CGM détectées par marquage de la GS ainsi que les cônes, détectés par marquage de la protéine de jonction zoludine (ZO1) (vert). À fort grossissement, les jonctions entre les cônes et les CGM en « Z » sont visibles.
|
|
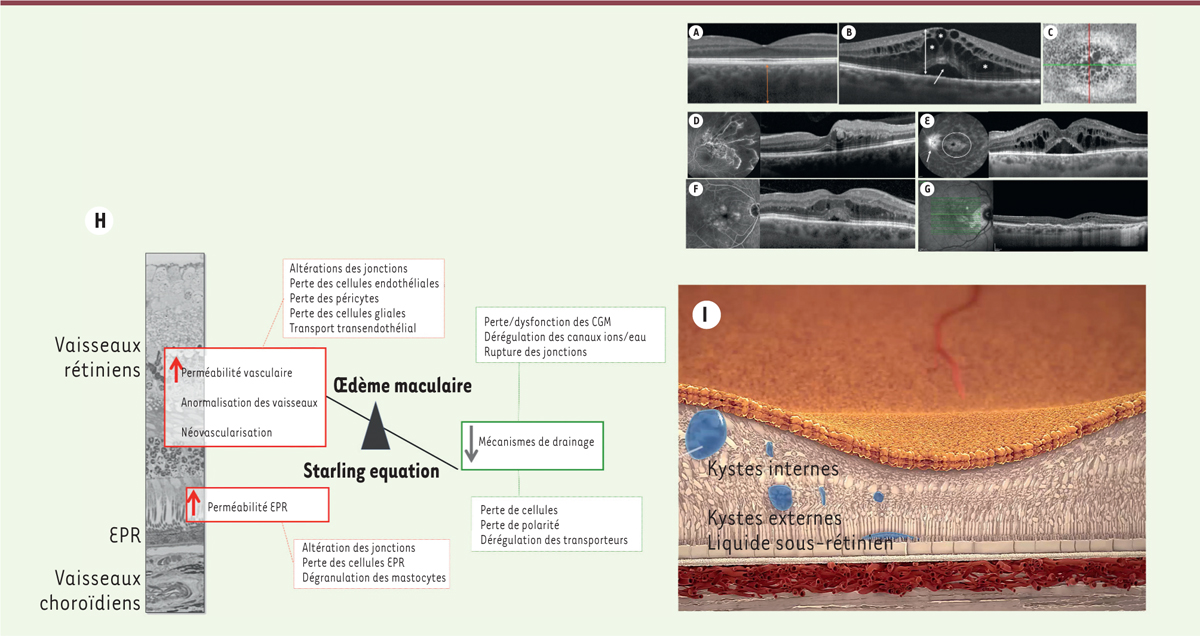
L’œdème maculaire peut être défini comme une augmentation du volume de la macula. Il entraîne des symptômes visuels, tels que des métamorphopsies (déformations), des micropsies (réduction de la taille des images), une vision floue et une difficulté à lire, une réduction de la sensibilité aux contrastes et de la vision des couleurs, jusqu’au scotome central (tâche noire). Le liquide extracellulaire peut s’infiltrer dans les couches de la rétine, s’accumuler dans des cavités, communément appelées « kystes », ou sous la rétine
(
Figure 2
A-G)
. Une augmentation du volume intracellulaire peut également se produire.
 | Figure 2.
Œdèmes maculaires : mécanismes et formes cliniques. A-G.
Images de formes cliniques d’œdèmes maculaires (OM) en tomographie à cohérence optique (OCT) et en angiographie à la fluorescéine.
A.
Coupe OCT d’une rétine normale,
B.
OM cystoïde diabétique avec des kystes dans les couches internes et externes (étoiles) et du liquide sous-rétinien (flèche),
C.
OCT en face montrant l’organisation radiaire des kystes,
D.
OM d’une occlusion de branche veineuse, montrant les anomalies vasculaires avec diffusion de fluorescéine et l’OM correspondant en OCT,
E.
OM d’Irvine Gass montrant la diffusion du colorant à la papille et dans les kystes centraux,
F.
OM diabétique montrant des microanévrismes diffusant et les kystes correspondants en OCT,
G.
OM dû à une néovascularisation choroïdienne dans la DMLA.
H.
Représentation schématique des mécanismes responsables de l’OM.
I.
Représentation schématique d’un OM montrant des « kystes » dans les couches internes, externes et du liquide sous-rétinien.
|
|
Les limites de l’étude expérimentale de l’œdème maculaire Aucun modèle animal de laboratoire ne permet de reproduire le phénotype de l’OM. Les rongeurs, les lagomorphes (lapins) et autres espèces de laboratoire ne possèdent en effet pas de macula et les primates non humains peuvent rarement être utilisés. Les spécimens oculaires humains sont donc particulièrement précieux mais rares, et les procédures de fixation/déshydratation nécessaires à la préparation des tissus peuvent interférer avec la pathologie de l’œdème. |
Pourquoi et comment l’œdème maculaire se forme
C’est par un processus actif que la rétine préserve son état de déshydratation relative. Les barrières hémato-rétiniennes interne et externe préviennent l’entrée de fluide
(
Figure 2
H)
. C’est l’épithélium pigmentaire rétinien (EPR) qui assure un transport hydro-ionique actif qui draine les fluides de l’espace sous-rétinien vers la choroïde. Les cellules gliales de Müller jouent également un rôle majeur de drainage grâce à une distribution étagée et contrôlée de canaux ioniques et aqueux [
3
]. L’œdème rétinien est la conséquence d’un déséquilibre entre l’entrée et la sortie des fluides et la conductivité hydraulique de la rétine.
Altération des barrières hémato-rétiniennes et augmentation de l’entrée des fluides La barrière hémato-rétinienne interne Les principaux mécanismes conduisant à une augmentation de la perméabilité de la barrière hémato-rétinienne interne sont les suivants :
-
l’altération des protéines de la jonction intercellulaire par une régulation négative de leur expression/fonction, un changement de leur état de phosphorylation ou la perte de composants d’ancrage de la membrane,
-
l’augmentation du transport transendothélial qui est très dépendant du facteur de croissance de l’endothélium vasculaire (VEGF) et des cavéolines ; elle est l’un des effets prédominants du VEGF dans les microvaisseaux rétiniens.
-
la perte de cellules constituant la barrière (cellules endothéliales, péricytes, cellules macrogliales).
-
Ces mécanismes sont généralement activés de façon simultanée ou séquentielle par l’hyperglycémie, l’hypoxie, le stress oxydatif et les médiateurs de l’inflammation. La rupture de la barrière hémato-rétinienne interne induit des œdèmes des couches rétiniennes internes, comme on en observe souvent au contact de micro-anévrismes au cours des rétinopathies diabétiques
(
Figure 2
F)
.
La barrière hémato-rétinienne externe
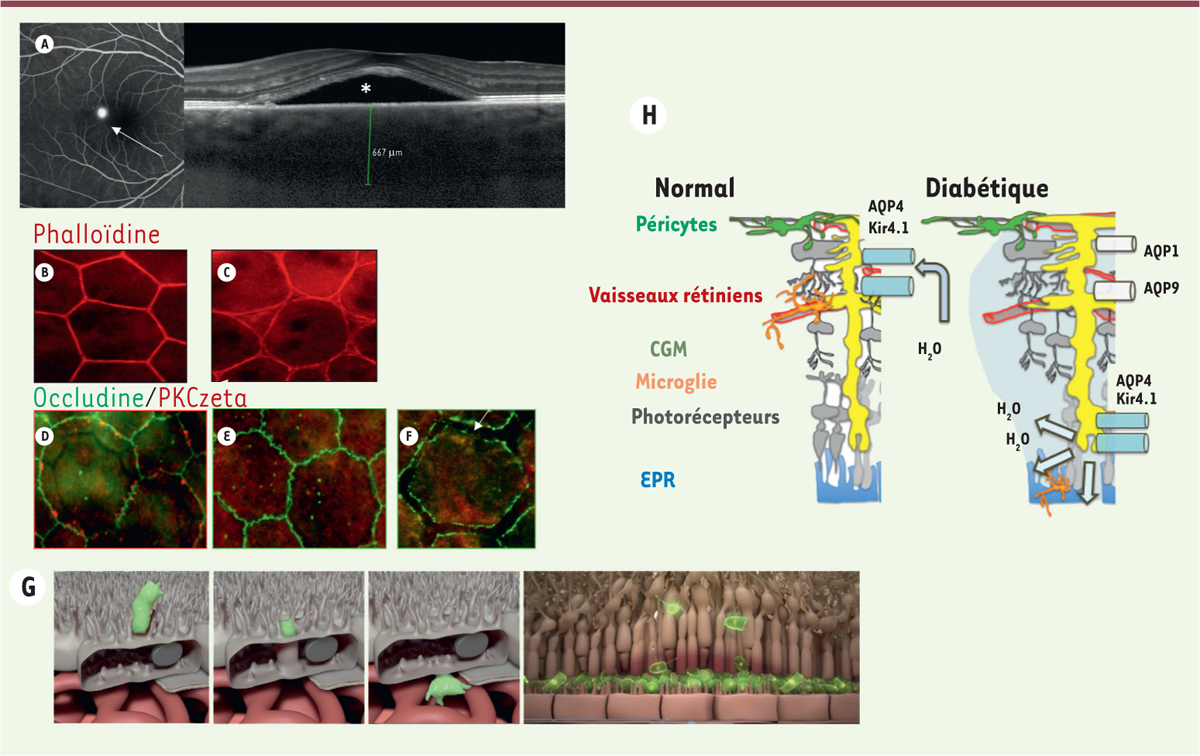
La barrière hémato-rétinienne externe est formée par les cellules de l’épithélium pigmentaire rétinien hautement polarisé. Une perturbation focale des jonctions intercellulaires de l’EPR peut en soi être le site d’entrée du fluide des vaisseaux choroïdiens, comme dans la choriorétinopathie séreuse centrale
(
Figure 3
A)
, où des sites focaux de fuite sont visibles à l’angiographie à la fluorescéine. Le stress oxydatif et/ou métabolique chronique peut également entraîner un dysfonctionnement diffus de la barrière de l’EPR, comme nous l’avons observé lors du diabète expérimental [
4
,
5
] avant tout signe de microangiopathie
(
Figure 4
B-F)
. Le VEGF-A et le facteur de croissance placentaire (PGF), dont l’expression est augmentée dans des conditions d’hypoxie ou d’exposition à l’insuline, modifient
in vitro
et
in vivo
la distribution subcellulaire de l’occludine, une des protéines responsables des jonctions serrées [
6
,
7
]. L’un des récepteurs du VEGF-A, le VEGF-R1 (ou Flt-1, pour
fms-like tyrosine kinase
), dont l’expression est sensible à l’hypoxie, pourrait être impliqué dans cet effet perméabilisant du VEGF sur l’EPR [
7
].
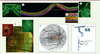
 | Figure 3.
Mécanismes de l’altération de la barrière externe. A.
Représentation angiographique et OCT d’une chorirétinite séreuse centrale avec un point de fuite de l’EPR (flèche) induisant une bulle de liquide sous-rétinien (étoile).
B-F.
Montage à plat et immunohistochimie des cellules EPR d’un rat normal (B et D) et d’un rat diabétique avant la survenue d’une microangiopathie (C, E, F). La phalloïdine marque le cytosquelette d’actine altéré par le diabète (B, C). Dans l’EPR normal, l’occludine forme des boucles aux jonctions, qui renferment la PKCz qui phosphoryle l’occludine pour la maintenir à ces jonctions (D). Chez le rat diabétique, la PKCz est délocalisée et les jonctions sont ouvertes (flèche) (E, F).
G.
Représentation schématique de la transcytose d’une cellules microgliale dans l’EPR et accumulation de microglies dans l’espace sous-rétinien en cas d’altération de la transcytose.
H.
Représentation schématique de la distribution des canaux Kir4.1 et AQP4 dans les CGM en conditions normales et diabétiques.
|
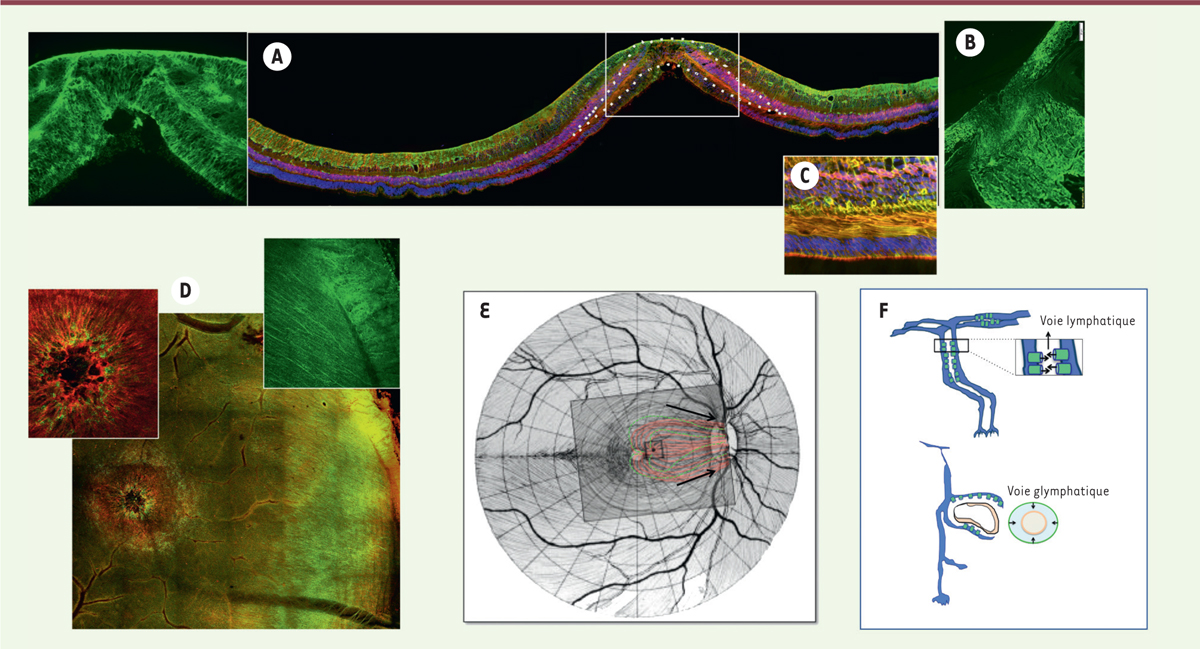
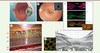
 | Figure 4.
Distribution d’AQP4 dans la macula humaine et système glymphatique. A-B.
Marquage immunohistochimique de AQP4 (vert) et des CGM dont le marqueur est la glutamine synthétase (rouge). Les noyaux sont marqués en bleu par le DAPI.
B.
Nerf optique.
C.
Marquage des CGM en Z par ZO1 (vert) et par la glutamine synthétase (rouge).
D.
Montage à plat d’une rétine postérieure humaine marquée par AQP4 (vert) et par la glutamine synthétase pour identifier les GCM (rouge). La macula est identifiée par l’organisation radiaire des GCM et la densité de AQP4. L’AQP4 forme des canaux le long des CGM (encart).
E-F.
Représentation schématique d’un possible réseau glymphatique le long des GCM et des vaisseaux, avec un drainage vers le nerf optique (adapté de [
3
]).
|
Les cellules microgliales sont éliminées de la rétine par un mécanisme de migration transépithéliale qui fait intervenir les cavéolines (au niveau des vésicules) et la voie Rho-kinase et la PKCz (protéine kinase Cz). Au cours du diabète, ces mécanismes d’élimination sont altérés, conduisant à l’accumulation de cellules microgliales activées qui produisent des cytokines pro-inflammatoires et du VEGF [
8
]
(
Figure 3
)
. Les cellules microgliales qui expriment le VEGF-R1 sont également activées par le VEGF [
9
].
Les mastocytes sont abondants le long des vaisseaux. Leur dégranulation locale, induite dans un modèle de rat, conduit à la formation de décollements séreux de la rétine et de décollements de l’EPR, qui sont similaires à ceux observés en clinique [
10
]. Ces cellules pourraient jouer un rôle important, en particulier dans les uvéites et dans la DMLA, où l’activation de la voie alterne du complément, qui induit la dégranulation mastocytaire (par la production des anaphylatoxines C3a et C5a), a été démontrée.
Altération des fonctions de drainage
Les cellules de l’EPR et les cellules gliales de Müller (CGM) drainent activement l’eau et les osmolytes de la rétine vers la circulation systémique ou le vitré [
46
] (
→
).
(→) Voir la Synthèse de F. Behar-Cohen
et al.
,
m/s
n° 6-7, juin-juillet 2020, page 594
Les transports hydro-ioniques peuvent être modifiés en raison de la mort des cellules de l’EPR et/ou des CGM, de leur souffrance métabolique, du dysfonctionnement de leur cytosquelette, ou en réponse à des signaux extracellulaires. Les altérations touchant les CGM perturbent la détoxification et le recyclage du glutamate et de l’acide γ-aminobutyrique (GABA) ainsi que le métabolisme de nombreux osmorégulateurs. L’activation de l’EPR et des CGM libère de nombreux facteurs inflammatoires pro-œdémateux. La perturbation de l’homéostasie du potassium, finement modulée par les CGM, contribue à la mort des cellules neuronales et à l’ischémie. Le potassium régule en effet le flux sanguin régional, en réponse aux changements de l’activité neuronale. Une réduction de la conductance potassique a ainsi été observée dans des modèles de diabète, d’occlusion veineuse rétinienne, de diverses formes de dégénérescence rétinienne et d’uvéite [
3
]
(
Figure 3G
)
.
Néovascularisations et anomalies microvasculaires La présence de néovaisseaux actifs se manifeste par une diffusion de la fluorescéine lors de l’angiographie, témoignant d’une entrée anormale de fluide. L’accumulation de liquide sous-rétinien et intrarétinien secondaire au développement de néovaisseaux choroïdiens résulte non seulement du néovaisseau anormal lui-même, mais aussi de la rupture de la barrière hémato-rétinienne externe qui lui est associée et qui s’oppose au drainage efficace du fluide. Les facteurs tractionnels Des adhérences vitréennes anormales et le développement de proliférations gliales à la surface de la rétine peuvent entraîner des tractions importantes capables de produire des œdèmes en exerçant des forces mécaniques sur les vaisseaux, et par un déplacement antéro-postérieur de la rétine. Le traitement est, dans ce cas, chirurgical. Pourquoi l’œdème se forme-t-il spécifiquement dans la macula ? Plusieurs hypothèses Altération des protéines de jonction dans la zone des cellules de Müller en forme de « Z »
Dans la macula, les CGM sont très allongées par rapport aux cellules périphériques, atteignant plusieurs centaines de micromètres et suivent une trajectoire en « Z ». Le long de cette trajectoire les prolongements des cellules gliales sont étroitement liés aux axones des photorécepteurs par des protéines de jonction, comme la zonula occludens 1 (ZO-1) [
11
], et par des jonctions
tight-like
, au niveau de la limitante externe
(
Figure 1
et 4)
. Dans des conditions pathologiques, ce « filtre moléculaire » dysfonctionne, permettant aux protéines et à l’eau de s’accumuler entre les axones et les CGM en formant des « kystes », comme on l’a observé dans l’OM cystoïde
1
(
Figure 2
)
.
L’hypothèse d’un système « glymphatique »
Dans le système nerveux central, la voie glymphatique [
47
] (
→
) représente une voie d’élimination des déchets pour les solutés et les protéines [
12
,
13
]. La distribution dans la rétine des canaux hydriques aquaporine-4 (AQP4), qui participeraient à la voie glymphatique dans le cerveau, plaide en faveur de l’existence d’un flux hydraulique entre les CGM, autour des vaisseaux, vers la tête du nerf optique
(
Figure 4
)
. Une voie glymphatique pourrait donc exister dans la rétine, en particulier dans la macula, pour l’élimination des solutés et des protéines [
3
] allant jusqu’au nerf optique. Dans les maladies de la rétine, telles que la rétinopathie diabétique, l’expression et/ou la localisation de l’AQP4 sont modifiées, perturbant cette voie glymphatique et favorisant ainsi l’accumulation de protéines et de liquide, particulièrement dans la macula où l’expression de AQP4 est très dense dans les CGM
(
Figure 4
A)
. D’autres études devraient explorer cette hypothèse qui reste encore spéculative.
(→) Voir la Synthèse de J. L. Thomas
et al.
,
m/s
n° 1, janvier 2019, page 55
Les traitements de l’œdème maculaire : mécanismes d’action Le seul symptôme accessible à un traitement est l’œdème lui-même. Les médicaments utilisés ont un effet significatif sur la vision puisqu’ils réduisent le volume de liquide présent dans la macula et donc les anomalies de transmission des photons. Il s’agit de traitements symptomatiques dont les effets cessent lorsque la concentration intraoculaire de principe actif est réduite. Les anti-VEGF
De nombreux essais ont confirmé l’efficacité et la sécurité de différentes molécules (anticorps, protéines recombinantes) anti-VEGF (ranibizumab, bévacizumab, aflibercept) dans le traitement de la DMLA humide [
14
], de l’œdème maculaire diabétique [
15
] et des occlusions veineuses [
16
]. Des protocoles permettent aujourd’hui de suivre un rythme de traitement personnalisé, son efficacité étant évaluée principalement sur la récidive de l’œdème en tomographie à cohérence optique et sur la vision [
17
]. Des efforts de recherche considérables se concentrent sur l’optimisation de la durée d’action des anti-VEGF, en augmentant la dose injectée, en développant de nouvelles molécules, comme des anticorps à chaîne unique qui seront bientôt disponibles en France [
18
], des réservoirs implantables [
19
], et de la thérapie génique virale [
20
] et non virale [
21
].
Bien que le bénéfice clinique des anti-VEGF soit indéniable, les mécanismes exacts sur lesquels reposent leurs effets anti-œdémateux dans diverses formes d’œdème maculaire ne sont pas entièrement compris. Deux des trois agents anti-VEGF couramment utilisés pour les injections intravitréennes sont approuvés pour des indications ophtalmiques : le ranibizumab et l’aflibercept. Le bévacizumab est utilisé hors autorisation de mise sur le marché (AMM) pour réduire l’œdème maculaire d’origines diverses. Il s’agit d’un anticorps monoclonal humanisé de 150 kDa qui se lie à toutes les isoformes du VEGF-A. Le ranibizumab est un F(ab’)
2
de 48 kDa dont l’affinité de liaison au VEGF est 10 à 100 fois supérieure à celle du bévacizumab. L’aflibercept est un récepteur soluble de 115 kDa consistant en une séquence d’acides aminés entièrement humaine correspondant aux domaines extracellulaires des VEGFR humains 1 et 2 fusionnés à la région Fc d’une IgG1 (immunoglobuline d’isotype G1) humaine. Comme le bévacizumab et le ranibizumab, l’aflibercept se lie à toutes les isoformes du VEGF-A, mais il se lie également au PGF et au VEGF-B [
22
].
Des mécanismes anti-œdémateux indépendants de la neutralisation du VEGF
Le bévacizumab n’atteint pas la choroïde mais réduit l’œdème maculaire dans la DMLA humide
Le ranibizumab a été réalisé (Genentech) parce que l’anticorps anti-VEGF qui avait été développé en cancérologie n’atteignait pas l’EPR et la choroïde [
23
]. Bien que le bévacizumab n’atteigne pas sa cible, son efficacité est pourtant similaire à celle du ranibizumab dans la DMLA [
24
].
Les médicaments anti-VEGF n’agissent pas comme des agents anti-angiogéniques dans la DMLA
Tous les anti-VEGF inhibent très efficacement la prolifération des cellules endothéliales et la formation des vaisseaux. Pourtant, malgré des injections répétées, 80 % des néovaisseaux de la DMLA continuent de croître [
25
]
(
Figure 5
)
.
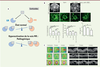 | Figure 5.
Implication de la voie minéralocorticoïde dans la DMLA néovasculaire. A.
Représentation schématique des effets de l’activation de la voie gluco (GR) ou minéralocorticoïde (MR) dans la rétine.
B.
Effet de la spironolactone ou d’un anti-VEGF de rat ou de la combinaison sur la néovascularisation choroidienne expérimentale chez le rat.
C.
Exemple de l’effet de la spironolactone administrée par voie orale en complément d’une injection mensuelle de ranibizumab chez des patients présentant une DMLA néovasculaire réfractaire. Les deux premiers cas montrent une diminution de l’œdème pendant le co-traitement (3 mois) et une perte de l’effet à l’arrêt de la spironolactone (6 mois), le dernier cas ne montre pas d’effet (adapté de [
44
]).
|
Chez les rongeurs, bien que le bévacizumab ne neutralise pas le VEGF, son injection dans le vitré des animaux exerce des effets oculaires
Divers effets biologiques du bévacizumab ont été rapportés dans la rétine chez les rongeurs alors que cet anticorps ne se lie pas et ne neutralise pas le VEGF murin [
26
].
Ces observations suggèrent donc que des effets indirects, ne faisant pas intervenir le VEGF, résultent de l’injection intravitréenne des anti-VEGF. Mécanismes proposés
Modification des gradients de pression oncotiques
Le vitré étant un milieu à faible concentration protéique (environ 0,5 mg/ml), l’injection de protéines thérapeutiques crée une augmentation significative de la pression oncotique
3
. La rétine étant perméable à l’eau, celle-ci va suivre le gradient oncotique. Cet effet pourrait expliquer le changement très rapide de l’épaisseur de la rétine et la récurrence de l’œdème maculaire lorsque la concentration de protéines thérapeutiques dans le vitré diminue en dessous d’un seuil.
L’injection intravitréenne de protéines induit des effets biologiques
Dans les études cliniques, pour des raisons éthiques évidentes, les sujets inclus dans le groupe contrôle reçoivent une injection fictive (ils ne reçoivent aucune injection). Dans les études précliniques, les animaux contrôles sont traités par l’injection d’une solution « véhicule » et l’effet d’une protéine dite « témoin » n’est jamais testé. Il est donc difficile d’évaluer l’effet qu’aurait l’injection de protéines non spécifiques.
Pour explorer les effets biologiques d’une protéine dénuée d’effets spécifiques sur la rétine, nous avons donc analysé le transcriptome de la neurorétine de rat après l’injection de ranibizumab, qui ne neutralise pas le VEGF de rat, ou d’un Fab non spécifique, ou encore du « véhicule » utilisé. Cette analyse a été réalisée 24 heures après l’injection, un délai trop court pour observer une réaction immunitaire potentielle de l’animal contre une protéine humaine. Cette expérience simple a montré que l’expression de nombreux gènes, connus pour avoir des effets significatifs sur l’œdème maculaire chez l’homme, est modulée en réponse à la modification de composition physico-chimique du vitré qui a été induite par l’injection des macromolécules [
27
]. À une époque où, pour prolonger la durée de leur action anti-œdémateuse, des doses plus élevées de protéines anti-VEGF sont injectées dans le vitré, il est important de comprendre les conséquences biologiques de l’augmentation des concentrations de protéines qui est ainsi engendrée localement. Cela devrait aider au développement de nouvelles molécules présentant, sans qu’elles soient spécifiques, des propriétés physico-chimiques anti-œdémateuses.
Les corticoïdes Les corticoïdes réduisent l’œdème maculaire diabétique, des occlusions veineuses et inflammatoires Les injections perioculaires et intraoculaires sont utilisées pour atteindre des concentrations efficaces de médicaments dans la rétine. Pour éviter les injections fréquentes, les ophtalmologistes ont d’abord utilisé la triamcinolone acétonide, indiquée en rhumatologie (Kenacort®). Ce médicament n’est pas indiqué et est inadapté à l’injection intraoculaire car il contient des excipients potentiellement toxiques pour la rétine. Les cristaux en suspension que cette préparation contient, permettent néanmoins une efficacité prolongée de plusieurs mois après injection intravitréenne, mais sans contrôle de la libération.
Nous avons contribué à montrer que la toxicité des glucocorticoïdes sur la rétine peut être particulièrement difficile à mettre en évidence puisque toute réaction inflammatoire est inhibée et que les mécanismes de mort induite sont atypiques, impliquant la paraptose
4
[
28
] ou une apoptose indépendante de l’activation des caspases [
29
]. Les molécules les plus hydrophobes sont les plus toxiques, impliquant des mécanismes de déstabilisation des membranes cellulaires [
30
]. L’injection intravitréenne de triamcinolone induit une réduction majeure des œdèmes maculaires diabétiques, inflammatoires et de l’occlusion veineuse rétinienne, dans des études randomisées, mais les effets secondaires, en particulier la cataracte mais surtout l’hypertonie oculaire fréquente et parfois sévère, limitent son utilisation. Les injections intravitréennes de glucocorticoïdes ne s’accompagnent pas de leur passage systémique, expliquant qu’ils soient sans risque chez les patients diabétiques [
31
]. La triamcinolone acétonide est utilisée hors AMM en injection péri-oculaire, en particulier dans le traitement des inflammations intraoculaires. Contrairement aux injections intravitréenne, les injections périoculaires n’épargnent pas le passage systémique. Elles doivent donc être évitées chez les patients diabétiques. L’utilisation de la voie suprachoroïdienne [
32
] a été développée récemment pour administrer la triamciniolone acétonide. Cette voie d’administration semblerait réduire les risques d’hypertonie. Afin de mieux contrôler la libération de corticoïdes dans la cavité vitréenne, deux implants administrés par injection intraoculaire simple ont été développés. L’un est biodégradable, il est composé d’un copolymère, le PLGA (
poly[lactic-co-glycolic acid]
), chargé de dexaméthasone phosphate disodique (Ozurdex®, Allergan). Il s’avère efficace pendant environ trois mois dans les œdèmes maculaires diabétiques, dans le cas de l’occlusion veineuse et des réactions inflammatoires [
33
]. Ce dispositif expose le patient à l’apparition de cataractes fréquentes et d’hypertonies oculaires parfois sévères mais contrôlables par des traitements médicaux et plus rarement chirurgicaux. Plus récemment, un implant non biodégradable libérant de la fluocinolone acétonide pendant 3 ans a été développé et approuvé en France pour le traitement des œdèmes maculaires diabétiques évoluant depuis plusieurs années. Des effets secondaires dus aux glucocorticoïdes sont aussi observés. Le coût de ces implants limite leur utilisation qui serait pourtant nécessaire dans les cas où l’observance des traitements conventionnels est insuffisante et quand les autres thérapies ont échoué.
Les glucocorticoïdes assèchent la rétine mieux et plus vite que les anti-VEGF, mais cela ne se traduit pas systématiquement par une augmentation du gain visuel. Le passage d’une molécule à l’autre peut être proposé, voire l’association des deux. L’effet anti-œdémateux très rapide, observé après injection intraoculaire de triamcinolone, dans les première heures qui suivent l’injection [
34
], suggère que des mécanismes actifs de drainage des fluides sont activés, en plus de l’effet sur la perméabilité qui s’observe à plus long terme. Nous avons ainsi montré que le la dexaméthasone et la triamcinolone régulent de façon différentielle l’expression et la distribution des canaux potassiques Kir4.1 et du canal aqueux AQP4 dans les CGM chez le rat [
35
]. L’effet différentiel des deux molécules pourraient impliquer l’activation du récepteur minéralocorticoïde (MR), dont nous avons démontré l’implication dans la régulation de l’expression et la distribution de ces canaux dans les CGM [
36
].
Pourquoi les corticoïdes ne sont-ils pas efficaces dans l’œdème maculaire de la DMLA néovasculaire ?
Il est surprenant de constater que les gluocorticoïdes sont inefficaces dans la DMLA néovasculaire alors qu’ils sont anti-œdémateux, anti-inflammatoires et anti-angiogéniques. Cela est d’autant plus étonnant que l’inflammation est reconnue comme un facteur causal majeur dans la survenue et le développement de la DMLA. Les corticostéroïdes se lient aux récepteurs des gluco-(GR) et minéralo-(MR) corticoïdes
5,
qui, associés à leur ligand, transloquent dans le noyau cellulaire et agissent comme des facteurs de transcription qui reconnaissent les séquences GRE (élément de réponse aux glucocorticoïdes). Leurs effets biologiques sont spécifiques des tissus selon l’expression relative des récepteurs, de leurs cofacteurs, et des enzymes pré-réceptorales 11β-hydroxystéroïde déshydrogénase de type 1 et 2 (11β-HSD-1 et 2)
6
, qui contrôlent les quantités relatives de cortisol et de cortisone dans les cellules.
Outre les cellules rénales, où il participe à l’équilibre hydro-sodé, plusieurs autres cellules et organes expriment le MR dans lesquels son activation peut être pathogène, justifiant l’utilisation d’antagonistes [
37
]. Dans l’œil, comme dans le système nerveux central, le ligand du MR est le cortisol, et non l’aldostérone que nous n’avons pas pu détecter dans la rétine. Au niveau de la rétine, nous avons montré que la voie activée par les minéralocorticoïdes était responsable des effets pro-inflammatoires et pro-œdémateux que l’on observe [
38
,
39
]
(
Figure 5
A)
, ce qui a été confirmé par différentes équipes dans des modèles animaux [
40
-
42
]. L’activation de cette voie pourrait expliquer, en partie, la survenue d’une forme particulière d’œdème maculaire cortico-induit, que l’on appelle choriorétinopathie séreuse centrale, et que l’on observe lors de l’utilisation des glucocorticoïdes [
43
]. Dans le modèle de néovascularisation choroïdienne induite par photocoagulation laser chez le rat, un modèle utilisé pour le développement de médicaments pour la DMLA néovasculaire, nous avons montré que des antagonistes des récepteurs des minéralocorticoïdes (MRA), chargés dans des microsphères de PLGA et administrés par voie systémique ou par voie locale, inhibaient cette néovascularisation choroïdienne
(
Figure 5
B).
Parallèlement, l’utilisation de souris transgéniques a montré que l’invalidation du MR dans les cellules endothéliales prévenait la néovascularisation. Les mécanismes sont indépendants de la voie du VEGF et reposeraient sur une amplification de l’expression de la décorine, un protéoglycane matriciel. Chez l’homme, dans un essai pilote, non contrôlé, nous avons observé que l’addition par voie orale de spironolactone, un antagoniste de l’aldostérone se liant au MR, à des injections mensuelles d’anti-VEGF, chez des patients résistant au traitement anti-VEGF depuis plusieurs mois, pourrait avoir un effet bénéfique
(
Figure 5C
)
[
44
]. Ces résultats préliminaires nécessitent d’être confirmés, mais ils suggèrent qu’une optimisation de l’utilisation des glucocorticoïdes dans l’œil, qui permettrait d’activer le GR tout en neutralisant le MR, pourrait non seulement permettre de réduire les doses et les effets secondaires des glucocorticoïdes, mais aussi d’étendre leurs indications [
45
].
|
Conclusions et perspectives L’OM, l’une des premières causes d’altération de la vision centrale reste un problème de santé publique. Le handicap visuel majore en effet les risques dus à d’autres pathologies et les autres handicaps. Par exemple, un patient diabétique déficient visuel ne pourra plus surveiller sa glycémie et ainsi assurer, par lui-même, sa prise en charge. Quand l’OM est cliniquement décelable, dans la plupart des maladies chroniques de la rétine, les lésions cellulaires et en particulier celles qui touchent les photorécepteurs, sont déjà irréversibles. Les efforts futurs devront donc porter non seulement sur l’identification et l’élaboration de nouvelles molécules ou l’optimisation de molécules déjà connues, mais également sur le développement de biomarqueurs moléculaires et d’imagerie qui permettront une détection précoce de l’œdème, et serviront de critères d’évaluation prédictifs de la fonction visuelle dans les études cliniques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Bourne
RRA
,
Jonas
JB
,
Bron
AM
,
et al.
Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: magnitude, temporal trends and projections.
.
Br J Ophthalmol.
2018;
;
102
:
:575.
–
585
.
2.
Omri
S
,
Omri
B
,
Savoldelli
M
,
et al.
The outer limiting membrane (OLM) revisited : clinical implications.
.
Clin Ophthalmol Auckl NZ.
2010;
;
4
:
:183.
–
195
.
3.
Daruich
A
,
Matet
A
,
Moulin
A
,
et al.
Mechanisms of macular edema : beyond the surface.
.
Prog Retin Eye Res.
2018;
;
63
:
:20.
–
68
.
4.
Omri
S
,
Behar-Cohen
F
,
Rothschild
P-R
,
et al.
PKCζ mediates breakdown of outer blood-retinal barriers in diabetic retinopathy.
.
PLoS One.
2013;
;
8
:
:e81600.
.
5.
Rothschild
PR
,
Salah
S
,
Berdugo
M
,
et al.
ROCK-1 mediates diabetes-induced retinal pigment epithelial and endothelial cell blebbing : Contribution to diabetic retinopathy.
.
Sci Rep.
2017;
;
7
:
:8834.
.
6.
Kowalczuk
L
,
Touchard
E
,
Omri
S
,
et al.
Placental growth factor contributes to micro-vascular abnormalization and blood-retinal barrier breakdown in diabetic retinopathy.
.
PLoS One.
2011;
;
6
:
:e17462.
.
7.
Miyamoto
N
,
de Kozak
Y
,
Jeanny
JC
,
et al.
Placental growth factor-1 and epithelial haemato-retinal barrier breakdown : potential implication in the pathogenesis of diabetic retinopathy.
.
Diabetologia.
2007;
;
50
:
:461.
–
470
.
8.
Omri
S
,
Behar-Cohen
F
,
de Kozak
Y
,
et al.
Microglia/macrophages migrate through retinal epithelium barrier by a transcellular route in diabetic retinopathy : role of PKCζ in the Goto Kakizaki rat model.
.
Am J Pathol.
2011;
;
179
:
:942.
–
953
.
9.
Couturier
A
,
Bousquet
E
,
Zhao
M
,
et al.
Anti-vascular endothelial growth factor acts on retinal microglia/macrophage activation in a rat model of ocular inflammation.
.
Mol Vis.
2014;
;
20
:
:908.
–
920
.
10.
Bousquet
E
,
Zhao
M
,
Thillaye-Goldenberg
B
,
et al.
Choroidal mast cells in retinal pathology : a potential target for intervention.
.
Am J Pathol.
2015;
;
185
:
:2083.
–
2095
.
11.
Matet
A
,
Savastano
MC
,
Rispoli
M
,
et al.
En face optical coherence tomography of foveal microstructure in full-thickness macular hole : a model to study perifoveal Müller cells.
.
Am J Ophthalmol.
2015;
;
159
:
(1142–1151)
:e3.
.
12.
Iliff
JJ
,
Wang
M
,
Liao
Y
, et al.
A Paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β.
.
Sci Transl Med.
2012;
;
4
:
:147ra111.
.
13.
Nakada
T
,
Kwee
IL
,
Igarashi
H
,
Suzuki
Y
.
Aquaporin-4 functionality and Virchow-Robin space water dynamics: physiological model for neurovascular coupling and glymphatic flow.
.
Int J Mol Sci.
2017;
;
18
:
14.
Solomon
SD
,
Lindsley
K
,
Vedula
SS
, et al.
Anti-vascular endothelial growth factor for neovascular age-related macular degeneration.
.
Cochrane Database Syst Rev.
2014
:
:CD005139.
.
15.
Virgili
G
,
Parravano
M
,
Evans
JR
, et al.
Anti-vascular endothelial growth factor for diabetic macular oedema : a network meta-analysis.
.
Cochrane Database Syst Rev.
2017;
;
6
:
:CD007419.
.
16.
Sangroongruangsri
S
,
Ratanapakorn
T
,
Wu
O
,
et al.
Comparative efficacy of bevacizumab, ranibizumab, and aflibercept for treatment of macular edema secondary to retinal vein occlusion: a systematic review and network meta-analysis.
.
Expert Rev Clin Pharmacol.
2018;
;
11
:
:903.
–
916
.
17.
Freund
KB
,
Korobelnik
J-F
,
Devenyi
R
,
et al.
Treat-and-extend regimens with anti-VEGF agents in retinal diseases: a literature review and consensus recommendations.
.
Retina Phila Pa.
2015;
;
35
:
:1489.
–
1506
.
18.
Dugel
PU
,
Jaffe
GJ
,
Sallstig
P
,
et al.
Brolucizumab versus aflibercept in participants with neovascular age-related macular degeneration: a randomized trial.
.
Ophthalmology.
2017;
;
124
:
:1296.
–
1304
.
19.
Stewart
MW
.
Extended duration vascular endothelial growth factor iinhibition in the eye: failures, successes, and future possibilities.
.
Pharmaceutics.
2018
;
:10.
.
20.
Moore
NA
,
Morral
N
,
Ciulla
TA
,
Bracha
P
.
Gene therapy for inherited retinal and optic nerve degenerations.
.
Expert Opin Biol Ther.
2018;
;
18
:
:37.
–
49
.
21.
Bordet
T
,
Behar-Cohen
F
.
Ocular gene therapies in clinical practice: viral vectors and nonviral alternatives.
.
Drug Discov Today.
2019;
;
24
:
:1685.
–
1693
.
22.
Stewart
MW
.
Pharmacokinetics, pharmacodynamics and pre-clinical characteristics of ophthalmic drugs that bind VEGF.
.
Expert Rev Clin Pharmacol.
2014;
;
7
:
:167.
–
180
.
23.
Mordenti
J
,
Cuthbertson
RA
,
Ferrara
N
,
et al.
Comparisons of the intraocular tissue distribution, pharmacokinetics, and safety of 125I-labeled full-length and Fab antibodies in rhesus monkeys following intravitreal administration.
.
Toxicol Pathol.
1999;
;
27
:
:536.
–
544
.
24.
CATT Research Group.
,
Martin
DF
,
Maguire
MG
,
Ying
G
, et al.
Ranibizumab and bevacizumab for neovascular age-related macular degeneration.
.
N Engl J Med.
2011;
;
364
:
:1897.
–
1908
.
25.
Xu
D
,
Dávila
JP
,
Rahimi
M
,
et al.
Long-term progression of type 1 neovascularization in age-related macular degeneration using optical coherence tomography angiography.
.
Am J Ophthalmol.
2018;
;
187
:
:10.
–
20
.
26.
Fuh
G
,
Wu
P
,
Liang
WC
,
et al.
Structure-function studies of two synthetic anti-vascular endothelial growth factor Fabs and comparison with the Avastin Fab.
.
J Biol Chem.
2006;
;
281
:
:6625.
–
6631
.
27.
Behar-Cohen
F
,
Dernigoghossian
M
,
Andrieu-Soler
C
, et al.
Potential antiedematous effects of intravitreous anti-VEGF, unrelated to VEGF neutralization.
.
Drug Discov Today.
2019
.
https://doi.org/10.1016/j.drudis.2019.05.034
.
28.
Valamanesh
F
,
Torriglia
A
,
Savoldelli
M
,
et al.
Glucocorticoids induce retinal toxicity through mechanisms mainly associated with paraptosis.
.
Mol Vis.
2007;
;
13
:
:1746.
–
1757
.
29.
Valamanesh
F
,
Berdugo
M
,
Sennlaub
F
,
et al.
Effects of triamcinolone acetonide on vessels of the posterior segment of the eye.
.
Mol Vis.
2009;
;
15
:
:2634.
–
2648
.
30.
Torriglia
A
,
Valamanesh
F
,
Behar-Cohen
F
.
On the retinal toxicity of intraocular glucocorticoids.
.
Biochem Pharmacol.
2010;
;
80
:
:1878.
–
1886
.
31.
Yang
Y
,
Bailey
C
,
Loewenstein
A
,
Massin
P
.
Intravitreal corticosteroids in diabetic macular edema: pharmacokinetic considerations.
.
Retina Phila Pa.
2015;
;
35
:
:2440.
–
2449
.
32.
Einmahl
S
,
Savoldelli
M
,
D’Hermies
F
,
et al.
Evaluation of a novel biomaterial in the suprachoroidal space of the rabbit eye.
.
Invest Ophthalmol Vis Sci.
2002;
;
43
:
:1533.
–
1539
.
33.
Daruich
A
,
Matet
A
,
Behar-Cohen
F
.
Sustained-release steroids for the treatment of diabetic macular edema.
.
Curr Diab Rep.
2015;
;
15
:
:99.
.
34.
Miyamoto
N
,
Iossifov
D
,
Metge
F
,
Behar-Cohen
F
.
Early effects of intravitreal triamcinolone on macular edema : mechanistic implication.
.
Ophthalmology.
2006;
;
113
:
:2048.
–
2053
.
35.
Zhao
M
,
Bousquet
E
,
Valamanesh
F
,
et al.
Differential regulations of AQP4 and Kir4.1 by triamcinolone acetonide and dexamethasone in the healthy and inflamed retina.
.
Invest Ophthalmol Vis Sci.
2011;
;
52
:
:6340.
–
6347
.
36.
Zhao
M
,
Valamanesh
F
,
Celerier
I
,
et al.
The neuroretina is a novel mineralocorticoid target : aldosterone up-regulates ion and water channels in Müller glial cells.
.
FASEB J.
2010;
;
24
:
:3405.
–
3415
.
37.
Jaisser
F
,
Farman
N
.
Emerging roles of the mineralocorticoid receptor in pathology: toward New paradigms in clinical pharmacology.
.
Pharmacol Rev.
2016;
;
68
:
:49.
–
75
.
38.
Canonica
J
,
Mehanna
C
,
Bonnard
B
,
et al.
Effect of acute and chronic aldosterone exposure on the retinal pigment epithelium-choroid complex in rodents.
.
Exp Eye Res.
2019;
;
187
:
:107747.
.
39.
Zhao
M
,
Célérier
I
,
Bousquet
E
,
et al.
Mineralocorticoid receptor is involved in rat and human ocular chorioretinopathy.
.
J Clin Invest.
2012;
;
122
:
:2672.
–
2679
.
40.
Allingham
MJ
,
Tserentsoodol
N
,
Saloupis
P
,
et al.
Aldosterone exposure causes increased retinal edema and severe retinopathy following laser-induced retinal vein occlusion in mice.
.
Invest Ophthalmol Vis Sci.
2018;
;
59
:
:3355.
–
3365
.
41.
Wilkinson-Berka
JL
,
Tan
G
,
Jaworski
K
,
Miller
AG
.
Identification of a retinal aldosterone system and the protective effects of mineralocorticoid receptor antagonism on retinal vascular pathology.
.
Circ Res.
2009;
;
104
:
:124.
–
133
.
42.
Wilkinson-Berka
JL
,
Behar-Cohen
F
.
Angiotensin II and aldosterone: co-conspirators in ocular physiology and disease.
.
Exp Eye Res.
2020
:
:108005.
.
43.
Daruich
A
,
Matet
A
,
Dirani
A
,
et al.
Central serous chorioretinopathy: recent findings and new physiopathology hypothesis.
.
Prog Retin Eye Res.
2015;
;
48
:
:82.
–
118
.
44.
Zhao
M
,
Mantel
I
,
Gelize
E
,
et al.
Mineralocorticoid receptor antagonism limits experimental choroidal neovascularization and structural changes associated with neovascular age-related macular degeneration.
.
Nat Commun.
2019;
;
10
:
:369.
.
45.
Behar-Cohen
F.
.
Towards an optimized use of ocular corticosteroids: EURETINA award lecture 2017.
.
Ophthalmologica.
2018;
;
240
:
:111.
–
119
.
46.
Behar-Cohen
F
,
Gelizé
E
,
Jonet
L
,
Lassiaz
P
.
Anatomie de la rétine.
.
Med Sci (Paris).
2020;
;
36
:
:594.
–
9
.
47.
Thomas
JL
,
Jacob
L
,
Boisserand
L
.
Système lymphatique et cerveau. Med Sci (Paris).
2019;
;
35
:
:55.
–
61
.
|