| |
| Med Sci (Paris). 36(8-9): 689–691. doi: 10.1051/medsci/2020137.Vers un vaccin contre les maladies inflammatoires chroniques ? Sabrine Naimi1 and Benoit Chassaing1,2* 1Inserm U1016, équipe Interactions microbiote/mucus dans les maladies inflammatoires chroniques, Université de Paris, Institut Cochin
,
24 rue du Faubourg Saint-Jacques
,
75014Paris
,
France 2Neuroscience institute, Institute for biomedical sciences, Georgia State University
,
Atlanta
,
États-Unis MeSH keywords: Animaux, Anticorps monoclonaux, Maladie chronique, Rectocolite hémorragique, Modèles animaux de maladie humaine, Flagelline, Humains, Inflammation, Souris, Obésité, Vaccination, usage thérapeutique, anatomopathologie, prévention et contrôle, antagonistes et inhibiteurs, immunologie, métabolisme, thérapie, méthodes, tendances |
Maladies inflammatoires chroniques et dysbiose intestinale
Le microbiote intestinal, qui désigne l’ensemble des micro-organismes (bactéries, champignons, virus, protistes) vivant dans le tractus gastro-intestinal, a une grande importance physiologique. Cependant, de nombreuses études ont montré que, dans certaines conditions, il pouvait devenir néfaste pour l’organisme qui l’héberge. Ainsi, différentes maladies inflammatoires, telles que le syndrome métabolique et les maladies inflammatoires chroniques de l’intestin (maladie de Crohn et rectocolite hémorragique), sont associées à des modifications de la composition et de la fonction du microbiote intestinal [
1
-
4
], notamment une concentration élevée de bactéries exprimant la flagelline, la protéine majoritaire des flagelles qui confèrent aux bactéries flagellées leur motilité. Des études précédentes ont par exemple démontré l’implication de certaines bactéries flagellées, telles que les gamma-protéobactéries de l’espèce
Escherichia coli
(colibacille), dans le développement de l’inflammation intestinale [
3
,
5
,
6
]. Ces bactéries expriment certains facteurs de virulence qui leur permettent de coloniser l’intestin de l’hôte, et leurs flagelles leur permettent de pénétrer à l’intérieur de la couche de mucus protectrice de l’épithélium intestinal et ainsi d’interagir avec cet épithélium pour induire une inflammation intestinale chronique [
7
,
8
]. Ainsi, cette couche de mucus, normalement stérile et formant une barrière qui protège l’organisme de son propre microbiote chez les sujets sains, perd sa stérilité chez des individus souffrant d’inflammation chronique, tels que ceux atteints d’une maladie inflammmatoire chronique de l’intestin ou d’un diabète de type 2 [
9
,
10
].
|
Flagelline et anticorps anti-flagelline
Chez l’homme, des immunoglobulines de type IgA, sécrétées naturellement dans l’intestin par les plasmocytes (issus de la différenciation terminale des lymphocytes B), sont dirigées vers la lumière intestinale afin de protéger l’organisme contre l’intrusion de micro-organismes [
11
,
12
]. Nous avions précédemment montré que les anticorps d’isotype IgA dirigés contre la flagelline pouvaient conduire à l’extinction de l’expression de la flagelline par certaines bactéries intestinales impliquées dans le déclenchement de l’inflammation, telles que les protéobactéries [
10
,
13
]. Notre équipe de recherche a donc souhaité mettre en place un protocole visant à stimuler, chez la souris, la production de tels anticorps dans l’intestin, afin de diminuer l’expression de la flagelline par les bactéries flagellées, et ainsi prévenir leur pénétration dans le mucus recouvrant l’épithélium intestinal et le développement de maladies inflammatoires chroniques.
|
Une immunisation contre la flagelline protège la souris contre une colite expérimentale
Dans le but d’évaluer l’effet protecteur d’une immunisation contre la flagelline contre l’inflammation intestinale chronique, notre équipe a administré de la flagelline par voie intra-péritonéale et de manière répétée à des souris, induisant ainsi une forte augmentation des anticorps anti-flagelline du type IgA dans la muqueuse intestinale [
14
]. Cette production accrue d’anticorps anti-flagelline est associée à une diminution de l’expression de la flagelline par les bactéries flagellées intestinales des souris immunisées. Cette immunisation a de plus permis d’augmenter l’épaisseur de mucus stérile à la surface de l’épithélium intestinal, donc la distance entre le microbiote et l’épithélium [
14
]. Une inflammation intestinale chronique a ensuite été induite chez ces souris et chez des souris témoins non immunisées contre la flagelline, grâce à des injections hebdomadaires d’un anticorps inhibant les récepteurs de l’interleukine 10 (IL-10, cytokine anti-inflammatoire intestinale). Les souris témoins ont développé une perte de poids, une splénomégalie, une colomégalie, un raccourcissement du côlon, ainsi qu’une élévation de certains marqueurs pro-inflammatoires (lipocaline 2 fécale, IL-6 sérique, myéloperoxydase colique), alors que les souris préalablement immunisées présentaient une réduction significative de l’ensemble des paramètres mesurant l’inflammation intestinale. Ce résultat montre donc qu’une immunisation préalable contre la flagelline protège ces animaux contre la colite expérimentale. De plus, l’utilisation de souris ne pouvant pas synthétiser d’anticorps anti-flagelline a permis de mettre en évidence le rôle central joué par ces anticorps dans la protection contre l’inflammation intestinale chronique [
14
].
|
L’immunisation contre la flagelline protège contre l’obésité
Les désordres métaboliques, tels que le diabète de type 2, sont également associés à la capacité du microbiote intestinal de pénétrer dans le mucus recouvrant l’épithélium [
13
]. Des souris nourries avec des aliments riches en graisses pendant quatre semaines ont été préalablement immunisées contre la flagelline, et l’impact sur l’apparition des désordres métaboliques liés à leur régime alimentaire a été analysé. Contrairement aux souris témoins (non immunisées), les souris immunisées ont présenté une faible prise de poids, une faible adiposité, ainsi qu’une inflammation intestinale atténuée. Ce résultat indique donc qu’une immunisation contre la flagelline joue un rôle protecteur contre l’apparition de diverses formes d’inflammation chronique.
|
Les résultats de cette étude récente démontrent le potentiel d’une immunisation anti-flagelline pour prévenir l’inflammation intestinale et le développement des maladies qui lui sont associées [
14
]. Chez la souris, cette approche vaccinale, fondée sur l’administration de flagelline purifiée par voie intrapéritonéale, a permis d’induire la production d’anticorps anti-flagelline dans la muqueuse intestinale
(
Figure 1
)
. Cette forte augmentation locale de la quantité d’anticorps entraîne une diminution de l’expression des flagelles par les bactéries flagellées intestinales, ce qui permet de réduire la présence de ces bactéries dans la muqueuse intestinale et ainsi de protéger l’organisme hôte contre l’inflammation intestinale [
14
]. D’autres travaux sont en cours chez la souris afin d’étudier le potentiel curatif d’une telle approche contre des maladies inflammatoires chroniques ou des dérégulations métaboliques déjà établies.
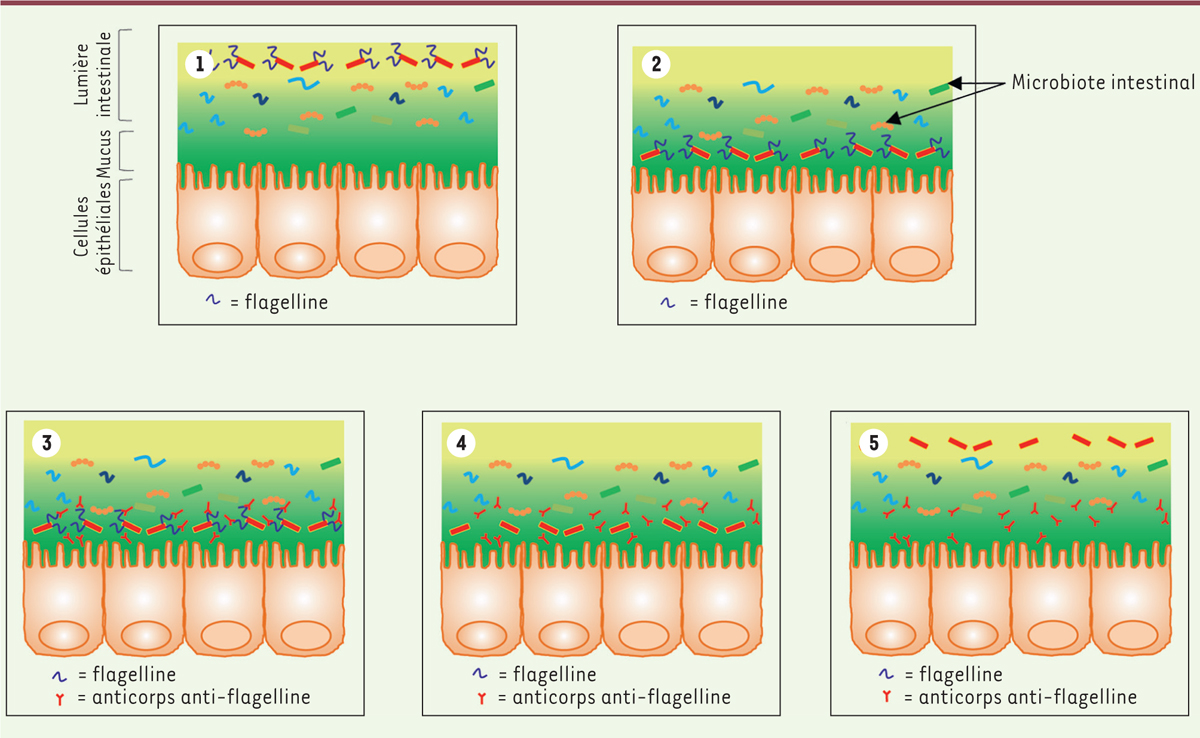
 | Figure 1.
Effet de l’administration intrapéritonéale de flagelline sur la muqueuse intestinale chez la souris.
En conditions normales, le microbiote intestinal contient certaines bacté ries exprimant la flagelline
(1)
, ce qui leur permet de pénétrer dans la couche de mucus, normalement sté rile, recouvrant l’épithélium intestinal
(2).
Les anticorps anti-flagelline de la muqueuse intestinale, produits à la suite du protocole d’immunisation des souris (injections intrapéritonéales répétées de flagelline purifiée), se lient spécifiquement aux flagelles bacté riens
(3)
, induisant un arrêt d’expression des flagelles par les bacté ries ciblé es
(4)
, et la relocalisation de ces bactéries à distance de la surface é pithé liale
(5)
.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Cette étude a été financée par la Crohn’s and colitis foundation et la Kenneth Rainin foundation, ainsi que par un starting grant de l’European Research Council (INVADERS).
|
1.
Nagao-Kitamoto
H
,
Shreiner
AB
,
Gillilland
MG
,
III
,
et al.
Functional characterization of inflammatory bowel disease–associated gut dysbiosis in gnotobiotic mice.
.
Cell Mol Gastroenterol Hepatol.
2016;
;
2
:
:468.
–
481
.
2.
Vijay-Kumar
M
,
Aitken
JD
,
Carvalho
FA
,
et al.
Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5.
.
Science.
2010;
;
328
:
:228.
–
231
.
3.
Shin
NR
,
Whon
TW
,
Bae
JW
.
Proteobacteria: microbial signature of dysbiosis in gut microbiota.
.
Trends Biotechnol.
2015;
;
33
:
:496.
–
503
.
4.
Chassaing
B
,
Koren
O
,
Carvalho
FA
,
et al.
AIEC pathobiont instigates chronic colitis in susceptible hosts by altering microbiota composition.
.
Gut.
2014;
;
63
:
:1069.
–
1080
.
5.
Carvalho
FA
,
Koren
O
,
Goodrich
JK
,
et al.
Transient inability to manage proteobacteria promotes chronic gut inflammation in TLR5-deficient mice.
.
Cell Host Microbe.
2012;
;
12
:
:139.
–
152
.
6.
Chassaing
B
,
Darfeuille-Michaud
A
.
The commensal microbiota and enteropathogens in the pathogenesis of inflammatory bowel diseases.
.
Gastroenterology.
2011;
;
140
:
(1720–8)
:e3.
.
7.
Chassaing
B
,
Ley
RE
,
Gewirtz
AT
.
Intestinal epithelial cell toll-like receptor 5 regulates the intestinal microbiota to prevent low-grade inflammation and metabolic syndrome in mice.
.
Gastroenterology.
2014;
;
147
:
(1363–77)
:e17.
.
8.
Sevrin
G
,
Massier
S
,
Chassaing
B
,
et al.
Adaptation of adherent-invasive E. coli to gut environment: impact on flagellum expression and bacterial colonization ability.
.
Gut Microbes.
2018
:
:1.
–
17
.
9.
Adeshirlarijaney
A
,
Zou
J
,
Tran
HQ
,
et al.
Amelioration of metabolic syndrome by metformin associates with reduced indices of low-grade inflammation independently of the gut microbiota.
.
Am J Physiol Endocrinol Metab.
2019;
;
317
:
:E1121.
–
E1E30
.
10.
Johansson
ME
,
Gustafsson
JK
,
Holmén-Larsson
J
,
et al.
Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis.
.
Gut.
2014;
;
63
:
:281.
–
291
.
11.
Lodes
MJ
,
Cong
Y
,
Elson
CO
,
et al.
Bacterial flagellin is a dominant antigen in Crohn disease.
.
J Clin Invest.
2004;
;
113
:
:1296.
–
1306
.
12.
Cullender
TC
,
Chassaing
B
,
Janzon
A
,
et al.
Innate and adaptive immunity interact to quench microbiome flagellar motility in the gut.
.
Cell Host Microbe.
2013;
;
14
:
:571.
–
581
.
13.
Chassaing
B
,
Raja
SM
,
Lewis
JD
,
et al.
Colonic microbiota encroachment correlates with dysglycemia in humans.
.
J Clin Invest.
2004;
;
113
:
:1296.
–
1306
.
14.
Tran
HQ
,
Ley
RE
,
Gewirtz
AT
,
Chassaing
B
.
Flagellin-elicited adaptive immunity suppresses flagellated microbiota and vaccinates against chronic inflammatory diseases.
.
Nat Commun.
2019;
;
10
:
:1.
–
15
.
|