| |
| Med Sci (Paris). 36(8-9): 695–699. doi: 10.1051/medsci/2020139.Immunothérapies du cancer : quel impact sur les fonctions cognitives ? Hélène Castel1,2* and Florence Joly2,3,4,5 1Normandie Univ, UniRouen, Inserm U1239, DC2N, Institut de recherche et d’innovation en biomédecine (IRIB)
,
25 rue Tesnière
,
76000Rouen
,
France 2Plate-forme Cancer et cognition, Ligue nationale contre le cancer
,
14000Caen
,
France 3Département d’oncologie médicale, Centre François Baclesse
,
14000Caen
,
France 4Normandie Univ, UniCaen, Inserm U1086, Anticipe
,
14000Caen
,
France 5CHU de Caen
,
14000Caen
,
France MeSH keywords: Animaux, Antinéoplasiques immunologiques, Encéphale, Vaccins anticancéreux, Points de contrôle du cycle cellulaire, Cognition, Humains, Immunothérapie, Immunothérapie adoptive, Tumeurs, Inhibiteurs de protéines kinases, Récepteurs chimériques pour l'antigène, Lymphocytes T, effets indésirables, effets des médicaments et substances chimiques, physiologie, pharmacologie, usage thérapeutique, méthodes, immunologie, thérapie, métabolisme |
Un changement de paradigme important dans le traitement du cancer est apparu ces dernières années avec les molécules d’immunothérapie qui ciblent le système immunitaire pour combattre la tolérance de l’hôte à la présence d’un cancer et stimuler une réponse immunitaire anti-tumorale. Actuellement, l’utilisation d’anticorps inhibiteurs de points de contrôle immunitaire (
immune check-point inhibitors
, ICI) apparaît comme l’approche la plus encourageante pour traiter les patients atteints de cancer, mais peut aussi induire des effets indésirables modérés ou sévères chez moins de 1 % des patients (bien davantage pour l’anti-CTLA-4, cependant) [
13
] (
→
).
(→) Voir la Synthèse de M. Kostine
et al.
,
m/s
n° 12, décembre 2019, page 94
De plus, bien que les thérapies cellulaires consistant à injecter des lymphocytes T-CAR (
chimeric antigen receptor
) chez les patients soient utilisées avec succès en hémato-oncologie, celles-ci sont associées à des toxicités neurologiques fréquentes et parfois graves, voire fatales.
|
Impact des traitements du cancer sur les fonctions cognitives
Les nouvelles thérapies du cancer, en particulier les immunothérapies, ont entraîné une amélioration significative de la survie d’une partie des patients, même en présence de métastases. Les effets secondaires des traitements, comme la fatigue, les troubles émotionnels ou les altérations des fonctions cognitives, rapportés avec les chimiothérapies, constituent un défi pour l’utilisation des nouvelles thérapies chez les patients cancéreux. Les déficits cognitifs (
cancer-related cognitive impairment
, CRCI) évalués après chimiothérapie regroupent des déficits d’apprentissage, de mémoire, d’attention, de fonctions exécutives ou de vitesse de traitement de l’information. Ces déficits peuvent être associés à une diminution du volume ou de la densité des substances blanche et grise, à des changements d’activation cérébrale ou de connectivité, dans des régions impliquées dans les fonctions cognitives [
1
]. Récemment, nous avons pu mettre en évidence que le CRCI n’était pas exclusivement lié aux chimiothérapies, et pouvait être associé à certaines thérapies ciblées telles que celles faisant appel aux agents anti-angiogéniques, qui entraînent parfois un déclin cognitif et une fatigue sévère [
2
]. De telles observations suggèrent que toutes les thérapies anti-cancéreuses doivent être évaluées quant à un possible CRCI. Actuellement, les études cliniques et précliniques de
l’International cognition and cancer task force
(ICCTF) et de la plate-forme française Cancer et cognition
1
posent la question de la part du cancer, de la réaction inflammatoire ou immunitaire associée, de la chimiothérapie, et éventuellement de la radiothérapie, dans l’apparition des dysfonctionnements cognitifs, dans un contexte favorisant l’anxiété ou la dépression chez des patients souvent âgés
(
Figure 1
)
. Avec l’émergence des nouvelles thérapies souvent utilisées en complément de la radiothérapie ou de la chimiothérapie, l’enjeu est de comprendre comment, en fonction du cancer et de l’état du patient, ces différents traitements entraînent, par addition ou synergie, des effets indésirables sur la cognition, associés à un vieillissement cérébral prématuré et responsables d’une altération majeure de la qualité de vie
(
Figure 1
)
.
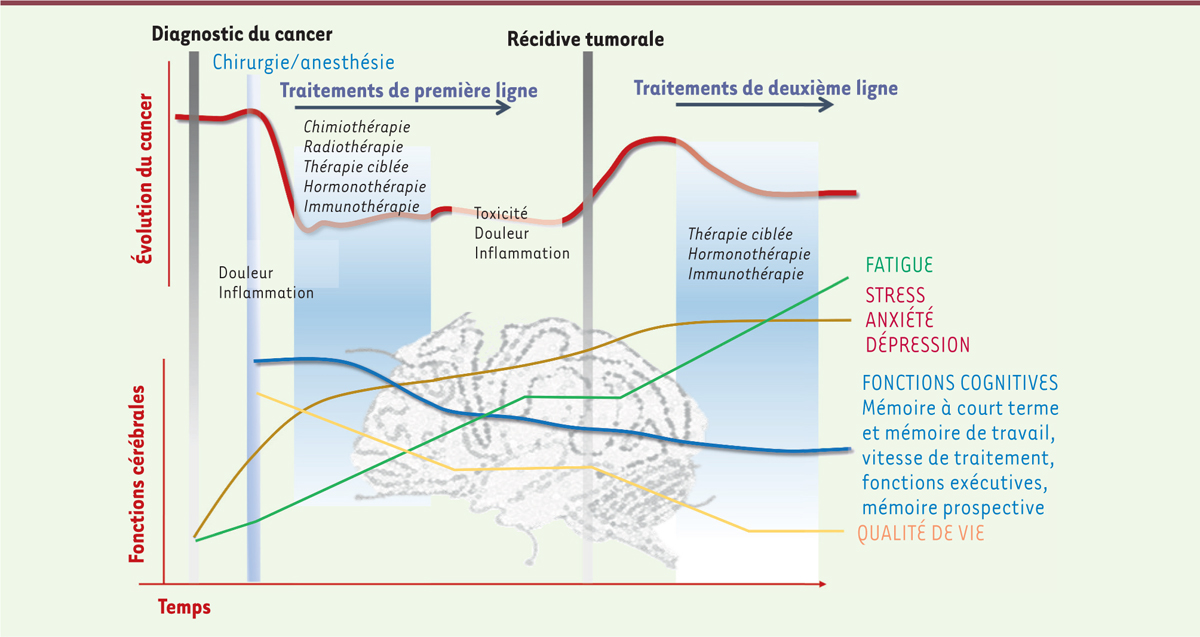
 | Figure 1.
Illustration du parcours d’un patient atteint de cancer.
L’évolution du cancer, représentée dans le graphique du haut par la courbe rouge, oscille à partir de l’annonce du diagnostic en fonction de la prise en charge (anesthésie et chirurgie, chimiothérapie, radiothérapie, voire nouvelles thérapies telles que les immunothérapies), et s’accompagne de douleurs et comorbidités. Le patient atteint de cancer est susceptible de présenter des troubles anxio-dépressifs, mais également une fatigue sévère et des déficits cognitifs, l’ensemble impactant fortement la qualité de vie.
|
|
Efficacité actuelle des immunothérapies spécifiques et effets indésirables
Les progrès faits au cours des quinze dernières années dans la connaissance du microenvironnement tumoral et dans l’immunité anti-tumorale permettent de proposer des pistes de traitements fondés sur la manipulation de l’immunité, reposant sur le blocage de l’immunosuppression, la stimulation de l’infiltration immunitaire, l’induction d’une mort cellulaire tumorale immunogénique, l’activation des cellules présentatrices d’antigènes, et/ou la promotion de l’activité des cellules effectrices. Parmi les différents types d’immunothérapie actuellement développés, la stratégie consistant à débloquer la réponse anti-tumorale des lymphocytes T spécifiques de la tumeur est très prometteuse. Elle implique principalement des anticorps monoclonaux dirigés contre CTLA-4 (
cytotoxic T-lymphocyte antigen-4 ;
l’ipilimumab) ou contre PD-1 (
programmed cell death protein-1
; le nivolumab ou le pembrolizumab), des molécules présentes à la surface des lymphocytes T activés et qui en contrôlent négativement l’activation. PD-1 en particulier est activé par ses ligands PD-L1 et PD-L2 (
programmed cell death-ligands 1 and 2
) exprimés par les cellules tumorales, permettant une action immunosuppressive locale
(
Figure 2
)
. La neutralisation de CTLA-4 ou de PD-1, voire de PD-L1, a donc pour objectif de favoriser une réponse immune anti-tumorale. Ces ICI sont perçus actuellement comme des outils thérapeutiques innovants, utilisés en monothérapie ou en combinaison dans la lutte contre de nombreux types de cancers solides [
3
]. Mais l’immunothérapie anticancéreuse englobe d’autres approches, telles que la thérapie par des lymphocytes T modifiés exprimant un récepteur antigénique chimérique recombinant, les lymphocytes T-CAR, capables de cibler des protéines membranaires exprimées par les cellules tumorales ou les cellules du système immunitaire
2
[
4
,
14
] (
→
).
(→) Voir la Synthèse de V. Catros,
m/s
n° 4, avril 2019, page 316
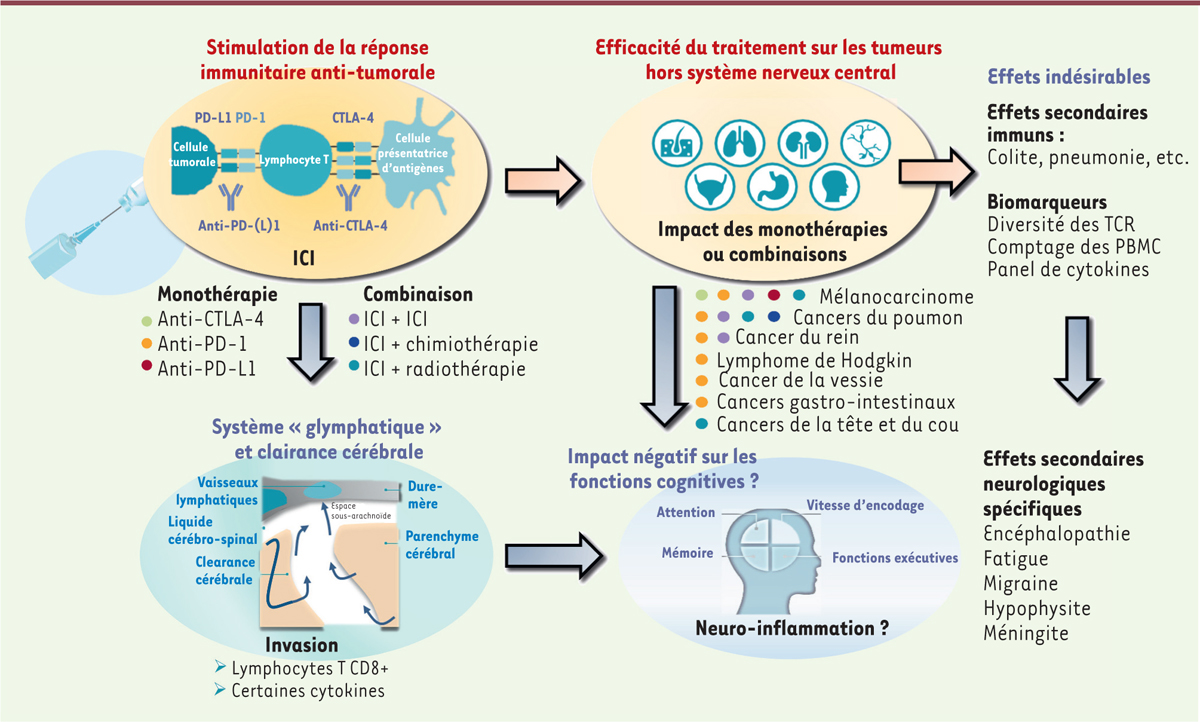
 | Figure 2.
Impact potentiel des immunothérapies sur les fonctions cognitives.
Les anticorps anti-CTLA-4 et anti-PD-(L)1 sont utilisés en monothérapie ou en thérapie combinée, et ont montré leur efficacité dans de nombreuses tumeurs hors du système nerveux central. Sous immunothérapie, certains biomarqueurs, tels que la diversité des récepteurs des lymphocytes T (TCR) ou le taux de leucocytes, permettraient de prédire des effets indésirables, y compris d’ordre neurologique puisque des déficits cognitifs ont pu être décrits. La connexion entre le système « glymphatique » et le système lymphatique méningé permet l’accès aux leucocytes et la circulation des cytokines dans le parenchyme cérébral, une des causes possibles d’altération cognitive sous immunothérapie. CTLA-4,
cytotoxic T-lymphocyte antigen-4
; ICI,
immune checkpoint inhibitors
; PBMC,
peripheral blood mononuclear cells
; PD-1,
programmed cell death-1
; PD-L1,
programmed cell death-ligand 1
; TCR
, T cell receptor
.
|
L’utilisation des cellules T-CAR anti-CD19 a été approuvée pour lutter contre des hémopathies malignes telles que la leucémie aiguë lymphoblastique, et d’autres types de lymphocytes T-CAR sont actuellement développés et testés pour traiter d’autres types de cancers.
Les succès et promesses de ces immunothérapies ne doivent pas conduire à négliger la question des toxicités. Des effets indésirables affectant un certain nombre d’organes tels que les poumons, la peau, les reins, les glandes endocrines, le foie ou le tractus digestif, voire le système nerveux central et périphérique, peuvent être associés à l’activation de la réponse immunitaire lors de l’utilisation des ICI [
13
] ou des cellules T-CAR [
14
]. Les principaux effets secondaires des lymphocytes T-CAR, en particulier, sont liés au syndrome de relargage de cytokines
3,
. Les ICI, quant à eux, peuvent contribuer à des changements neurobiologiques en provoquant une inflammation systémique. Leur combinaison, ou leur association à la chimiothérapie ou à la radiothérapie pour produire un effet abscopal
4,
, augmenterait l’efficacité anti-tumorale, mais pourrait également potentialiser les toxicités neurologiques. Néanmoins, dans les études pivots
5
évaluant l’utilisation des ICI, les troubles cognitifs ne sont pas spécifiquement mesurés, et dans la mesure où ils ne motivent pas une consultation neurologique, leur existence a probablement été sous-estimée.
|
Effets indésirables neurologiques et impact cognitif des ICI et lymphocytes T-CAR
L’incidence globale des évènements neurologiques indésirables signalés dans les études est de 4 % à 6 % en mono-immunothérapie, et de 12 % pour une thérapie combinée. La plupart de ces effets indésirables neurologiques sont notés de grade 1 à 2, et l’incidence d’une toxicité de grade 3 ou 4 est inférieure à 1 % pour tous les types de traitement [
5
]. Le spectre clinique des troubles neurologiques est hétérogène. Les céphalées (21 %), les encéphalopathies (19 %) et méningites (15 %) sont les effets neurotoxiques les plus fréquemment signalés [
6
]. Une hypophysite, maladie inflammatoire hypophysaire rare (et trop peu connue des oncologues), a également été signalée comme effet indésirable des anticorps inhibiteurs de CTLA-4, en particulier chez les patients atteints de mélanome métastatique
(
Figure 2
)
. Cette maladie provoque des déficits hormonaux des axes corticotrope ou thyréotrope qui pourraient induire des troubles de l’attention, une fatigue et des troubles cognitifs. En faveur de l’existence d’un lien entre hormones hypophysaires et cognition, on peut citer une étude chez des femmes atteintes d’un cancer du sein et recevant un traitement par leuproréline, un nonapeptide de synthèse analogue de l’hormone de libération des gonadotrophines (GnRH), qui ne montrent pas de réponse mesurable du cortisol lors d’un test au froid, mais présentent une altération des performances de mémoire à long-terme [
6
]. La fatigue est une manifestation clinique reconnue de maladies auto-immunes telles que le lupus érythémateux disséminé. Avec une incidence supérieure à 20 % pour les traitements utilisant les anticorps anti-PD-1 et anti-CTLA-4, elle est en fait l’effet indésirable le plus fréquemment signalé par les patients cancéreux recevant une immunothérapie. Des études cliniques transversales ont révélé des associations entre une intensification de la fatigue et des altérations cognitives (sans toutefois démontrer de lien de causalité), et des altérations de connectivité fonctionnelle de réseaux neuronaux ont été mises en évidence chez certains patients après un cancer. Cette fatigue pathologique semble donc indiquer un évènement neurologique indésirable, voire un impact cognitif lié à la perturbation du système immunitaire provoqué par ces ICI, peut-être en raison de l’induction d’une auto-immunité. Une étude clinique pilote a été menée chez 15 patients adultes atteints de cancer, traités par l’ipilimumab, le nivolumab ou le pembrolizumab, pour évaluer leurs troubles cognitifs. Deux tests cognitifs de dépistage ont été utilisés, le test MoCA (
Montreal cognitive assessment
) et le test des neuf images (TNI-93), avant le début du traitement et trois mois plus tard. Les auteurs ont conclu que la détérioration cognitive chez ces patients était associée à une chimiothérapie cytotoxique antérieure et non à l’immunothérapie [
8
]. Cependant, la petite taille de l’échantillon, l’absence d’un groupe témoin constitué de patients n’ayant pas reçu de chimiothérapie, et l’absence de recours à un bilan neuropsychologique standardisé ne permettent pas de conclure sur les effets potentiels des immunothérapies sur la cognition.
L’hypothèse d’un impact des ICI sur la cognition est étayée par une étude préclinique qui a testé l’impact de ces molécules, seules ou en combinaison avec une radiothérapie excluant le système nerveux central, sur les performances comportementales et cognitives chez des souris porteuses ou non de tumeurs. L’immunothérapie seule ou en combinaison avec la radiothérapie semble associée à des altérations cognitives et à une neuro-inflammation objectivée par une activation microgliale, et à des taux sériques de cytokines pro-inflammatoires significativement plus élevés chez les souris porteuses de tumeurs [
9
]. De fait, cette association d’immunothérapie avec la radiothérapie, en induisant un effet abscopal, peut exacerber l’effet néfaste de l’immunothérapie sur les fonctions cognitives. Dans le cas d’un cancer nécessitant une radiothérapie cérébrale, l’association de l’immunothérapie interpelle quant à sa neurotoxicité : en effet, il a été montré que le taux global de nécrose radiologique est accru (27 %) lorsque les patients reçoivent un traitement combiné associant une radio-chirurgie stéréotaxique cérébrale avec une immunothérapie, ce qui peut être à l’origine de complications neurologiques [
6
].
Pendant le traitement par ICI, les modifications du nombre de lymphocytes, de granulocytes éosinophiles, de granulocytes neutrophiles, de monocytes, et du rapport entre les nombres de lymphocytes et de granulocytes neutrophiles, ainsi que la diversification ou l’augmentation du répertoire des récepteurs des lymphocytes T (
T cell receptors
, TCR) peuvent désormais être considérées comme des marqueurs sanguins associés à la réponse immunitaire anti-tumorale. Mais il reste à identifier des biomarqueurs cliniques ou moléculaires fiables permettant de prédire les patients à risque de développer des effets neurologiques ou cognitifs majeurs liés à la réactivité immunitaire. De tels biomarqueurs pourraient inclure l’augmentation de la diversité des TCR, capable de prédire la survenue d’un syndrome de relargage de cytokines
,
ou le nombre de leucocytes associé aux effets indésirables des anticorps anti-CTLA-4 [
6
]. Enfin, certaines cytokines pourraient agir directement sur les fonctions cérébrales en traversant la barrière hémato-encéphalique. Récemment, un score de toxicité, appelé CYTOX, a été défini. Il prend en compte 11 cytokines dont la concentration plasmatique est augmentée chez des patients atteints de mélanocarcinome et présentant des toxicités immunologiques graves au début du traitement par un anticorps anti-PD-1 seul ou en combinaison avec un anticorps anti-CTLA-4 [
10
].
Dans le cas des traitements par les lymphocytes T-CAR, la question de leur impact neurologique se pose fondamentalement. En effet, l’utilisation de cellules T-CAR provoque régulièrement un syndrome de relargage de cytokines, nécessitant, chez 27 % des patients, une prise en charge en unité de soins intensifs. Les effets indésirables neurologiques et une encéphalopathie associée aux cellules T-CAR touchent environ 40 % des patients, et peuvent entraîner la mort [
6
]. À titre d’exemple, chez les patients atteints de leucémie aiguë lymphoblastique à précurseurs B (B-ALL) traités par cellules T-CAR anti-CD19, des taux sériques élevés d’interleukine (IL)-1α, IL-2, IL-3, IL-5, IL-6, IL-10, IL-15, d’IP10 (ou CXCL10,
C-X-C motif chemokine 10
), d’INF-γ (interféron gamme), de G-CSF, GM-CSF et MCP-1 (ou CCL2,
C-C motif chemokine ligand 2
) ont été décrits chez ceux qui présentaient une neurotoxicité sévère [
11
]. L’examen cérébral des patients décédés des suites de cette neurotoxicité a montré des lésions et des nécroses vasculaires avec infiltration péri-vasculaire de cellules T CD8
+
, ce qui suggère que les déficits neurologiques et la toxicité peuvent être au moins en partie relayés par l’invasion cérébrale directe des cellules T-CAR et la libération de cytokines
in situ (
Figure 2
)
. Le système nerveux central a été longtemps considéré comme un organe sanctuaire bénéficiant d’un « immuno-privilège » (
immune privilege
) et protégé par la barrière hémato-encéphalique. Cependant, un système « glymphatique »
6
de drainage du parenchyme cérébral a récemment été décrit. Le liquide cérébro-spinal au contact des méninges, qui assurent une immunosurveillance du cerveau, circule dans des espaces paravasculaires le long des branches des artères méningées qui pénètrent dans le cerveau, et ce flux permet de drainer les fluides interstitiels vers les sinus veineux de la dure-mère
(
Figure 2
)
. Ces études indiquent que des cytokines méningées peuvent ainsi être transportées dans certaines aires cérébrales, et modifier les fonctions émotionnelles ou cognitives. Elles renforcent l’idée que l’impact de l’immunothérapie sur l’homéostasie du système immunitaire pourrait atteindre le cerveau et induire un déclin cognitif
(
Figure 2
)
.
|
Des altérations cognitives ont été décrites après des chimiothérapies ou des thérapies ciblées contre le cancer, mais n’ont pas été spécifiquement étudiées chez les patients cancéreux recevant une immunothérapie. Les données fragmentaires obtenues chez ces patients, la présence du système « glymphatique » permettant une surveillance immunitaire méningée du système nerveux central, et une première étude préclinique évaluant l’impact d’ICI associés à une radiothérapie périphérique, suggèrent l’existence de dysfonctionnements cognitifs induits par l’immunothérapie. Pour l’heure, les troubles neurologiques semblent relativement rares chez les patients traités par des ICI, mais peuvent s’avérer sévères et apparaître pendant ou après la période de traitement. Les cellules T-CAR, utilisées avec succès dans le traitement d’onco-hémopathies, sont quant à elles associées à des troubles neurologiques fréquents et graves, qui apparaissent généralement peu de temps après leur administration aux patients. Devant les résultats très prometteurs des immunothérapies, parfois administrées de façon prolongée, il est important de caractériser les déficits cognitifs et émotionnels potentiels
via
notamment l’utilisation d’une batterie de tests cognitifs neuropsychologiques, d’inclure des groupes de patients témoins dans les protocoles, et de prendre en compte la totalité du parcours de soins [
12
]. Des études « translationnelles » impliquant chercheurs et médecins cliniciens devraient apporter des réponses concernant le rôle du type de cancer ou d’un statut inflammatoire systémique dans la susceptibilité des patients à présenter une atteinte cérébrale résultant de certaines immunothérapies, et permettre d’identifier des biomarqueurs prédictifs ainsi que d’évaluer l’efficacité de stratégies de prévention.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions les Dr Marie Lange, Laure Tron, Martine Dubois, et Laurence Desrues pour leurs collaborations dans les études de la plate-forme Cancer et cognition, et les laboratoires BMS, la Ligue contre le cancer, le Cancéropôle Nord-Ouest et la région Normandie et l’Union Européenne (l’Europe s’implique en Normandie avec des fonds de développement régional-FEDER) pour le soutien financier des recherches sur l’effet des immunothérapies sur les fonctions cognitives.
|
Footnotes |
1.
Lange
M
,
Joly
F
,
Vardy
J
,
et al.
Cancer-related cognitive impairment: an update on state of the art, detection, and management strategies in cancer survivors.
.
Ann Oncol.
2019;
;
30
:
:1925.
–
1940
.
2.
Joly
F
,
Heutte
N
,
Duclos
B
,
et al.
Prospective evaluation of the impact of antiangiogenic treatment on cognitive functions in metastatic renal cancer.
.
Eur Urol Focus.
2016;
;
2
:
:642.
–
649
.
3.
Dempke
WCM
,
Fenchel
K
,
Uciechowski
P
,
Dale
SP
,
Second- and third-generation drugs for immuno-oncology treatment: The more the better?
.
Eur J Cancer.
2017;
;
74
:
:55.
–
72
.
4.
Davila
ML
,
Sadelain
M
,
Biology and clinical application of CAR T cells for B cell malignancies.
.
Int J Hematol.
2016;
;
104
:
:6.
–
17
.
5.
Wick
W
,
Hertenstein
A
,
Platten
M
,
Neurological sequelae of cancer immunotherapies and targeted therapies.
.
Lancet Oncol.
2016;
;
17
:
:e529.
–
e541
.
6.
Joly
F
,
Castel
H
,
Tron
L
,
et al.
Potential effect of immunotherapy agents on cognitive function in cancer patients.
.
J Natl Cancer Inst.
2020;
;
112
:
:123.
–
7
.
7.
Eggermont
AM
,
Chiarion-Sileni
V
,
Grob
JJ
,
et al.
Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial.
.
Lancet Oncol.
2015;
;
16
:
:522.
–
530
.
8.
Cuzzubbo
S
,
Belin
C
,
Chouahnia
K
,
et al.
Assessing cognitive function in patients treated with immune checkpoint inhibitors: a feasibility study.
.
Psychooncology.
2018;
;
27
:
:1861.
–
1864
.
9.
McGinnis
GJ
,
Friedman
D
,
Young
KH
,
et al.
Neuroinflammatory and cognitive consequences of combined radiation and immunotherapy in a novel preclinical model.
.
Oncotarget.
2017;
;
8
:
:9155.
–
9173
.
10.
Lim
SY
,
Lee
JH
,
Gide
TN
,
et al.
Circulating cytokines predict immune-related toxicity in melanoma patients receiving anti-PD-1-based immunotherapy.
.
Clin Cancer Res.
2019;
;
25
:
:1557.
–
1563
.
11.
Touat
M
,
Talmasov
D
,
Ricard
D
,
Psimaras
D
,
Neurological toxicities associated with immune-checkpoint inhibitors.
.
Curr Opin Neurol.
2017;
;
30
:
:659.
–
668
.
12.
Lange
M
,
Castel
H
,
Le Fel
J
,
et al.
How to assess and manage cognitive impairment induced by treatments of non-central nervous system cancer.
.
Neurosci Biobehav Rev.
2019;
;
107
:
:602.
–
614
.
13.
Kostine
M
,
Marabelle
A
,
Schaeverbeke
T
,
Kfoury
M
,
Les limites des inhibiteurs de points de contrôle immunitaire et la gestion de leur toxicité.
.
Med Sci (Paris).
2019;
;
35
:
:949.
–
956
.
14.
Catros
V.
,
Les CAR-T cells, des cellules tueuses spécifiques d’antigènes tumoraux : de nouvelles générations pour le traitement des tumeurs solides.
.
Med Sci (Paris).
2019;
;
35
:
:316.
–
326
.
|