Le système lymphatique associé au système nerveux central (SNC) regroupe les vaisseaux et ganglions lymphatiques qui sont impliqués dans le drainage du liquide céphalo-rachidien (LCR) et la clairance du parenchyme cérébral [ 1 - 3 ] ( → ).
(→) Voir la Synthèse de J.L. Thomas et al. , m/s n° 1, janvier 2019, page 55
Ce système lymphatique est également un acteur de la surveillance immunitaire du SNC [ 4 ]. Une étude récente, réalisée par l’équipe dirigée par Akiko Iwasaki à l’université de Yale (États-Unis) en collaboration avec notre équipe à l’Institut du cerveau et de la moelle épinière (ICM, Paris), a permis de montrer que le facteur de croissance vasculaire lymphatique VEGF-C ( vascular endothelial growth factor-C ) augmente le drainage lymphatique des antigènes tumoraux et accroît la réponse lymphocytaire contre les tumeurs cérébrales [ 5 ]. Les résultats de cette étude confirment l’importance du système lymphatique associé au SNC dans la surveillance immunitaire du SNC, et suggèrent une possible approche thérapeutique utilisant VEGF-C contre les tumeurs cérébrales.
Le fonctionnement du SNC dépend de sa perfusion continuelle par la circulation sanguine périphérique. Les vaisseaux sanguins assurent les échanges trophiques et de cellules immunitaires entre le sang et, d’une part, le parenchyme du SNC, à travers la barrière hémato-encéphalique, et, d‘autre part, le LCR, au niveau du plexus choroïde des ventricules cérébraux. Un autre type d’interface vasculaire est établi par les vaisseaux lymphatiques, à la périphérie du SNC, dans la dure-mère des méninges [ 1 ] ainsi que dans les régions extra-crâniennes collectrices du LCR [ 2 ]. Anatomiquement, les vaisseaux lymphatiques méningés suivent les sinus veineux crâniens ainsi que certaines branches des artères cérébrales ; ils ne sont pas en contact anatomique direct avec le SNC, mais avec le LCR, les artères et veines irrigant le SNC [ 1 ]. En conditions pathologiques, l’ablation locale des vaisseaux lymphatiques méningés dorsaux par photocoagulation promeut l’accumulation de la protéine β-amyloïde dans les méninges et l’aggrave dans le parenchyme cérébral dans un modèle murin de la maladie d’Alzheimer, tandis qu’elle réduit l’inflammation dans un modèle murin de la sclérose en plaques [ 4 ]. En participant à l’homéostasie du SNC et en assurant la connexion du SNC avec l’immunité périphérique, les vaisseaux lymphatiques méningés représentent donc une cible thérapeutique attractive pour contrôler la réponse immunitaire dans le SNC dans une situation pathologique neuroinflammatoire, infectieuse ou tumorale.
Un privilège immunitaire est conféré au SNC par la présence de la barrière hémato-encéphalique et de la dure-mère des méninges, qui contrôlent la libre circulation des antigènes du SNC et des cellules immunitaires, hors du SNC et du LCR, vers la circulation périphérique [ 6 ]. Ces barrières protègent le SNC des infections périphériques, mais dans le cas d’une infection ou d’une tumeur du SNC, elles limitent l’information transmise au système immunitaire ainsi que l’entrée des acteurs circulants de la défense immunitaire dans le SNC. La présence du système lymphatique méningé amène à reconsidérer le modèle du privilège immunitaire du SNC [ 4 ], et suggère la possibilité qu’une augmentation du drainage lymphatique méningé pourrait provoquer une activation lymphocytaire dans les ganglions lymphatiques drainant le LCR et les fluides interstitiels cérébraux, c’est-à-dire sensibiliser les lymphocytes T naïfs n’ayant pas encore rencontré l’antigène qui va les activer ( T cell priming ). Nous avons testé cette hypothèse dans le contexte des tumeurs cérébrales.
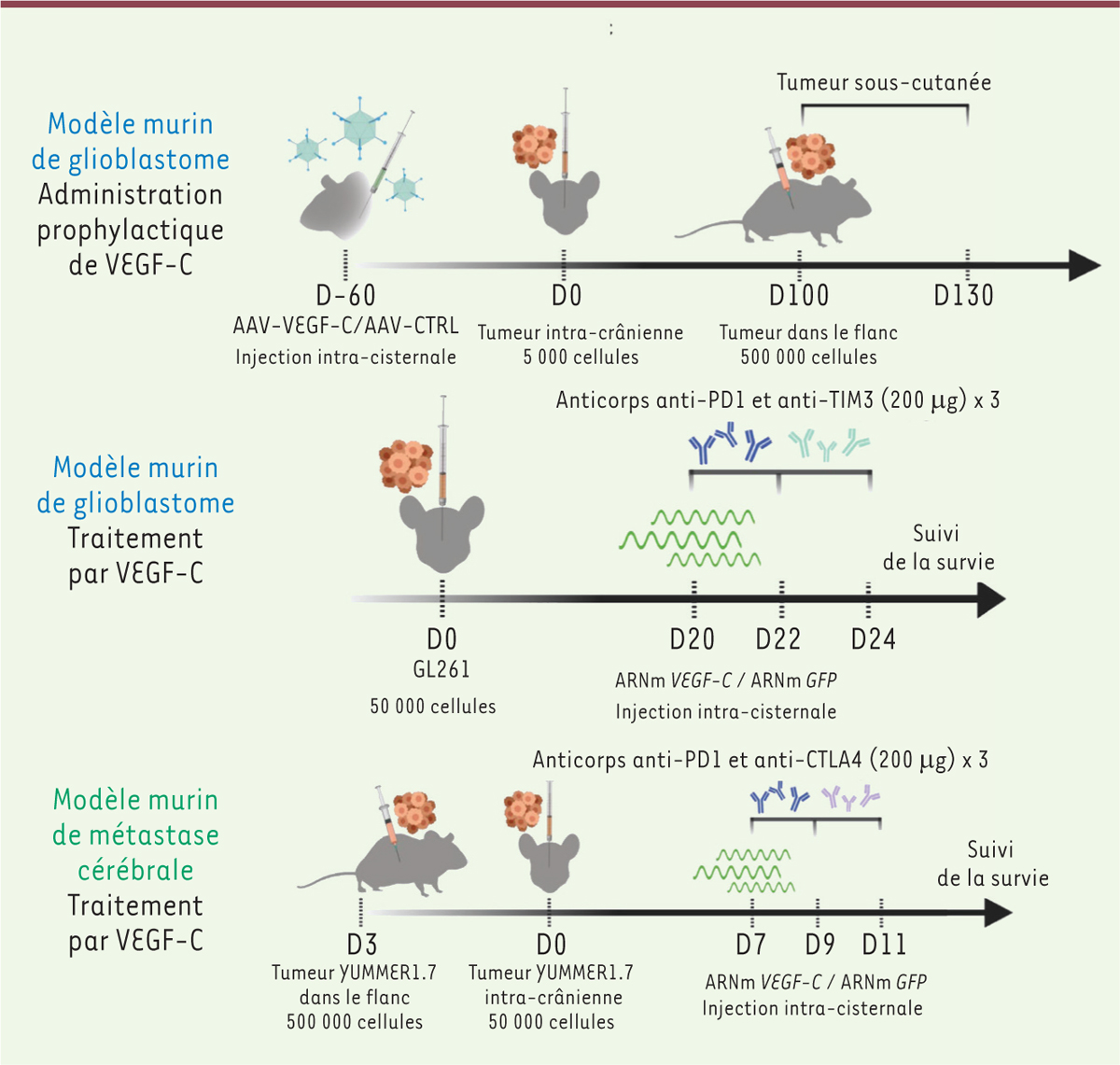
Les glioblastomes sont les plus fréquentes (80 %), les plus infiltrantes, et les plus agressives des tumeurs cérébrales primaires ; elles sont résistantes à la radiothérapie, à la chimiothérapie et à l’immunothérapie [ 7 ]. L’efflux de LCR est par ailleurs réduit chez les souris porteuses d’un glioblastome, suggérant un défaut de drainage lymphatique du LCR [ 8 ]. Nous avons postulé qu’un « gain de fonction » du système lymphatique associé au SNC pourrait avoir trois conséquences : 1) augmenter le drainage lymphatique du LCR et des antigènes tumoraux ; 2) sensibiliser les lymphocytes naïfs dans les ganglions lymphatiques drainant le LCR et stimuler la réponse immunitaire adaptative contre la tumeur ; 3) accroître la population des lymphocytes T infiltrant la tumeur, permettant ainsi d’améliorer l’efficacité d’une immunothérapie. Les expériences ont été réalisées en utilisant des souris modèles de glioblastome, ainsi qu’un modèle de métastases cérébrales ( Figure 1 ) . Les souris porteuses d’un glioblastome syngénique ont été obtenues par une greffe intracérébrale de cellules de lignées de glioblastome murin (GL-261 ou CT-2A) chez des souris C57Bl/6. Une administration intrathécale de VEGF-C a été réalisée pour stimuler la croissance lymphatique méningée, et en particulier accroître le diamètre des vaisseaux lymphatiques, soit de manière prophylactique avant la greffe tumorale, en utilisant un vecteur AAV ( adeno-associated virus ) exprimant VEGF-C sur une période de 4 semaines, soit comme traitement après la greffe, en utilisant des ARN messagers (ARNm) stabilisés de VEGF-C (ARNm VEGF-C ) qui sont rapidement traduits en protéine, avec un pic 24 heures après l’injection.
| Figure 1.
Hypothèses testées (A) et modèles expérimentaux utilisés (B) dans l’étude de Song
et al. [
5
]
. Le modèle murin de glioblastome (cellules GL-261 ou CT-2A) est examiné après un prétraitement prophylactique par injection d’un vecteur AAV-VEGF-C ou d’un vecteur témoin non-recombinant (AAV-CTRL) dans le LCR, ou après un traitement post-inoculation de la tumeur avec l’ARNm du VEGF-C. Une greffe sous-cutanée a été réalisée chez les animaux ayant rejeté une tumeur cérébrale pour tester s’ils avaient développé une immunité anti-tumorale à long-terme. Pour le traitement post-inoculation, une combinaison de l’ARNm du VEGF-C et d’un anticorps anti-PD-1, avec un anticorps anti-TIM3 contre les cellules tueuses naturelles (
natural killer
, NK) a été utilisée. Un traitement similaire appliqué plus tôt après l’inoculation (jours 7, 9, 11) produit le même effet thérapeutique (figure adaptée de [
5
]).
|
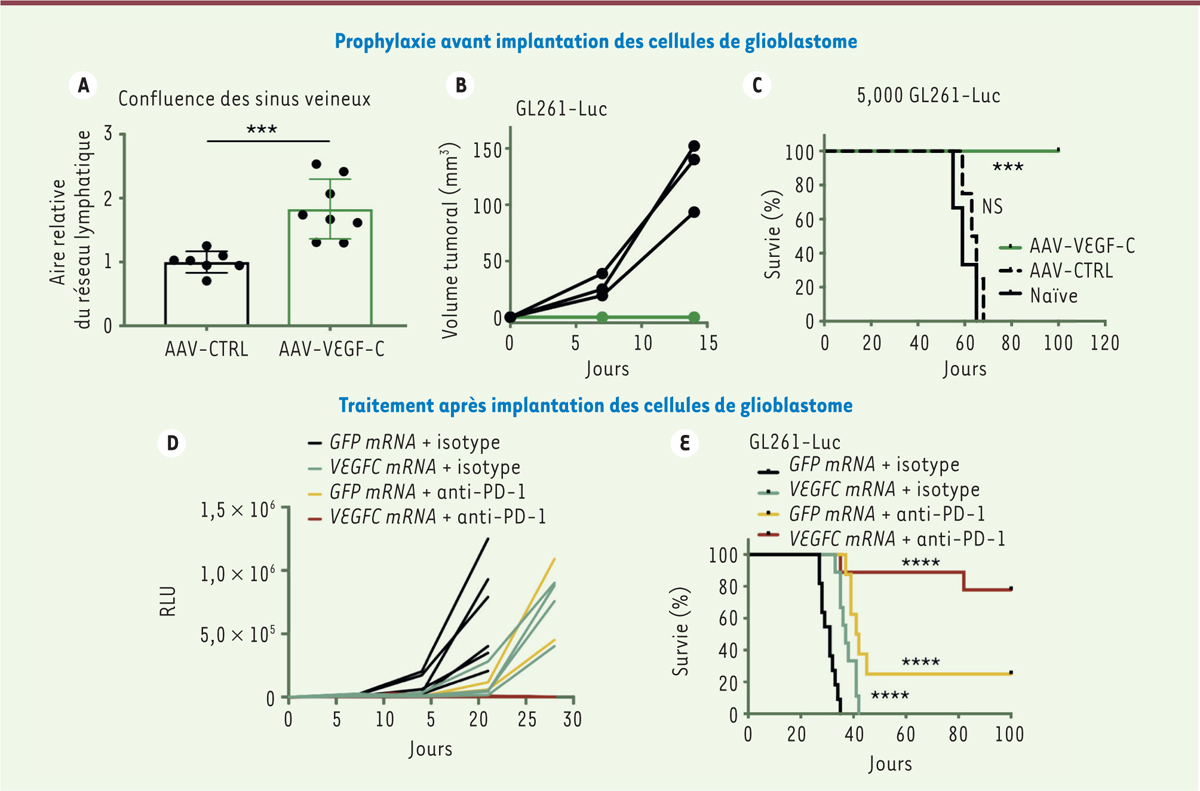
Le traitement prophylactique des souris par VEGF-C a pour effet d’accroître le réseau vasculaire lymphatique méningé dorsal ( Figure 2A ) , d’empêcher la tumeur de se développer ( Figure 2B ) et de faire survivre les souris après la greffe de cellules de glioblastome (5 × 10 3 ou 5 × 10 4 cellules), alors que les souris greffées non traitées ou traitées avec un vecteur AAV non-recombinant meurent en 5 semaines, par suite du développement de la tumeur ( Figure 2C ) . Les effets bénéfiques du prétraitement au VEGF-C et de la croissance des vaisseaux lymphatiques méningés qu’il induit sont cependant perdus lorsqu’on compromet le système immunitaire en aval des vaisseaux lymphatiques méningés, soit en ligaturant les afférences des ganglions lymphatiques cervicaux profonds qui drainent le LCR, soit en détruisant les populations de lymphocytes T CD4 + ou CD8 + par administration par voie intrapéritonéale d’anticorps anti-CD4 ou anti-CD8. Dans ces conditions expérimentales, les souris prétraitées par VEGF-C succombent à l’inoculation tumorale comme les souris témoins. Ces expériences démontrent que les lymphocytes T ainsi que la connexion des vaisseaux lymphatiques méningés aux ganglions cervicaux profonds sont nécessaires pour détruire la tumeur. Elles suggèrent que, sous l’effet de VEGF-C, les vaisseaux lymphatiques méningés apportent aux ganglions lymphatiques drainant le LCR une information sur les antigènes tumoraux qui est absente chez les souris témoins, et qui permet la production des lymphocytes tueurs de la tumeur. Cet amorçage de la réponse lymphocytaire anti-tumorale conférée par le traitement prophylactique par VEGF-C permet d’induire une immunité robuste et à long terme chez les souris survivant à la greffe tumorale, qui peuvent ainsi rejeter une tumeur sous-cutanée de glioblastome, alors que cette tumeur se développe chez des souris témoins. Cette immunité anti-glioblastome ne dépend que des lymphocytes T, car les souris déficientes en lymphocytes B ayant reçu un prétraitement par VEGF-C peuvent survivre à la greffe tumorale.
| Figure 2.
Effets du prétraitement prophylactique par VEGF-C avant l’implantation des cellules de glioblastome (A-C), ou du traitement avec l’ARNm du VEGF-C après l’implantation de ces cellules (D, E). (A)
VEGF-C induit une expansion du réseau lymphatique méningé dorsal (zone de confluence des sinus veineux sagittal et transverse de la dure-mère) par un facteur d’environ 2. Après le prétraitement prophylactique par VEGF-C, la croissance tumorale est inhibée
(B)
et les animaux survivent
(C)
. Après une bithérapie associant ARNm du VEGF-C et immunothérapie par anticorps anti-PD1, la croissance de la tumeur est inhibée
(D)
et la survie des animaux est augmentée par rapport à celle des animaux soumis à une simple immunothérapie
(E)
. RLU :
relative light unit
. 5 000 GL261-Luc : nombre (5 000) de cellules de glioblastome murin (lignée GL261-Luc) injectées dans le striatum pour induire le glioblastome (figure adaptée de [
5
]).
|
Le traitement du glioblastome nécessite que le VEGF-C administré soit disponible rapidement et durablement, ce que permet l’utilisation d’ARNm stabilisés, administrés en une seule fois 0, 3 ou 7 jours après l’inoculation tumorale, mais pas celle de la protéine recombinante, dont la demi-vie est trop courte (quelques heures), ou celle du vecteur d’expression viral (AAV), avec lequel l’expression de la protéine est différée de plusieurs jours. Les ARNm VEGF-C ont été conjugués à un marqueur fluorescent (Cy5), ce qui a permis de confirmer, avec l’appui d’autres données biochimiques et transcriptionelles, leur large expression dans les espaces méningés et les ganglions cervicaux profonds ainsi que dans certaines cellules cérébrales. Le traitement avec les ARNm VEGF-C fournit un avantage de survie, mais ne sauve pas de la mort les souris porteuses de tumeurs. En revanche, la combinaison de l’injection des ARNm VEGF-C avec l’immunothérapie par un inhibiteur de point de contrôle immunitaire tel qu’un anticorps anti-PD1, inhibe la croissance tumorale ( Figure 2D ) et augmente la survie des souris après inoculation des cellules de glioblastome, plus que l’immunothérapie seule ne le permet (80 % contre 30 % de survie 100 jours après l’implantation de la tumeur) ( Figure 2E ) . Cette réponse dépend, en amont, de la fonctionnalité des vaisseaux lymphatiques méningés, et elle disparaît chez des souris traitées de manière prophylactique avec un vecteur AAV-VEGF-C bloquant, ce qui piège la protéine VEGF-C disponible dans les méninges et détruit les vaisseaux lymphatiques méningés. Cette réponse dépend également, en aval, des lymphocytes T qui sont responsables de la réponse immunitaire induite par la bithérapie par ARNm VEGF-C plus anticorps anti-PD1 ; la réponse est perdue suite à l’injection systémique d’anticorps anti-CD4 et anti-CD8, et peut être transmise à une souris témoin porteuse de glioblastome par transfert de lymphocytes T issus des ganglions cervicaux de souris traitées par la bithérapie sus-citée.
Le transfert d’immunité par les lymphocytes T ganglionnaires et le bénéfice apporté à l’immunothérapie par l’administration de VEGF-C suggèrent que le trafic des antigènes tumoraux et des cellules immunitaires circulant entre le SNC (tumeur cérébrale), les ganglions lymphatiques drainant le LCR et le SNC (environnement tumoral) est modifié par le VEGF-C. Deux résultats ont permis de confirmer cette prédiction. D’une part, dans les ganglions lymphatiques cervicaux, le VEGF-C augmente l’immunité cellulaire anti-tumorale d’un facteur 2,5 à 3 : on observe une augmentation des cellules présentatrices d’antigène tumoral CD45 + -BFP + ( blue fluorescent protein ) 1, et des lymphocytes T spécifiques de l’antigène rétroviral Emv2-env, exprimé par les cellules GL-261. Aucune cellule tumorale (CD45 - -BFP + ) n’a cependant été détectée dans les ganglions lymphatiques cervicaux, indiquant que le VEGF-C n’induit pas le développement de métastases, au demeurant exceptionnelles dans les glioblastomes. D’autre part, dans le tissu cérébral, le VEGF-C augmente significativement et progressivement (d’environ 4 fois après deux semaines) l’infiltration lymphocytaire (lymphocytes CD3 + ) de la tumeur. Des expériences de phénotypage cellulaire par cytométrie en flux et séquençage des transcrits ont montré que le VEGF-C modifiait principalement les lymphocytes, en augmentant la population de lymphocytes T CD4 + -FOXP3 + promotrices de la réponse anti-tumorale et celle des lymphocytes T CD8 + cérébraux sécrétant de multiples cytokines (interféron g, interleukine 2, granzyme, facteur de nécrose tumorale TNF). Le système des marqueurs CD45.1/CD45.2, qui sont deux alloantigènes de CD45, a été utilisé pour réaliser des expériences supplémentaires de transfert adoptif de cellules ganglionnaires lymphatiques CD45.2 + dans des souris CD45.1 porteuses de tumeurs, avec ou sans traitement par ARNm VEGF-C . Le résultat de ces expériences indique que le VEGF-C augmente également l’attraction du parenchyme cérébral pour les lymphocytes T. Ces changements dans le comportement des lymphocytes T induits par le VEGF-C ne dépendent pas du récepteur VEGFR3, car l’expression de ce récepteur n’a pas été détectée sur ces cellules, et la stimulation directe des lymphocytes par le VEGF-C n’a pas modifié l’expression des transcrits dans ces cellules. La réponse des lymphocytes au VEGF-C est donc secondaire à une réponse lymphatique primaire qui peut provoquer la sécrétion de molécules activant les lymphocytes et produites par les cellules endothéliales lymphatiques. Cette étape peut impliquer la cytokine lymphatique CCL21 ( C-C motif chemokine ligand 21 ), qui a déjà été impliquée dans le trafic de lymphocytes T CCR7 ( C-C motif chemokine receptor 7 ) + dans le système lymphatique méningé [ 4 , 10 ].
Cette capacité anti-glioblastome du VEGF-C n’est pas partagée par les autres membres de la famille des facteurs de croissance vasculaire VEGF-A, VEGF-B ou VEGF-D. Par ailleurs, en plus d’agir sur le glioblastome, l’administration intrathécale de VEGF-C, en combinaison avec une immunothérapie, permet de juguler le développement de métastases cérébrales de mélanome (lignées cellulaires YUMMER1.7 et B16 implantées dans le cerveau), qui constituent la majorité des tumeurs cérébrales ( Figure 1 ) . Chez l’homme, on a pu constater le faible niveau d’expression des transcrits de VEGF-C dans la tumeur de patients atteints de glioblastome (TCGA, study accessionphs 000178.v10.p8), lorsqu’on compare avec l’expression de ce gène dans le cortex cérébral non-tumoral (GTEX, study accessionphs 000424.v7.p2). On a également observé une corrélation positive entre le taux d’expression cérébrale du VEGF-C et l’importance de l’infiltration lymphocytaire dans les glioblastomes (données GSE121810). Le VEGF-C apparait donc comme une molécule d’intérêt thérapeutique pour le traitement des tumeurs cérébrales chez l’homme, en raison : 1) de son action ciblée sur le compartiment lymphatique méningé qui accroît l’activité de drainage des antigènes tumoraux vers le système immunitaire périphérique ; 2) de son effet secondaire activateur des lymphocytes T CD8 + anti-tumoraux ; 3) de la disponibilité d’un mode d’administration efficace sous la forme d’ARNm stabilisés ( Figure 3 ) .
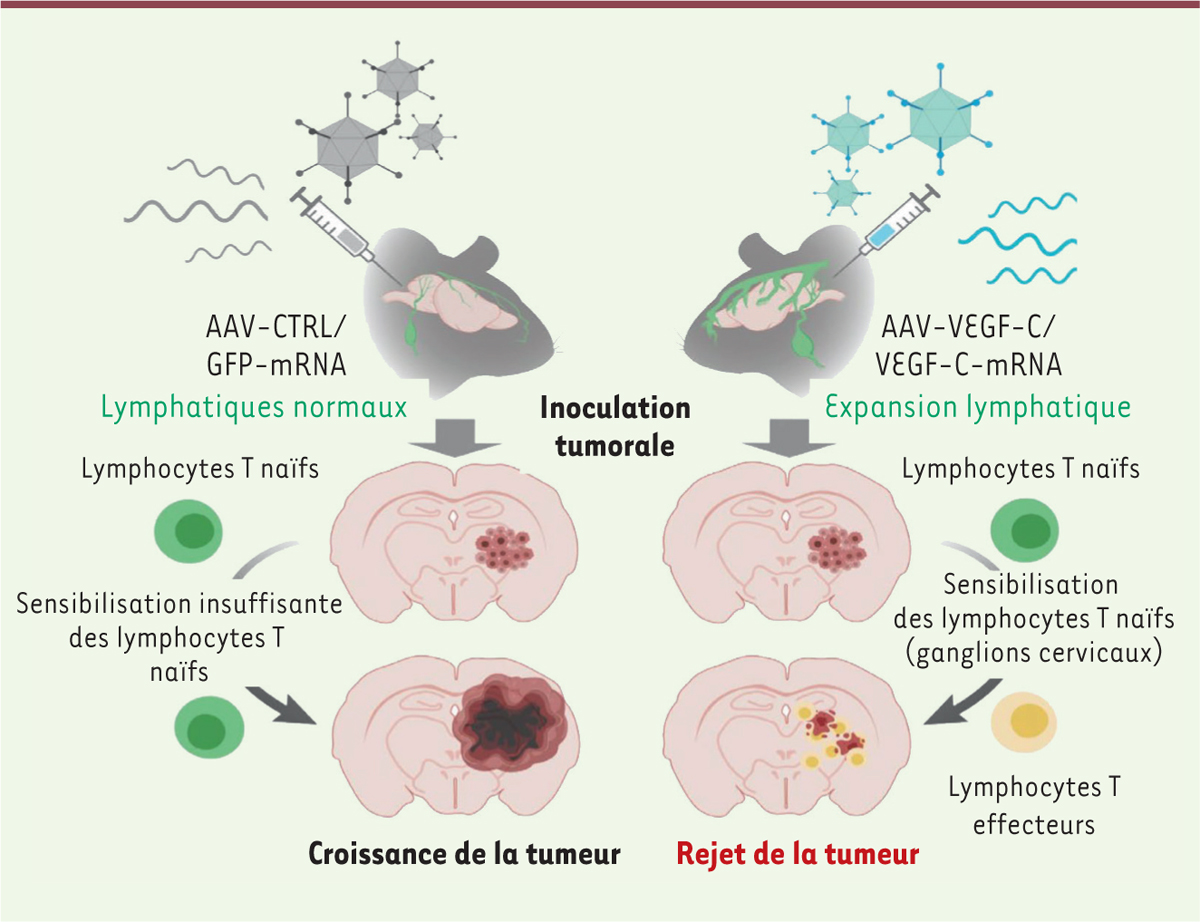
| Figure 3.
Schéma du mécanisme de rejet des tumeurs cérébrales dépendant de VEGF-C et du réseau lymphatique
(figure adaptée de [
5
]).
|
Les résultats et conclusions de nos recherches ont été confirmés par une autre étude, qui combine un modèle de glioblastome exprimant VEGF-C et l’ablation locale des vaisseaux lymphatiques méningés, et qui démontre que le VEGF-C agit sur les vaisseaux lymphatiques méningés dorsaux pour amplifier la réponse immunitaire anti-tumorale [ 9 ]. Hors du SNC, l’expression tumorale de VEGF-C est connue pour être un critère de malignité et de pronostic défavorable, la dispersion des métastases étant facilitée par l’extension du réseau vasculaire lymphatique en réponse au VEGF-C. Bien que l’effet de VEGF-C dans les tumeurs cérébrales soit opposé, l’infiltration lymphocytaire est augmentée dans les deux types de tumeurs, et doit donc accroître l’efficacité de l’immunothérapie dans les deux cas [ 10 ]. VEGF-C s’avère donc être un levier thérapeutique potentiel pour augmenter le drainage des antigènes tumoraux vers la périphérie, promouvoir l’amorçage des lymphocytes T et leur infiltration dans l’environnement tumoral, avec dans le cas des glioblastomes, un risque réduit de métastases.