| |
| Med Sci (Paris). 36(8-9): 706–708. doi: 10.1051/medsci/2020142.Mémoire olfactive chez la souris : un neurone pour un souvenir ? Anne Didier1 and Nathalie Mandairon1* 1Centre de Recherche en Neuroscience de Lyon – Inserm U1028 – CNRS UMR5292 – UCBL – Équipe Neuroplasticité et neuropathologie de la perception olfactive, Centre hospitalier Le Vinatier – Bâtiment 462 – Neurocampus
,
95 boulevard Pinel
,
69675Bron Cedex
,
France MeSH keywords: Cellules souches adultes, Animaux, Lignage cellulaire, Survie cellulaire, Mammifères, Mémoire, Souris, Cellules souches neurales, Neurogenèse, Neurones, Optogénétique, Odorat, Facteurs temps, cytologie, physiologie |
La plupart des mammifères sont exposés à des changements de leur environnement nécessitant des ajustements de la perception olfactive et de la mémoire afin de guider de façon efficace leur comportement. Ces ajustements impliquent des phénomènes de plasticité cérébrale, dont la plupart mettent en jeu des modifications du nombre ou de l’efficacité des synapses neuronales. Cependant, il existe une autre forme de plasticité cérébrale, qui implique la formation de neurones dans le cerveau mature : c’est la neurogenèse adulte. Chez la souris, les régions du cerveau concernées par la neurogenèse adulte sont principalement l’hippocampe et le bulbe olfactif, structures importantes pour le traitement des informations respectivement spatiales (ou plus largement, contextuelles) et olfactives [
1
]. Les nouveaux neurones des bulbes olfactifs sont issus de cellules souches situées dans la paroi des ventricules latéraux. Ces cellules donnent naissance à des neuroblastes (neurones immatures), qui migrent jusqu’aux bulbes olfactifs pour s’y établir et subir une maturation fonctionnelle [
2
]. La neurogenèse adulte, bien que restreinte à de rares régions du cerveau des mammifères, semble jouer un rôle crucial dans l’apprentissage et la mise en mémoire, comme l’indiquent certaines expériences dans lesquelles le blocage de la neurogenèse altère la mise en mémoire [
3
-
4
]. Dans l’hippocampe, la neurogenèse adulte jouerait également un rôle important dans les processus d’oubli : une augmentation de la neurogenèse dans l’hippocampe favoriserait l’oubli, tandis que sa diminution prolongerait la mémoire tout en réduisant la flexibilité comportementale [
5
-
7
]. Ainsi, le renouvellement neuronal serait à la base de la mise en place, ou inversement de l’effacement, de la trace mnésique. Il était donc nécessaire de déterminer comment la production continue de nouveaux neurones peut, d’une part, assurer la stabilité de la mémoire déjà acquise et, d’autre part, préserver une flexibilité pour la formation de nouveaux souvenirs.
|
Les performances olfactives sont liées au taux de neurogenèse
Des études antérieures ont montré qu’un apprentissage olfactif de discrimination (apprendre à l’animal à distinguer deux odeurs très ressemblantes qui ne sont pas spontanément discriminées) dépend de la présence dans le bulbe olfactif de nouveaux neurones dans leur période critique de développement (c’est-à-dire pendant environ 1 mois après leur naissance), et augmente leur taux de survie [
8
-
9
]. Pour mieux comprendre le rôle de ces neurones dans la mémoire à long terme, nous avons tout d’abord cherché à savoir si les nouveaux neurones qui survivaient grâce à l’apprentissage étaient présents dans le bulbe olfactif aussi longtemps que les informations apprises étaient gardées en mémoire. Nous avons ainsi testé la mémoire de souris entre une et cinq semaines après un apprentissage de discrimination olfactive, et nous avons analysé la survie des nouveaux neurones dans le bulbe olfactif grâce à la technique de marquage des neurones néo-formés par la bromo-désoxyuridine (BrdU)
(
Figure 1A
)
. Cette molécule s’intègre dans l’ADN au moment de sa synthèse (quand la cellule est en division), et on peut la visualiser ensuite par immunomarquage et identifier ainsi les neurones formés chez l’adulte. Nous avons montré que tant que l’information est en mémoire, les nouveaux neurones sont présents dans le bulbe olfactif, alors que, lorsque la mémoire est altérée, ces neurones ont disparu [
10
]. Ainsi, l’oubli s’accompagne d’une perte neuronale qui survient entre 30 et 40 jours après l’apprentissage olfactif.
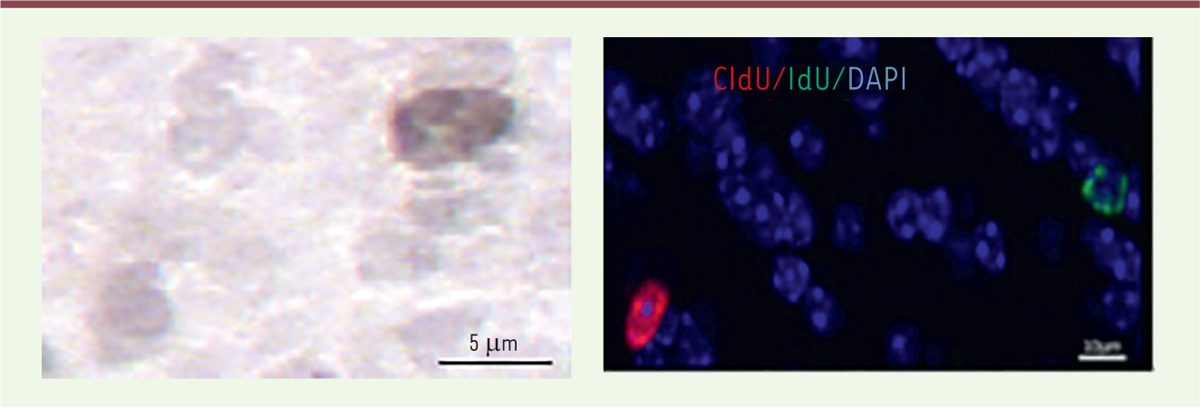
 | Figure 1.
Coupes de bulbes olfactifs de souris adultes, montrant la présence de neurones nés récemment dans la zone sous-ventriculaire des ventricules latéraux. A.
Exemple d’un de ces nouveaux neurones, marqué au BrdU.
B.
Exemple de deux nouveaux neurones issus de deux vagues différentes de neurogenèse et marqués, l’un au CldU (en rouge), et l’autre à l’IdU (en vert). Le marquage au DAPI (en bleu) permet de visualiser le noyau cellulaire.
|
|
Le délai entre les sessions d’apprentissage est un élément essentiel de la mémoire
Dans une deuxième série d’expériences, nous avons cherché à déterminer les modifications de la neurogenèse accompagnant deux apprentissages successifs qui réclament à la fois stabilité pour la mémoire déjà formée lors d’un premier apprentissage et flexibilité pour l’acquisition d’une nouvelle information. Les souris sont soumises à deux apprentissages successifs de discrimination olfactive, avec un intervalle variable entre les apprentissages. Chaque apprentissage augmente la survie d’une population de jeunes neurones présents dans le bulbe olfactif, et que l’on peut identifier, selon le même principe qu’avec la BrdU, grâce à deux autres marqueurs (chloro-désoxyuridine, CldU, et iodo-désoxyuridine, IdU) permettant de révéler deux vagues de nouveaux neurones, une au moment de chaque apprentissage
(
Figure 1B
)
. Lorsque l’intervalle entre les apprentissages est court (4 jours), le deuxième apprentissage est mémorisé alors que le premier est oublié. Dans ce cas, seul les nouveaux neurones sauvés par le deuxième apprentissage sont présents dans le bulbe olfactif. Lorsque le délai est un peu plus long (14 jours), les deux apprentissages sont retenus et les deux populations de nouveaux neurones sont présentes dans le bulbe olfactif. Enfin, pour les délais beaucoup plus longs (au-delà de 24 jours), seul le deuxième apprentissage est conservé et seuls les nouveaux neurones qui sous-tendent ce deuxième apprentissage sont présents dans le bulbe olfactif
(
Figure 2
)
. Ainsi, l’intervalle entre les deux apprentissages est critique pour le maintien de la mémoire déjà stockée et pour la survie des nouveaux neurones. Nous avons également montré que pour les délais courts, si l’information olfactive (les odeurs à discriminer) reste présente dans l’environnement, la mémoire des deux apprentissages est conservée ainsi que les deux populations de neurones
(
Figure 2
)
[
10
]. Ces résultats suggèrent que la survie des neurones dans le bulbe olfactif n’est pas assurée pendant la semaine qui suit l’apprentissage. Ils sont en effet dans un état fragilisé et sont vulnérables aux interférences provoquées par un nouvel apprentissage. Cependant, si l’information reste pertinente (présente dans l’environnement), la survie des neurones est assurée.
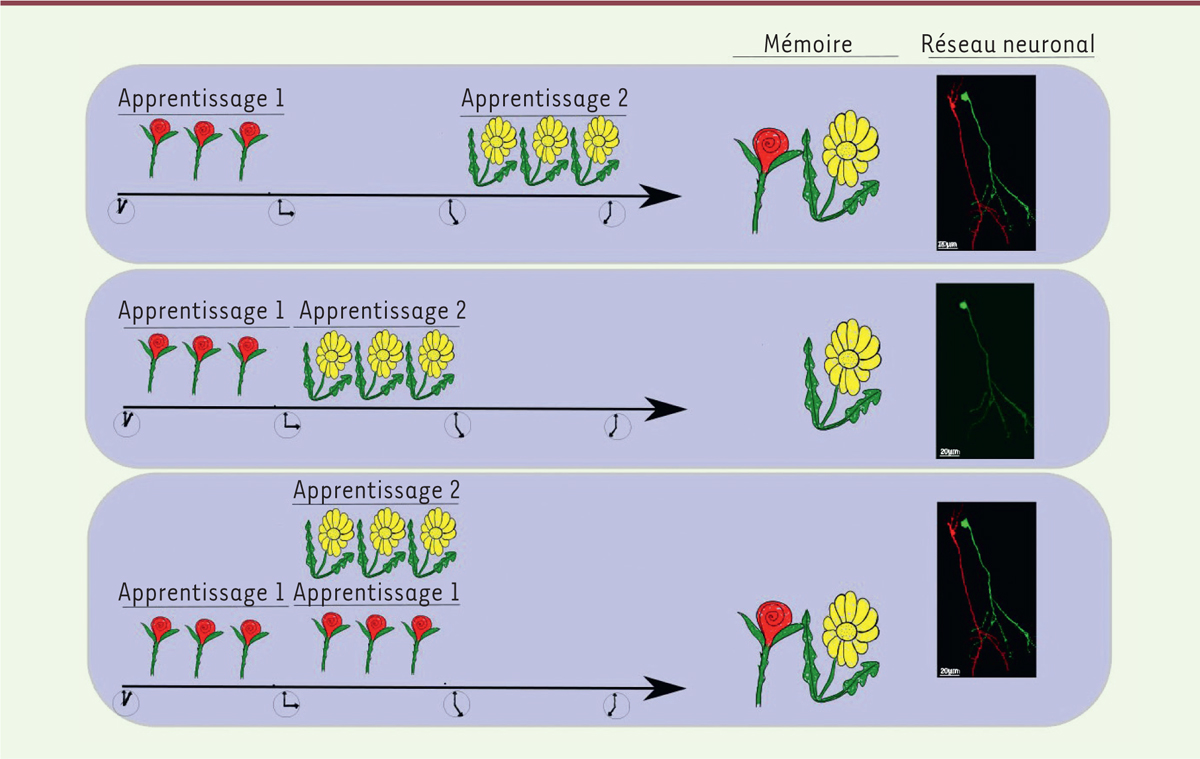
 | Figure 2.
Représentation schématique des trois protocoles de succession de deux apprentissages olfactifs utilisés dans cette étude.
Si le délai entre les deux apprentissages olfactifs est suffisamment long, les informations acquises successivement sont mémorisées et les nouveaux neurones du bulbe olfactif (marqués en rouge ou en vert) permettant chacun des apprentissages survivent. Lorsque ce délai est plus court, le deuxième apprentissage induit la mort des neurones qui sous-tendaient la mémoire du premier apprentissage, ce qui provoque l’oubli de cet apprentissage. Cependant, lorsque l’information mémorisée reste présente dans l’environnement au-delà de la phase d’apprentissage, les nouveaux neurones survivent et la mémoire du premier apprentissage est conservée.
|
|
Des cohortes distinctes de nouveaux neurones pour des mémoires distinctes
Il est possible de moduler l’activité d’une population spécifique de neurones grâce à la technique d’optogénétique, qui consiste à faire exprimer un canal ionique photosensible par une population de neurones
via
l’injection locale d’un vecteur viral recombinant. Une stimulation lumineuse à une longueur d’onde spécifique provoque l’ouverture des canaux photosensibles et la dépolarisation (par un flux entrant de cations) ou l’hyperpolarisation (par un flux entrant d’anions) du neurone, selon la nature de ces canaux. Nous avons injecté un virus permettant l’expression d’un canal photosensible inhibiteur, l’halorhodopsine, dans la zone sous-ventriculaire des ventricules latéraux afin de transduire les nouveaux neurones au moment de leur naissance. Des fibres optiques implantées au-dessus des bulbes olfactifs ont ensuite permis d’inhiber les neurones néoformés grâce à l’activation de l’halorhodopsine par la lumière, afin de tester si l’activité de ces neurones est nécessaire au rappel de la mémoire de discrimination olfactive. En inhibant ainsi l’activité d’un groupe de nouveaux neurones âgés de 8 à 18 jours au moment de l’apprentissage olfactif, nous avons provoqué l’oubli spécifique de cet apprentissage. Ce résultat montre le rôle crucial des nouveaux neurones comme support de ce souvenir. Cependant, cette manipulation n’a pas affecté la mémoire d’une tâche de discrimination apprise quatre jours après la première, ce qui suggère que ces neurones nés chez l’adulte ne contribuent qu’à une seule trace mnésique [
10
].
|
L’environnement olfactif change constamment, ce qui nécessite des adaptations de la perception par des apprentissages et la mise en mémoire des odeurs. Chez certaines espèces de mammifères, de nouveaux neurones naissent et s’intègrent dans le système olfactif adulte : c’est la neurogenèse adulte. Nous avons montré, chez la souris, que les nouveaux neurones contrôlent le caractère transitoire ou persistant de la mémoire en fonction du délai entre deux apprentissages et de la pertinence des informations apprises. En effet, la neurogenèse et les populations successives de jeunes neurones présents dans les bulbes olfactifs assurent la stabilité de la mémoire olfactive déjà acquise, tout en préservant une part de flexibilité permettant la formation de nouveaux souvenirs.
Ce mécanisme conduisant une population neuronale néoformée à n’être le support que d’un seul souvenir est-il extrapolable à l’espèce humaine ? L’existence même de la neurogenèse adulte est discutée chez l’homme [
11
]. Si des neurones immatures ont pu être observés dans le bulbe olfactif humain, les approches actuelles n’ont cependant pas mis en évidence de processus actif de neurogenèse pour cette structure. En revanche, il existe des arguments convaincants en faveur de la formation, chez l’homme adulte, de nouveaux neurones dans l’hippocampe [
12
], une autre structure cérébrale spécialisée dans la formation des souvenirs, à laquelle pourrait donc s’appliquer le principe mnésique que nous avons mis en évidence dans le système olfactif chez la souris.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les travaux de A. Didier et N. Mandairon ont bénéficié du soutien du CNRS, de l’Inserm, de l’université Claude Bernard Lyon 1, de l’École normale supérieure de Lyon. Nous remercions C. Benetollo (plateforme « Neurogénétique Fonctionnelle » du CRNL), et D. Nègre, G. Froment et C. Costa (SFR BioScience de Lyon, UMS3444/US8) pour la production de lentivirus.
|
1.
Ming
G
,
Song
H
.
Adult neurogenesis in the mammalian central nervous system.
.
Annu Rev Neurosci.
2005;
;
28
:
:223.
–
250
.
2.
Lois
C
,
Alvarez-Buylla
A
.
Long-distance neuronal migration in the adult mammalian brain.
.
Science.
1994;
;
264
:
:1145.
–
1148
.
3.
Dupret
D
,
Revest
JM
,
Koehl
M
et al.
Spatial relational memory requires hippocampal adult neurogenesis.
.
PLoS One.
2008;
;
3
:
:e1959.
.
4.
Gheusi
G
,
Lledo
PM
.
Adult neurogenesis in the olfactory system shapes odor memory and perception.
.
Prog Brain Res.
2014;
;
208
:
:157.
–
175
.
5.
Akers
KG
,
Martinez-Canabal
A
,
Restivo
L
,
et al.
Hippocampal neurogenesis regulates forgetting during adulthood and infancy.
.
Science.
2014;
;
344
:
:598.
–
602
.
6.
Frankland
PW
,
Josselyn
SA
.
Hippocampal neurogenesis and memory clearance.
.
Neuropsychopharmacology.
2016;
;
41
:
:382.
–
383
.
7.
Richards
BA
,
Frankland
PW
.
The persistence and transience of memory.
.
Neuron.
2017;
;
94
:
:1071.
–
1084
.
8.
Moreno
MM
,
Linster
C
,
Escanilla
O
,
et al.
Olfactory perceptual learning requires adult neurogenesis.
.
Proc Natl Acad Sci USA.
2009;
;
106
:
:17980.
–
17985
.
9.
Mouret
A
,
Lepousez
G
,
Gras
J
,
et al.
Turnover of newborn olfactory bulb neurons optimizes olfaction.
.
J Neurosci.
2009;
;
29
:
:12302.
–
12314
.
10.
Forest
J
,
Moreno
M
,
Cavelius
M
,
et al.
Short-term availability of adult-born neurons for memory encoding.
.
Nat Commun.
2019;
;
10
:
:5609.
.
11.
Bergmann
O
,
Spalding
KL
,
Frisén
J
.
Adult neurogenesis in humans.
.
Cold Spring Harb Perspect Biol.
2015;
;
7
:
:a018994.
.
12.
Spalding
KL
,
Bergmann
O
,
Alkass
K
,
et al.
Dynamics of hippocampal neurogenesis in adult humans?
.
Cell.
2013;
;
153
:
:1219.
–
1227
.
|