2007
→ Aller vers ANALYSE→ Aller vers SYNTHESE
Évaluations des traitements de la maladie d'Alzheimer
L'important développement de la recherche clinique et thérapeutique concernant la maladie d'Alzheimer au cours des dernières décennies a conduit à l'élaboration d'une méthodologie de plus en plus rigoureuse tant dans les critères de diagnostic ou de sévérité que dans l'évaluation cognitive et celle du retentissement de la maladie sur le comportement et la vie quotidienne.
L'évaluation des effets des traitements pharmacologiques dans la maladie d'Alzheimer, anticholinestérasiques ou psychotropes essentiellement, a nécessité la mise au point d'outils tant de diagnostic que d'évaluation qualitative ou quantitative de l'impact cognitif, comportemental ou global des différents médicaments (Caban-Holt et coll., 2005

). Des règles d'évaluation des effets d'un médicament destiné au traitement de la maladie d'Alzheimer ont été proposées par un certain nombre d'experts et ont abouti à l'élaboration de règles standard de procédures ou «
guidelines », préconisées par les différentes agences d'enregistrement pour l'établissement de l'efficacité d'une nouvelle substance.
En ce qui concerne l'Agence européenne des médicaments, l'EMEA
1
, ces
guidelines2
EMEA – London, CPMP/EWP/553/95 – 1997
déjà « anciennes » puisque leur publication date de 1997, servent de canevas pour quasiment tous les essais réalisés par les laboratoires pharmaceutiques industriels. Elles renseignent sur les différents points méthodologiques permettant de bâtir un essai apte à répondre à la question posée et, en cas de réponse positive, à enregistrer ce nouveau médicament. Ces
guidelines, comme celles de la
Food and Drug Administration (FDA
3
) (Leber, 1990

), ont été construites dans le but de mettre en évidence chez des patients présentant une maladie d'Alzheimer, un effet essentiellement cognitif d'un traitement considéré comme symptomatique. Cet effet doit par ailleurs s'accompagner, pour être pertinent, d'un effet positif global et d'un retentissement sur les activités de la vie au quotidien. L'impact ou plutôt l'effet sur les manifestations comportementales a été partiellement occulté, bien que celles-ci soient actuellement au cœ ur d'un grand nombre d'essais. Selon les recommandations de l'EMEA, l'efficacité d'un produit pour le traitement de la maladie d'Alzheimer devait être démontrée dans deux études, sur les aspects cognitifs, fonctionnels globaux de la maladie et sur l'activité quotidienne des patients. Ces recommandations sont actuellement en cours de révision, notamment sur trois points : le diagnostic différentiel des démences, l'inclusion de patients (et le problème de leur évaluation) à des stades très précoces de la maladie et les essais de prévention ou d'arrêt de la maladie.
Critères de diagnostic
Des critères opérationnels de diagnostic qui font l'objet d'un consensus général de la communauté scientifique existent pour le syndrome démentiel comme pour la maladie d'Alzheimer. En effet, les outils de diagnostic sont doubles :
• d'une part pour permettre le diagnostic de démence le plus souvent à l'aide des critères du
Diagnostic and Statistical Manual of Mental Disorder (DSM) DSMIII-R/DSMIV (
American Psychiatry Association, 1994

) ou de l'
International Classification of Disease 10 (ICD-10) pour lesquels semblent exister une concordance entre eux, une bonne validité et reproductibilité inter-juge dans le cadre de la maladie d'Alzheimer, du moins pour les critères du DSM ;
• d'autre part pour poser le diagnostic de la maladie d'Alzheimer en maladie possible, probable ou certaine, ceci à l'aide des critères du
National Institute of Neurological and Communicative Disorders and Strokes -
Alzheimer's Disease and Related Disorders Association (NINCDS-ADRDA), dont la sensibilité est de 93 % mais la spécificité de 23 % (McKhann et coll., 1984

). Même s'il existe une standardisation internationale des critères diagnostiques, le diagnostic de certitude de la maladie d'Alzheimer ne peut pas se faire du vivant du patient ; il reste donc un diagnostic d'exclusion des autres types de démence et même au sein des centres experts, la fiabilité de la détection de la maladie d'Alzheimer n'excède pas 85 %.
Évaluation cognitive
Dans la maladie d'Alzheimer, l'évaluation cognitive est essentiellement effectuée par une évaluation globale.
Le
Mini Mental State Examination (MMSE) est un instrument internationalement utilisé et considéré comme donnant un reflet global des performances cognitives (Folstein et coll., 1975

). Il explore de façon très rapide la mémoire, l'orientation, le langage, et les praxies constructives. Il est utilisé à la fois comme outil de diagnostic de démence, de maladie d'Alzheimer, et comme critère d'inclusion (sévérité) et d'efficacité. Ses inconvénients sont sa qualité métrologique faible, la dégradation non linéaire dans le temps, sa sensibilité au langage, sa non spécificité avec un effet plafond (maladie d'Alzheimer au stade léger) ou plancher (maladie d'Alzheimer au stade sévère). Par ailleurs, si le seuil de 10 est généralement retenu pour séparer les démences modérées des sévères, celui pour séparer démence modérée et légère varie selon les auteurs.
L'Alzheimer's Disease Assessment Scale (ADAS) permet d'évaluer pour sa partie cognitive (ADAS-Cog) quatre pôles cognitifs (la mémoire, l'orientation, les praxies et le langage) et est utilisée comme critère principal d'efficacité dans pratiquement tous les essais (Rosen et coll., 1984

) à l'exception des études incluant des patients avec démences sévères. Cette échelle spécifique (en fait qui explore surtout mémoire et langage) et sensible au changement est considérée comme un «
gold standard », tout au moins dans les essais à traitement « symptomatique », pour l'évaluation de l'efficacité, dans une partie importante d'un protocole qu'est le calcul du nombre de patients et comme facteur pronostique, la sévérité du score de
baseline étant corrélé au déclin cognitif. Mais elle ne permet pas l'évaluation des deux pôles extrêmes de la maladie (stades sévères ou très précoces), a une faible qualité métrologique, est parfois inutilisable (troubles du langage) ou non analysable du fait de valeurs manquantes à des sous-scores. Doit être discutée aussi la significativité clinique de l'amélioration du score à 6 mois de 4 points,
cut-off fixé par la FDA en 1990 pour les essais Tacrine et repris depuis dans toutes les analyses de répondeurs.
Les autres échelles cognitives globales telles la SIB (
Severe Impairment Battery ; Panisset et coll., 1994

; Bullock et coll., 2005

) ou le SKT (
Syndrom Kurztest ; Overall et coll., 1992

) sont d'utilisation plus occasionnelle, essentiellement en cas de démence sévère pour la SIB tenant compte des spécificités comportementales et cognitives de ces patients.
À côté de ces échelles globales, et relevant plus d'études académiques, l'effet sur des fonctions cognitives plus spécifiques et précises (anosognosie, langage, compétence...) a été évalué avec des outils le plus souvent différents et pas spécialement comparables, le médicament pouvant alors plus servir à valider l'outil clinique que l'inverse (Kashiwa et coll., 2005

; Starkstein et coll., 2006a

et b

). Cette recherche est pourtant primordiale pour la compréhension et le démembrement des effets cognitifs des anti cholinestérasiques.
Évaluation clinique globale de la démence
La progression des signes et des symptômes est un indice pour juger celle de la maladie et différentes échelles ont été construites dans ce sens. Cependant, il n'existe pas à ce jour de consensus sur les critères permettant d'évaluer la sévérité ou la progression de la maladie. La définition de la démence sévère a par ailleurs évolué dans le temps et n'est plus la même que celle décrite il y a vingt ans.
La réalisation de ces échelles nécessite le plus souvent l'intervention d'un aidant « caregiver » en plus de l'évaluation du patient, et fait appel à des procédures standardisées (entretien semi-structuré, questionnaire...).
Certaines échelles, telles que la
Clinical Dementia Rating (CDR ; Hughes et coll., 1982

) ou la
Global Dementia Scale (GDS ; Reisberg et coll., 1982

), tiennent compte à la fois des déficits cognitifs et des activités de la vie quotidienne.
L'échelle CDR postule l'existence d'une progression homogène des troubles, qu'ils soient cognitifs (mémoire, orientation, jugement) ou comportementaux (comportement social, soins personnels, comportement à domicile) et définit des stades de maladie. La cotation est double :
• catégorielle permettant une évaluation de la sévérité, le critère mémoire étant l'axe principal. Cette cotation accepte des variations de congruence, la rendant plus proche de la réalité ;
• dimensionnelle avec évaluation quantitative des déficits et de la sévérité (Sum of Boxes, CDR SB).
L'intérêt de cette échelle au cours d'un essai est double : elle sert à l'inclusion des patients en fonction d'un stade de sévérité, et comme critère d'évaluation.
L'échelle GDS permet elle aussi une classification de la sévérité de la maladie d'Alzheimer en stades (1 à 7) en fonction d'une évaluation cognitive et d'une appréciation de l'autonomie.
D'autres échelles ne sont que des échelles d'appréciation globale du changement :
• non spécifiques de la maladie d'Alzheimer telles la
Clinical Global Impression (CGI : Guy, 1976

) ou la
Clinical Global Impression of Changes (CGIC), dérivée de la première et où l'entretien et la cotation sont libres (même variables d'un essai à l'autre), source de grande variabilité ;
• ou construites pour les essais de la maladie d'Alzheimer. Ces échelles (
Clinical Interview Based Impression : CIBI ;
Clinical Interview Based Impression of Changes : CIBIC ;
CIBIC with caregiver impact : CIBIC-plus, Joffres et coll., 2000

;
AD Cooperative study-
Clinical Global Impression of Change : ADCS-CGIC, Schneider et coll., 1996

et 2006

) reposant sur l'appréciation du clinicien ont été développées à la demande des agences d'enregistrement (FDA) qui désiraient que l'éventuel effet noté sur les différents tests cognitifs puisse être dépisté par un clinicien indépendant et « aveugle » de ces résultats. Les procédures (évaluation, entretiens structurés) diffèrent d'une échelle à l'autre, faisant intervenir ou non l'aidant. Pour les deux dernières, le jugement du clinicien (expert de la maladie, entraîné et le même pendant tout l'essai) doit se faire selon un entretien semi-dirigé et à l'aide d'une cotation définie (fonctions cognitives, comportementales, ADL
4
Activities of Daily Living
et état général), sans connaissance des performances cognitives mais avec une bonne appréciation de la sévérité de la maladie et selon 7 points d'ancrage (4 : état inchangé ; >4 : aggravation ; <4 : amélioration). Ces évaluations sont toujours retrouvées dans les essais, présentées de façon dichotomique (amélioration ou inchangé
versus aggravation) ou quantitative pouvant même devenir le critère principal (démence sévère, effet des antipsychotiques ou autres psychotropes).
Cette approche clinométrique permet de se dédouaner de l'effet a priori positif attendu, peut être complètement indépendante de la maladie mais ne permet pas de connaître l'intérêt du traitement pour le patient et pour l'aidant.
Il importe néanmoins de souligner :
• la non spécificité de ces évaluations globales ; une amélioration n'est pas spécifique d'un effet anti-démence ou anti-Alzheimer, pouvant être par exemple en relation avec une amélioration comportementale donc fonctionnelle induite par un psychotrope ;
• les nombreuses formes disponibles de ces échelles rendant souvent les comparaisons hasardeuses.
Activités de la vie quotidienne
Les différentes échelles utilisées dérivent pour beaucoup de l'échelle gériatrique ADL de Katz (
Physical Self-Maintenance Scale évaluant 6 items) ou des IADL de Lawton et Brody (1969

) (
Instrumental Activities of Daily Living) comportant 8 items : utilisation du téléphone, transports, gestion des finances, prise des médicaments, faire les courses, repas, entretien de la maison, lessive. Ces deux sous-échelles, non spécifiques de la maladie d'Alzheimer, sont robustes, résistantes au changement et sexe dépendantes. Leur intérêt se résume plus dans leur valeur de dépistage d'une pathologie cognitive démentielle sans préjuger du diagnostic ; la nécessité d'une aide du fait des troubles cognitifs aux différents items de l'IADL (plus particulièrement téléphone, transports, prise des médicaments, gestion des finances) constitue un retentissement significatif de ces troubles sur l'activité quotidienne.
La
Global Deterioration Scale-Functional Assesment Staging (Auer et Reisberg, 1997

) ou GDS-FAST (échelle hiérarchique cotant 16 stades de détérioration depuis le normal, utilisée par des structures spécialisées), la
Progressive Disease Scale (de Jong, 1989

) ou PDS (où l'évaluation est réalisée à partir d'échelles analogiques visuelles remplies par la personne aidante pour les activités de la vie quotidienne), l'
Interview for Deterioration in Daily Living in Dementia (Teunisse et coll., 1991

) ou IDDD (permettant de faire la distinction entre l'initiative et les performances), la
Disability Assessment Dementia (Gelinas et coll., 1999

) ou DAD (son intérêt par rapport aux autres IADL réside en la subdivision de chaque fonction en 3 parties : initiation, programmation et réalisation), ou des outils de mesure récents et adaptés au stade sévère tels que l'
Alzheimer's Disease Cooperative Study Activities of Daily Living Severe scale (ADCS-ADL ; Galasko et coll., 2000

) ont été diversement utilisés soit dans des essais thérapeutiques ou lors du suivi prospectif dans des études cliniques d'histoire naturelle de la maladie.
Ce sont le plus souvent des hétéro-évaluations faisant appel à l'aidant interrogé par le soignant ou directement cotateur, et très rarement, sauf en cas d'études spécifiques (évaluation de l'anosognosie), des auto-évaluations.
Échelles comportementales
L'évaluation des modifications comportementales et l'impact des thérapeutiques sur cette symptomatologie ne sont apparus que secondairement par rapport aux fonctions cognitives ou fonctionnelles. Pourtant, les symptômes neuropsychiatriques appartiennent au tableau clinique de la maladie d'Alzheimer ; ils sont très fréquents, présents chez plus de 80 % des patients et ont souvent un impact négatif (Ryu et coll., 2005

).
L'échelle la plus largement utilisée actuellement que ce soit pour l'évaluation des traitements anticholinestérasique, psychotrope, physiopathologique ou non médicamenteux est la
Neuropsychiatric Inventory (NPI ; Cummings et coll., 1994

). La NPI a été mise au point pour des patients atteints de la maladie d'Alzheimer et d'autres formes de démence, mais est largement utilisée pour apprécier les changements de comportement dans d'autres pathologies. Les informations permettant d'établir ce bilan peuvent être recueillies à l'aide d'un entretien structuré auprès de l'aidant, du personnel soignant (CGA-NPI, NPI-Q, NPI-NH
5
CGA-NPI : Caregiver Administered-NPI ; NPI-Q : NPI Questionnaire ; NPI-NH : NPI-Nursing Home
) mais aussi du patient (Kang et coll., 2004

). Son intérêt est manifeste, appréciant l'existence, la sévérité d'un certain nombre de symptômes comportementaux (apathie, dépression, anxiété, euphorie, désinhibition, dysphorie, sommeil, appétit, hallucinations, délire, comportement moteur aberrant, irritabilité) et le retentissement de cette symptomatologie sur l'aidant. Mais cette échelle de passation longue, non linéaire, quantifie des manifestations comportementales plutôt que des symptômes ressentis, nécessite une habitude des entretiens psychiatriques et ne semble pas corrélée aux troubles cognitifs.
Bien plus que l'analyse du score global pris en tant que tel ou reflet de l'impact potentiel sur l'aidant, les différentes analyses en sous-groupes ou en
cluster et de l'évolutivité dans le temps de la symptomatologie comportementale apparaissent primordiales tant pour juger de l'impact des différentes thérapeutiques pharmacologiques ou non sur ces symptômes que de leur impact propre sur l'aidant, de leur rôle dans la prescription de psychotropes ou dans l'institutionnalisation et donc de leur retentissement socioéconomique (Franco et coll., 2006

).
D'autres échelles sont ou ont été utilisées, qu'elles soient globales spécifiques (
Behavioral Pathology in Alzheimer's disease Scale : Behave-AD, Reisberg et coll., 1996

; Harwood et coll., 1998a

) ou non de la maladie d'Alzheimer (
Behavioral Rating Scale for Dementia : BRSD, Mack et coll., 1999

) ou explorant des axes précis comme la dépression (
Geriatric Depression Scale : GDS, Yesavage et coll., 1983

;
Cornell scale : Alexopoulos et coll., 1988

; Harwood et coll., 1998b

), l'anxiété (Starkstein et coll., 2007

), l'agitation (
Cohen Mansfield agitation inventory : Cohen-Mansfield, 1986

) par exemple. Leur sensibilité au changement est assez mal connue, leur étude ayant le plus souvent été effectuée sur des populations assez hétérogènes, tant dans le diagnostic que dans la sévérité de la symptomatologie démentielle.
Autres échelles
À côté de ces échelles appréciant la symptomatologie cognitive ou comportementale, diverses échelles ont été conçues dans le but d'étudier le retentissement de la pathologie chez l'aidant. L'échelle de Zarit (Zarit et coll., 1980

) est un auto-questionnaire destiné à évaluer le « fardeau » représenté par la prise en charge familiale d'un parent dément vivant à domicile. Elle permet de mettre en évidence le degré d'épuisement ou d'usure psychologique des aidants familiaux. Le questionnaire
Ressource Utilization in Dementia (RUD, Wimo et coll., 2000

) permet d'estimer le temps quotidien moyen que passe l'aidant à s'occuper du patient. Elles peuvent permettre et font souvent partie des évaluations socioéconomiques (Feldman et coll., 2004

; Sano et coll., 2006

) dans lesquelles interviennent le coût de la maladie (direct et indirect) chez le patient et l'aidant, les coûts des traitements et l'impact socio-familial, mais aussi, du moins pour l'aidant, d'une ébauche de l'évaluation de la qualité de vie (Takeda et coll., 2006

; Thomas et coll., 2006

).
D'autres évaluations, certes moins nombreuses, se sont développées ces dernières années (Loveman et coll., 2006

). Elles concernent plus particulièrement l'impact des thérapeutiques non médicamenteuses sur la prise en charge du patient et l'évolutivité de la maladie (Suh et coll., 2004

; Kotynia-English et coll., 2005

) mais aussi l'évaluation des besoins (
Client Service Receipt Inventory) tant du patient, du conjoint (Lingler et coll., 2005

) que de la société pour faire face à ces pathologies, l'évaluation des pratiques médicales (
collaborative care) de la prise en charge (Ballard et Fox, 2006

) et la mise au point d'outils de « dépistage » d'utilisation écologique et aisée (Schneider et coll., 2006

). Par ailleurs, de nouvelles questions à côté de celle de l'effet symptomatique sont posées. Quel est l'impact de ces traitements sur la qualité de vie, et comment le mesurer ? Les essais sont longs, d'interprétation difficile faisant intervenir la subjectivité du conjoint (EuroQol :
ADRQL scale, Jonsson et coll., 2006

) et, enfin, la qualité de vie mesurée est celle du conjoint et non du patient. Ces traitements ont-ils un retentissement sur le temps d'apparition d'une dépendance, de l'institutionnalisation ? Avec, dans ce cas, une maîtrise des variables encore plus difficile.
Intérêt et limites des différents outils
Ces échelles, diagnostiques, cognitives et comportementales ont permis de répondre aux différentes requêtes des « guidelines », de mettre en évidence un effet des traitements anticholinestérasiques, de même magnitude et cinétique d'apparition dans les essais contrôlés.
Mais les assomptions implicites des essais impliquent que la maladie soit homogène tant sur le plan clinique, biologique, et évolutif, que les critères d'évaluation soient valides et linéaires dans le temps et impliquent une corrélation entre les aspects fonctionnels et les déficits cognitifs. Peu de ces assomptions sont vérifiées :
• la maladie est hétérogène tant dans son aspect clinique, neuropathologique qu'évolutif ; les populations étudiées ne sont pas toujours comparables (essais multicentriques) ;
• les instruments sont peu performants (résistance au traitement, effet plancher/plafond, multiplicité des échelles et, pour une échelle donnée, des formes de passation).
Ces échelles, par ailleurs, n'apparaissent pas adaptées pour l'évaluation à long terme des médicaments, en pratique quotidienne de consultation ou pour apprécier le déclin évolutif.
Qu'en est-il de l'évaluation des nouveaux traitements ? Les différents outils sont-ils adaptés aux thérapeutiques anti-neurodégénératives, physiopathologiques (voire préventives) actuellement en cours d'évaluation ? Bien sûr, l'évaluation cognitive et comportementale apparaît toujours importante mais on connaît les problèmes de sensibilité dans les formes débutantes, de l'effet plafond avec les échelles standard et la difficulté de diagnostic des formes débutantes de la maladie (Busse et coll., 2006

; Tabert et coll., 2006

). La validation de nouveaux outils est nécessaire (Galasko, 2005

) et l'utilisation de critères intermédiaires (
surrogate-endpoints) est discutée. L'IRM structurelle (mesure de l'atrophie cérébrale, hippocampique : Modrego, 2006

; van de Pol et coll., 2006

) ou fonctionnelle (diagnostic différentiel entre démences, des patients à risques : Bondi et coll., 2005

; Goekoop et coll., 2006

; Sauer et coll., 2006

), suivi évolutif, anomalies chez les patients pré-symptomatiques (Bassett et coll., 2006

; Mosconi et coll., 2006

) pour l'IRMf, étude des protéines Tau pour la spectro-IRM, l'analyse des biomarqueurs (protéine Tau totale, phospho-Tau et peptide amyloïde : Kapaki et coll., 2005

; Bibl et coll., 2006

; Hansson et coll., 2006

), la tomographie d'émission monophotonique (TEMP : Varma et coll., 2002

) et bien sûr le
Pittsburgh Compound B, PIB (quantification des plaques amyloïdes : Edison et coll., 2006

; Kemppainen et coll., 2006

) montrent de plus en plus leur intérêt (de Leon et coll., 2004

; Ackl et coll., 2005

; Apostolova et coll., 2006

). Mais il importe de répondre à un certain nombre de questions (linéarité, quantification, corrélation avec symptomatologie...) avant de pouvoir les utiliser comme critères diagnostiques ou d'évaluation dans des essais thérapeutiques.
En conclusion,
les
guidelines et l'utilisation et l'uniformisation de certaines échelles cognitives, comportementales et fonctionnelles ont permis de nombreuses avancées, tant dans la connaissance de la maladie d'Alzheimer que dans la réalisation d'essais cliniques ou pharmacologiques pour lesquels des effets thérapeutiques ont été démontrés (Trinh et coll., 2003

; Kapaki et Paraskevas, 2005

; Birks, 2006

) même si la puissance de ces effets sont discutés par certains (Hogan et coll., 2004

; Kaduszkiewicz et coll., 2005

). Mais devant le développement de nouvelles approches physiopathologiques et thérapeutiques, une révision s'impose tant dans les recommandations méthodologiques que dans l'utilisation des outils
ad hoc.
Bibliographie
[1] ackl n,
ising m,
schreiber ya,
atiya m,
sonntag a,
auer dp. Hippocampal metabolic abnormalities in mild cognitive impairment and Alzheimer’s disease.
Neurosci Lett. 2005;
384:23
-28

[2] alexopoulos ga,
abrams rc,
young rc,
shamoian ca. Cornell scale for depression in dementia.
Biol Psych. 1988;
23:271
-284

[3]american psychiatric association. Diagnostic and statistical manual of mental disorders (4th edn).
Washington:American Psychiatric Association;
1994.

[4] apostolova lg,
dinov id,
dutton ra,
hayashi km,
toga aw. 3D comparison of hippocampal atrophy in amnestic mild cognitive impairment and Alzheimer’s disease.
Brain. 2006;
129:2867
-2873

[5] auer s,
reisberg b. The GDS/FAST staging system.
Int Psychogeriatr. 1997;
91:167
-171

[6] ballard c,
fox c. Effectiveness of collaborative care for elderly adults with Alzheimer’s disease in primary care.
Lancet Neurol. 2006;
5:644
-645

[7] bassett ss,
yousem dm,
cristinzio c,
kusevic i,
yassa ma. Familial risk for Alzheimer’s disease alters fMRI activation patterns.
Brain. 2006;
129:1229
-1239

[8] bibl m,
mollenhauer b,
esselmann h,
lewczuk p,
klafki hw. CSF amyloid-beta-peptides in Alzheimer’s disease, dementia with Lewy bodies and Parkinson’s disease dementia.
Brain. 2006;
129:1177
-1187

[9] birks j. Cholinesterase inhibitors for Alzheimer’s disease.
Cochrane Database Syst Rev. 2006;
25:CD005593
-

[10] bondi mw,
houston ws,
eyler lt,
brown gg. fMRI evidence of compensatory mechanisms in older adults at genetic risk for Alzheimer disease.
Neurology. 2005;
64:501
-508

[11] bullock r,
touchon j,
bergman h,
gambina g,
he y. Rivastigmine and donepezil treatment in moderate to moderately-severe Alzheimer’s disease over a 2-year period.
Curr Med Res Opin. 2005;
21:1317
-1327

[12] busse a,
hensel a,
guhne u,
angermeyer mc,
riedel-heller sg. Mild cognitive impairment: long-term course of four clinical subtypes.
Neurology. 2006;
67:2176
-2185

[13] caban-holt a,
bottiggi k,
schmitt fa. Measuring treatment response in Alzheimer’s disease clinical trials.
Geriatrics. 2005;
1Suppl:3
-8

[14] cohen-mansfield j. Agitated behaviors in the elderly. II Preliminary results in the cognitively deteriorated.
J Am Geriatr Soc. 1986;
34:722
-727

[15] cummings jl,
mega m,
gray k,
rosenberg-thompson s,
carusi da,
gornbein j. The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia.
Neurology. 1994;
44:2308
-2314

[16] de leon mj,
desanti s,
zinkowski r,
mehta pd,
pratico d. MRI and CSF studies in the early diagnosis of Alzheimer’s disease.
J Intern Med. 2004;
256:205
-223

[17] de jong r. Measurement of quality-of-life changes in patients with Alzheimer’s disease.
Clin Ther. 1989;
11:545
-554

[18] edison p,
archer ha,
hinz r,
hammers a,
pavese n. Amyloid, hypometabolism, and cognition in Alzheimer disease. An [11C]PIB and [18F]FDG PET study.
Neurology. 2006;
67:1
-1

[19] feldman h,
gauthier s,
hecker j,
vellas b,
hux m. Donepezil MSAD Study Investigators Group Economic evaluation of donepezil in moderate to severe Alzheimer disease.
Neurology. 2004;
63:644
-650

[20] folstein mf,
folstein se,
mchugh pr. ”Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician.
J Psychiatr Res. 1975;
12:189
-198

[21] franco kn,
messinger-rapport b. Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence.
J Am Med Dir Assoc. 2006;
7:201
-202

[22] galasko d. Biomarkers for Alzheimer’s disease--clinical needs and application.
J Alzheimers Dis. 2005;
8:339
-346

[23] galasko dr,
schmitt fa,
jin s. Detailed assessment of cognition and activities of daily living in moderate to severe Alzheimer’s disease.
Neurobiol Aging. 2000;
21:S168

[24] gelinas i,
gauthier l,
mcintyre m,
gauthier s. Development of a functional measure for persons with Alzheimer’s disease: the disability assessment for dementia.
Am J Occup Ther. 1999;
53:471
-481

[25] goekoop r,
scheltens p,
barkhof f,
rombouts sa. Cholinergic challenge in Alzheimer patients and mild cognitive impairment differentially affects hippocampal activation--a pharmacological fMRI study.
Brain. 2006;
129:141
-157

[26] guy w. CGI Clinical Global Impressions.
In: , editors.
ECDEU assessment manual for psychopharmacology..
Rockville :US Dept of Health, Education, and Welfare, Publication ADM 76-338;
1976.
p.
-

[27] hansson o,
zetterberg h,
buchhave p,
londos e,
blennow k,
minthon l. Association between CSF biomarkers and incipient Alzheimer’s disease in patients with mild cognitive impairment: a follow-up study.
Lancet Neurol. 2006;
5:228
-234

[28] harwood dg,
ownby rl,
barker ww,
duara r. The behavioral pathology in Alzheimer’s Disease Scale (BEHAVE-AD): factor structure among community-dwelling Alzheimer’s disease patients.
Int J Geriatr Psychiatry. 1998a;
13:793
-800

[29] harwood dg,
ownby rl,
barker ww,
duara r. The factor structure of the Cornell Scale for Depression in Dementia among probable Alzheimer’s disease patients.
Am J Geriatr Psychiatry. 1998b;
6:212
-220

[30] hogan db,
goldlist b,
naglie g,
patterson c. Comparison studies of cholinesterase inhibitors for Alzheimer’s disease.
Lancet Neurol. 2004;
3:622
-626

[31] hughes cp,
berg l,
danziger wl,
coben la,
martin rl. A new clinical scale for the staging of dementia.
Br J Psychiatry. 1982;
140:566
-572

[32] joffres c,
graham j,
rockwood k. Qualitative analysis of the clinician interview-based impression of change (Plus): methodological issues and implications for clinical research.
Int Psychogeriatr. 2000;
12:403
-413

[33] jonsson l,
andreasen n,
kilander l,
soininen h,
waldemar g. Patient- and proxy-reported utility in Alzheimer disease using the EuroQoL.
Alzheimer Dis Assoc Disord. 2006;
20:49
-55

[34] kaduszkiewicz h,
zimmermann t,
beck-bornholdt hp,
van den bussche h. Cholinesterase inhibitors for patients with Alzheimer’s disease: systematic review of randomised clinical trials.
BMJ. 2005;
331:321
-327

[35] kang sj,
choi sh,
lee bh,
jeong y,
hahm ds. Caregiver-administered Neuropsychiatry Inventory (CGA-NPI).
J Geriatr Psychiatry Neurol. 2004;
17:32
-35

[36] kapaki e,
paraskevas gp. The cognitive effects of cholinesterase inhibitor treatment in every-day practice.
Curr Med Res Opin. 2005;
21:871
-875

[37] kapaki e,
liappas i,
paraskevas gp,
theotoka i,
rabavilas a. The diagnostic value of tau protein, beta-amyloid (1-42) and their ratio for the discrimination of alcohol-related cognitive disorders from Alzheimer’s disease in the early stages.
Int J Geriatr Psychiatry. 2005;
20:722
-729

[38] kashiwa y,
kitabayashi y,
narumoto j,
nakamura k,
ueda h,
fukui k. Anosognosia in Alzheimer’s disease: association with patient characteristics, psychiatric symptoms and cognitive deficits.
Psychiatry Clin Neurosci. 2005;
59:697
-704

[39] kemppainen nm,
aalto s,
wilson ia,
nagren k,
helin s. Voxel-based analysis of PET amyloid ligand [11C]PIB uptake in Alzheimer disease.
Neurology. 2006;
67:1575
-1580

[40] kotynia-english r,
mcgowan h,
almeida op. A randomized trial of early psychiatric intervention in residential care: impact on health outcomes.
Int Psychogeriatr. 2005;
17:475
-485

[41] lawton mp,
brody em. Assessment of older people: self-maintaining and instrumental activities of daily living.
Gerontologist. 1969;
9:179
-186

[42] leber p. Guidelines for the clinical evaluation of anti-dementia drugs, 1st draft.
Rockville:US Food and Drug Administration;
1990.
p.

[43] lingler jh,
martire lm,
schulz r. Caregiver-specific outcomes in antidementia clinical drug trials: a systematic review and meta-analysis.
J Am Geriatr Soc. 2005;
53:983
-990

[44] loveman e,
green c,
kirby j,
takeda a,
picot j. The clinical and cost-effectiveness of donepezil, rivastigmine, galantamine and memantine for Alzheimer’s disease.
Health Technol Assess. 2006;
10:iii-iv, ix-xi, 1
-160

[45] mack jl,
patterson mb,
tariot pn. The Behavior Rating Scale for Dementia (BRSD): development of test scales and presentation of data for 555 individuals with Alzheimer’s disease.
J Geriatr Psychiatry Neurol. 1999;
12:211
-223

[46] mckhann g,
drachman d,
folstein m,
katzman r,
price d,
stadlan em. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease.
Neurology. 1984;
34:939
-944

[47] modrego pj. The effect of drugs for Alzheimer disease assessed by means of neuroradiological techniques.
Curr Med Chem. 2006;
13:3417
-3424

[48] mosconi l,
sorbi s,
de leon mj,
li y,
nacmias b. Hypometabolism exceeds atrophy in presymptomatic early-onset familial Alzheimer’s disease.
J Nucl Med. 2006;
47:1778
-1786

[49] overall je,
schaltenbrand r. The SKT neuropsychological test battery.
J Geriatr Psychiatry Neurol. 1992;
5:220
-227

[50] panisset m,
roudier m,
saxton j,
boller f. Severe impairment battery: a neuropsychological test for severely demented patients.
Arch Neurol. 1994;
51:41
-45

[51] reisberg b,
ferris sh,
de leon mj,
crook t. The Global Deterioration Scale for assessment of primary degenerative dementia.
Am J Psychiatry. 1982;
139:1136
-1139

[52] reisberg b,
auer sr,
monteiro im. Behavioral pathology in Alzheimer’s disease (BEHAVE-AD) rating scale.
Int Psychogeriatr. 1996;
8:301
-308

[53] rosen wg,
mohs rc,
davis k. A new rating scale for Alzheimer’s disease.
Am J Psychiatry. 1984;
141:1356
-1364

[54] ryu sh,
katona c,
rive b,
livingston g. Persistence of and changes in neuropsychiatric symptoms in Alzheimer disease over 6 months: the LASER-AD study.
Am J Geriatr Psychiatry. 2005;
3:976
-983

[55] sano m,
zhu cw,
whitehouse pj,
edland s,
jin s. ADCS Prevention Instrument Project: Pharmacoeconomics: Assessing Health-related Resource Use Among Healthy Elderly.
Alzheimer Dis Assoc Disord. 2006;
20:S191
-S202

[56] sauer j,
ffytche dh,
ballard c,
brown rg,
howard r. Differences between Alzheimer’s disease and dementia with Lewy bodies: an fMRI study of task-related brain activity.
Brain. 2006;
129 (Pt 7):1780
-1788

[57] schneider ls,
olin jt,
doody rs,
clark cm,
morris jc. Validity and reliability of the Alzheimer’s Disease Study-Clinical Global Impression of Change (ADCS-CGIC).
Alzheimer Dis Assoc Disord. 1996;
112:S22
-S32

[58] schneider ls,
clark cm,
doody r,
ferris sh,
morris jc. ADCS Prevention Instrument Project: ADCS-Clinicians’ Global Impression of Change Scales (ADCS-CGIC), Self-rated and Study Partner-rated Versions.
Alzheimer Dis Assoc Disord. 2006;
20:S124
-S138

[59] starkstein se,
jorge r,
mizrahi r,
robinson rg. A prospective longitudinal study of apathy in Alzheimer’s disease.
J Neurol Neurosurg Psychiatry. 2006a;
77:8
-11

[60] starkstein se,
jorge r,
mizrahi r,
robinson rg. A diagnostic formulation for anosognosia in Alzheimer’s disease.
J Neurol Neurosurg Psychiatry. 2006b;
77:719
-725

[61] starkstein se,
jorge r,
petracca g,
robinson rg. The construct of generalized anxiety disorder in Alzheimer disease.
Am J Geriatr Psychiatry. 2007;
15:42
-49

[62] suh gh,
ju ys,
yeon bk,
shah a. A longitudinal study of Alzheimer’s disease: rates of cognitive and functional decline.
Int J Geriatr Psychiatry. 2004;
19:817
-824

[63] tabert mh,
manly jj,
liu x,
pelton gh,
rosenblum s. Neuropsychological prediction of conversion to Alzheimer disease in patients with mild cognitive impairment.
Arch Gen Psychiatry. 2006;
63:916
-924

[64] takeda a,
loveman e,
clegg a,
kirby j,
picot j. A systematic review of the clinical effectiveness of donepezil, rivastigmine and galantamine on cognition, quality of life and adverse events in Alzheimer’s disease.
Int J Geriatr Psychiatry. 2006;
21:17
-28

[65] teunisse s,
derix mm,
van crevel h. Assessing the severity of dementia. Patient and caregiver.
Arch Neurol. 1991;
48:274
-277

[66] thomas p,
lalloue f,
preux pm,
hazif-thomas c,
pariel s. Dementia patients caregivers quality of life: the PIXEL study.
Int J Geriatr Psychiatry. 2006;
21:50
-56

[67] trinh nh,
hoblyn j,
mohanty s,
yaffe k. Efficacy of cholinesterase inhibitors in the treatment of neuropsychiatric symptoms and functional impairment in Alzheimer disease: a meta-analysis.
JAMA. 2003;
289:10
-16

[68] van de pol la,
hensel a,
barkhof f,
gertz hj,
scheltens p,
van der flier wm. Hippocampal atrophy in Alzheimer disease: age matters.
Neurology. 2006;
66:236
-238

[69] varma ar,
laitt r,
lloyd jj,
carson kj,
snowden js. Diagnostic value of high signal abnormalities on T2 weighted MRI in the differentiation of Alzheimer’s, frontotemporal and vascular dementias.
Acta Neurol Scand. 2002;
105:355
-364

[70] wimo a,
nordberg g,
jansson w,
grafström m.
Assessment of informal services to demented people with the RUD instrument.
Int J Geriatr Psychiatry. 2000;
15:969
-971

[71] yesavage ja,
brink tl,
rose tl,
lum o,
huang v. Development and validation of a geriatric depression screening scale: A preliminary report.
Journal of Psychiatric Research. 1983;
17:37
-49

[72] zarit sh,
reever ke,
bach-peterson j. Relatives of the impaired elderly: correlates of feelings of burden.
Gerontologist. 1980;
20:649
-655

Lucette Lacomblez
Fédération des maladies du système nerveux, AP-HP
Hôpital de la Salpêtrière, Paris
Service de Pharmacologie UMPC Paris VI
Traitements symptomatiques dans le déclin cognitif : contribution au débat
Plus de 10 ans après leur mise à disposition des cliniciens, les médicaments proposés pour le traitement symptomatique des formes légères à modérées de la maladie d'Alzheimer demeurent objet de controverses, de même que l'extension de leurs indications à d'autres affections à évolution démentielle ou à d'autres stades de la maladie. Parallèlement, ou en écho à ces controverses, leur emploi dans la population demeure modeste et le nombre de patients recevant cette catégorie de molécules est largement en deçà du nombre de ceux qui potentiellement pourraient en recevoir. Dans certains pays, notamment au Royaume-Uni ou au Canada, un débat vif remet en question les performances de ces médicaments ainsi que leur utilité clinique ou économique. En témoignent les polémiques qui entourent les recommandations du
National Institute for Health and Clinical Excellence (NICE, 2006

). En France, faute de recommandations émises par la Haute Autorité en Santé, ce sont celles de l'Autorisation de mise sur le marché (AMM) qui prévalent, même si certains auteurs, par exemple dans des revues de formation continue, proposent un usage plus large de ces médicaments.
L'objectif de cette contribution est d'interroger les critères de jugement employés habituellement dans les essais et la notion de seuil de pertinence clinique, puis de passer en revue la qualité des essais de chaque classe thérapeutique et leurs résultats.
Critères de jugement de l'action symptomatique dans la maladie d'Alzheimer
La maladie d'Alzheimer est une maladie chronique, dont l'évolution s'étale sur plus de 10 ans. Les symptômes repérables sont cognitifs et comportementaux d'une part, sociaux au sens large du terme (déclin d'autonomie, altération de la relation à autrui et de la capacité à vivre dans la communauté, consommation élevée de biens et services médico-sociaux, hospitalisations itératives, institutionnalisation...) d'autre part. La prise en charge des patients mobilise lourdement l'entourage, générant un indiscutable fardeau et une altération de la qualité de vie des aidants.
Dans les années 1980, un consensus s'est établi pour harmoniser la quantification de ces symptômes par des outils de mesure. Ces outils ont été traduits dans différentes langues mais leurs procédures de validation ont été peu publiées. Les mesures se font pour l'essentiel avec des variables continues, dont l'ampleur de l'échelle est toujours importante.
Consensuellement sont retenus :
• pour la mesure des performances cognitives : soit des batteries cognitives stricto-sensu comme l'Alzheimer's Disease Assessment Scale – Cognitive (ADAS-Cog), dont le score varie de 0 à 70, le Mini Mental State Examination (MMSE) (0-30) et la Severe Impairment Battery (0-100), soit une échelle d'impression clinique basée sur un entretien avec le malade et ses aidants. Cette dernière, la CIBIC (Clinician's Interview-Based Impression of Change), suit une variable discrète à 7 niveaux, mesurant soit la stabilisation du patient, soit son évolution, favorable ou défavorable, par trois niveaux (modérément, significativement et de manière très importante) ;
• pour la mesure des troubles du comportement : le Neuropsychiatric Inventory (NPI) dont le nombre d'items est variable (généralement 10 ou 12, parfois 4) et le score total potentiel égal au nombre d'items multiplié par 12.
Pour les autres variables, le consensus est moins fort et les essais utilisent diverses échelles :
• pour l'autonomie fonctionnelle : l'ADCS-ADL (Alzheimer Disease Cooperative Study-Activities of Daily Living) (0-78), dont il existe une version pour les déments sévères, la DAD (Disability Assessment for Dementia) (exprimée en pourcentage du score total, 0-100), plus rarement les ADL (Activities of Daily Living) de Katz ou les IADL (Instrumental Activities of Daily Living) de Lawton ;
• pour la mesure du fardeau familial : le plus souvent l'échelle de Zarit (088) ;
• pour la mesure des coûts, des méthodologies variées et controversées ;
• pour la mesure de la qualité de vie, des échelles très variées concernant les malades ou leurs aidants.
Toutes ces échelles posent deux questions de fond. La première est relative à leurs qualités métrologiques qui n'ont fait qu'exceptionnellement objet de publications. L'incertitude sur la mesure, les facteurs de variation liés à l'examinateur ou aux caractéristiques des malades (âge, niveau d'éducation, apprentissage, stades et caractéristiques cliniques de la maladie) sont insuffisamment étudiés, même si le consensus des professionnels à leur égard est très fort. L'absence de données sur l'incertitude de la mesure questionne la pertinence clinique ou statistique d'une variation de quelques points de ces scores. Cela est essentiel pour les échelles cognitives, notamment pour l'ADAS-Cog, dont les variations observées dans les essais pharmacologiques, on le verra, sont de faible amplitude. La littérature est quasi muette sur ce sujet, sauf de rares articles où l'interrogation sur le sens d'une variation de quelques points est forte (Doraiswamy et coll., 2001

). Pour les échelles composites, additionnant des sous-scores, l'indépendance des items qui les composent mériterait d'être authentifiée. Cela a été fait pour le score du fardeau de Zarit et l'on observe une forte corrélation entre certains sous-scores (Vernooij-Dassen et coll., 2003

). Cela n'a pas été publié pour le NPI, pour lequel l'hypothèse de fortes redondances internes reste posée.
La seconde question concerne la pertinence clinique d'une variation de score d'une échelle aux
extrema éloignés. Les variables continues employées dans les essais concernant la maladie d'Alzheimer ont toutes des amplitudes importantes et tout se passe comme si la plus petite variation de score était perçue comme ayant du sens clinique. Pourtant, un consensus d'experts de la FDA en 1989, se basant sur l'histoire naturelle de la maladie d'Alzheimer à 6 mois, a proposé une variation de 4 points de l'ADAS-Cog comme pertinente cliniquement et rendant détectable l'effet pharmacologique (
PCNS Drugs Advisory Committee, 1989

; Rockwood et McKnight, 2001

). Curieusement, ce consensus n'est jamais rappelé lors de la publication des essais pharmacologiques et ne fait l'objet d'aucun commentaire ou remise en cause. Ainsi, l'effet d'un médicament sera jugé toujours positif sans référence à cette borne, quelle que soit l'ampleur de la variation. Ce même consensus d'experts propose pour la CIBIC une pertinence clinique dans la stabilisation ou le non-déclin, ce qui est assez logique. Les autres variables (SIB ou
Severe Impairment Battery, Zarit, autonomie et surtout NPI) n'ont pas fait l'objet de réflexion publiée.
Qualité des essais publiés
Le nombre d'essais randomisés avec les médicaments anti-Alzheimer est élevé (plus de 250 publications référencées dans
Medline). Ces essais ne sont pas tous de qualité égale, voire comportent un certain nombre de défauts méthodologiques qui peuvent obérer la pertinence des résultats rapportés. Une revue systématique de ces essais (Kaduszkiewicz et coll., 2005

) montre que seul un petit nombre d'entre eux (22 au total) remplit partiellement les critères du
Consort Statement, sans jamais y satisfaire totalement. La critique la plus fréquente est la multiplicité des tests sur les variables de résultats secondaires, sans correction du seuil de significativité en fonction du nombre de tests statistiques pratiqués, aboutissant à des résultats sur celles-ci à faible niveau de preuve.
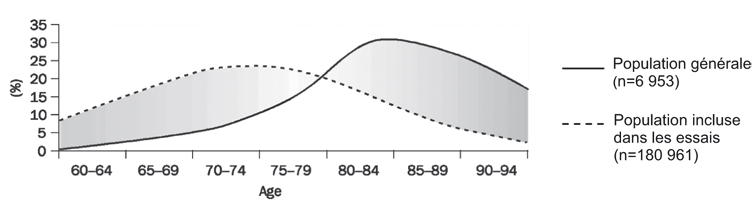
Une population incluse dans un essai doit être la plus proche possible des malades rencontrés dans la vie courante. La maladie d'Alzheimer concerne avant tout des sujets très âgés et plus de la moitié des malades a plus de 85 ans (Ferri et coll., 2005

). Une comparaison entre les malades en population générale et celle des malades inclus dans les études montre d'importantes différences. Cela a été magistralement démontré (Schoenmaker et Van Gool, 2004

) pour la population des Pays-Bas (figure 1

). Ce biais majeur conduit à deux questions portant sur :
• une modification de l'effet en fonction de l'âge, renforcé ou diminué chez des plus âgés (un travail plutôt confidentiel, sans suite et à très faible niveau de preuve (Schneider et coll., 1998

), fait état d'un effet plus important après 75 ans qu'avant) ;
• la tolérance et le rapport bénéfice/risque qui peuvent être différents chez des sujets plus âgés, plus polypathologiques ou polymédiqués.
Enfin, le débat demeure complexe sur la durée des essais. L'impact sur des symptômes peut valablement être évalué sur une durée assez brève (6 mois), ce délai bref participant à la faisabilité d'essais difficiles à mener dans ce type de population. Mais dans une maladie dont la durée dépasse 10 ans, il est difficile de tirer des conclusions d'une variation symptomatique observée pendant 6 mois quant à l'évolution globale de la maladie, son impact médico-social et surtout la qualité de vie des patients et de leur entourage. Peu d'études valides ont excédé cette durée de 6 mois (Nordic et AD2000) et une conclusion est difficile à apporter (Winblad et coll., 2001

; Courtney et coll., 2004

). L'étude AD2000, dont la méthodologie reste controversée, observe à long terme un très faible effet cognitif sur le MMSE sans aucune conséquence sur le comportement, l'autonomie, l'entrée en institution, les coûts, le fardeau de prise en charge... Quant aux prolongations après 6 mois en ouvert, des essais randomisés comparant les malades traités à une cohorte théorique ou à des séries historiques datant des années 1980, leur valeur méthodologique est très modeste.
Inhibiteurs de l'acétylcholinestérase (IAChE)
Cette classe thérapeutique repose sur une hypothèse physiopathologique cohérente avec ce que l'on sait de la maladie d'Alzheimer où l'altération des voies cholinergiques est corrélée à l'ampleur du déclin cognitif. Un assez grand nombre d'essais a été mené avec cette classe, concernant plus de 10 000 patients depuis le milieu des années 1980. Diverses méta-analyses ont été publiées, plus ou moins sévères dans les critères de sélection des essais à retenir. On citera ici principalement celles de la
Cochrane Database (Birks et coll., 2000

; Birks, 2006

; Birks et Harvey, 2006

; Loy et Schneider, 2006

) et la plus récente publiée dans une revue à comité de lecture (Takeda et coll., 2006

). Leurs résultats ne sont pas divergents sur l'essentiel.
Effets cliniques très modestes dans les formes légères à modérées, non démontrés dans les formes sévères
L'impact sur les variables usuelles des différents médicaments, évalués séparément et en méta-analyse globale aux doses les plus élevées, est présenté dans les tableaux I

à III

. Pour l'ADAS-Cog, la variation moyenne du score reste en deçà du seuil de pertinence clinique, en méta-analyse comme dans l'évaluation individuelle des études. Seul un essai de phase 2 avec un petit nombre de malades atteint ce seuil. Quelle que soit la variable considérée, le résultat observé, statistiquement significatif, ne représente qu'un écart modeste sur une échelle de variation potentielle importante. Ainsi pour la NPI, que peut bien signifier sur le plan clinique une variation de 2,5 points d'un score comportemental composite variant potentiellement de 0 à 120 ? De fait, il est difficile d'affirmer que les IAChE soient actifs sur les composantes comportementales de la maladie d'Alzheimer.
Tableau I Impact des IAChE sur les scores de l'ADAS-Cog dans la maladie d'Alzheimer (Source : Cochrane Database)
| |
Différence moyenne IAChE/placebo
|
IC 95 %
|
|
Donépézil
|
2,8
|
2,10–3,74
|
|
Galantamine
|
3,1
|
2,3–3,7
|
|
Rivastigmine
|
2,09
|
1,54–2,65
|
|
Ensemble
|
2,7
|
2,3–3,0
|
Tableau II Impact des IAChE sur l'échelle CIBIC dans la maladie d'Alzheimer (Source : Cochrane Database)
| |
Fréquence d'amélioration IAChE/placebo
|
OR (IC 95 %)
|
|
Donépézil
|
30 % vs 19 %
|
1,82 (1,42–2,35)
|
|
Rivastigmine
|
26 % vs 18 %
|
1,54 (1,25–1,89)
|
|
Ensemble
|
24 % vs 17 %
|
1,56 (1,32–1,85)
|
Tableau III Impact des IAChE sur les scores du NPI dans la maladie d'Alzheimer (Source : Cochrane Database)
| |
Différence moyenne IAChE/placebo
|
IC 95 %
|
|
Donepezil
|
2,62
|
0,43–4,88
|
|
Galantamine
|
2,1
|
0,2–4,0
|
|
Rivastigmine
|
ns
|
(une seule étude)
|
|
Ensemble
|
2,44
|
0,76–4,12
|
En bref, les IAChE ont un effet très modeste sur la cognition à 6 mois, n'atteignant pas le seuil de pertinence clinique, et semblent sans effet réel sur le comportement, l'autonomie, le fardeau des aidants, la capacité à vivre au domicile. L'impact sur les coûts de prise en charge fait l'objet d'un débat acharné. Sans impact probable sur les coûts de prise en charge des malades, les IAChE demeurent interrogeables dans leur strict apport coût/bénéfice. C'est entre autres motifs pourquoi le NICE les considère comme une « option » dans la prise en charge des malades.
Quant aux essais dans les formes sévères de la maladie d'Alzheimer, ils sont trop peu nombreux et trop décevants pour qu'on puisse proposer une extension des indications des IAChE (Birks et coll., 2000

; Birks, 2006

; Birks et Harvey, 2006

; Loy et Schneider, 2006

).
Équivalence des différentes molécules
En dépit des efforts des firmes industrielles, aucune étude crédible ne permet d'affirmer qu'un médicament est supérieur à un autre. Si effet thérapeutique il y a, c'est un effet de classe. Les études comparatives publiées sont biaisées, toujours sponsorisées par la firme commercialisant le vainqueur de la confrontation, ce que montre bien une revue récente de ces essais (Hogan et coll., 2004

). De même, aucune preuve ne vient soutenir l'idée qu'en cas d'échec d'un IAChE, un autre pourrait produire un effet plus positif. Cette stratégie, appelée «
switch », a fait l'objet de quelques communications dans les congrès, sans lendemain dans les revues à comité de lecture sélectif.
Interrogations sur la tolérance au long cours
La tolérance des IAChE (tacrine exclue) semble, au terme des études de 6 mois, plutôt satisfaisante et limitée à des troubles digestifs rapidement régressifs et dose-dépendants. D'autres effets plutôt exceptionnels ont pu être mentionnés (cauchemars, crampes...) mais ils ne permettent pas de remettre en cause l'idée largement répandue de la bonne tolérance immédiate de ces drogues. Plus difficile est l'évaluation de leur tolérance au long cours, sur laquelle trop peu de données sont disponibles. Pour le donépézil, l'étude Nordic (12 mois) et l'étude AD2000 (3 ans pour certains patients) ne montrent aucun effet sur la mortalité. Pour la galantamine, il a été observé dans une étude de 2 ans menée sur le MCI (Mild Cognitive Impairment), toujours non publiée, une surmortalité importante (facteur trois) par accident vasculaire cérébral, non expliquée à ce jour par des variables patients. Peut-être s'agit-il du hasard, mais ces résultats ont légitimé une recommandation officielle (Afssaps) de non prescription en France de cette molécule dans le MCI compte tenu d'un risque potentiel. S'il y a danger d'une prise au long cours pour les malades atteint de MCI (qui sur le plan nosologique reste un facteur de risque et non une maladie), que dire alors de ceux atteints de maladie d'Alzheimer qui sont bien plus âgés et fragiles ? Une certaine prudence devrait être de mise (que l'on garde en mémoire le cas des neuroleptiques atypiques).
Les questions de tolérance au long cours des médicaments chez les malades âgés sont éternelles. Les critères d'exclusion dans les essais (même si ce n'est pas le cas de toutes les études des IAChE) font que les sujets porteurs des comorbidités les plus fréquemment présentes en population sont éliminés dans les essais. En outre, il existe une sous-déclaration des accidents médicamenteux chez les sujets âgés. Ce phénomène de sous-déclaration est renforcé parce que l'imputabilité est plus difficile à imaginer ou à établir chez les malades âgés. Un accident vasculaire cérébral chez un sujet âgé hypertendu, atteint de maladie d'Alzheimer et traité par IAChE, évoquera a priori moins un accident médicamenteux qu'une évolution banale de sa pathologie cardiovasculaire.
Seuls des essais à très long terme, sur un grand nombre de patients, permettraient de répondre valablement. Mais l'obtention d'une AMM pour ces médicaments et un discours dominant d'efficacité rendent difficile la réalisation de ce type d'études car elles seraient qualifiées de non éthiques. Une question aussi importante que celle du risque à long terme peut ainsi rester définitivement sans réponse. À défaut, une prudence extrême semble de mise chez les patients à risque d'accident cardiovasculaire, soit un nombre très élevé de sujets âgés atteints de maladie d'Alzheimer.
Question des « bons répondeurs »
L'analyse des résultats montre, dans toutes les études, l'existence d'un groupe de patients dont l'ampleur de la réponse cognitive est au-dessus du seuil de 4 points à l'ADAS-Cog. Sur le plan méthodologique, il faut rappeler que :
• cette détermination a posteriori constitue un niveau de preuve faible ;
• le repérage est fait dans le cadre de l'étude et donc pas nécessairement généralisable à l'ensemble de la population.
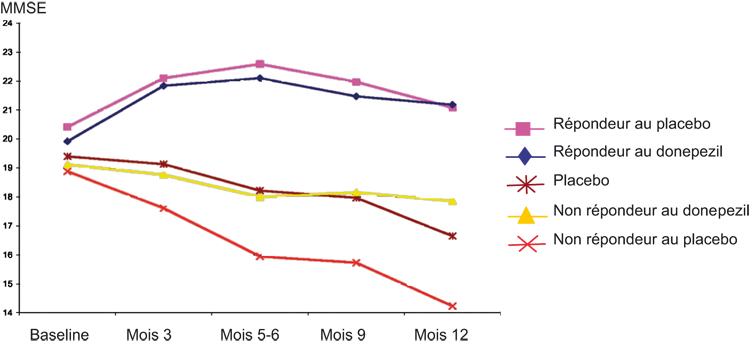
On sait d'après les séries historiques et les patients des essais sous placebo que l'évolution spontanée des fonctions cognitives en 6 mois des malades les répartit en un très gros tiers de malades dont l'état s'aggrave, un tiers de malades qui demeurent stables et un petit tiers dont l'état s'améliore. Ces malades dont l'état s'améliore spontanément sont lus comme des bons répondeurs au placebo et de même on observe des bons répondeurs sous IAChE. Ceux-ci sont un peu plus nombreux (de 5 à 15 % selon les études) et leur état s'améliore un peu plus que celui des bons répondeurs au placebo. Aucune donnée n'a été publiée, mais des informations transmises par les firmes pharmaceutiques au NICE sur l'étude Nordic (NICE, 2005

) chiffrent l'écart moyen à 1 point d'ADAS-Cog entre bons répondeurs au placebo et bons répondeurs aux IAChE (figure 2

et tableau IV

).
Tableau IV Écart des scores ADAS-Cog donépézil/placebo selon la typologie de réponse (Étude Nordic, source NICE)
| |
Donépézil
|
Placebo
|
|
Fréquence bons répondeurs
|
39 % (23 – 56 %)
|
22 % (11 – 34 %)
|
|
ADAS-Cog bons répondeurs (score moyen)
|
6,26 (4,72 – 7,8)
|
5,27 (3,64 – 6,90)
|
|
ADAS-Cog non répondeurs (score moyen)
|
1,21 (0,3 – 2,11)
|
-0,99 (-0,04 – -1,94)
|
En dépit de multiples études, même si une grande partie des données demeure non publiée par les firmes pharmaceutiques, aucun critère de définition a priori des bons répondeurs n'a pu être mis en évidence (caractéristiques cliniques ou biologiques des patients). Cette définition est pourtant essentielle pour établir des critères d'inclusion dans une étude prospective, seule à même de valider définitivement l'idée de meilleurs répondeurs sous traitement. Mais cette identification a priori réduirait fortement le nombre de prescriptions potentielles et l'on comprend l'enthousiasme relatif des firmes à pousser les recherches en ce domaine.
Pourtant cet écart, fût-il minime, autorise pour beaucoup l'introduction des IAChE, en l'absence des contre-indications usuelles. Cette attitude semblerait légitime, visant à faire bénéficier le patient d'un effet potentiel bien qu'incertain. Mais elle doit s'accompagner d'une part d'une évaluation très stricte des risques cardiovasculaires et, d'autre part, d'une réévaluation cognitive systématique des malades à 4 ou 6 mois. Si l'état des malades est amélioré, il serait licite de continuer le traitement tant qu'il demeure bien toléré et que la maladie n'atteint pas le stade sévère. Dans tous les autres cas, il devrait être interrompu. Ceci suppose une relation de confiance forte entre le patient, son entourage et l'équipe médicale. C'est ce que proposait la première recommandation du NICE et qui constitue la pratique canadienne : sans effet positif observé sur la cognition et l'autonomie, on interrompt les IAChE.
Qu'en est-il dans les autres formes de déclin cognitif ?
Diverses extensions d'AMM ont été proposées ou sont en cours. On retiendra un niveau de preuve dans la démence vasculaire assez voisin de celui de la maladie d'Alzheimer et une absence d'effet dans le MCI. Une étude observe un effet modeste sur les troubles cognitifs de la maladie de Parkinson. En revanche, le cas de la maladie des corps de Lewy diffus mérite plus de commentaires. Les professionnels adhèrent plutôt à l'idée d'une efficacité certaine des IAChE sur les symptômes cognitifs et psychiatriques de cette pathologie, voire supérieure à celle observée dans la maladie d'Alzheimer. Paradoxalement, aucune étude ne vient soutenir cette opinion. Plus encore, la seule étude publiée (McKeith et coll., 2000

) n'observe ni effet cognitif, ni effet sur les hallucinations ou les délires. La méta-analyse de la
Cochrane Database (Wild et coll., 2003

) conclut à une absence de preuve d'efficacité.
Mémantine
L'emploi de cette molécule dans la maladie d'Alzheimer repose sur une hypothèse physiopathologique très incertaine, celle de la toxicité cellulaire d'un tonus glutamatergique élevé, à laquelle aucune revue sérieuse sur la physiopathologie de la maladie d'Alzheimer ne fait référence. Un nombre d'études assez modeste a été mené avec cette molécule, dans les formes sévères de la maladie d'Alzheimer ou des démences vasculaires (McShane et coll., 2006

). Le dossier scientifique a obtenu une AMM européenne sans pour autant convaincre une partie de la communauté scientifique. Ainsi, le NICE propose pour l'heure de poursuivre les essais mais ne recommande pas l'emploi de cette molécule en clinique (NICE, 2006

).
Les essais montrent dans la démence sévère un effet moyen de 3 points à la SIB (amplitude 0-100), écart dont la pertinence clinique ne saute pas aux yeux. Quant à la réduction de l'agitation qui atteint le seuil de significativité, on peut s'interroger dans la mesure où il n'est pas fait de correction de ce seuil en fonction du nombre de tests effectués (les items du NPI sont nombreux !).
Existe-t-il une synergie IAChE-mémantine ?
Se développe en France une pratique d'association entre un IAChE et la mémantine, avec l'arrière pensée d'une synergie ou d'une addition d'effet. Aucune étude ne vient soutenir cette hypothèse. Un seul essai (Tariot et coll., 2004

) a inclus des patients recevant un IAChE depuis plus d'un an et comparé l'effet d'une dose usuelle de mémantine au placebo. Les résultats sont similaires à ceux observés dans d'autres études menées avec la mémantine seule, infirmant l'idée d'une synergie.
En conclusion,
dans l'état actuel de la controverse, une conclusion ne peut que refléter l'avis de l'auteur qui est loin d'être convaincu de l'efficacité de ces médicaments. Sur le strict plan scientifique, le service médical global rendu est suffisamment faible pour que ces médicaments ne constituent qu'une option au sein de la prise en charge d'un malade qui doit être globale et multidisciplinaire. Plus encore, leur tolérance au long cours chez la majorité des patients qui sont très âgés, polypathologiques et polymédiqués, reste incertaine, notamment en cas de pathologies cardiovasculaires si fréquentes après 80 ans. Devant un bénéfice très incertain mais possible pour les IAChE, en dépit d'une toxicité potentielle, l'attitude de tester l'appartenance du malade au « club » des bons répondeurs peut se légitimer. Ce qui reviendra à les prescrire sous réserve à des patients exempts de pathologies cardiovasculaires et à les interrompre au terme de 4 à 6 mois en l'absence d'amélioration, et toujours lorsque le patient atteint le stade sévère de la maladie. Cela suppose l'instauration avec le malade et son entourage d'une relation d'une qualité très élevée. Cela suppose aussi un repositionnement du rôle du médicament dans la prise en charge de ces maladies chroniques à évolution toujours fatale. Enfin, les IAChE ont joué un rôle symbolique fort chez les médecins prenant en charge le déclin cognitif. Ils ont accompagné un mouvement de reconnaissance de la maladie d'Alzheimer et le déploiement de moyens dédiés aux malades. On comprend combien il est difficile aujourd'hui de dire le peu d'efficacité voire l'inefficacité de ces médicaments.
Bibliographie
[1] birks j. Cholinesterase inhibitors for Alzheimer’s disease.
Cochrane Database of Systematic Reviews. 2006;
:Issue 1 Art No: CD005593. DOI: 10.1002/14651858.CD005593
-

[2] birks j,
harvey rj. Donepezil for dementia due to Alzheimer’s disease.
Cochrane Database of Systematic Reviews. 2006;
:Issue 1 Art No: CD001190. DOI: 10.1002/14651858.CD001190.pub2
-

[3] birks j,
grimley evans j,
iakovidou v,
tsolaki m. Rivastigmine for Alzheimer’s disease.
Cochrane Database of Systematic Reviews. 2000;
:Issue 4 Art No: CD001191. DOI: 10.1002/14651858.CD001191
-

[4] courtney c,
farrell d,
gray r,
hills r,
lynch l. Long-term donepezil treatment in 565 patients with Alzheimer’s disease (AD2000): randomised double-blind trial.
Lancet. 2004;
363:2105
-2115

[5] doraiswamy pm,
kaiser l,
bieber f,
and garman rl. The Alzheimer’s Disease Assessment Scale: Evaluation of Psychometric Properties and patterns of Cognitive Decline Multicenter Clinical Trials of Mild to Moderate Alzheimer’s Disease.
Alzheimer Disease and Associated Disorders. 2001;
15:174
-183

[6] ferri cp,
prince m,
brayne c,
brodaty h,
fratiglioni l. Global prevalence of dementia: a Delphi consensus study.
Lancet. 2005;
336:2112
-2117

[7] hogan db,
goldlist b,
naglie g,
patterson c. Comparison studies of cholinesterase inhibitors for Alzheimer’s disease.
Lancet Neurol. 2004;
3:622
-626

[8] kaduszkiewicz h,
zimmermann t,
beck-bornholdt hp. Cholinesterase inhibitors for patients with Alzheimer’s disease: systematic review of RCT.
BMJ. 2005;
331:321
-327

[9] loy c,
schneider l. Galantamine for Alzheimer’s disease and mild cognitive impairment.
Cochrane Database of Systematic Reviews. 2006;
:Issue 1 Art No: CD001747. DOI: 10.1002/14651858.CD001747.pub3
-

[10] mckeith i,
del ser t,
spano pf,
emre m,
wesnes k. Efficacy of rivastigmine in dementia with Lewy bodies: a randomised, double-blind, placebo-controlled international study.
Lancet. 2000;
356:2031
-2036

[11] mcshane r,
areosa sastre a,
minakaran n. Memantine for dementia.
Cochrane Database of Systematic Reviews. 2006;
:Issue 2 Art No: CD003154. DOI: 10.1002/14651858.CD003154.pub5
-

[12]national institute for health and clinical excellence (nice). Addendum -Technical Report no. 2 Dec 2005. Site internet :
http://www.nice.org.uk.

[13]national institute for health and clinical excellence (nice).Donepezil, galantamine, rivastigmine (review) and memantine for the treatment of Alzheimer’s disease. Nice guidance TA111 nov 2006. Site internet:
http://www.nice.org.uk.

[14]pcns drugs advisory committee. PCNS Drugs Advisory Committee Meeting.
Rockville:FDA;
July 7, 1989.

[15] rockwood k,
mcknight c. Assessing the clinical importance of statistically significant improvement in anti-dementia drug trial.
Neuroepidemiology. 2001;
20:51
-56

[16] schneider ls,
anand r,
farlow mr. Systematic review of the efficacy of rivastigmine for patients with Alzheimer’s disease.
Int J Geriatr Psychopharm. 1998;
1:S26
-S34

[17] schoenmaker n,
van gool wa. The age gap between patients in clinical studies and in the general population: a pitfall for dementia research.
Lancet Neurol. 2004;
3:627
-630

[18] takeda a,
loveman e,
clegg a,
kirby j,
picot j. A systematic review of the clinical effectiveness of donepezil, rivastigmine and galantamine on cognition, quality of life and adverse events in Alzheimer’s disease.
Int J Geriatr Psychiatry. 2006;
21:17
-28

[19] tariot pn,
farlow mr,
grossberg gt,
graham sm,
mcdonald s,
gergel i. Memantine study group Memantine treatment for patients with moderate to severe alzheimer disease already receiving donepezil.
Jama. 2004;
291:317
-324

[20] vernooij-dassen m,
kurz x,
scuvee-moreau ,
dresse a. The measure of sense of competence in caregivers of patients with dementia.
RESP. 2003;
51:227
-235

[21] wild r,
pettit t,
burns a. Cholinesterase inhibitors for dementia with Lewy bodies.
Cochrane Database of Systematic Reviews. 2003;
:Issue 3 Art No: CD003672. DOI: 10.1002/14651858.CD003672
-

[22] winblad b,
engedal k,
soininen h,
verhey f,
waldemar g. A 1-year, randomized, placebo-controlled study of donepezil in patients with mild to moderate AD.
Neurology. 2001;
57:489
-495

Olivier Saint-Jean
Service de gériatrie,
Hôpital Européen Georges Pompidou, Paris
Considérations éthiques dans la prise en charge des patients
La personne atteinte de maladie d'Alzheimer évolue souvent de crise en crise émotionnelle et relationnelle. Beaucoup de ces crises pourraient être évitées par une démarche d'anticipation. Une attention quotidienne des proches et des soignants associée à une vision globale de la situation permet souvent d'anticiper les difficultés, et offre au malade un parcours moins heurté, moins violent, moins douloureux et plus paisible.
La fin de vie des patients présentant une démence de type Alzheimer pose des problèmes spécifiques de prise en charge tant physique que psychologique et éthique.
Pour une pratique éthique de gestion des crises
Les crises avec débats éthiques apparaissent lorsque :
• il y a conflit d'intention ou d'intérêt entre la personne âgée malade et ceux qui la prennent en charge ;
• il y a décision à prendre avec des choix qui comportent des risques ;
• il y a incertitude sur le résultat des actions entreprises ;
• il y a contraintes entraînant des privations de liberté ;
• il y a intervention à un coût économique élevé pour des ressources rares ;
• il y a situation d'urgence où l'information est nécessairement incomplète pour prendre des décisions ;
• il y a danger d'isolement voire d'abandon en fin de vie de ces malades lorsque la communication est devenue très difficile.
Le débat éthique fait référence à des valeurs morales. La hiérarchie en est différente pour chaque personne. Elle est liée aux valeurs dominantes de notre société et à l'histoire personnelle de chacun. Le conflit éthique naît d'une tension, voire d'une contradiction entre ces valeurs. Par exemple : liberté/sécurité ; équité/égalité : respect de l'autonomie/protection des faibles...
Lorsque les décisions sont difficiles à prendre, quels sont les acteurs en cause ? Car il s'agit d'une partie qui se joue à plusieurs : le sujet âgé luimême, la famille ou l'entourage, les professionnels, et l'institution soignante ou hébergeante. Le malade lui-même est un sujet âgé fragile et vulnérable avec d'autres pathologies qui s'ajoutent à la maladie d'Alzheimer.
Les situations de crises peuvent être dues à l'évolution de la maladie démentielle, aux pathologies associées, à l'incompréhension devant les agissements du patient, à la compétence insuffisante des intervenants, ou à l'interprétation variable des symptômes par les soignants et les médecins, particulièrement des symptômes douloureux.
Les difficultés importantes surviennent lorsque la personne âgée n'est pas reconnue comme acteur de la décision la concernant, son avis n'étant ni demandé ni recherché. On la considère comme un incapable. Les décisions en période de crise seront d'autant plus difficiles à prendre que l'histoire de vie du malade âgé n'est pas connue. Un manque d'information sur le vécu affectif et relationnel passé, sur les choix antérieurs et les valeurs du malade âgé.
Les crises arrivent d'autant plus facilement que l'histoire familiale comporte des conflits et des ruptures antérieures qui n'ont pas été réparés. Des avis divergents entre les membres de la famille sur les modes de prises en charge ou le choix de vie pour la personne âgée aggravent ces crises. Cela peut survenir par exemple entre le conjoint et les enfants. La situation est fragilisée lorsqu'un soutien insuffisant est apporté à la famille, en particulier s'il s'agit d'un conjoint âgé et lui-même malade. Des abus plus ou moins acceptés par la personne âgée peuvent survenir lorsqu'il y a des conflits d'intérêts financiers entre la personne âgée et ceux qui la prennent en charge.
Dans ces conflits où l'émotionnel devient irrationnel, on balance entre surprotection familiale et à l'inverse abandon familial avec phénomène de deuil anticipé.
L'entourage professionnel manque souvent de temps et de compétences. On fait des choses qu'on n'a pas envie de faire ou qu'on ne devrait pas faire et on ne fait pas des choses qu'on devrait faire ou qu'on voudrait faire. Le plus souvent, les crises surviennent dans un contexte de surcharge de travail avec risque de dérapage. La situation s'aggrave lorsque s'ajoutent insuffisances de compétences gériatriques médicales et paramédicales ou insuffisances de compétences de management du personnel. Dans ces circonstances, il ne faut pas négliger les défauts de contrôle, les projections et les fantasmes face à la vieillesse, à la maladie et à la mort.
Ceci peut conduire à des dérives très délétères voire mortelles... d'autant plus si l'institution lamine les possibilités d'expressions pour les soignants.
Démarche éthique
Dans ces situations de crises (en particulier lorsqu'il s'agit d'un problème de santé), plutôt que des solutions, nous pouvons proposer une démarche éthique pour créer les conditions qui rendront plus facile la résolution dans le sens du respect et de la dignité du malade.
Cette démarche repose sur un trépied de base :
• rendre au malade âgé sa place de sujet âgé à part entière avec son identité propre et son histoire propre. Soulignons l'importance de la qualité de l'écoute sans projection en aidant le sujet à s'exprimer, en cherchant le sens de ses comportements non verbaux ;
• donner du temps au temps. Les urgences qui engagent le pronostic vital sont rares. Ce temps permet de prendre la distance indispensable pour comprendre ce qui se passe, dénouer et apaiser les crises ;
• créer une triangulation. Il est nécessaire d'introduire un tiers, de ne pas s'enfermer dans une relation à deux, où le malade est en position de faiblesse. Ce tiers peut être un psychologue, un médecin consultant extérieur, tout autre référent non impliqué et dont la compétence est reconnue. Il n'est pas souhaitable qu'il soit en position d'autorité hiérarchique et administrative.
Ce trépied étant acquis, la démarche éthique peut ensuite être engagée en 4 temps selon dix critères principaux.
Premier temps : analyse de la situation
• Se rendre auprès du sujet âgé malade pour rechercher ses souhaits, ses choix, ses désirs par ce qu'il en dit et par son comportement non verbal.
• Chercher plus d'informations : sur le sujet âgé, à travers son histoire de vie, ses comportements antérieurs, les valeurs qu'il a manifestées ; sur la maladie elle-même et les maladies associées, leur degré d'évolution, leur pronostic, les possibilités thérapeutiques ; sur le problème actuel. Est-il identifié, accepté et bien compris par les différents acteurs ? La recherche d'informations est un temps fondamental qui peut largement être anticipé par un recueil d'éléments avant que la maladie ne soit à un stade sévère.
• Identifier les problèmes éthiques : quelles sont les valeurs en opposition ? Quels autres conflits sont sous-jacents ? Quels sont les enjeux pour les différents acteurs ?
Deuxième temps : recherche de solutions
• Prendre du recul, trouver un moment et un lieu pour une discussion, à plusieurs, avec la famille, avec les soignants. Cette discussion devrait se faire en présence du malade. Soulignons aussi l'intérêt d'une anticipation, d'une réflexion préalable qui permettra de prendre suffisamment de recul au moment de la crise.
• Être créatif, trouver plusieurs solutions (ou propositions). Une solution unique est une impasse ; deux solutions enferment dans un dilemme de type binaire ; trois solutions permettent un véritable choix et ouvrent souvent vers d'autres possibilités ou une autre issue, une quatrième voire une cinquième solution.
• Vérifier la faisabilité, le coût et la conformité juridique des solutions retenues. Adapter la solution à un contexte qui peut changer.
Troisième temps : prise de décisions
• Prendre une décision et en assumer les conséquences après avoir envisagé en équipe plusieurs possibilités différentes. C'est la responsabilité et le rôle du médecin lorsqu'elle concerne la santé au sens large. Lorsque la décision est lourde et le résultat incertain, il n'est ni juste ni éthique de faire prendre cette décision par la famille. En cas d'échec avec des conséquences dramatiques, elle en porterait ensuite la culpabilité. C'est le devoir et l'honneur du médecin d'assumer cette décision. Parfois aussi, le médecin pourra aider à « délier » un proche d'une promesse faite de « ne jamais placer en institution » ou « de rester toujours à la maison » lorsque cela est devenu intenable.
• Faire connaître et expliquer la proposition retenue ; retourner auprès du malade pour lui en faire-part et rechercher son accord par une vérification verbale et non verbale.
• Laisser des traces écrites de la décision prise et du contexte dans le dossier médical et le dossier de soins. C'est une obligation légale. Ces traces écrites et ces explications sont indispensables pour éviter des décisions contraires qui seraient prises ultérieurement dans un contexte d'urgence par des intervenants non avertis, comme un interne ou un médecin de garde.
Quatrième temps : réévaluation
La décision prise est un choix qui engage et auquel on doit se tenir ; mais il est toujours temporaire et doit être régulièrement revu et réadapté. La date et le moment où la situation sera réévaluée, et où les décisions seront réexaminées, doivent être précisés et également notifiés par écrit.
Cette démarche en quatre temps apporte dans la tempête de ces situations difficiles comme un repère et un phare pour trouver la bonne navigation vers des eaux plus calmes car, comme le disait déjà Sénèque « il n'est pas de vent favorable à celui qui ne sait où il va ».
Mais comme une aventure, le voyage (de la vie) continue et reste toujours un mystère de la personne humaine, comme le dit Emmanuel Levinas « Rencontrer autrui c'est être tenu en éveil par une énigme ».
Accompagnement de fin de vie des personnes âgées démentes : quelques réflexions sur l'humain et l'éthique
1
Texte en partie publié dans la revue JALMALV
En fin de vie, les patients atteints de maladie d'Alzheimer ou d'autres formes apparentées, sont dans des situations d'extrême faiblesse et d'extrême vulnérabilité. Ces fins de vie, souvent longues et difficiles, sont vécues douloureusement par les familles et difficilement par les soignants. À ce stade, les situations d'abandon sont malheureusement assez fréquentes.
Mais, à l'inverse, il est aussi des exemples d'accompagnement de fin de vie remarquable oú la personne, malgré sa maladie, est restituée dans toute sa part d'humanité et où le témoignage des familles nous apprend à quel point ces derniers instants ont été importants, parfois même jusqu'à permettre de panser les blessures que cette maladie et son histoire leur avaient infligées.
Comment comprendre des situations aussi extrêmes et paradoxales ?
Plusieurs éléments font de l'évolution terminale de la maladie d'Alzheimer une situation où la communication devient extrêmement difficile, voire inexistante ce qui, pour certains, fait remettre en cause la persistance d'un sujet chez cet être qui termine sa vie.
En effet, chez les personnes atteintes de démence de type Alzheimer ou des formes apparentées, à un stade avancé de la maladie, la détérioration cérébrale est importante. Elle affecte le fonctionnement intellectuel. Le sujet devient de moins en moins un « sujet pensant ». Il y a perte des fonctions cognitives, en premier lieu de la mémoire en particulier de la mémoire récente, perte du langage qui se déstructure et le sujet devient progressivement mutique, perte des gestes qui permettent la vie quotidienne, le sujet devient de plus en plus apraxique.
Les troubles de la communication, les pertes et les manques apparaissent alors au premier plan avec une dépendance physique et psychique importante.
Le sujet, au premier abord, n'apparaît plus capable de se faire comprendre, de communiquer ses volontés, ses choix ou ses désirs. Il n'apparaît également plus capable de comprendre ce qu'on lui dit ou ce qu'on lui propose. Alors rapidement, dans la vie quotidienne et dans les soins, on parle à sa place, on décide pour lui. C'est un processus de « réification » qui transforme le sujet en objet : objet de soins, objet d'attention dans le meilleur des cas.
Comment un sujet devient-il ainsi un objet ?
L'être humain n'est plus pris dans sa globalité mais il devient le porteur d'une maladie qui l'envahit et l'accable. Sa maladie occupe tout l'espace de la relation. Comme si la lésion neuronale, avec ses dépôts amyloïdes et ses neurofibrilles telle qu'elle apparaît sous le microscope, prenait la place du sujet jusqu'à le définir « c'est un Alzheimer ! ». Le sujet disparaît derrière sa maladie. Les professionnels, médecins et soignants vont mesurer les manques, les déficits et les pertes qui s'installent et tenter de compenser ces pertes en faisant à la place du sujet (toilette, habillage, soins d'hygiène, voire d'alimentation...). Mais cela peut devenir de simples gestes techniques sans s'engager dans une relation avec quelqu'un dont on pense qu'il n'est plus là.
Pour les proches, la famille, c'est plus difficile. L'époux, l'épouse, le frère, la sœ ur, le fils ou la fille, vivent ces situations en les interprétant et en les mettant en comparaison avec ce qu'était cette personne dans le passé, son histoire commune, la vie tissée ensemble autrefois. La communication entre eux est très difficile voire impossible, surtout si on n'a pas aidé les proches à trouver d'autres modes de communication, cela est vécu très douloureusement. Ils ne reconnaissent plus leur parent qui ne correspond plus à l'image de celui qu'on a aimé, avec qui on a partagé des moments de vie. Il y a une trop grande distance entre la personne qui est là et le souvenir de ce qu'elle a été. Souvent, la personne malade de son côté ne reconnaît plus non plus ses proches, les confond entre eux en confondant les générations. Alors, les proches parfois vont faire comme si la personne qu'ils ont connue était déjà morte, plutôt que de la voir dans son état actuel, c'est le phénomène du deuil anticipé.
Ces situations sont renforcées par le long « mourir » car ce sont des gens qui « meurent longtemps », on ne meurt pas directement de la maladie d'Alzheimer. Celle-ci fragilise les malades de plus en plus jusqu'à les rendre grabataires et mutiques. Ils mourront d'une infection intercurrente.
Les bénévoles accompagnants sont dans une situation un peu différente. Ils ne connaissent pas cette histoire passée et n'en sont donc pas affectés. Mais il leur faudra affronter de grandes périodes de silence, des réactions parfois peu compréhensibles. C'est un accompagnement difficile qui demande des grandes qualités d'écoute et de cœ ur.
Engager une démarche éthique
Pour sortir de ces situations délétères et douloureuses, ou mieux pour prévenir ces dérives, que peut-on faire ? Entrer dans une démarche volontaire, affirmer la permanence de l'humain en toute circonstance, même les plus dégradées, faire le pari du sens au-delà d'un apparent non-sens, s'appuyer sur des exemples de fin de vie paisible et même osons le mot « réussie ». Guidé par un certain savoir-faire, on peut créer un « espace relationnel » éclairé par une réflexion éthique.
Quatre principes éthiques
L'éthique est donc fondamentale pour l'accompagnement de fin de vie des patients atteints de maladie d'Alzheimer. Elle sert de boussole dans les situations difficiles et de cadre de soutien dans les conflits. Rappelons-en les quatre principes fondamentaux.
Principe d'humanité et de dignité
Le premier, le principal, est le principe d'humanité inséparable du principe de dignité. Toute personne, quels que soient son état, sa situation et son histoire, a une qualité « d'être humain » qui le fait appartenir de sa naissance à sa mort, tous les jours, en toute circonstance à la communauté des êtres humains. Homme ou femme, il a une dignité propre et inaliénable qui en fait un être unique. Comme l'énonce Kant dans les fondements de la métaphysique des mœ urs : ce qui a une dignité c'est ce qui est supérieur à tout prix et par suite n'admet pas d'équivalence. Cette dignité essentielle de la personne est qualitative et elle ne peut faire l'objet d'aucune quantification, ni comparaison, ni commerce.
En même temps, l'existence de chacun s'incarne dans le temps avec un début et une fin et s'inscrit dans une histoire, la sienne propre en relation à celle de ses contemporains. Cette incarnation donne à chacun son épaisseur humaine. Chacun est le produit de sa propre histoire ; « la vieillesse est un héritage » dit Simone de Beauvoir. Respecter le sujet, c'est considérer l'ensemble des éléments constitutifs de sa personnalité tels qu'ils ont été, tels qu'ils sont encore maintenant présents parfois difficiles à entrevoir. Affirmer la permanence du sujet, c'est prendre en compte ces éléments repérés au travers de l'histoire de vie. Il convient donc de les recueillir et pour la famille d'en porter le témoignage alors qu'on a l'impression qu'ils disparaissent du souvenir.
Ainsi, quel que soit le stade évolutif de sa maladie, cette personne est un être humain unique qui mérite notre attention et notre respect, tout autant pour ce qu'il est aujourd'hui que pour les traces de ce qu'il fut. Le principe de dignité et le principe d'humanité se complètent à deux niveaux : à un premier niveau on insistera davantage sur l'aspect d'humanité, le sujet s'incarne dans son histoire propre en relation avec l'histoire de ses contemporains et de la société où il vit. Mais cette histoire qui lui donne son humanité n'est pas ce qui le rend digne. Cette qualité est indépendante des actes et des attitudes du parcours de vie car à un autre niveau, la dignité et l'humanité sont un absolu hors du temps propre à chacun.
C'est sur le socle de ce principe d'humanité et ce principe de dignité que peuvent s'évaluer les situations et s'engager les actions de soins et d'accompagnement de ces malades.
Principe de solidarité
Le second principe est le principe de solidarité. Selon ce principe, les personnes appartenant à la même communauté humaine sont liées par une responsabilité collective pour s'accorder une aide mutuelle et une obligation de porter assistance à celui qui est atteint par les aléas de la vie. Il s'agit donc d'un principe de civilisation. Il permet de créer le lien social où des actions volontaires et réfléchies ont pour but de corriger les inégalités de la nature. Ce principe est à la base de notre système de santé. Il garantit le droit à chacun à la protection de sa santé et à une prise en charge quel que soit son âge ou son infirmité. Ce principe maintient aussi le lien entre les générations, entre les actifs qui peuvent produire et les inactifs qui ne peuvent plus participer au système de production en raison de leur âge ou de leur maladie. Mais notre société moderne est ambivalente. Elle affirme ses principes de civilisation davantage sur ses performances technologiques que sur le lien qu'elle crée entre ses membres. Évidemment, ces malades peuvent mettre en cause notre société très tournée vers la performance. Il s'agit de personnes qui n'ont plus aucune « utilité sociale », ce qui en terme de rentabilité économique pourrait paraître absurde. La maladie démentielle à un stade avancé constitue donc un véritable enjeu éthique pour notre société en exigeant de maintenir ce lien de solidarité. En effet, au-delà des conditions concrètes de prise en charge et la qualité des soins, la reconnaissance de ces êtres affaiblis par la maladie est précieuse pour maintenir notre humanité dans son entièreté et pour nous protéger des dérives où conduiraient les idoles modernes, culte de la performance, de la compétitivité, culte du corps, culte de la rationalité et culte du libéralisme économique...
Principe d'équité et de justice
Le troisième principe est le principe d'équité et de justice. L'équité et la justice nécessitent pour chaque homme la reconnaissance et le respect de ses droits. Dans le cas particulier de la maladie, cela requiert un accès au soin, au traitement requis, quelle que soit sa situation physique, psychique ou économique et sans discrimination sur l'âge ou le handicap. Cela conduit donc à la vigilance par rapport à l'âgisme. En effet, certaines méthodes diagnostiques, certains soins, certains services sont peu accessibles simplement en raison de l'âge. Ils deviennent inaccessibles si à l'âge s'ajoute une maladie d'Alzheimer. Il faut certainement éviter d'imposer à ces malades des circuits diagnostiques complexes ou des soins lourds s'ils n'en tirent pas ou peu de bénéfice. Il faut certes éviter l'acharnement thérapeutique au grand âge, mais les situations d'abandon et d'exclusion thérapeutique sont beaucoup plus fréquentes que les situations d'acharnement. L'important est de bien poser le problème, de prendre les décisions réfléchies et concertées.
Lorsque ces malades arrivent en fin de vie, il faut apprendre à reconnaître et traiter la douleur chez ces personnes âgées peu communicantes. Pourtant, actuellement encore, lorsqu'on compare les taux de prescriptions antalgiques pour telle ou telle pathologie grave, on constate à un niveau de pathologie identique que les malades ayant en même temps une maladie d'Alzheimer reçoivent moins d'antalgiques. Ce n'est pas que la maladie d'Alzheimer endurcirait face à la souffrance, cela signifie que nous ne savons pas reconnaître la douleur, que nous n'y sommes pas attentifs. Il y a donc tout un travail de formation à faire auprès des médecins mais également auprès des soignants. Des progrès ont été faits, en particulier en mettant à disposition des échelles d'évaluation non verbales de la douleur qui permettent à la fois de mieux apprécier cette douleur mais également de mieux communiquer en équipe pour la prise en charge de ces malades.
Enfin, appliquer le principe d'équité et de justice ne consiste certainement pas à hospitaliser systématiquement ces patients. Mourir à l'hôpital crée souvent des conditions d'une mort difficile pour ces personnes qui arrivent dans des services où les soignants ne sont pas formés à la prise en charge particulière de la maladie d'Alzheimer.
Il y a un apprentissage gériatrique pour apprécier les situations où « ne rien faire » constitue une perte de chance et les situations où au contraire « vouloir faire » se rapproche de l'acharnement thérapeutique. Ce savoir-faire gériatrique doit pouvoir remonter en amont vers les maisons de retraite, vers le domicile pour ne prendre la décision d'un transfert hospitalier qu'à juste titre. Les équipes mobiles gériatriques allant dans les Ehpad
2
Établissement d'hébergement pour personnes âgées dépendantes
, ou au domicile, pourraient aider à ce type d'apprentissage pour des décisions mieux appropriées, d'autant plus qu'actuellement, les Ehpad et les USLD
3
Unité de soins de longue durée
où le personnel est un peu plus nombreux essayent de plus en plus souvent de garder jusqu'à la fin ces patients atteints de maladie d'Alzheimer.
Principe d'autonomie
Enfin, le quatrième principe est le principe d'autonomie. « Autonomos » pour les cités grecques signifiait qu'elles se gouvernaient elles-mêmes, selon les lois qu'elles s'étaient données. Le principe d'autonomie exige que chaque individu puisse gouverner sa vie librement, prendre lui-même les décisions qui concernent aussi bien les grandes orientations de son existence que les actions quotidiennes. Appliquée au domaine de la santé, elle assure la reconnaissance et le respect de la liberté du sujet en particulier, face aux choix thérapeutiques qui peuvent lui être proposés.
Qu'en est-il quand le sujet est réputé incapable de décider ou de choisir, surtout si cela est juridiquement confirmé par une mesure de tutelle ? Quel moyen prend-on alors pour connaître quels peuvent être ses souhaits ou sa volonté ? Comment respecter cette liberté alors que les décisions que nous prenons pour lui, sont importantes car il s'agit souvent de ses conditions d'existence, de son lieu de vie ou de sa fin de vie ?
Deux dispositions législatives récentes permettent de mieux respecter cette volonté du malade en fin de vie pourvu qu'elle ait pu être anticipée et envisagée lorsqu'il avait encore les moyens de s'exprimer. Il s'agit de la loi Kouchner du 4 mars 2002 et de la loi Léonetti du 22 avril 2005. La première permet de désigner une personne de confiance qui pourra s'exprimer au nom du malade et participer aux décisions le concernant. La deuxième admet la possibilité de rédiger des directives anticipées quant aux types de soins que l'on accepterait, que l'on refuserait si on est devenu incapable de s'exprimer le jour où leur nécessité apparaît.
Dans la loi du 4 mars 2002, article 11 : « Information des usagers du système de santé - expression de leur volonté » L'article 1111-6 dit : « Toute personne majeure peut désigner une personne de confiance qui peut être un parent, un proche ou le médecin traitant et qui sera consulté au cas ou elle-même serait hors d'état d'exprimer sa volonté et de recevoir l'information nécessaire à cette fin ». Cette désignation doit être faite par écrit, elle est révocable à tout moment. La loi du 22 avril 2005 relative au droit des malades et à la fin de vie, stipule dans l'article 7 : « Toute personne majeure peut rédiger des directives anticipées pour le cas où elle serait un jour hors d'état d'exprimer sa volonté. Ces directives anticipées indiquent les souhaits de la personne relatifs à sa fin de vie concernant les conditions de la limitation ou l'arrêt du traitement. Elles sont révocables à tout moment ».
Il s'agit là de progrès importants dans le respect de l'autonomie de l'individu malade. Le diagnostic de maladie d'Alzheimer est fait de plus en plus fréquemment à un stade relativement précoce où les capacités cognitives sont suffisamment préservées pour que le malade puisse faire connaître ses volontés pour le futur. Cela suppose une annonce du diagnostic claire, avec un soutien permanent et un suivi régulier pour pouvoir envisager avec le malade l'évolution de sa maladie avec anticipation et l'inciter à désigner sa personne de confiance, voire rédiger les directives anticipées. Ces deux dispositions ne sont pas contradictoires et plutôt complémentaires avec une préférence pour la personne de confiance qui pourra bénéficier des éclairages nécessaires de la part des médecins pour comprendre le problème dans son contexte et participer au dialogue pour toute décision thérapeutique difficile.
En conclusion,
tout effort, tout travail fait pour rejoindre le malade dans son monde, être à son écoute, tenter de communiquer, de comprendre ce qu'il ressent et ce qu'il veut, est une attitude qui va dans le sens du respect et de l'autonomie de la personne.
Devant ces situations de fin de vie chez des malades très fragiles, la démarche éthique demande un engagement et une volonté. Elle reste une aventure. Cette démarche éthique nous invite à entrer dans une démarche de résistance, comme le dit Emmanuel Hirsch, face au rejet économique et social dont sont victimes ces malades très dépendants, et dans une démarche de résistance vis-à-vis de la rigidité et parfois de la maltraitance des institutions.
La démarche éthique est aussi une démarche d'humilité, de reconnaissance et d'acceptation d'une certaine impuissance et de notre propre vulnérabilité face à ces malades très dépendants et parfois déroutants.
La démarche éthique est une démarche d'humanité. Au-delà du handicap psychique et de la dégradation physique qu'il génère, il reste toujours un être humain à part entière, un homme ou une femme qui assume sa part de notre destinée collective dans le malheur d'une maladie très invalidante. Cet homme et cette femme, malgré ou plutôt au-delà de la maladie, ne cessent jamais d'être nos frères en humanité.
La démarche éthique est enfin une démarche d'ouverture vers l'amour audelà de nos compétences professionnelles. En maintenant envers et contre tout son statut d'être humain unique, nous affirmons la complétude de l'être humain dans toutes ses dimensions y compris les plus fragiles. Ce sujet si fragile et déroutant nous invite à une vraie rencontre humaine ; cette rencontre, en nous dépouillant de nos oripeaux professionnels, nous met en présence d'un être humain dans son altérité si différent et si proche, et cette rencontre ou cette reconnaissance fait grandir notre humanité commune.
François Blanchard
Service de médecine interne et gérontologie clinique
CHRU Reims
Aspects juridiques
Comme l'indiquent Sassier et coll. (2001

), « La fabrication de la démocratie se lit aisément à la façon dont les personnes les plus fragiles sont prises en charge et protégées dans toute société ».
Si notre société reconnaît aux personnes handicapées mentales la qualité de citoyen à part entière, en réalité, la démence est malheureusement encore aujourd'hui source d'incompréhension, de marginalisation et d'exclusion.
Ces personnes, dont l'autonomie est réduite, voire inexistante, doivent bénéficier d'un cadre protecteur dans leur propre intérêt et dans l'intérêt de la collectivité tout entière.
Il conviendra donc d'examiner cette protection du patient atteint de démence, comme tous citoyens et les droits fondamentaux qu'il détient, en sa qualité d'usager du système de santé.
Protection juridique du patient atteint de démence
On rappellera en effet qu'il existe trois régimes légaux de protection des « majeurs incapables » dont on brossera rapidement les principales caractéristiques : la sauvegarde de justice, et la curatelle la tutelle.
Sauvegarde de justice
Il s'agit d'une mesure provisoire des personnes dont les facultés mentales sont altérées par une maladie, une infirmité ou un affaiblissement dû à l'âge. Cette mesure est également une mesure d'urgence destinée à protéger la personne, dans l'attente de l'instruction du dossier de tutelle qui peut durer de nombreux mois.
La personne placée sous sauvegarde de justice conserve sa capacité juridique et le plein exercice de ses droits. Toutefois, les actes et engagements qu'elle prend peuvent être rescindés ou réduits (ramenés à de plus justes proportions).
Curatelle
Il s'agit d'une mesure d'assistance à la personne. Le majeur est assisté par un curateur. Cette mesure peut être prononcée dans le cas où « sans être hors d'état d'agir lui-même », le majeur « a besoin d'être conseillé ou contrôlé dans les actes de la vie civile ». Le Code Civil vise l'altération des facultés mentales, la prodigalité (exemple : dépenses somptuaires), l'intempérance (exemple l'alcoolisme, les déviances sexuelles), l'oisiveté, par lesquels le majeur s'expose à tomber dans le besoin ou compromet l'exécution de ses obligations familiales. Il existe plusieurs types de curatelle :
• la curatelle simple : le majeur protégé peut agir seul pour les actes de la vie courante mais il doit être assisté par son curateur pour les actes de disposition (vente, emprunt...) ;
• la curatelle aménagée : le juge définit un certain nombre d'actes autorisés et d'actes interdits sans le concours du curateur ;
• la curatelle renforcée : le curateur va gérer à la place de la personne empêchée et devra rendre compte de sa gestion auprès du juge des tutelles.
Tutelle
La tutelle est la mesure de protection la plus rigoureuse. Il s'agit d'une mesure de représentation. Elle peut être prononcée lorsque le majeur a « besoin d'être représenté d'une manière continue dans les actes de la vie civile ». Elle peut prendre plusieurs formes :
• la tutelle complète : le tuteur prend les décisions tantôt seul (pour les actes de gestion courante), tantôt avec l'autorisation du Conseil de famille (pour les actes de disposition) ;
• l'administration légale sous contrôle judiciaire : l'administrateur a des pouvoirs semblables à celui du tuteur mais au lieu de se faire autoriser par le conseil de famille pour les actes de disposition, il se fait autoriser par le juge des tutelles ;
• la gérance de tutelle : lorsqu'il y a un patrimoine peu important, un gérant de tutelle est nommé (il n'y a pas de tuteur). Il perçoit les revenus du majeur protégé et les applique à l'entretien de celui-ci et à l'acquittement des obligations alimentaires auxquels il est tenu le cas échéant. Pour les autres actes, sauf autorisation exceptionnelle du juge des tutelles, le gérant de tutelle en réfère au juge des tutelles.
Le majeur sous tutelle n'a plus aucune capacité juridique : tous les actes passés par le majeur sous tutelle sont nuls de plein droit (testaments, vente, location...), sauf décision contraire du juge qui peut laisser pour certains actes préalablement déterminés, un espace de liberté au majeur protégé.
Soulignons qu'une réforme des tutelles est actuellement en cours.
Respect des droits fondamentaux : mythe ou réalité pour les patients vulnérables ?
Il existe un certain nombre de droits fondamentaux prévus par les textes (Déclaration universelle des droits de l'homme de 1948, Constitution, Code civil et Code de la santé publique, suite notamment à la loi du 4 mars 2002 sur le droit des patients et sur la qualité du système de santé).
La loi du 4 mars 2002 a justement eu le mérite de regrouper ces textes jusque-là éparpillés et de consacrer légalement des principes dégagés par la jurisprudence quelques années auparavant tout en les complétant.
Parmi ces droits, figurent :
• le droit au respect de la personne ;
• le droit au respect de la vie privée et au secret ;
• le droit à la qualité des soins ;
• le droit à l'information et à l'accès au dossier médical ;
• le droit au respect de la volonté du patient.
Mais, en pratique, comment sont respectés ces droits en cas de démence du patient ? Et surtout, sont-il respectés ?
Droit au respect de la personne
L'article L.1110-2 du Code de la santé publique (CSP) pose le principe selon lequel « la personne malade a droit au respect de sa dignité ».
De ce droit fondamental, découlent d'autres droits tout aussi essentiels parmi lesquels on peut citer notamment l'interdiction de toutes discriminations dans l'accès aux soins (article L. 1110-3 du CSP).
Or, en pratique, on constate que même si des progrès certains ont été réalisés, une discrimination existe néanmoins à l'égard des personnes âgées dépendantes dans l'accès aux soins : diagnostic tardif faute de référents gériatriques disponibles – il faut attendre entre 3 et 6 mois pour obtenir une consultation mémoire à l'hôpital–, refus d'admission par certains EPAHD des « cas lourds » faute de moyens... Finalement, après un « parcours du combattant », le patient déjà très diminué est envoyé à plusieurs dizaines de kilomètres de son domicile (il est « déporté »), loin de son conjoint lui-même âgé qui ne peut souvent pas se déplacer.
Droit au respect de la vie privée et du secret
Le droit au respect de la vie privée est un principe fondamental rappelé par la loi du 4 mars 2002 en ces termes : « Toute personne prise en charge par un professionnel, un établissement, un réseau de santé ou tout autre organisme participant à la prévention et aux soins a droit au respect de sa vie privée et du secret des informations la concernant (...) » (article L.1110-4 du CSP).
Le respect de la vie privée a pour corollaire le secret professionnel.
L'article L 1110-4 du Code de la Santé publique réaffirme ce droit fondamental et en précise le champ d'application : « Excepté dans les cas de dérogation, expressément prévus par la loi, ce secret couvre l'ensemble des informations concernant la personne venues à la connaissance du professionnel de santé, de tout membre du personnel de ces établissements ou organismes et de toute autre personne en relation, de par ses activités, avec ces établissements ou organismes. Il s'impose à tout professionnel de santé, ainsi qu'à tous les professionnels intervenant dans le système de santé ».
Concernant la famille, les proches du patient qui sont souvent les interlocuteurs directs de l'équipe médicale et soignante, des informations concernant le patient peuvent leur être communiquées en cas de diagnostic ou de pronostic grave ou fatal pour apporter un soutien direct au patient, sauf opposition de sa part (article L 1110-4 du CSP).
Une question peut se poser ici : le patient atteint de la maladie d'Alzheimer a-t-il réellement la capacité de s'y opposer, lorsque la maladie est à un stade déjà avancé ? Et s'il s'y oppose, quelle serait la valeur juridique de cette opposition ?
Droit à la qualité des soins
Le droit d'accès à des soins de qualité qui garantissent la meilleure sécurité sanitaire au regard des connaissances médicales avérées est posé par l'article L. 1110-5 du Code de la Santé publique.
Concernant les patients atteints de la maladie d'Alzheimer, on a vu précédemment le retard souvent apporté au diagnostic de la maladie, faute de moyen et parfois... de compétence.
Dans la perspective de soins de qualité, sont notamment visées certaines dispositions de la loi du 22 avril 2005 sur les droits des patients et sur la fin de vie : « ... Ces actes ne doivent pas être poursuivis par une obstination déraisonnable. Lorsqu'ils apparaissent inutiles, disproportionnés ou n'ayant d'autre effet que le seul maintien artificiel de la vie, ils peuvent être suspendus ou ne pas être entrepris. Dans ce cas, le médecin sauvegarde la dignité du mourant et assure la qualité de sa vie en dispensant (les soins palliatifs) ».
De même, est visé au titre des droits fondamentaux, le droit de toute personne de recevoir des soins visant à soulager sa douleur.
Droit à l'information
Le droit à l'information a pour objet l'expression d'un choix : consentir ou refuser les soins.
L'article L. 1111-2 du Code de la santé publique pose le principe de l'obligation d'information et définit son contenu : « Toute personne a le droit d'être informée sur son état de santé. Cette information porte sur les différentes investigations, traitements ou actions de prévention qui sont proposés, leur utilité, leur urgence éventuelle, leurs conséquences, les risques fréquents ou graves normalement prévisibles qu'ils comportent ainsi que sur les autres solutions possibles et sur les conséquences prévisibles en cas de refus ». Cette obligation porte également sur des informations qui pourraient intervenir postérieurement à l'acte.
Cette délivrance de l'information est essentielle en particulier pour le patient dont la maladie a été diagnostiquée à un stade précoce, car cette information va lui permettre de s'organiser, prévoir son avenir, celui de sa famille, de ses proches pendant qu'il est encore temps.
Par ailleurs, l'annonce de la maladie constitue une étape extrêmement importante, car elle conditionne la prise en charge future du patient.
En principe, si le patient destinataire de cette information est placé sous le régime de la tutelle, c'est dans ce cas le tuteur qui doit recevoir l'information (article L.1111-2 CSP). Néanmoins, les patients sous tutelle « ont le droit de recevoir eux-mêmes l'information et de participer à la prise de décision les concernant, d'une manière adaptée (...) à leurs facultés de discernement... » (article L.1111-2 CSP). Le majeur sous tutelle se voit donc associé à la décision médicale.
En pratique, peuvent se poser les questions suivantes, notamment lorsque la maladie est diagnostiquée à un stade déjà avancé : le patient est-il apte à comprendre l'information qui lui est donnée ? Cette information n'entraîne-t-elle pas des risques pour le patient qui est particulièrement vulnérable ?
Il existe certaines exceptions à l'obligation d'information.
D'abord l'urgence ou l'impossibilité d'informer peuvent dispenser les professionnels de santé de cette information. La difficulté ici est de déterminer ce qu'est une « impossibilité d'informer ». L'impossibilité d'informer peut-elle résulter des troubles cognitifs présentés par le patient ? La jurisprudence est à ce jour muette sur ce point.
Par ailleurs, le patient peut refuser d'être informé sur le diagnostic ou le pronostic. Dans ce cas, l'équipe médicale doit respecter sa volonté et le préciser dans le dossier médical. La difficulté sera de déterminer si le patient est apte à opposer un tel refus d'information.
Enfin, comme le prévoyait déjà l'article 35 alinéa 2 du Code de déontologie, il existe une clause de conscience. Le médecin peut dans l'intérêt du patient et pour des raisons légitimes qu'il apprécie en conscience, tenir un patient dans l'ignorance d'un diagnostic ou d'un pronostic grave (sauf en cas de contamination). Ainsi, si le médecin estime que la révélation du diagnostic de la maladie d'Alzheimer ou du pronostic peut avoir des conséquences néfastes graves pour le patient, il a le droit (voire même le devoir) de se taire.
Accès au dossier médical
Depuis la loi du 4 mars 2002, les patients peuvent avoir accès directement à leur dossier médical.
Il existe toutefois des aménagements à cet accès direct. C'est ainsi que si la communication des éléments sans accompagnement peut entraîner des risques pour le patient, le médecin peut recommander la présence d'une tierce personne. Si le patient refuse, le médecin est alors tenu de lui communiquer son dossier médical.
Si ces risques sont d'une particulière gravité, à titre exceptionnel, le médecin peut imposer la présence d'un médecin pour les informations recueillies dans le cadre d'une hospitalisation d'office ou d'une hospitalisation à la demande d'un tiers.
Ainsi, il apparaît surprenant que le patient puisse consulter son dossier médical, sans garde fou véritable, alors qu'il pourrait être tenu dans l'ignorance de son diagnostic par le médecin dans le cadre de la « clause de conscience »...
Droit au respect de la volonté du patient
Le droit au respect de la volonté du patient trouve sa traduction notamment :
• dans le droit d'exprimer un consentement ;
• dans le droit du libre choix de son médecin mais également dans d'autres domaines ;
• dans le droit de désigner une personne de confiance ;
• dans le droit de rédiger des directives anticipées.
Droit d'exprimer un consentement
Le consentement aux soins est le corollaire de l'information.
Ce consentement doit être recueilli auprès du patient. S'il s'agit d'un majeur sous tutelle, ce consentement doit alors émaner du tuteur mais « le consentement (...) du majeur sous tutelle doit être systématiquement recherché s'il est apte à exprimer sa volonté et à participer à la décision » (article L.1111-4 CSP). Le majeur sous tutelle est ainsi associé à la décision médicale le concernant.
Ce consentement doit être « libre et éclairé » et peut être retiré à tout moment (article L. 1111-4 du Code de la santé publique).
S'agissant d'un patient souffrant de troubles cognitifs graves, peut-on réellement parler de consentement « libre et éclairé » ? N'est-ce pas une « imposture » ?... pour reprendre le titre d'un excellent ouvrage intitulé « Le consentement : droit nouveau du patient ou imposture ? » (Caverni et Gori, 2005

).
L'article L.1111-4 du Code de la santé publique précise que « lorsque la personne est hors d'état d'exprimer sa volonté, aucune intervention ou investigation ne peut être réalisée, sauf urgence ou impossibilité, sans que la personne de confiance (...), ou la famille, ou à défaut, un de ses proches ait été consulté ».
Ce même article précise également que « le médecin doit respecter la volonté de la personne après l'avoir informée des conséquences de ses choix. Si la volonté de la personne de refuser ou d'interrompre tout traitement met sa vie en danger, le médecin doit tout mettre en œ uvre pour convaincre d'accepter les soins indispensables... »
Droit du libre choix dans certains domaines
En principe, le patient doit avoir le libre choix de son médecin, de son lieu de vie, mais aussi de conduire...
Concernant le libre choix du médecin, il passe d'abord par le choix de la structure... Or, ce choix qui est important n'est pas libre, compte tenu du nombre insuffisant de lits.
Quant au choix du lieu de vie, on assiste à une certaine « déportation » de la personne âgée de son domicile, faute de solution alternative (un conjoint lui-même âgé qui ne peut plus s'en occuper, des enfants qui ne donnent plus signe de vie, des services de soins à domicile qui ne peuvent répondre à la demande croissante des familles...).
Le libre choix posé par les grands principes du droit se trouve ainsi souvent contrarié pour des raisons tirées du manque de moyens de la filière de soins.
Autre liberté contrariée, cette fois dans l'intérêt du patient : la conduite automobile.
La démence constitue une contre-indication à la conduite automobile (notamment, voir rapport Domont, 2003
1).
Il est en pratique extrêmement difficile pour les équipes médicales de faire « entendre » et admettre à un patient (mais aussi souvent à sa famille) qu'il ne doit plus conduire en raison de son état de santé. Face à une telle situation, les équipes médicales doivent, avec tact – comme elles savent le faire –, convaincre le patient du danger qu'il court pour lui-même et qu'il fait courir aux autres. Il convient également de lui expliquer qu'en cas d'accident, il ne sera pas couvert par sa compagnie d'assurance (l'aspect financier peut parfois être dissuasif...). S'il persiste néanmoins, la famille est alors l’ultime recours. Elle seule peut saisir la Commission médicale départementale compétente ou encore le Préfet. L'équipe médicale, tenue au secret médical, ne peut en aucun cas « dénoncer » le patient aux instances compétentes...
Il existe encore d'autres privations de la liberté, lorsque le patient est sous un régime de tutelle (comme par exemple celui de voter, de se marier...)
Droit de désigner une personne de confiance
Parce que le malade peut craindre, en raison de la nature et de l'évolution de la maladie, qu'il ne pourra plus à un moment donné exprimer sa volonté, le législateur lui offre la possibilité de désigner une personne de confiance qui pourra être consultée et s'exprimer sur les décisions concernant sa santé.
La personne de confiance est une innovation de la loi du 4 mars 2002.
Tout patient majeur, dès lors qu'il n'est pas sous tutelle, peut désigner une personne de confiance qui peut être un proche, un membre de la famille ou le médecin traitant. Cette désignation doit être faite par écrit et est révocable à tout moment par le patient (article L. 1111-6 du CSP).
En cas de tutelle, si le patient a désigné avant sa mise sous tutelle une personne de confiance, le juge des tutelles peut soit confirmer la mission de cette personne de confiance, soit révoquer sa désignation.
La loi du 4 mars 2002 a attribué à la personne de confiance, un double rôle :
• avec l'accord du patient, elle peut l'assister lors de ses démarches et être présente lors de la consultation ;
• si le patient est hors d'état d'exprimer sa volonté, elle doit être consultée.
Depuis la loi du 22 avril 2005 relative aux droits des patients et à la fin de vie, la personne de confiance se voit reconnaître un rôle beaucoup plus important. Il en en effet désormais prévu, qu'elle soit :
• « consultée » lorsque le patient est hors d'état d'exprimer sa volonté dans les cas suivants : en cas de la limitation ou d'arrêt de traitement susceptible de mettre la vie en danger du patient ; en cas de limitation ou d'arrêt d'un traitement inutile, disproportionné ou n'ayant d'autre objet que la seule prolongation artificielle de la vie du patient en phase avancée ou terminale d'une affection grave et incurable ;
• « informée » lorsque le médecin ne peut soulager la souffrance du patient qu'en lui appliquant un traitement qui peut mettre en cause le pronostic vital.
Il faut noter que sauf urgence ou impossibilité, l'avis de la personne de confiance prévaut sur tout autre avis non médical qui serait donné (par exemple, par un membre de la famille ou un proche) dans la décision médicale, à l'exclusion toutefois des directives anticipées du patient qui priment (article L. 1111-12 du CSP).
En pratique, cette personne de confiance devrait être désignée avant un stade avancé de la maladie, car sinon quelle serait la valeur de cette désignation sur le plan juridique ?
Droit de rédiger des directives anticipées
Comme pour la désignation de la personne de confiance, le législateur permet aujourd'hui au patient de « prendre les devants » avant qu'il ne soit trop tard et d'exprimer sa volonté de manière anticipée, en lui accordant le droit de rédiger des directives anticipées.
En effet, depuis la loi du 22 avril 2005, toute personne majeure peut rédiger des directives anticipées pour le cas où elle serait un jour hors d'état d'exprimer sa volonté.
Dans ce document, le patient peut indiquer ses souhaits relatifs à la fin de sa vie concernant les conditions de la limitation ou de l'arrêt d'un traitement éventuel. Ces directives anticipées peuvent être modifiées ou révoquées à tout moment par le patient.
Les conditions de validité de ces directives anticipées ont été précisées par le décret du 6 février 2006. Elles portent sur la durée et sur la forme.
Ainsi, la durée de validité des directives anticipées est de trois ans à compter de leur établissement. Elles peuvent être renouvelées par le patient pour une nouvelle période de trois ans.
Dès lors que ces directives anticipées ont été établies dans le délai de trois ans, précédant soit l'état d'inconscience du patient, soit le jour où il s'est avéré hors d'état d'en effectuer le renouvellement, ces directives demeurent valides quel que soit le moment où elles sont ultérieurement prises en compte.
Comme pour la désignation de la personne de confiance, la rédaction des directives anticipées devrait normalement intervenir avant le stade avancé de la maladie, pour les mêmes raisons.
Compte tenu du délai de validité de ce document, l'équipe médicale devra ainsi veiller à demander tous les trois ans au patient s'il persiste dans ses volontés et dans ce cas, lui demander de renouveler ses directives ou d'établir de nouvelles directives anticipées.
Il apparaît ainsi que la désignation de la personne de confiance et la rédaction des directives anticipées constituent une avancée dans la reconnaissance effective des droits des patients vulnérables. Mais il y a encore beaucoup de progrès à réaliser pour que le respect des droits fondamentaux devienne une réalité pour ces patients captifs d'eux-mêmes.
Dispositions au regard de la recherche biomédicale
Les principaux textes applicables à ce domaine sont : la Directive 2001/20/CE du Parlement européen et du Conseil du 4 avril 2001, la Loi nº 2004-806 du 9 août 2004 et le Décret n° 2006-477 du 26 avril 2006.
Différents points sont à retenir concernant les patients atteints de la maladie d'Alzheimer faisant l'objet d'une protection légale ou étant hors d'état de manifester leur volonté.
En vertu de l'article L.1121-8 du Code de la santé publique (issu de la loi du 9 août 2006), les majeurs protégés ou hors d'état d'exprimer leur consentement ne peuvent être sollicités pour des recherches biomédicales que dans les cas suivants :
• lorsque des recherches d'une efficacité comparable ne peuvent être effectuées sur une autre catégorie ;
• lorsque l'importance du bénéfice escompté pour ces personnes est de nature à justifier le risque prévisible encouru ou lorsque ces recherches se justifient au regard du bénéfice escompté pour d'autres personnes placées dans la même situation. Dans ce dernier cas, les risques prévisibles et les contraintes que comporte la recherche doivent présenter un caractère minimal.
Information
Conformément à l'article L. 122-2 du Code de la santé publique (issu de la loi du 9 août 2006), les majeurs protégés ou les majeurs hors d'état d'exprimer leur consentement et qui ne font pas l'objet d'une mesure de protection juridique reçoivent une information adaptée à leur capacité de compréhension, tant de la part de l'investigateur que des personnes, organes ou autorités chargés de les assister, de les représenter ou d'autoriser la recherche, eux-mêmes informés par l'investigateur. Ils sont consultés dans la mesure où leur état le permet. Leur adhésion personnelle en vue de leur participation à la recherche biomédicale est recherchée. Il ne peut être passé outre à leur refus ou à la révocation de leur acceptation.
Consentement et autorisations
L'article L. 1122-2 du Code de la santé publique distingue le cas où le patient est sous sauvegarde de justice, curatelle ou tutelle ou hors d'état de manifester sa volonté et ne fait l'objet d'aucune mesure de protection. Si le patient est sous sauvegarde de justice, il ne peut être sollicité aux fins de participer à une recherche biomédicale. Si le patient est sous curatelle, le consentement est donné par l'intéressé assisté par son curateur. Toutefois, si le majeur sous curatelle est sollicité en vue de sa participation à une recherche dont le comité de protection des personnes estime qu'elle comporte, par l'importance des contraintes ou par la spécificité des interventions auxquelles elle conduit, un risque sérieux d'atteinte à la vie privée ou à l'intégrité du corps humain, le juge des tutelles est saisi aux fins de s'assurer de l'aptitude à consentir du majeur. En cas d'inaptitude, c'est au juge qu'il appartient de prendre la décision d'autoriser ou non la recherche biomédicale.
Si le patient est sous tutelle, l'autorisation est donnée par son représentant légal et, si le comité de protection des personnes estime que la recherche comporte, par l'importance des contraintes ou par la spécificité des interventions auxquelles elle conduit, un risque sérieux d'atteinte à la vie privée ou à l'intégrité du corps humain, par le conseil de famille s'il a été institué, ou par le juge des tutelles.
Si le patient est hors d'état d'exprimer son consentement et ne fait l'objet d'aucune mesure de protection juridique, l'autorisation est donnée par la personne de confiance, à défaut de celle-ci, par la famille, ou, à défaut, par une personne entretenant avec l'intéressé des liens étroits et stables. Toutefois, si le comité de protection des personnes estime que la recherche comporte, par l'importance des contraintes ou par la spécificité des interventions auxquelles elle conduit, un risque sérieux d'atteinte à la vie privée ou à l'intégrité du corps humain, l'autorisation est donnée par le juge des tutelles.
Bibliographie
[1] caverni jp,
gori r. Le consentement : droit nouveau du patient ou imposture ?.
Paris:Editions In Press;
2005.
210pp.

[2] sassier m,
fossier t,
nogues h,
brovelli g. L’avenir des tutelles.
Paris:Editions Dunod;
2001.
241pp.

[3] collectif acnf (association congrès des notaires de france) . 102
e Congrès des Notaires de France, Strasbourg 21/24 mai 2006, Les personnes vulnérables.
Paris:ACNF;
.
907pp.

Danièle Ganem-Chabenet
Avocat au Barreau de Paris
Missions et perspectives de la Caisse nationale de solidarité pour l’anatomie (CNSA)
La Caisse nationale de solidarité pour l'autonomie (CNSA) est un nouvel établissement public administratif, créé par la loi du 30 juin 2004, et dont la loi sur le handicap du 11 février 2005 précise et renforce les missions :
• financer l'accompagnement de la perte d'autonomie des personnes âgées et des personnes handicapées ;
• garantir l'égalité de traitement sur tout le territoire et pour l'ensemble des handicaps ;
• assurer une mission d'expertise, d'information et d'animation.
La CNSA est à la fois une caisse et une agence. Ses missions font l'objet d'une convention d'objectifs et de gestion conclue avec l'État.
Financer l'accompagnement de la perte d'autonomie des personnes âgées et handicapées
La CNSA rassemble l'essentiel des moyens de l'État et de l'assurance maladie consacrés à l'autonomie des personnes âgées et des personnes handicapées : la contribution solidarité autonomie (journée de solidarité) (2 milliards d'euros), le 0,1 % CSG (1 milliard), la contribution des caisses de retraite (64 millions), les crédits d'assurance maladie destinés aux personnes âgées (4,3 milliards) et aux personnes handicapées (6,6 milliards).
Elle délègue aux départements une partie de ces ressources qui financent ainsi l'Aide pour l'autonomie (APA) destinées aux personnes âgées, (1,4 milliard), la prestation de compensation du handicap (PCH) (500 millions), la création des Maisons départementales des personnes handicapées (MDPH) (20 millions en 2006).
Le reste des crédits est destiné aux établissements et services médico-sociaux, accueillant ou accompagnant des personnes âgées (4,8 milliards) et handicapées (6,8 milliards).
Garantir l'égalité de traitement sur tout le territoire et pour l'ensemble des handicaps
La loi place sous la responsabilité des Conseils généraux l'action de proximité en faveur des personnes privées d'autonomie, et charge la CNSA de veiller au respect de l'égalité de traitement pour toutes les personnes concernées sur l'ensemble du territoire français.
De même, la CNSA doit assurer la répartition équitable entre les départements et régions, des enveloppes financières destinées au fonctionnement des établissements et services médico-sociaux.
Assurer une mission d'expertise, d'information et d'animation
La CNSA accompagne la création, au 1er janvier 2006, des MDPH et exerce un rôle essentiel dans l'animation du réseau des Maisons départementales pour permettre l'échange d'expériences et d'informations entre les départements, diffuser les « bonnes pratiques » d'évaluation individuelle des besoins, favoriser la comparaison des services rendus aux personnes accueillies par les maisons départementales. Elle apporte son expertise pour construire les outils de programmation du financement des établissements et services.
Elle adresse chaque année au Parlement un rapport qui dresse un diagnostic d'ensemble de la perte d'autonomie et des moyens mis en œ uvre. Elle formule toutes les recommandations nécessaires.
Convention d'objectifs et de gestion
Dans le cadre de sa convention d'objectifs et de gestion avec l'État, la CNSA a comme axe général de travail d'améliorer la performance du dispositif institutionnel de prise en charge du handicap et de la perte d'autonomie.
De manière plus spécifique, les axes de travail sont :
• d'élaborer des propositions et diffuser des bonnes pratiques concernant la lutte contre la perte d'autonomie des personnes âgées et handicapées ;
• de contribuer à l'information et au conseil sur les aides humaines et techniques, à leur évaluation, à la qualité des conditions de leur distribution ainsi qu'à leur complémentarité ou substituabilité ;
• de contribuer à l'élaboration d'outils et référentiels de valorisation des besoins individuels de compensation et à l'étude de la convergence des diverses prestations compensant la perte d'autonomie ;
• de promouvoir une réflexion prospective et des programmes de recherche, y compris au plan international, favorisant l'évolution et la modernisation des politiques dans le champ de la gérontologie et du handicap ;
• de s'inscrire dans une stratégie globale de renforcement de la recherche afin de favoriser l'évolution, la modernisation et l'organisation technique des politiques conduites dans le champ de la gérontologie et du handicap.
La CNSA s'engage ainsi à promouvoir le développement d'outils nécessaires à l'accompagnement des politiques menées, notamment à conduire des études et élaborer des propositions :
• sur les outils d'évaluation de la perte d'autonomie ;
• sur les référentiels de coûts et de bonne organisation des établissements et services ;
• sur la solvabilisation et le « reste à charge » des personnes âgées en perte d'autonomie et des personnes handicapées, selon que ces personnes sont à domicile ou en établissement, ainsi que les évolutions pertinentes en matière de tarification des établissements et services médico-sociaux.
Instances
Le conseil de la CNSA (48 membres) réunit les représentants de l'ensemble des acteurs concernés par la perte d'autonomie :
• les associations de personnes handicapées ;
• les associations de personnes âgées (et en particulier France Alzheimer) ;
• les conseils généraux ;
• les organisations syndicales nationales représentatives de salariés et d'employeurs ;
• tous les ministères concernés ;
• le Parlement ;
• ainsi que des personnalités qualifiées et représentants d'institutions intervenant dans les secteurs concernés.
Le conseil scientifique de la CNSA est pluridisciplinaire pour couvrir tous les champs de compétence nécessaires et il est ainsi composé de personnalités qualifiées et de représentants des ministères, des sociétés savantes (Société Française de gériatrie et de gérontologie, Fondation nationale de gérontologie, Sofmer) et des organismes de recherche. On y trouve donc aussi bien des médecins (chirurgiens, gériatres, pédopsychiatres, spécialistes en réadaptation fonctionnelle...), que des experts en démographie, épidémiologie, sociologie, anthropologie et en économie. Chaque année il fournit un avis sur les questions d'ordre scientifique ou technique de l'activité de la CNSA. À la demande du conseil ou du directeur de la CNSA, il fournit des conseils et avis sur des questions particulières d'ordre scientifique ou technique.
Autres moyens d'intervention
La CNSA dispose d'un budget (section IV) qui lui permet de promouvoir des actions innovantes et de renforcer la professionnalisation des métiers de service en faveur des personnes âgées. Ce budget lui permet de financer des dépenses de modernisation des services ou de professionnalisation des métiers qui apportent au domicile des personnes âgées dépendantes une assistance dans les actes quotidiens de la vie, ainsi que des dépenses de formation et de qualification des personnels soignants recrutés dans le cadre des mesures de médicalisation des établissements et services mentionnés au paragraphe 3 de l'article L.314-3-1. Récemment, des moyens additionnels ont été accordés pour financer le même type d'actions dans le champ des personnes en situation de handicap.
Elle dispose aussi d'une autre section budgétaire (section V) qui lui permet de financer d'autres dépenses en faveur des personnes handicapées et des personnes âgées dépendantes, et notamment des dépenses d'animation et de prévention et les frais d'étude dans les domaines d'action de la caisse.
Recherche et innovation
Les champs d'investigation peuvent se décliner selon 3 dimensions :
• celle des personnes et de leurs besoins, au niveau individuel et au niveau collectif ;
• celle de l'offre proposée avec les aides humaines, les aides techniques, les structures médico-sociales, le logement et l'accessibilité des lieux... ;
• celle des modes d'accompagnement et de coordination, intégrant les dimensions sanitaire, médico-sociale et sociale, examinés de manière pluridisciplinaire (sociologique, psychologique, organisationnelle, économique...).
Par ailleurs la CNSA s'inscrit dans une dynamique d'amélioration continue des réponses apportées aux personnes et des dispositifs d'accompagnement. Celle-ci peut être décomposée en quatre volets :
• un premier volet pour réunir les connaissances nécessaires à l'analyse des écarts et des dysfonctionnements. Ces informations doivent être aussi un moyen d'objectiver les débats ;
• un second volet pour proposer de nouvelles solutions et pour les tester avec méthode ;
• un troisième volet pour mettre en œ uvre de manière opérationnelle les solutions éprouvées ;
• enfin un volet pour évaluer, identifier les améliorations possibles et démultiplier.
Ceux-ci s'appuient à la fois sur l'utilisation optimisée des systèmes d'information, sur les études et les actions innovantes développées dans le cadre de la section V décrite ci-dessus et sur les actions conduites sous l'égide du conseil scientifique de la CNSA.
Concernant la personne et ses besoins
Concernant la dimension de la personne et ses besoins, au niveau individuel, une commission du conseil scientifique travaille sur la question de l'évaluation des besoins des personnes. Les objectifs de cette commission sont :
• de finaliser l'état des lieux sur les systèmes d'évaluation existants et leurs caractéristiques spécifiques ;
• d'élaborer un plan de formation des acteurs de terrain ;
• de définir un cahier des charges générique pour les systèmes d'évaluation sur la qualité de la mesure, sur les conditions de l'expérimentation, sur les principes et les champs couverts par le système d'évaluation.
La question des personnes atteintes de la maladie d'Alzheimer et des personnes en situation de handicap psychique est analysée plus particulièrement.
Des études sont aussi prévues dans le cadre de la section V pour mieux connaître la situation des personnes privées d'autonomie (attentes et besoins, écarts entre les évaluations et les aides, frais réels rapportés à la prise en charge collective...). Un référentiel pour le processus de choix des personnes âgées à l'entrée en institution est en cours d'élaboration en lien avec le Conseil national d'évaluation sociale et médico-sociale. Il est prévu aussi de conduire une enquête prospective et rétrospective dans la population générale (personnes âgées, entourage) sur les choix de vie domicile/institution.
Concernant les personnes et leurs besoins au niveau collectif, une autre commission du Conseil scientifique a travaillé à identifier les questions principales que se pose la CNSA pour le pilotage de son action et à voir comment y répondre par les enquêtes existantes, l'enquête Handicap santé qui est en train d'être montée par la Drees et l'Insee et le système d'information des MDPH en cours de construction. La question de la collecte d'information pour les personnes atteintes de la maladie d'Alzheimer et pour leurs aidants a été étudiée en particulier.
Il est envisagé aussi de conduire, dans le cadre de la section V, des études épidémiologiques pour mieux connaître les populations en situation de dépendance, avec peut-être la mise en place de cohortes et étude sur la migration des personnes âgées après 65 ans.
Il est à noter que les programmes interdépartementaux d'accompagnement des handicaps et de la perte d'autonomie (PRIAC) qui consistent en une remontée des besoins de structures à partir des exercices de planification interdépartementaux et qui ont été élaborés pour la première fois en 2006, sont une source d'information précieuse pour préciser les besoins au niveau collectif.
Concernant l'offre proposée
Concernant l'offre proposée en aide humaine, outre la promotion d'actions innovantes et le renforcement de la professionnalisation dans le domaine des métiers de service prévus dans le cadre de la section IV, le conseil scientifique a mis dans ses priorités la question des aidants informels pour laquelle de grandes études pluridisciplinaires devraient être soutenues.
Suite à la conférence de la famille de juillet 2006, il est prévu de conduire des actions de sensibilisation, d'accompagnement et de formation des aidants informels. Ainsi des outils pourraient être créés pour les familles, comme un cahier regroupant tous les textes qui les concernent (congé familial, formation, professionnalisation/VAE). Des formations sous forme de rencontres sur des thèmes spécifiques pourraient être organisées. Il est prévu aussi l'élaboration de référentiels sur les bonnes conduites à tenir auprès des personnes âgées avec détérioration intellectuelle (maladie d'Alzheimer et troubles apparentés) avec des supports adaptés aux différents publics.
Pour une meilleure connaissance et évaluation des aides techniques et de leurs marchés, une « métabase », site Internet pour faciliter l'accès à l'information relative aux appareillages et aides techniques disponibles sur le marché, est en cours de création.
Une étude sur les nouvelles technologies pour la santé et pour l'autonomie est en cours avec l'Agence nationale de la recherche. Elle a pour objectifs d'élaborer un scénario français et de faire des propositions pour améliorer l'accompagnement du transfert des technologies et leur diffusion vis-à-vis en particulier des industriels et des MDPH.
La création de centres d'expertise technique spécialisés est à l'étude. On pourrait imaginer que l'un d'eux soit dévolu aux aides techniques et aménagements pour les malades atteints de la maladie d'Alzheimer (Exemple : aide à la stimulation cognitive et à la mémoire, au repérage...)
Concernant les structures médico-sociales et le logement, des études sont prévues sur la mesure de l'efficience, portant notamment sur la tarification, avec une attention particulière à la prise en charge des frais de transport (en particulier pour les accueils de jour).
Une étude en partenariat avec la Direction générale des affaires sociales (DGAS) et la Direction de la Sécurité sociale est en cours sur l'amélioration de la qualité dans les maisons de retraite, dans le cadre du renouvellement des conventions tripartites parvenues à échéance en 2006.
Enfin un appel d'offres pour des accueils de jour et gardes itinérantes de nuit est en cours avec la DGAS (sur la base d'un guide de réflexion de la Fondation Médéric Alzheimer).
Par ailleurs, des études sont en cours conduisant à des référentiels sur l'adaptation des espaces de vie au grand âge (habitats individuels, hébergements collectifs incluant les maisons de retraite ou EHPAD) pour déboucher sur des actions opérationnelles dans le cadre d'un programme architectural expérimental pour la réalisation de structures d'accueil pour personnes âgées d'un type nouveau. Sont aussi en cours de préparation des guides destinés aux gestionnaires d'EHPAD, par exemple sur « l'appréciation de la qualité d'usage des espaces » (partenariat : DGAS, Cridev) ; ou sur «la configuration des bâtiments et confort d'été » (partenariat : DGAS et Ademe).
D'autre part, un groupe de travail prospectif du conseil, baptisé « du projet de vie au lieu de vie » pour sortir de l'alternative domicile/établissement, analyse des solutions innovantes de logement et d'accompagnement (petites unités de vie, regroupements intergénérationnels...). Dans ce domaine, une recherche-action, en partenariat avec la Fondation de France et la DGAS, est en cours sur de nouvelles formes d'habitat collectif accompagné pour personnes âgées et devrait déboucher sur un cahier des charges pour la réalisation d'un programme architectural.
Accompagnement et coordination des actions
Dans le domaine des modes d'accompagnement et de coordination, le nombre de structures et d'acteurs impliqués étant très important (Hôpital, maison de retraite, accueil de jour, CLIC (Centres locaux d'information et de coordination gérontologique), médecins généralistes, services d'aides à domiciles, équipes médico-sociales, réseau gérontologique...), toute solution permettant de mieux coordonner les différentes actions et d'accompagner la personne est la bienvenue. Dans ce cadre, une étude « gestionnaire de cas Prisma France » est en cours avec l'hôpital européen Georges Pompidou et la Direction générale de la santé dans le 20e arrondissement de Paris, dans la Somme et en Alsace.
Il est vraisemblable que les besoins de coordination et d'accompagnement feront émerger de nouveaux métiers.
Dans l'avenir, on peut imaginer que pour les personnes âgées dépendantes, comme pour les personnes en situation de handicap, il y ait mise en place d'un processus plus intégré (accueil, évaluation, suivi). Certains départements ont déjà commencé à aller dans cette voie en articulant Clic et MDPH.
En conclusion,
il faut rappeler la convergence (inscrite dans la loi pour 2010 pour les prestations) entre les personnes handicapées et les personnes âgées dépendantes. C'est dans cette perspective que la CNSA fonctionne de manière transversale entre les deux champs personnes âgées dépendantes et personnes handicapées. Par ailleurs, étant donné les enjeux et l'ampleur de la tâche, la CNSA travaille dans le cadre de nombreux partenariats aussi bien avec les services de l'État, les conseils généraux, les associations, les organismes de recherche, les structures de protection sociale... Enfin, la complexité des questions abordées nécessite de dépasser certains cloisonnements et de travailler de plus en plus dans un contexte interdisciplinaire.
Marie-Aline Bloch
Directeur scientifique de la Caisse nationale de solidarité pour l'autonomie (CNSA)
Paris
 ). Des règles d'évaluation des effets d'un médicament destiné au traitement de la maladie d'Alzheimer ont été proposées par un certain nombre d'experts et ont abouti à l'élaboration de règles standard de procédures ou « guidelines », préconisées par les différentes agences d'enregistrement pour l'établissement de l'efficacité d'une nouvelle substance.
). Des règles d'évaluation des effets d'un médicament destiné au traitement de la maladie d'Alzheimer ont été proposées par un certain nombre d'experts et ont abouti à l'élaboration de règles standard de procédures ou « guidelines », préconisées par les différentes agences d'enregistrement pour l'établissement de l'efficacité d'une nouvelle substance. ), ont été construites dans le but de mettre en évidence chez des patients présentant une maladie d'Alzheimer, un effet essentiellement cognitif d'un traitement considéré comme symptomatique. Cet effet doit par ailleurs s'accompagner, pour être pertinent, d'un effet positif global et d'un retentissement sur les activités de la vie au quotidien. L'impact ou plutôt l'effet sur les manifestations comportementales a été partiellement occulté, bien que celles-ci soient actuellement au cœ ur d'un grand nombre d'essais. Selon les recommandations de l'EMEA, l'efficacité d'un produit pour le traitement de la maladie d'Alzheimer devait être démontrée dans deux études, sur les aspects cognitifs, fonctionnels globaux de la maladie et sur l'activité quotidienne des patients. Ces recommandations sont actuellement en cours de révision, notamment sur trois points : le diagnostic différentiel des démences, l'inclusion de patients (et le problème de leur évaluation) à des stades très précoces de la maladie et les essais de prévention ou d'arrêt de la maladie.
), ont été construites dans le but de mettre en évidence chez des patients présentant une maladie d'Alzheimer, un effet essentiellement cognitif d'un traitement considéré comme symptomatique. Cet effet doit par ailleurs s'accompagner, pour être pertinent, d'un effet positif global et d'un retentissement sur les activités de la vie au quotidien. L'impact ou plutôt l'effet sur les manifestations comportementales a été partiellement occulté, bien que celles-ci soient actuellement au cœ ur d'un grand nombre d'essais. Selon les recommandations de l'EMEA, l'efficacité d'un produit pour le traitement de la maladie d'Alzheimer devait être démontrée dans deux études, sur les aspects cognitifs, fonctionnels globaux de la maladie et sur l'activité quotidienne des patients. Ces recommandations sont actuellement en cours de révision, notamment sur trois points : le diagnostic différentiel des démences, l'inclusion de patients (et le problème de leur évaluation) à des stades très précoces de la maladie et les essais de prévention ou d'arrêt de la maladie. ) ou de l'International Classification of Disease 10 (ICD-10) pour lesquels semblent exister une concordance entre eux, une bonne validité et reproductibilité inter-juge dans le cadre de la maladie d'Alzheimer, du moins pour les critères du DSM ;
) ou de l'International Classification of Disease 10 (ICD-10) pour lesquels semblent exister une concordance entre eux, une bonne validité et reproductibilité inter-juge dans le cadre de la maladie d'Alzheimer, du moins pour les critères du DSM ; ). Même s'il existe une standardisation internationale des critères diagnostiques, le diagnostic de certitude de la maladie d'Alzheimer ne peut pas se faire du vivant du patient ; il reste donc un diagnostic d'exclusion des autres types de démence et même au sein des centres experts, la fiabilité de la détection de la maladie d'Alzheimer n'excède pas 85 %.
). Même s'il existe une standardisation internationale des critères diagnostiques, le diagnostic de certitude de la maladie d'Alzheimer ne peut pas se faire du vivant du patient ; il reste donc un diagnostic d'exclusion des autres types de démence et même au sein des centres experts, la fiabilité de la détection de la maladie d'Alzheimer n'excède pas 85 %. ). Il explore de façon très rapide la mémoire, l'orientation, le langage, et les praxies constructives. Il est utilisé à la fois comme outil de diagnostic de démence, de maladie d'Alzheimer, et comme critère d'inclusion (sévérité) et d'efficacité. Ses inconvénients sont sa qualité métrologique faible, la dégradation non linéaire dans le temps, sa sensibilité au langage, sa non spécificité avec un effet plafond (maladie d'Alzheimer au stade léger) ou plancher (maladie d'Alzheimer au stade sévère). Par ailleurs, si le seuil de 10 est généralement retenu pour séparer les démences modérées des sévères, celui pour séparer démence modérée et légère varie selon les auteurs.
). Il explore de façon très rapide la mémoire, l'orientation, le langage, et les praxies constructives. Il est utilisé à la fois comme outil de diagnostic de démence, de maladie d'Alzheimer, et comme critère d'inclusion (sévérité) et d'efficacité. Ses inconvénients sont sa qualité métrologique faible, la dégradation non linéaire dans le temps, sa sensibilité au langage, sa non spécificité avec un effet plafond (maladie d'Alzheimer au stade léger) ou plancher (maladie d'Alzheimer au stade sévère). Par ailleurs, si le seuil de 10 est généralement retenu pour séparer les démences modérées des sévères, celui pour séparer démence modérée et légère varie selon les auteurs. ) à l'exception des études incluant des patients avec démences sévères. Cette échelle spécifique (en fait qui explore surtout mémoire et langage) et sensible au changement est considérée comme un « gold standard », tout au moins dans les essais à traitement « symptomatique », pour l'évaluation de l'efficacité, dans une partie importante d'un protocole qu'est le calcul du nombre de patients et comme facteur pronostique, la sévérité du score de baseline étant corrélé au déclin cognitif. Mais elle ne permet pas l'évaluation des deux pôles extrêmes de la maladie (stades sévères ou très précoces), a une faible qualité métrologique, est parfois inutilisable (troubles du langage) ou non analysable du fait de valeurs manquantes à des sous-scores. Doit être discutée aussi la significativité clinique de l'amélioration du score à 6 mois de 4 points, cut-off fixé par la FDA en 1990 pour les essais Tacrine et repris depuis dans toutes les analyses de répondeurs.
) à l'exception des études incluant des patients avec démences sévères. Cette échelle spécifique (en fait qui explore surtout mémoire et langage) et sensible au changement est considérée comme un « gold standard », tout au moins dans les essais à traitement « symptomatique », pour l'évaluation de l'efficacité, dans une partie importante d'un protocole qu'est le calcul du nombre de patients et comme facteur pronostique, la sévérité du score de baseline étant corrélé au déclin cognitif. Mais elle ne permet pas l'évaluation des deux pôles extrêmes de la maladie (stades sévères ou très précoces), a une faible qualité métrologique, est parfois inutilisable (troubles du langage) ou non analysable du fait de valeurs manquantes à des sous-scores. Doit être discutée aussi la significativité clinique de l'amélioration du score à 6 mois de 4 points, cut-off fixé par la FDA en 1990 pour les essais Tacrine et repris depuis dans toutes les analyses de répondeurs. ; Bullock et coll., 2005
; Bullock et coll., 2005 ) ou le SKT (Syndrom Kurztest ; Overall et coll., 1992
) ou le SKT (Syndrom Kurztest ; Overall et coll., 1992 ) sont d'utilisation plus occasionnelle, essentiellement en cas de démence sévère pour la SIB tenant compte des spécificités comportementales et cognitives de ces patients.
) sont d'utilisation plus occasionnelle, essentiellement en cas de démence sévère pour la SIB tenant compte des spécificités comportementales et cognitives de ces patients. ; Starkstein et coll., 2006a
; Starkstein et coll., 2006a et b
et b ). Cette recherche est pourtant primordiale pour la compréhension et le démembrement des effets cognitifs des anti cholinestérasiques.
). Cette recherche est pourtant primordiale pour la compréhension et le démembrement des effets cognitifs des anti cholinestérasiques. ) ou la Global Dementia Scale (GDS ; Reisberg et coll., 1982
) ou la Global Dementia Scale (GDS ; Reisberg et coll., 1982 ), tiennent compte à la fois des déficits cognitifs et des activités de la vie quotidienne.
), tiennent compte à la fois des déficits cognitifs et des activités de la vie quotidienne. ) ou la Clinical Global Impression of Changes (CGIC), dérivée de la première et où l'entretien et la cotation sont libres (même variables d'un essai à l'autre), source de grande variabilité ;
) ou la Clinical Global Impression of Changes (CGIC), dérivée de la première et où l'entretien et la cotation sont libres (même variables d'un essai à l'autre), source de grande variabilité ; ; AD Cooperative study-Clinical Global Impression of Change : ADCS-CGIC, Schneider et coll., 1996
; AD Cooperative study-Clinical Global Impression of Change : ADCS-CGIC, Schneider et coll., 1996 et 2006
et 2006 ) reposant sur l'appréciation du clinicien ont été développées à la demande des agences d'enregistrement (FDA) qui désiraient que l'éventuel effet noté sur les différents tests cognitifs puisse être dépisté par un clinicien indépendant et « aveugle » de ces résultats. Les procédures (évaluation, entretiens structurés) diffèrent d'une échelle à l'autre, faisant intervenir ou non l'aidant. Pour les deux dernières, le jugement du clinicien (expert de la maladie, entraîné et le même pendant tout l'essai) doit se faire selon un entretien semi-dirigé et à l'aide d'une cotation définie (fonctions cognitives, comportementales, ADL4
et état général), sans connaissance des performances cognitives mais avec une bonne appréciation de la sévérité de la maladie et selon 7 points d'ancrage (4 : état inchangé ; >4 : aggravation ; <4 : amélioration). Ces évaluations sont toujours retrouvées dans les essais, présentées de façon dichotomique (amélioration ou inchangé versus aggravation) ou quantitative pouvant même devenir le critère principal (démence sévère, effet des antipsychotiques ou autres psychotropes).
) reposant sur l'appréciation du clinicien ont été développées à la demande des agences d'enregistrement (FDA) qui désiraient que l'éventuel effet noté sur les différents tests cognitifs puisse être dépisté par un clinicien indépendant et « aveugle » de ces résultats. Les procédures (évaluation, entretiens structurés) diffèrent d'une échelle à l'autre, faisant intervenir ou non l'aidant. Pour les deux dernières, le jugement du clinicien (expert de la maladie, entraîné et le même pendant tout l'essai) doit se faire selon un entretien semi-dirigé et à l'aide d'une cotation définie (fonctions cognitives, comportementales, ADL4
et état général), sans connaissance des performances cognitives mais avec une bonne appréciation de la sévérité de la maladie et selon 7 points d'ancrage (4 : état inchangé ; >4 : aggravation ; <4 : amélioration). Ces évaluations sont toujours retrouvées dans les essais, présentées de façon dichotomique (amélioration ou inchangé versus aggravation) ou quantitative pouvant même devenir le critère principal (démence sévère, effet des antipsychotiques ou autres psychotropes). ) (Instrumental Activities of Daily Living) comportant 8 items : utilisation du téléphone, transports, gestion des finances, prise des médicaments, faire les courses, repas, entretien de la maison, lessive. Ces deux sous-échelles, non spécifiques de la maladie d'Alzheimer, sont robustes, résistantes au changement et sexe dépendantes. Leur intérêt se résume plus dans leur valeur de dépistage d'une pathologie cognitive démentielle sans préjuger du diagnostic ; la nécessité d'une aide du fait des troubles cognitifs aux différents items de l'IADL (plus particulièrement téléphone, transports, prise des médicaments, gestion des finances) constitue un retentissement significatif de ces troubles sur l'activité quotidienne.
) (Instrumental Activities of Daily Living) comportant 8 items : utilisation du téléphone, transports, gestion des finances, prise des médicaments, faire les courses, repas, entretien de la maison, lessive. Ces deux sous-échelles, non spécifiques de la maladie d'Alzheimer, sont robustes, résistantes au changement et sexe dépendantes. Leur intérêt se résume plus dans leur valeur de dépistage d'une pathologie cognitive démentielle sans préjuger du diagnostic ; la nécessité d'une aide du fait des troubles cognitifs aux différents items de l'IADL (plus particulièrement téléphone, transports, prise des médicaments, gestion des finances) constitue un retentissement significatif de ces troubles sur l'activité quotidienne. ) ou GDS-FAST (échelle hiérarchique cotant 16 stades de détérioration depuis le normal, utilisée par des structures spécialisées), la Progressive Disease Scale (de Jong, 1989
) ou GDS-FAST (échelle hiérarchique cotant 16 stades de détérioration depuis le normal, utilisée par des structures spécialisées), la Progressive Disease Scale (de Jong, 1989 ) ou PDS (où l'évaluation est réalisée à partir d'échelles analogiques visuelles remplies par la personne aidante pour les activités de la vie quotidienne), l'Interview for Deterioration in Daily Living in Dementia (Teunisse et coll., 1991
) ou PDS (où l'évaluation est réalisée à partir d'échelles analogiques visuelles remplies par la personne aidante pour les activités de la vie quotidienne), l'Interview for Deterioration in Daily Living in Dementia (Teunisse et coll., 1991 ) ou IDDD (permettant de faire la distinction entre l'initiative et les performances), la Disability Assessment Dementia (Gelinas et coll., 1999
) ou IDDD (permettant de faire la distinction entre l'initiative et les performances), la Disability Assessment Dementia (Gelinas et coll., 1999 ) ou DAD (son intérêt par rapport aux autres IADL réside en la subdivision de chaque fonction en 3 parties : initiation, programmation et réalisation), ou des outils de mesure récents et adaptés au stade sévère tels que l'Alzheimer's Disease Cooperative Study Activities of Daily Living Severe scale (ADCS-ADL ; Galasko et coll., 2000
) ou DAD (son intérêt par rapport aux autres IADL réside en la subdivision de chaque fonction en 3 parties : initiation, programmation et réalisation), ou des outils de mesure récents et adaptés au stade sévère tels que l'Alzheimer's Disease Cooperative Study Activities of Daily Living Severe scale (ADCS-ADL ; Galasko et coll., 2000 ) ont été diversement utilisés soit dans des essais thérapeutiques ou lors du suivi prospectif dans des études cliniques d'histoire naturelle de la maladie.
) ont été diversement utilisés soit dans des essais thérapeutiques ou lors du suivi prospectif dans des études cliniques d'histoire naturelle de la maladie. ).
). ). La NPI a été mise au point pour des patients atteints de la maladie d'Alzheimer et d'autres formes de démence, mais est largement utilisée pour apprécier les changements de comportement dans d'autres pathologies. Les informations permettant d'établir ce bilan peuvent être recueillies à l'aide d'un entretien structuré auprès de l'aidant, du personnel soignant (CGA-NPI, NPI-Q, NPI-NH5
) mais aussi du patient (Kang et coll., 2004
). La NPI a été mise au point pour des patients atteints de la maladie d'Alzheimer et d'autres formes de démence, mais est largement utilisée pour apprécier les changements de comportement dans d'autres pathologies. Les informations permettant d'établir ce bilan peuvent être recueillies à l'aide d'un entretien structuré auprès de l'aidant, du personnel soignant (CGA-NPI, NPI-Q, NPI-NH5
) mais aussi du patient (Kang et coll., 2004 ). Son intérêt est manifeste, appréciant l'existence, la sévérité d'un certain nombre de symptômes comportementaux (apathie, dépression, anxiété, euphorie, désinhibition, dysphorie, sommeil, appétit, hallucinations, délire, comportement moteur aberrant, irritabilité) et le retentissement de cette symptomatologie sur l'aidant. Mais cette échelle de passation longue, non linéaire, quantifie des manifestations comportementales plutôt que des symptômes ressentis, nécessite une habitude des entretiens psychiatriques et ne semble pas corrélée aux troubles cognitifs.
). Son intérêt est manifeste, appréciant l'existence, la sévérité d'un certain nombre de symptômes comportementaux (apathie, dépression, anxiété, euphorie, désinhibition, dysphorie, sommeil, appétit, hallucinations, délire, comportement moteur aberrant, irritabilité) et le retentissement de cette symptomatologie sur l'aidant. Mais cette échelle de passation longue, non linéaire, quantifie des manifestations comportementales plutôt que des symptômes ressentis, nécessite une habitude des entretiens psychiatriques et ne semble pas corrélée aux troubles cognitifs. ).
). ; Harwood et coll., 1998a
; Harwood et coll., 1998a ) ou non de la maladie d'Alzheimer (Behavioral Rating Scale for Dementia : BRSD, Mack et coll., 1999
) ou non de la maladie d'Alzheimer (Behavioral Rating Scale for Dementia : BRSD, Mack et coll., 1999 ) ou explorant des axes précis comme la dépression (Geriatric Depression Scale : GDS, Yesavage et coll., 1983
) ou explorant des axes précis comme la dépression (Geriatric Depression Scale : GDS, Yesavage et coll., 1983 ; Cornell scale : Alexopoulos et coll., 1988
; Cornell scale : Alexopoulos et coll., 1988 ; Harwood et coll., 1998b
; Harwood et coll., 1998b ), l'anxiété (Starkstein et coll., 2007
), l'anxiété (Starkstein et coll., 2007 ), l'agitation (Cohen Mansfield agitation inventory : Cohen-Mansfield, 1986
), l'agitation (Cohen Mansfield agitation inventory : Cohen-Mansfield, 1986 ) par exemple. Leur sensibilité au changement est assez mal connue, leur étude ayant le plus souvent été effectuée sur des populations assez hétérogènes, tant dans le diagnostic que dans la sévérité de la symptomatologie démentielle.
) par exemple. Leur sensibilité au changement est assez mal connue, leur étude ayant le plus souvent été effectuée sur des populations assez hétérogènes, tant dans le diagnostic que dans la sévérité de la symptomatologie démentielle. ) est un auto-questionnaire destiné à évaluer le « fardeau » représenté par la prise en charge familiale d'un parent dément vivant à domicile. Elle permet de mettre en évidence le degré d'épuisement ou d'usure psychologique des aidants familiaux. Le questionnaire Ressource Utilization in Dementia (RUD, Wimo et coll., 2000
) est un auto-questionnaire destiné à évaluer le « fardeau » représenté par la prise en charge familiale d'un parent dément vivant à domicile. Elle permet de mettre en évidence le degré d'épuisement ou d'usure psychologique des aidants familiaux. Le questionnaire Ressource Utilization in Dementia (RUD, Wimo et coll., 2000 ) permet d'estimer le temps quotidien moyen que passe l'aidant à s'occuper du patient. Elles peuvent permettre et font souvent partie des évaluations socioéconomiques (Feldman et coll., 2004
) permet d'estimer le temps quotidien moyen que passe l'aidant à s'occuper du patient. Elles peuvent permettre et font souvent partie des évaluations socioéconomiques (Feldman et coll., 2004 ; Sano et coll., 2006
; Sano et coll., 2006 ) dans lesquelles interviennent le coût de la maladie (direct et indirect) chez le patient et l'aidant, les coûts des traitements et l'impact socio-familial, mais aussi, du moins pour l'aidant, d'une ébauche de l'évaluation de la qualité de vie (Takeda et coll., 2006
) dans lesquelles interviennent le coût de la maladie (direct et indirect) chez le patient et l'aidant, les coûts des traitements et l'impact socio-familial, mais aussi, du moins pour l'aidant, d'une ébauche de l'évaluation de la qualité de vie (Takeda et coll., 2006 ; Thomas et coll., 2006
; Thomas et coll., 2006 ).
). ). Elles concernent plus particulièrement l'impact des thérapeutiques non médicamenteuses sur la prise en charge du patient et l'évolutivité de la maladie (Suh et coll., 2004
). Elles concernent plus particulièrement l'impact des thérapeutiques non médicamenteuses sur la prise en charge du patient et l'évolutivité de la maladie (Suh et coll., 2004 ; Kotynia-English et coll., 2005
; Kotynia-English et coll., 2005 ) mais aussi l'évaluation des besoins (Client Service Receipt Inventory) tant du patient, du conjoint (Lingler et coll., 2005
) mais aussi l'évaluation des besoins (Client Service Receipt Inventory) tant du patient, du conjoint (Lingler et coll., 2005 ) que de la société pour faire face à ces pathologies, l'évaluation des pratiques médicales (collaborative care) de la prise en charge (Ballard et Fox, 2006
) que de la société pour faire face à ces pathologies, l'évaluation des pratiques médicales (collaborative care) de la prise en charge (Ballard et Fox, 2006 ) et la mise au point d'outils de « dépistage » d'utilisation écologique et aisée (Schneider et coll., 2006
) et la mise au point d'outils de « dépistage » d'utilisation écologique et aisée (Schneider et coll., 2006 ). Par ailleurs, de nouvelles questions à côté de celle de l'effet symptomatique sont posées. Quel est l'impact de ces traitements sur la qualité de vie, et comment le mesurer ? Les essais sont longs, d'interprétation difficile faisant intervenir la subjectivité du conjoint (EuroQol : ADRQL scale, Jonsson et coll., 2006
). Par ailleurs, de nouvelles questions à côté de celle de l'effet symptomatique sont posées. Quel est l'impact de ces traitements sur la qualité de vie, et comment le mesurer ? Les essais sont longs, d'interprétation difficile faisant intervenir la subjectivité du conjoint (EuroQol : ADRQL scale, Jonsson et coll., 2006 ) et, enfin, la qualité de vie mesurée est celle du conjoint et non du patient. Ces traitements ont-ils un retentissement sur le temps d'apparition d'une dépendance, de l'institutionnalisation ? Avec, dans ce cas, une maîtrise des variables encore plus difficile.
) et, enfin, la qualité de vie mesurée est celle du conjoint et non du patient. Ces traitements ont-ils un retentissement sur le temps d'apparition d'une dépendance, de l'institutionnalisation ? Avec, dans ce cas, une maîtrise des variables encore plus difficile. ; Tabert et coll., 2006
; Tabert et coll., 2006 ). La validation de nouveaux outils est nécessaire (Galasko, 2005
). La validation de nouveaux outils est nécessaire (Galasko, 2005 ) et l'utilisation de critères intermédiaires (surrogate-endpoints) est discutée. L'IRM structurelle (mesure de l'atrophie cérébrale, hippocampique : Modrego, 2006
) et l'utilisation de critères intermédiaires (surrogate-endpoints) est discutée. L'IRM structurelle (mesure de l'atrophie cérébrale, hippocampique : Modrego, 2006 ; van de Pol et coll., 2006
; van de Pol et coll., 2006 ) ou fonctionnelle (diagnostic différentiel entre démences, des patients à risques : Bondi et coll., 2005
) ou fonctionnelle (diagnostic différentiel entre démences, des patients à risques : Bondi et coll., 2005 ; Goekoop et coll., 2006
; Goekoop et coll., 2006 ; Sauer et coll., 2006
; Sauer et coll., 2006 ), suivi évolutif, anomalies chez les patients pré-symptomatiques (Bassett et coll., 2006
), suivi évolutif, anomalies chez les patients pré-symptomatiques (Bassett et coll., 2006 ; Mosconi et coll., 2006
; Mosconi et coll., 2006 ) pour l'IRMf, étude des protéines Tau pour la spectro-IRM, l'analyse des biomarqueurs (protéine Tau totale, phospho-Tau et peptide amyloïde : Kapaki et coll., 2005
) pour l'IRMf, étude des protéines Tau pour la spectro-IRM, l'analyse des biomarqueurs (protéine Tau totale, phospho-Tau et peptide amyloïde : Kapaki et coll., 2005 ; Bibl et coll., 2006
; Bibl et coll., 2006 ; Hansson et coll., 2006
; Hansson et coll., 2006 ), la tomographie d'émission monophotonique (TEMP : Varma et coll., 2002
), la tomographie d'émission monophotonique (TEMP : Varma et coll., 2002 ) et bien sûr le Pittsburgh Compound B, PIB (quantification des plaques amyloïdes : Edison et coll., 2006
) et bien sûr le Pittsburgh Compound B, PIB (quantification des plaques amyloïdes : Edison et coll., 2006 ; Kemppainen et coll., 2006
; Kemppainen et coll., 2006 ) montrent de plus en plus leur intérêt (de Leon et coll., 2004
) montrent de plus en plus leur intérêt (de Leon et coll., 2004 ; Ackl et coll., 2005
; Ackl et coll., 2005 ; Apostolova et coll., 2006
; Apostolova et coll., 2006 ). Mais il importe de répondre à un certain nombre de questions (linéarité, quantification, corrélation avec symptomatologie...) avant de pouvoir les utiliser comme critères diagnostiques ou d'évaluation dans des essais thérapeutiques.
). Mais il importe de répondre à un certain nombre de questions (linéarité, quantification, corrélation avec symptomatologie...) avant de pouvoir les utiliser comme critères diagnostiques ou d'évaluation dans des essais thérapeutiques. ; Kapaki et Paraskevas, 2005
; Kapaki et Paraskevas, 2005 ; Birks, 2006
; Birks, 2006 ) même si la puissance de ces effets sont discutés par certains (Hogan et coll., 2004
) même si la puissance de ces effets sont discutés par certains (Hogan et coll., 2004 ; Kaduszkiewicz et coll., 2005
; Kaduszkiewicz et coll., 2005 ). Mais devant le développement de nouvelles approches physiopathologiques et thérapeutiques, une révision s'impose tant dans les recommandations méthodologiques que dans l'utilisation des outils ad hoc.
). Mais devant le développement de nouvelles approches physiopathologiques et thérapeutiques, une révision s'impose tant dans les recommandations méthodologiques que dans l'utilisation des outils ad hoc.






































































 ). En France, faute de recommandations émises par la Haute Autorité en Santé, ce sont celles de l'Autorisation de mise sur le marché (AMM) qui prévalent, même si certains auteurs, par exemple dans des revues de formation continue, proposent un usage plus large de ces médicaments.
). En France, faute de recommandations émises par la Haute Autorité en Santé, ce sont celles de l'Autorisation de mise sur le marché (AMM) qui prévalent, même si certains auteurs, par exemple dans des revues de formation continue, proposent un usage plus large de ces médicaments. ). Pour les échelles composites, additionnant des sous-scores, l'indépendance des items qui les composent mériterait d'être authentifiée. Cela a été fait pour le score du fardeau de Zarit et l'on observe une forte corrélation entre certains sous-scores (Vernooij-Dassen et coll., 2003
). Pour les échelles composites, additionnant des sous-scores, l'indépendance des items qui les composent mériterait d'être authentifiée. Cela a été fait pour le score du fardeau de Zarit et l'on observe une forte corrélation entre certains sous-scores (Vernooij-Dassen et coll., 2003 ). Cela n'a pas été publié pour le NPI, pour lequel l'hypothèse de fortes redondances internes reste posée.
). Cela n'a pas été publié pour le NPI, pour lequel l'hypothèse de fortes redondances internes reste posée. ; Rockwood et McKnight, 2001
; Rockwood et McKnight, 2001 ). Curieusement, ce consensus n'est jamais rappelé lors de la publication des essais pharmacologiques et ne fait l'objet d'aucun commentaire ou remise en cause. Ainsi, l'effet d'un médicament sera jugé toujours positif sans référence à cette borne, quelle que soit l'ampleur de la variation. Ce même consensus d'experts propose pour la CIBIC une pertinence clinique dans la stabilisation ou le non-déclin, ce qui est assez logique. Les autres variables (SIB ou Severe Impairment Battery, Zarit, autonomie et surtout NPI) n'ont pas fait l'objet de réflexion publiée.
). Curieusement, ce consensus n'est jamais rappelé lors de la publication des essais pharmacologiques et ne fait l'objet d'aucun commentaire ou remise en cause. Ainsi, l'effet d'un médicament sera jugé toujours positif sans référence à cette borne, quelle que soit l'ampleur de la variation. Ce même consensus d'experts propose pour la CIBIC une pertinence clinique dans la stabilisation ou le non-déclin, ce qui est assez logique. Les autres variables (SIB ou Severe Impairment Battery, Zarit, autonomie et surtout NPI) n'ont pas fait l'objet de réflexion publiée. ) montre que seul un petit nombre d'entre eux (22 au total) remplit partiellement les critères du Consort Statement, sans jamais y satisfaire totalement. La critique la plus fréquente est la multiplicité des tests sur les variables de résultats secondaires, sans correction du seuil de significativité en fonction du nombre de tests statistiques pratiqués, aboutissant à des résultats sur celles-ci à faible niveau de preuve.
) montre que seul un petit nombre d'entre eux (22 au total) remplit partiellement les critères du Consort Statement, sans jamais y satisfaire totalement. La critique la plus fréquente est la multiplicité des tests sur les variables de résultats secondaires, sans correction du seuil de significativité en fonction du nombre de tests statistiques pratiqués, aboutissant à des résultats sur celles-ci à faible niveau de preuve. ). Une comparaison entre les malades en population générale et celle des malades inclus dans les études montre d'importantes différences. Cela a été magistralement démontré (Schoenmaker et Van Gool, 2004
). Une comparaison entre les malades en population générale et celle des malades inclus dans les études montre d'importantes différences. Cela a été magistralement démontré (Schoenmaker et Van Gool, 2004 ) pour la population des Pays-Bas (figure 1
) pour la population des Pays-Bas (figure 1 ). Ce biais majeur conduit à deux questions portant sur :
). Ce biais majeur conduit à deux questions portant sur : ), fait état d'un effet plus important après 75 ans qu'avant) ;
), fait état d'un effet plus important après 75 ans qu'avant) ;
 )
) ; Courtney et coll., 2004
; Courtney et coll., 2004 ). L'étude AD2000, dont la méthodologie reste controversée, observe à long terme un très faible effet cognitif sur le MMSE sans aucune conséquence sur le comportement, l'autonomie, l'entrée en institution, les coûts, le fardeau de prise en charge... Quant aux prolongations après 6 mois en ouvert, des essais randomisés comparant les malades traités à une cohorte théorique ou à des séries historiques datant des années 1980, leur valeur méthodologique est très modeste.
). L'étude AD2000, dont la méthodologie reste controversée, observe à long terme un très faible effet cognitif sur le MMSE sans aucune conséquence sur le comportement, l'autonomie, l'entrée en institution, les coûts, le fardeau de prise en charge... Quant aux prolongations après 6 mois en ouvert, des essais randomisés comparant les malades traités à une cohorte théorique ou à des séries historiques datant des années 1980, leur valeur méthodologique est très modeste. ; Birks, 2006
; Birks, 2006 ; Birks et Harvey, 2006
; Birks et Harvey, 2006 ; Loy et Schneider, 2006
; Loy et Schneider, 2006 ) et la plus récente publiée dans une revue à comité de lecture (Takeda et coll., 2006
) et la plus récente publiée dans une revue à comité de lecture (Takeda et coll., 2006 ). Leurs résultats ne sont pas divergents sur l'essentiel.
). Leurs résultats ne sont pas divergents sur l'essentiel. à III
à III . Pour l'ADAS-Cog, la variation moyenne du score reste en deçà du seuil de pertinence clinique, en méta-analyse comme dans l'évaluation individuelle des études. Seul un essai de phase 2 avec un petit nombre de malades atteint ce seuil. Quelle que soit la variable considérée, le résultat observé, statistiquement significatif, ne représente qu'un écart modeste sur une échelle de variation potentielle importante. Ainsi pour la NPI, que peut bien signifier sur le plan clinique une variation de 2,5 points d'un score comportemental composite variant potentiellement de 0 à 120 ? De fait, il est difficile d'affirmer que les IAChE soient actifs sur les composantes comportementales de la maladie d'Alzheimer.
. Pour l'ADAS-Cog, la variation moyenne du score reste en deçà du seuil de pertinence clinique, en méta-analyse comme dans l'évaluation individuelle des études. Seul un essai de phase 2 avec un petit nombre de malades atteint ce seuil. Quelle que soit la variable considérée, le résultat observé, statistiquement significatif, ne représente qu'un écart modeste sur une échelle de variation potentielle importante. Ainsi pour la NPI, que peut bien signifier sur le plan clinique une variation de 2,5 points d'un score comportemental composite variant potentiellement de 0 à 120 ? De fait, il est difficile d'affirmer que les IAChE soient actifs sur les composantes comportementales de la maladie d'Alzheimer. ; Birks, 2006
; Birks, 2006 ; Birks et Harvey, 2006
; Birks et Harvey, 2006 ; Loy et Schneider, 2006
; Loy et Schneider, 2006 ).
). ). De même, aucune preuve ne vient soutenir l'idée qu'en cas d'échec d'un IAChE, un autre pourrait produire un effet plus positif. Cette stratégie, appelée « switch », a fait l'objet de quelques communications dans les congrès, sans lendemain dans les revues à comité de lecture sélectif.
). De même, aucune preuve ne vient soutenir l'idée qu'en cas d'échec d'un IAChE, un autre pourrait produire un effet plus positif. Cette stratégie, appelée « switch », a fait l'objet de quelques communications dans les congrès, sans lendemain dans les revues à comité de lecture sélectif. ) chiffrent l'écart moyen à 1 point d'ADAS-Cog entre bons répondeurs au placebo et bons répondeurs aux IAChE (figure 2
) chiffrent l'écart moyen à 1 point d'ADAS-Cog entre bons répondeurs au placebo et bons répondeurs aux IAChE (figure 2 et tableau IV
et tableau IV ).
). ) n'observe ni effet cognitif, ni effet sur les hallucinations ou les délires. La méta-analyse de la Cochrane Database (Wild et coll., 2003
) n'observe ni effet cognitif, ni effet sur les hallucinations ou les délires. La méta-analyse de la Cochrane Database (Wild et coll., 2003 ) conclut à une absence de preuve d'efficacité.
) conclut à une absence de preuve d'efficacité. ). Le dossier scientifique a obtenu une AMM européenne sans pour autant convaincre une partie de la communauté scientifique. Ainsi, le NICE propose pour l'heure de poursuivre les essais mais ne recommande pas l'emploi de cette molécule en clinique (NICE, 2006
). Le dossier scientifique a obtenu une AMM européenne sans pour autant convaincre une partie de la communauté scientifique. Ainsi, le NICE propose pour l'heure de poursuivre les essais mais ne recommande pas l'emploi de cette molécule en clinique (NICE, 2006 ).
). ) a inclus des patients recevant un IAChE depuis plus d'un an et comparé l'effet d'une dose usuelle de mémantine au placebo. Les résultats sont similaires à ceux observés dans d'autres études menées avec la mémantine seule, infirmant l'idée d'une synergie.
) a inclus des patients recevant un IAChE depuis plus d'un an et comparé l'effet d'une dose usuelle de mémantine au placebo. Les résultats sont similaires à ceux observés dans d'autres études menées avec la mémantine seule, infirmant l'idée d'une synergie.





















 ), « La fabrication de la démocratie se lit aisément à la façon dont les personnes les plus fragiles sont prises en charge et protégées dans toute société ».
), « La fabrication de la démocratie se lit aisément à la façon dont les personnes les plus fragiles sont prises en charge et protégées dans toute société ».  ).
).