Aspects cliniques et prise en charge de la maladie
2007
9-
Symptômes psychologiques et comportementaux
La maladie d'Alzheimer se caractérise par une altération des fonctions cognitives à laquelle sont associés des troubles connus sous le terme de troubles du comportement, symptômes psychiatriques ou symptômes neuropsychiatriques.
Cette dernière dénomination est importante car elle prend en compte le fait que ces symptômes sont directement reliés au processus pathologique de la maladie d'Alzheimer. En effet, les symptômes neuropsychiatriques sont définis comme des manifestations primaires d'un dysfonctionnement cérébral (Cummings et Mega, 2003

). Ils apparaissent spécifiquement à la suite d'une atteinte d'un système ou d'un circuit, comme le système limbique ou les circuits cortico-sous-corticaux. Les maladies dégénératives comme la maladie d'Alzheimer produisent à la fois des altérations structurales et chimiques et les troubles neuropsychiatriques peuvent être influencés soit par l'un soit par l'autre de ces changements.
Il faut cependant souligner que ces modifications biologiques spécifiques sont nécessaires mais non suffisantes pour produire les symptômes neuropsychiatriques, car des facteurs additionnels contribuent aussi à déterminer quel patient présentera les modifications comportementales.
Dans une dimension plus descriptive, l'
International Psychogeriatric Association (IPA) a proposé la dénomination de symptômes psychologiques et comportementaux des démences (SPCD) qui regroupent les troubles de la perception, du contenu des pensées, de l'humeur ou du comportement, fréquemment observés chez les patients déments (Finkel et coll., 1996

).
Les SPCD suscitent un intérêt croissant parce qu'ils occasionnent une part importante de la souffrance des patients et des aidants, et conditionnent fortement le mode de vie du patient et son parcours de soin.
Évaluation des symptômes psychologiques et comportementaux
Le mode de survenue des symptômes, le type précis, l'intensité, l'évolution dans le temps, l'association à d'autres symptômes, le retentissement sur l'adaptation et la vie quotidienne et sur les aidants, les influences de l'environnement doivent être évalués d'une manière précise. Ces évaluations doivent être répétées au cours du temps.
L'évaluation quantitative des SPCD se fait par des échelles d'évaluation ou des entretiens semi-structurés. Certains de ces instruments relèvent directement de la pratique de l'évaluation psychiatrique chez l'adulte jeune. D'autres ont été spécifiquement développés pour le sujet âgé. Parmi ces derniers, il faut distinguer les instruments permettant une évaluation de l'ensemble de la symptomatologie comme la
Behave AD (Behavioral pathology in Alzheimer's disease scale) (Reisberg, 1987

) ou comme l'Inventaire neuropsychiatrique (NPI, Cummings et coll., 1994

). D'autres échelles s'intéressent spécifiquement à une symptomatologie donnée comme l'échelle d'agitation de Cohen-Mansfield (Cohen-Mansfield, 1989

), l'échelle de dépression gériatrique (Yesavage et coll., 1983

) ou l'Inventaire apathie (Robert et coll., 2002

). Dans la majorité des cas, l'évaluation est effectuée à partir d'un entretien avec un accompagnant informé des comportements du patient. Les auto-évaluations du patient sont moins utilisées. À côté de l'évaluation de la fréquence et de la sévérité des symptômes, il existe aussi une évaluation du fardeau (par exemple, échelle de Zarit) et/ou du retentissement des troubles du comportement sur l'aidant (NPI).
Fréquence des symptômes
Comparativement aux troubles comportementaux présentés chez l'adulte jeune, les SPCD ont des caractéristiques particulières. En effet, des symptômes même apparemment opposés sont souvent associés entre eux. Des symptômes peuvent être présents à un moment de l'évolution, disparaître puis réapparaître. Ceci rend parfois difficile l'utilisation de critères diagnostiques nécessitant la présence stable de symptômes pendant une durée déterminée (par exemple pour un épisode dépressif majeur).
La fréquence des SPCD est importante puisque plus de 80 % des patients atteints de maladie d'Alzheimer présentent ce type de symptômes. Il existe cependant une grande variabilité interindividuelle (McKeith et Cumming, 2005

). Un tiers des patients présentent des symptômes qui ont une intensité sévère (Eustace et coll., 2002

). La fréquence tend généralement à augmenter avec la sévérité du déficit cognitif même si des pics peuvent survenir à des moments particuliers de l'évolution. Par exemple, les symptômes dépressifs ou l'apathie sont fréquents dans des formes légères à modérées. La majorité des études évaluant la fréquence des SPCD ont été effectuées avec l'Inventaire neuropsychiatrique. Le tableau 9.I

présente les résultats des principales études européennes. Ces résultats sont équivalents à ceux de l'étude américaine de Mega et coll. (1996

) mais portent sur une population plus importante. Quelle que soit la sévérité, le symptôme le plus fréquemment rencontré est l'apathie, suivi des symptômes dépressifs et de l'anxiété.
Tableau 9.I Fréquence (%) des SPCD évaluée avec l'Inventaire neuropsychiatrique (NPI) dans la maladie d'Alzheimer ; résultats de plusieurs études européennes
|
Études
|
MAA SB ED Verhey et coll., 2003 
|
Real-FR Benoit et coll., 2003 
|
Real-FR Benoit et coll., 2005 
|
EADC Byrne, 2003 
|
Total
|
| |
|
MMSE 11-20
|
MMSE 21-26
|
MMSE 4-28
|
N=836 (%)
|
| |
n=199 (%)
|
n=235 (%)
|
n=244 (%)
|
n=138 (%)
| |
|
Apathie
|
59,3
|
63,5
|
47,9
|
48,9
|
55,5
|
|
Dépression
|
57,3
|
42,7
|
36,9
|
45,3
|
44,9
|
|
Anxiété
|
39,2
|
46,3
|
44,3
|
33,8
|
42,0
|
|
Agitation
|
28,6
|
44,3
|
32,8
|
30,9
|
35,0
|
|
Irritabilité
|
39,7
|
25,0
|
28,3
|
31,7
|
30,6
|
|
Comportement moteur aberrant
|
34,7
|
29,8
|
14,7
|
18,7
|
24,7
|
|
Délire
|
34,7
|
24,7
|
10,2
|
19,4
|
22,0
|
|
Appétit
|
24,6
|
24,3
|
20,5
|
12,9
|
21,4
|
|
Sommeil
|
18,1
|
12,9
|
13,5
|
12,9
|
14,3
|
|
Désinhibition
|
12,6
|
13,3
|
10,2
|
14,4
|
12,4
|
|
Hallucinations
|
13,1
|
7,8
|
5,7
|
7,9
|
8,5
|
|
Euphorie
|
7,0
|
9,8
|
4,5
|
5,0
|
6,8
|
|
1 MMSE : Mini Mental State Examination score
|
À partir des études utilisant le NPI, plusieurs analyses factorielles ont été effectuées afin de subdiviser les SPCD en sous-groupes cohérents de symptômes. Le tableau 9.II présente les résultats de ces analyses.
Les différences de taille et de sévérité des populations expliquent en partie les variations observées entre ces études. L'étude la plus récente (Aalten et coll., sous presse

), réalisée par le groupe de l'
European Alzheimer's Disease Consortium (EADC) sur un nombre de patients important (n=2 354), isole 4 syndromes :
• l'hyperactivité incluant les items agitation, désinhibition, irritabilité, comportements moteurs aberrants et euphorie ;
• la psychose incluant les items délire, hallucination et trouble du sommeil ;
• l'affectif incluant les items dépression et anxiété ;
• l'apathie incluant les items apathie et troubles de l'appétit.
Cette subdivision est cohérente d'un point de vue clinique mais présente aussi un intérêt au niveau de l'approche étiologique des SPCD.
Tableau 9.II Analyses factorielles des symptômes neuropsychiatriques évalués par l'Inventaire neuropsychiatrique (NPI)
|
Références
|
N
|
|
Version NPI
|
Facteurs
|
Frisoni et coll., 1999 
|
162
|
13,3
|
10 items
|
Humeur/syndrome frontal/psychose
|
Fuh et coll., 2001 
|
95
|
12,7
|
12 items
|
Humeur-psychose/régulation psychomotrice/ implication sociale
|
Aalten et coll., 2003 
|
199
|
18,1
|
12 items
|
Humeur Apathie/psychose/hyperactivité
|
Spaletta et coll., 2004 
|
244
|
17,5
|
10 items
|
Humeur-excitation/humeur-dépression
Apathie/psychose/hyperactivité/anxieté
|
Benoit et coll., 2003 
|
244
|
23,4
|
10 items
|
Psychose-agitation/humeur/hallucination
|
Mirakhur et coll., 2004 
|
435
|
13,0
|
12 items
|
Affect/symptôme physique/psychose/hypomanie
|
Matsui et coll., 2006 
|
140
|
20,3
|
10 items
|
Humeur/psychose/euphorie
|
Hollingworth et coll., 2006 
|
1 120
|
12,8
|
12 items
|
Dyscontrôle comportemental/humeur/psychose/agitation
|
Aalten et coll., sous presse 
|
2 354
|
17,8
|
12 items
|
Hyperactivité/psychose/affectif/apathie
|
|
1 MMSE : Mini Mental State Examination score
|
Facteurs de risque ou symptômes précoces
Parmi les SPCD, les symptômes dépressifs ont fait l'objet du plus grand nombre d'études dans ce domaine. Ceci est compréhensible car ces symptômes, avec l'apathie et l'anxiété, sont les plus fréquents dans les formes légères.
Dans un premier temps, il a été mis en évidence une relation entre l'existence d'antécédents personnels de dépression et un risque plus élevé de développer une maladie d'Alzheimer plus tard au cours de l'existence. Récemment, Ownby et coll. (2006

) ont effectué une revue systématique de la littérature afin de réaliser une méta-analyse. Dans un premier temps, 153 études ont été sélectionnées ; seulement 20 d'entre elles présentaient des données suffisantes pour apprécier le niveau de risque associé à la dépression. Ces 20 études fournissent des données sur un échantillon de 102 172 personnes provenant de 8 pays différents.
Les résultats montrent que les patients avec des antécédents de dépression présentent un risque plus élevé de développer par la suite une maladie d'Alzheimer. L'
odds-ratio (OR) pour les études cas-témoins est de 2,03 et pour les études de cohortes de 1,90. Une autre subdivision a été effectuée en fonction de la présence d'un état dépressif majeur selon les critères diagnostiques comme ceux du DSM
1
Diagnostic and Statistical Manual of Mental Disorders
ou de la CIM
2
Classification internationale des maladies
(OR=2,23) ou sans critère diagnostique (OR=1,85).
Le deuxième objectif de cette analyse était d'évaluer si le risque de développer une maladie d'Alzheimer est relié à l'intervalle de temps entre le diagnostic de dépression et de maladie d'Alzheimer. Treize études incluant 2 études contrôlées et 11 études de cohorte ont pu être utilisées pour cette analyse. Les résultats indiquent qu'il existe une relation positive entre la longueur de cet intervalle et le risque de présenter une maladie d'Alzheimer (plus l'intervalle est long, plus le nombre de sujets présentant une maladie d'Alzheimer est élevé). Ce résultat peut être interprété comme un argument en faveur de l'hypothèse considérant la dépression comme un facteur de risque de la maladie d'Alzheimer plutôt qu'un prodrome de la maladie.
Cette hypothèse est particulièrement pertinente quand le terme de dépression recouvre les patients ayant présenté un épisode dépressif majeur. La pertinence est moindre si l'on considère uniquement la symptomatologie dépressive. Il faut rappeler que dans la maladie d'Alzheimer, on trouve beaucoup plus de symptômes dépressifs isolés que d'états dépressifs majeurs complets au sens des classifications diagnostiques internationales.
L'hypothèse des symptômes dépressifs comme prodrome de la maladie d'Alzheimer doit cependant être réexaminée en tenant compte de la distinction importante entre symptôme dépressif et apathie.
L'apathie est un trouble de la motivation se caractérisant par une perte d'initiative, une perte d'intérêt et un émoussement émotionnel (Marin et coll., 1991

et 1995

). Ces symptômes ont longtemps été regroupés par erreur sous le cadre des symptômes dépressifs alors que l'apathie diffère de la dépression (Lévy et coll., 1998

), même si les deux lignées symptomatiques peuvent être associées (Robert et coll., 2006a

).
Récemment, des études se sont intéressées aux symptômes neuropsychiatriques chez les patients présentant un trouble cognitif léger (
Mild Cognitive Impairment, MCI) en utilisant le même instrument que dans la maladie d'Alzheimer, c'est-à-dire le NPI. Les résultats indiquent que ces symptômes sont présents chez plus de 50 % des patients et que les symptômes les plus fréquents sont l'apathie, les symptômes dépressifs ou dysphorie et l'anxiété (Feldman et coll., 2004

; Geda et coll., 2004

; Hwang et coll., 2004

). L'analyse précise de la symptomatologie clinique montre que les premiers symptômes neuropsychiatriques observés sont dans le champ de l'apathie (perte d'intérêt, perte d'initiative) mais ne sont pas spécifiquement dépressifs, même quand la dépression est mise au premier plan (Berger et coll., 1999

). Récemment, il a été aussi montré que les patients atteints de MCI et présentant une symptomatologie apathique avaient des performances de mémoire significativement plus faibles que les patients atteints de MCI sans apathie (Robert et coll., 2006b

). Enfin, les symptômes apathiques étaient présents très précocement chez les patients présentant un MCI et qui allaient développer une maladie d'Alzheimer, alors que ce n'était pas le cas pour les symptômes anxieux ou dépressifs (Robert et coll., 2006c

).
Étiologie des symptômes psychologiques et comportementaux
Le déterminisme des SPCD reste encore insuffisamment exploré. Il est multifactoriel et intègre des composantes neurobiologiques, somatiques, psychologiques et environnementales. Sachant la labilité dans le temps de certains symptômes, une approche dynamique et diachronique est indispensable. En effet, certains facteurs prédominants à une période donnée pour un symptôme déterminé peuvent devenir secondaires par rapport à d'autres facteurs à un autre moment.
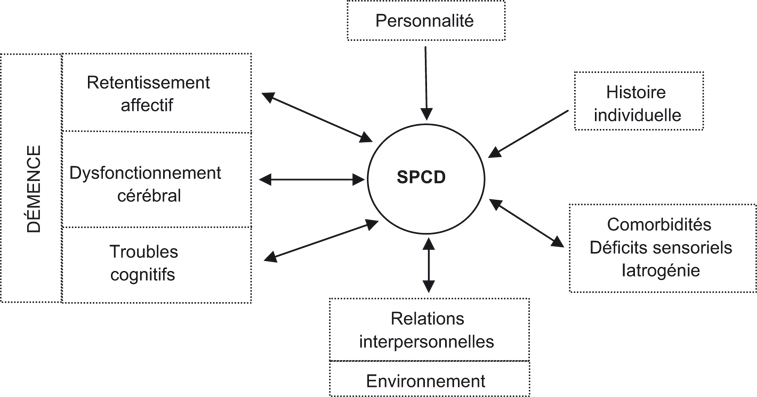
Compte tenu de cette difficulté à déterminer avec précision une physiopathologie unique pour un symptôme donné, une attitude pragmatique doit prévaloir, consistant à spécifier les facteurs les plus plausibles et les interactions entre eux (figure 9.1

). Parmi ces facteurs, il faut souligner l'importance :
• des atteintes neurofonctionnelles (Robert et Benoit, 2001

; Cummings, 2003

) ;
• des autres atteintes somatiques (affections sous-jacentes, comorbidité, iatrogénie) (Finkel et coll., 1996

) ;
• des modifications récentes de l'environnement (changement de lieu de résidence, facteurs de stress) (Burgio et coll., 2000

) ;
• des facteurs biographiques et familiaux (événements de vie), ou de traits de personnalité antérieurs (Meins et coll., 1998

; Low et coll., 2002

).
D'un point de vue biologique, les atteintes neuropathologiques dans les régions frontales, temporales et sous-corticales et les déficits de systèmes de neurotransmission qui en résultent, sous-tendent en partie l'apparition des SPCD et rendent le patient plus sensible aux autres facteurs étiologiques précédemment cités. La division en sous-groupes des SPCD est utile à ce niveau car elle permet d'être plus précis quant aux atteintes neurofonctionnelles.
Apathie
Les études d'imagerie cérébrale fonctionnelle (Craig et coll., 1996

; Mignéco et coll., 2001

; Benoit et coll., 2002

; Benoit et coll., 2005

; Holthoff et coll., 2005

; Robert et coll., 2006d

) ont mis en évidence l'existence d'une relation entre la présence d'apathie et une hypoperfusion prédominant au niveau des régions fronto-médianes (cingulum, région orbito-frontale). D'autres études ont souligné que la présence d'apathie était associée à une augmentation des lésions neuropathologiques au niveau du cingulum antérieur (Marshall et coll., 2006

), à une plus grande fréquence du gène
APOE4 (Monastero et coll., 2006

), et enfin à une atteinte préférentielle des systèmes de neurotransmission cholinergique et dopaminergique (Cummings, 2003

).
Symptôme affectif
L'anxiété a été peu étudiée. En revanche, il existe davantage de données sur les symptômes dépressifs. Des études d'imagerie cérébrale ont aussi montré une hypoperfusion au niveau des régions frontales (Starkstein et coll., 1995

; Hirono et coll., 1998

; Holthoff et coll., 2005

). Les patients présentant une maladie d'Alzheimer et des symptômes dépressifs auraient une plus grande perte cellulaire au niveau du locus coeruleus (Chan-Palay et Asan, 1989

; Forstl et coll., 1992

) et une diminution du taux de recapture de la sérotonine au niveau cortical (Chen et coll., 1996

), ceci comparativement aux patients sans symptôme dépressif.
Symptômes psychotiques et agitation
Les études d'imagerie ont mis en évidence une hypoperfusion des régions frontales (Hirono et coll., 2000

; Mega et coll., 2000

) ainsi qu'une atrophie frontale et temporale plus importante (Geroldi et coll., 2000

). L'atteinte des circuits fronto-sous-corticaux est plus souvent associée à des comportements agités, agressifs, désinhibés ou des symptômes délirants. Un taux plus élevé de dégénérescence neurofibrillaire au niveau orbito-frontal a été mis en relation avec la présence de symptômes psychotiques. Par ailleurs, la densité des plaques séniles et des dépôts neurofibrillaires serait plus élevée dans le prosubicullum et le cortex frontal médian (Tékin et coll., 2001

). Enfin, le déficit cholinergique serait aussi plus prononcé (Matthews et coll., 2002

).
Conséquences des symptômes psychologiques et comportementaux
Les conséquences des SPCD sont nombreuses tout au long de la maladie. Elles affectent l'évolution et le mode de vie du patient mais aussi celui de son accompagnant. Parmi celles qui ont fait l'objet d'un nombre important d'études, il faut citer le rôle des SPCD :
• comme un des facteurs déterminant le passage du patient en institution. Il a ainsi été mis en évidence dans la cohorte Real-FR (Réseau français pour la maladie d'Alzheimer) que les patients qui, après 1 an d'évolution, étaient institutionnalisés avaient comme caractéristiques au moment de l'inclusion une fréquence plus élevée de trouble du comportement à type d'agitation et de désinhibition (Benoit et coll., 2005

). Parallèlement, les accompagnants de ces patients évaluaient l'intensité du fardeau d'une manière plus importante à l'échelle de Zarit ;
• comme un des facteurs influençant le plus le fardeau de l'aidant. Une revue systématique de la littérature et une méta-analyse des données d'articles publiés entre 1990 et 2001 (Black et Almeida, 2004

) soutiennent l'idée que les SPCD sont associés avec la charge de soins, la détresse psychologique et la dépression de l'accompagnant. Une autre étude (Sink et coll., 2006

) a analysé, chez 5 788 patients, les caractéristiques des accompagnants et a mis en évidence une relation indiquant que les accompagnants qui étaient plus jeunes, qui avaient un niveau d'éducation moins élevé, qui étaient moins déprimés, qui ressentaient moins la charge des soins ou qui passaient moins d'heures par semaine à donner des soins, rapportaient plus de SPCD que les autres. Ceci conduit à toujours tenir compte de la dynamique entre le patient et l'accompagnant quand on est amené à évaluer des SPCD ;
• comme un des facteurs intervenant sur la qualité de vie des patients (Hoe et coll., 2006

) ;
• comme un des facteurs ayant des répercussions économiques en augmentant les coûts par patient. Par exemple, Murman et Colenda (2005

) ont mis en évidence qu'une aggravation de 1 point au NPI est associée avec une augmentation de 247 à 409 $US par an sur les coûts directs de soins pour la maladie d'Alzheimer.
Traitement des symptômes psychologiques et comportementaux
La prise en charge des SPCD est multimodale et doit être guidée par le niveau d'évolution de la maladie, mais aussi d'une manière plus spécifique par le type et les caractéristiques des symptômes présentés. La prise en charge d'une maladie intercurrente ou de la iatrogénie potentiellement en cause est fondamentale afin de permettre l'amélioration voire la résolution complète des SPCD.
Une revue systématique de la littérature a mis en évidence sur un total de 1 632 études portant sur les traitements non pharmacologiques pour les SPCD, que seulement 162 répondaient à des critères de qualité scientifique (Livingstone et coll., 2005

).
Les techniques d'information, l'enseignement des accompagnants et du personnel soignant des institutions et possiblement la stimulation cognitive sont apparus comme ayant un effet sur les SPCD (pour complément voir le chapitre sur les traitements non pharmacologiques).
Depuis la conférence de consensus de l
'International Psychogeriatric Association (Finkel et coll., 1996

), il est régulièrement rappelé que le premier traitement des SCPD est non pharmacologique et que ce n'est que dans un deuxième temps que doit intervenir l'approche pharmacologique.
L'analyse de la littérature concernant les deux modes de traitement est très inégale. Depuis quelques années, les études concernant les traitements pharmacologiques sont de plus en plus nombreuses et répondent aux critères scientifiques adaptés dans le cadre des essais thérapeutiques. Parallèlement, les études sur les approches non pharmacologiques sont aussi très nombreuses mais peu d'entre-elles répondent à ces critères. Ceci constitue un problème non négligeable. En effet, chez les patients vivant à domicile ou en institution, ces moyens non pharmacologiques sont très souvent utilisés et probablement d'une manière mal adaptée, compte tenu de l'insuffisance des données et procédures précises.
Il faut enfin souligner que la prise en charge des SPCD est aussi variable en fonction du degré de sévérité de la maladie et du type de SPCD. Suite à une concertation professionnelle récente consacrée aux traitements de l'agitation, de l'agressivité, de l'opposition et des troubles psychotiques, un texte de concertation rassemblant les informations et points de vue a été publié (Benoit et coll., 2006

).
Approche non pharmacologique
Le traitement non pharmacologique des SPCD repose sur trois types d'intervention.
Intervention centrée sur la relation aidant-patient
Toutes les catégories d'aidants peuvent être concernées. Il peut s'agir d'aidant informel ou d'aidant professionnel.
Trois types d'intervention visant à diminuer le fardeau de l'aidant ont été proposés :
• un soutien psychologique ;
• des programmes de formation ;
• la mise en place d'un réseau de soutien.
Intervention centrée sur l'environnement du patient
Un milieu architectural inadapté peut contribuer à l'apparition des SPCD ou les aggraver. En revanche, un environnement rassurant peut les soulager ou permettre de vivre avec un minimum de sécurité pour le malade comme pour l'aidant (Benoit et coll., 2006

).
Il a aussi été souligné l'importance d'essayer de respecter les rythmes de vie du patient, également de faciliter l'organisation du cadre temporel par le renforcement des indicateurs normaux du temps (exemple calendrier ou horloge de grande taille) et le renforcement du rythme veille/sommeil normal (McCurry et coll., 2005

).
Approche psychothérapique et socio-thérapique
Il est difficile de tirer des conclusions valides d'études peu nombreuses et souvent de qualité méthodologique moyenne (Anaes, 2003

). Les recommandations et consensus d'experts indiquent que ce type de traitements peut être bénéfique chez certains patients à certaines périodes de l'évolution. Ces traitements peuvent se décomposer en différentes techniques :
• techniques de renforcement ;
• techniques orientées sur les émotions comme l'évocation du passé ;
• techniques orientées sur la présence d'un proche ;
• techniques destinées à stimuler le patient. Celles-ci sont plus particulièrement indiquées contre l'apathie. Elles utilisent le principe de stimulations externes sensorielles, motrices ou cognitives comme les activités manuelles de groupe, l'écoute de la musique, l'utilisation de la présence d'animaux domestiques.
Enfin, les auteurs soulignent qu'on ne peut exclure l'efficacité des autres techniques mais que le nombre d'études à leur sujet demeure insuffisant.
Traitements pharmacologiques
Au niveau des traitements des SPCD, il est important de différencier deux types de médicaments : d'un côté les traitements ayant une indication spécifique pour la maladie d'Alzheimer et qui agissent sur les différents aspects de cette pathologie, et d'un autre côté d'autres médicaments qui agissent plus spécifiquement sur un type de SPCD.
Les médicaments spécifiques de la maladie d'Alzheimer actuellement commercialisés sont les inhibiteurs de l'acétylcholinestérase et la mémantine. Il faut rappeler ici que leur efficacité sur les SPCD a été rapportée par de nombreuses études cliniques. Quels que soient les traitements cholinergiques, ils ont montré une efficacité sur les SPCD (Birks et Harvey, 2006

). Les symptômes les plus particulièrement sensibles sont l'apathie, les symptômes dépressifs, les hallucinations, le délire (Cummings et coll., 2004

). Leur efficacité sur les SPCD a été aussi mise en évidence dans la maladie à corps de Lewy (McKeith et coll., 2000

) ou dans les démences vasculaires ou mixtes (Erkinjjuntti et coll., 2002

). La mémantine a, de son côté, montré une efficacité sur les symptômes à type d'agitation et d'agressivité (Gauthier et coll., 2005

; Cummings et coll., 2006

).
Antipsychotiques
Les antipsychotiques sont actifs sur les signes psychotiques, sur l'agitation et l'agressivité.
Plusieurs revues de la littérature et des méta-analyses ont été réalisées sur ce sujet. La plus récente (Sink et coll., 2005

) concerne les articles publiés entre 1966 et 2004 dans les bases
Medline et
Cochrane. Pour les neuroleptiques (antipsychotiques typiques), aucune différence entre les divers médicaments n'a été mise en évidence. L'efficacité est limitée et les effets secondaires fréquents. En ce qui concerne les antipsychotiques atypiques, les résultats montrent une efficacité modeste mais statistiquement significative de l'olanzapine et de la rispéridone avec des effets secondaires minimes à faible dose. Ces antipsychotiques seraient associés chez ces patients avec un risque plus élevé d'accidents vasculaires cérébraux.
Ce dernier point a conduit plusieurs agences de médicaments à publier des recommandations de précautions alors que d'autres études relativisent ce risque. Ainsi, l'étude de Gill et coll. (2005

) a été effectuée chez 17 845 sujets âgés présentant une démence. L'objectif était de comparer l'incidence des hospitalisations pour accident vasculaire cérébral (AVC) chez les patients recevant des antipsychotiques atypiques ou typiques. Après ajustement, les patients utilisant des antipsychotiques atypiques n'avaient pas un risque significativement plus élevé d'AVC comparés à ceux recevant un antipsychotique typique. Une autre méta-analyse (Schneider et coll., 2005

) (
Medline 1966-2005 ;
Cochrane database) indique que les antipsychotiques pourraient être associés avec une légère augmentation du risque de décès comparativement au placebo.
L'évaluation du rapport bénéfice/risque devra donc être documentée et la prescription limitée dans le temps et soumise à une réévaluation fréquente.
Antidépresseurs et autres psychotropes
Les antidépresseurs tricycliques doivent être utilisés avec précaution voire même évités chez les patients détériorés en raison d'effets secondaires fréquents. Il existe des recommandations pour l'utilisation des traitements antidépresseurs chez le sujet âgé mais pas spécifiquement pour les patients présentant une maladie d'Alzheimer. Il faut aussi souligner que le nombre d'études randomisées portant sur l'efficacité des antidépresseurs est très limité. Il est habituellement indiqué (Baldwin et coll., 2003

; Robert, 2004

) de privilégier le recours aux inhibiteurs spécifiques de la recapture de la sérotonine, aux antidépresseurs à double action, aux Imao (inhibiteurs de la monoamine oxydase) de nouvelle génération. La présence d'apathie amènera à préférer les antidépresseurs à double action ou un Imao.
Dans la méta-analyse proposée par Sink et ses collaborateurs (2005

) qui rassemble 21 articles portant sur le traitement des SPCD, cinq études évaluaient l'effet des antidépresseurs. Les résultats indiquent une efficacité seulement pour la dépression. Ces études ont été dans la plupart des cas réalisées chez des patients en institution et les symptômes n'étaient pas regroupés comme dans les études évaluant la fréquence des SPCD. Enfin, il faut signaler l'existence de deux études contrôlées sur la carbamazépine avec des résultats contradictoires.
En conclusion,
qu'ils concernent l'hyperactivité, la psychose, les troubles de l'affectif ou encore l'apathie, les symptômes psychologiques et comportementaux des démences appartiennent au tableau clinique de la maladie d'Alzheimer. Ils sont très fréquents, chez plus de 80 % des patients. L'évaluation et la prise en charge de ces symptômes sont indispensables aux différents stades, d'autant qu'ils précipitent l'évolution de la maladie, favorisent le recours à l'institutionnalisation, entravent la qualité de vie des patients et alourdissent le fardeau des aidants informels et de l'équipe soignante.
Bibliographie
[1] aalten p,
de vugt me,
lousberg r,
korten e,
jaspers n. Behavioral problems in dementia: a factor analysis of the neuropsychiatric inventory.
Dement Geriatr Cogn Disord. 2003;
15:99
-105

[2] aalten p,
verhey f,
boziki m,
bullock r,
byrne ej. Neuropsychiatric syndromes in dementia; results from the european alzheimer disease consortium.
Dement Geriatr Cogn Dis. sous presse;
:
-

[3]anaes. Prise en charge non médicamenteuse de la maladie d’Alzheimer et des troubles apparentés.
Paris:;
2003.

[4] baldwin rc,
anderson d,
black s,
evans s,
jones r. Guideline for the management of late-life depression in primary care.
Int J Geriatr Psychiatry. 2003;
18:829
-838

[5] benoit m,
koulibaly pm,
migneco o,
darcourt j,
pringuey dj,
robert ph. Brain perfusion in Alzheimer’s disease with and without apathy: a SPECT study with statistical parametric mapping analysis.
Psychiatry Research: Neuroimaging. 2002;
114:103
-111

[6] benoit m,
staccini p,
brocker p,
benhamidat t,
bertogliati c. Symptômes comportementaux et psychologiques dans la maladie d’Alzheimer : Résultats de l’étude REAL.FR.
Revue de Médecine Interne. 2003;
24:319s
-324s

[7] benoit m,
robert ph,
staccini p,
brocker p,
guerin o. One-year longitudinal evaluation of neuropsychiatric symptoms in Alzheimer’s disease. The REAL.FR study.
The Journal of Nutrition Health and Aging. 2005;
9:95
-99

[8] benoit m,
arbus c,
blanchard f,
camus v,
cerase v. Concertation professionnelle sur le traitement de l’agitation, de l’agressivité, de l’opposition et des troubles psychotiques dans les démences.
La Revue de Gériatrie. novembre 2006;
Tome 31, N°9:
-

[9] berger ak,
fratiglioni l,
forsell y,
windblad b,
bâckman l. The ocurrence of depressive symptoms in the preclinical phase of A.D. A population-base study.
Neurology. 1999;
53:1998
-2002

[10] birks j,
harvey rj. Donepezil for dementia due to alzheimer’s disease.
The Cochrane Library. 2006;
:1
-50

[11] black w,
almeida op. A systematic review of the association between the behavioral and psychological symptoms of demenetia and burden of care.
International Psychogeriatrics. 2004;
16:295
-315

[12] burgio ld,
butler fr,
roth dl,
hardin jm,
hsu cc,
ung k. Agitation in nursing home residents: the role of gender and social context.
Int Psychogeriatr. 2000;
12:495
-511

[13] byrne ej. BPSD in Europe: a report of the EADC thematic group.
International Psychogeriatrics. 2003;
15:95
-96

[14] chan-palay v,
asan e. Alterations in catecholamine neurons of the locus coeruleus in senile dementia of the Alzheimer type and in Parkinson’s disease with and without dementia and depression.
J Comp Neurol. 1989;
287:373
-392

[15] chen cplh,
adler jt,
bowen dm. Presynaptic serotonergic markers in community-acquired cases of Alzheimer’s disease: correlations with depression and medication.
Journal of Neurochemistry. 1996;
66:1592
-1598

[16] cohen-mansfield j. Agitation in the ederly.
In: bilig n, rabins p, editors.
Advances in psychosomatic medicine: Geriatric psychiatry.
Switzerland:Karger S;
1989.
p. 101
-113

[17] craig ah,
cummings jl,
fairbanks l,
itti l,
miller b. Cerebral blood flow correlates of apathy in Alzheimer disease.
Arch Neuro. 1996;
53:1116
-1120

[18] cummings jl. The neuropsychiatry of Alzheimer’s disease and related dementia.
London:Martin Dunitz;
2003.

[19] cummings jl,
mega ms. Neuropsychiatry and behavioral neuroscience.
Oxford:Oxford University Press;
2003.

[20] cummings jl,
mega ms,
gray k,
rosemberg-thompson s,
gornbein t. The Neuropsychiatric Inventory: Comprehensive assessment of psychopathology in dementia.
Neurology. 1994;
44:2308
-2314

[21] cummings jl,
schneider l,
tariot pn,
kershaw pr,
yuan w. Reduction of behavioral disturbances and caregiver distress by galantamine in patients with Alzheimer’s disease.
American Journal of Psychiatry. 2004;
161:532
-538

[22] cummings j,
schneider e,
tariot pn,
graham sn. Behavioural effects of memantine in Alzheimer disease patients receiving donepezil treatment.
Neurology. 2006;
67:57
-63

[23] erkinjuntti t,
kurz a,
gauthier s,
bullock r,
lilienfeld s,
damaraju cv. Efficacy of galantamine in probable vascular dementia and Alzheimer’s disease combined with cerebrovascular disease: a randomised trial.
Lancet. 2002;
359:1283
-1290

[24] eustace a,
coen r,
walsh c,
cunningham cj,
walsh jb. A longitudinal evaluation of behavioural and psychological symptoms of probable Alzheimer’s disease.
Int J Geriatr Psychiatry. 2002;
17:968
-973

[25] feldman h,
scheltens p,
scarpini e,
hermann n,
mesenbrink p. Behavioral symptoms in mild cognitive impairment.
Neurology. 2004;
62:1199
-1201

[26] finkel si,
costa e silva j,
cohen g,
miller s,
sartorius n. Behavioral and psychological signs and symptoms of dementia: A consensus statement on current knowledge and implications for research and treatment.
International Psychogeriatrics. 1996;
8:497
-500

[27] forstl h,
burns a,
luthert p,
cairns n,
lantos p,
levy r. Clinical and neuropathological correlates of depression in Alzheimer’s disease.
Psychol Med. 1992;
22:877
-884

[28] frisoni gb,
rozzini l,
gozzetti a. Behavioral syndromes in Alzheimer’s disease: description and correlates.
Dement Geriatr Cogn Dis. 1999;
10:130
-138

[29] fuh jl,
liu ck,
mega ms,
wang sj,
cummings jl. Behavioral disorders and caregivers’ reaction in Taiwanese patients with Alzheimer’s disease.
Int Psychogeriatr. 2001;
13:121
-128

[30] gauthier s,
wirth y,
mobius hj. Effects of memantine on behavioural symptoms in Alzheimer’s disease patients; an analysis of the neuropsychiatric inventory data of two randomized controlled studies.
Int J Geriatr Psychiatry. 2005;
20:459
-464

[31] geda ye,
smith ge,
knopman ds,
boeve bf,
tangalos eg. De novo genesis of neuropsychiatric symptoms in mild cognitive impairment (MCI).
Int Psychogeriatr. 2004;
16:51
-60

[32] geroldi c,
akkawi nm,
galluzzi s,
ubezio m,
binetti g. Temporal lobe asymmetry in patients with Alzheimer’s disease with delusions.
J Neurol Neurosurg Psychiatry. 2000;
69:187
-191

[33] gill s,
rochon pa,
herrmann n,
lee pe,
sykora k. Atypical antipsychotic drugs and risk of ischaemic stroke: population based retrospective cohort study.
British Medical Journal. 2005;
330:445

[34] hirono n,
mori e,
ishii k,
ikejiri y,
imamura t. Frontal lobe hypometabolism and depression in Alzheimer’s disease.
Neurology. 1998;
50:380
-383

[35] hirono n,
mega ms,
dinov id,
mishkin f,
cummings jl. Left frontotemporal hypoperfusion is associated with aggression in patients with dementia.
Arch Neuro. 2000;
57:861
-866

[36] hoe j,
hancock g,
livingston g,
orrell m. Quality of life of people with dementia in residential care homes.
Brit J Psychiat. 2006;
188:460
-464

[37] hollingworth p,
hamshere ml,
moskvina v,
dowzell k,
moore pj. Four components describe behavioral symptoms in 1120 individuals with late-onset Alzheimer’s disease.
J Am Geriatr Soc. 2006;
54:1348
-1354

[38] holthoff v,
baumann b,
kalbe e,
ludecke s,
lenz o. Regional cerbral metabolism in early alzheimer’s disease with clinically signifiant apathy or depression.
Biol Psychiatry. 2005;
57:412
-421

[39] hwang tj,
masterman dl,
ortiz f,
fairbanks la,
cummings jl. Mild cognitive impairment is associated with characteristic neuropsychiatric symptoms.
Alzheimer Dis Assoc Disord. 2004;
18:17
-21

[40] levy ml,
cummings jl,
fairbanks la,
masterman d,
miller bl. Apathy is not depression.
J Neuropsy Clin N. 1998;
10:314
-319

[41] livingston g,
johnston k,
katona c,
paton j,
lyketsos cg. Systematic review of psychological approaches to the management of neuropsychiatric symptoms of dementia.
Am J Psychiatry. 2005;
162:1996
-2021

[42] low lf,
brodaty h,
draper b. A study of premorbid personality and behavioural and psychological symptoms of dementia in nursing home residents.
Int J Geriatr Psychiatry. 2002;
17:779
-783

[43] marin rs,
biedrzycki rc,
firinciogullari s. Reliability and validity of the Apathy Evaluation Scale.
Psychiatry Res. 1991;
38:143
-162

[44] marin rs,
fogel bs,
hawkins j,
duffy j,
krupp b. Apathy: A treatable syndrome.
J of Neuropsychiatry and Clinical Neurosciences. 1995;
7:23
-30

[45] marshall g,
fairbanks l,
tekin s,
vinters hv,
cummings jl. Neuropathologic correlates of apathy in Alzheimer’s disease.
Dement Geriatr Cogn Dis. 2006;
21:144
-147

[46] matsui t,
nakaaki s,
murata y,
sato j,
shinagawa y. Determinant of the quality of life in Alzheimer’s disease patients as assessed by the japanese version of the Quality of Life-Alzheimer’s disease scale.
Dement Geriatr Cogn Dis. 2006;
21:182
-191

[47] matthews kl,
chen cp,
esiri mm,
keene j,
minger sl,
francis pt. Noradrenergic changes, aggressive behavior, and cognition in patients with dementia.
Biol Psychiatry. 2002;
51:407
-416

[48] mccurry sm,
gibbons le,
logsdon rg,
vitiello mv,
teri l. Nightime insomnia treatment and education for Alzheimer’s disease; a randomized controlled trial.
J Am Geriatr Soc. 2005;
53:793
-802

[49] mckeith i,
del ser t,
spano p,
emre m,
wesnes k. Efficacy of rivastigmine in dementia with lewy bodies: a randomised, double blind, placebo-controlled international study.
Lancet. 2000;
356:2031
-2036

[50] mckeith i,
cummings j. Behavioural changes and psychological symptoms in dementia disorders.
Lancet Neurol. 2005;
4:735
-742

[51] mega ms,
cummings jl,
fiorello t. The spectrum of behavioral changes in Alzheimer’s disease.
Neurology. 1996;
46:130
-135

[52] mega ms,
lee l,
dinov id,
mishkin f,
toga aw,
cummings jl. Cerebral correlates of psychotic symptoms in Alzheimer’s disease.
J Neurol Neurosurg Psychiatry. 2000;
69:167
-171

[53] meins w,
frey a,
thiesemann r. Premorbid personality traits in Alzheimer’s disease: do they predispose to noncognitive behavioral symptoms?.
Int Psychogeriatr. 1998;
10:369
-378

[54] migneco o,
benoît m,
koulibaly pm,
dygai i,
bertogliati c. Perfusion brain SPECT and statistical parametric mapping analysis indicate that apathy is a cingulate syndrome: a study in alzheimer’s disease and non demented patients.
NeuroImage. 2001;
13:896
-902

[55] mirakhur a,
craig d,
hart dj,
mcllroy sp,
passmore ap. Behavioral and psychological syndromes in Alzheimer’s Disease.
Int J Geriatr Psychiatry. 2004;
19:1035
-1039

[56] monastero r,
mariani e,
camarda c,
ingegni t,
averna m. Association between apolipoprotein E4 allele and apathy in probable Alzheimer’s disease.
Acta Psychiat Scand. 2006;
113:59
-63

[57] murman dl,
colenda c. The economic impact of neuropsychiatric symptoms in Alzheimer’s disease.
Pharmacoeconomics. 2005;
23:227
-242

[58] ownby r,
crocco e,
acevdo a. Depression and risk for Alzheimer Disease.
Arch Gen Psychiatry. 2006;
63:530
-538

[59] reisberg b,
borenstein j,
salob sp,
ferris sh,
franssen e. Behavioral symptoms in Alzheimer’s disease: Phenomenology and treatment.
J Clin Psychiatry. 1987;
48:9
-15

[60] robert p. Traitement des dépréssions du sujet âgé.
Revue du Praticien. 2004;
54:734
-738

[61] robert ph,
benoit m. Bases anatomiques des comportements et émotions.
In: paris e, editors.
Encyclopédie Médico-Chirurgicale..
Paris:Elsevier;
2001.
p. 530
-530

[62] robert ph,
clairet s,
benoit m,
koutaich j,
bertogliati c. The Apathy Inventory: assessment of apathy and awareness in Alzheimer’s disease, Parkinson’s disease and mild cognitive impairment.
International Journal of Geriatric Psychiatry. 2002;
17:1099
-1105

[63] robert p,
verhey f,
byrne ej,
hurt c,
de deyn pp. Grouping for behavioral and psychological symptoms in dementia: clinical and biological aspects. Consensus paper of the European Alzheimer disease consortium.
Eur Psychiatry. 2005;
20:490
-496

[64] robert p,
byrne ej,
aalten p,
verhey f,
nobili f. Apathy and depressive symptoms in Alzheimer’s Disease: results from the European Alzheimer’s Disease consortium.
Alzheimer’s and Dementia. 2006a;
2:S225

[65] robert p,
berr c,
volteau m,
bertogliati c,
benoit m. Neuropsychological performance in mild cognitive impairment with and without apathy.
Dement Geriatr Cogn Dis. 2006b;
21:192
-197

[66] robert p,
berr c,
volteau m,
bertogliati c,
benoit m. Apathy in patients with mild cognitive impairment and the risk of developing dementia of Alzheimer’s disease: a one year follow up study.
Clinical Neurology and Neurosurgery. 2006c;
108:733
-736

[67] robert p,
darcourt g,
koulibaly m,
clairet s,
benoit m. Lack of initiative and interest in Alzheimer’s disease. A single Photon Computed tomography study.
European Neurology. 2006d;
13:729
-735

[68] schneider ls,
dagerman ks,
insel p. Risk of death with atypical antipsychotic drug treatment for dementia: meta-analysis of randomized placebo-controlled trials.
Jama. 2005;
294:1934
-1943

[69] sink k,
holden k,
yaffe k. Pharmacological treatment of neuropsychiatric symptoms of dementia.
JAMA. 2005;
293:596
-608

[70] sink k,
covinsky ke,
barnes de,
newcomer rj,
yaffe k. Caregiver characteristics are associated with neuropsychiatric symptoms of dementia.
J Am Geriatr Soc. 2006;
54:796
-803

[71] spalleta g,
baldinetti f,
buccione i,
fadda l,
perri r. Cognition and behaviour are independent and heterogeneous dimensions in Alzheimer’s disease.
J Neurol. 2004;
251:688
-695

[72] starkstein se,
vazquez s,
migliorelli r,
teson a,
sabe l,
leiguarda r. A single-photon emission computed tomographic study of anosognosia in Alzheimer’s disease.
Arch Neurol. 1995;
52:415
-420

[73] tekin s,
mega ms,
masterman dm,
chow t,
garakian j. Orbitofrontal and anterior cingulate cortex neurofibrillary tangle burden is associated with agitation in Alzheimer disease.
Ann Neurol. 2001;
49:355
-361

[74] verhey f,
aalten p,
de vugt me. Incidence, prevalence and persistence of behavioral disorders in dementia.
International Psychogeriatrics. 2003;
15:S034
-002

[75] yesavage ja,
brink tl,
rose tl,
lum o,
huang v. Development and validation of a geriatric depression scale: a preliminary report.
J Psychiatry Res. 1983;
17:37
-49

→ Aller vers SYNTHESE
 ). Ils apparaissent spécifiquement à la suite d'une atteinte d'un système ou d'un circuit, comme le système limbique ou les circuits cortico-sous-corticaux. Les maladies dégénératives comme la maladie d'Alzheimer produisent à la fois des altérations structurales et chimiques et les troubles neuropsychiatriques peuvent être influencés soit par l'un soit par l'autre de ces changements.
). Ils apparaissent spécifiquement à la suite d'une atteinte d'un système ou d'un circuit, comme le système limbique ou les circuits cortico-sous-corticaux. Les maladies dégénératives comme la maladie d'Alzheimer produisent à la fois des altérations structurales et chimiques et les troubles neuropsychiatriques peuvent être influencés soit par l'un soit par l'autre de ces changements. ).
). ) ou comme l'Inventaire neuropsychiatrique (NPI, Cummings et coll., 1994
) ou comme l'Inventaire neuropsychiatrique (NPI, Cummings et coll., 1994 ). D'autres échelles s'intéressent spécifiquement à une symptomatologie donnée comme l'échelle d'agitation de Cohen-Mansfield (Cohen-Mansfield, 1989
). D'autres échelles s'intéressent spécifiquement à une symptomatologie donnée comme l'échelle d'agitation de Cohen-Mansfield (Cohen-Mansfield, 1989 ), l'échelle de dépression gériatrique (Yesavage et coll., 1983
), l'échelle de dépression gériatrique (Yesavage et coll., 1983 ) ou l'Inventaire apathie (Robert et coll., 2002
) ou l'Inventaire apathie (Robert et coll., 2002 ). Dans la majorité des cas, l'évaluation est effectuée à partir d'un entretien avec un accompagnant informé des comportements du patient. Les auto-évaluations du patient sont moins utilisées. À côté de l'évaluation de la fréquence et de la sévérité des symptômes, il existe aussi une évaluation du fardeau (par exemple, échelle de Zarit) et/ou du retentissement des troubles du comportement sur l'aidant (NPI).
). Dans la majorité des cas, l'évaluation est effectuée à partir d'un entretien avec un accompagnant informé des comportements du patient. Les auto-évaluations du patient sont moins utilisées. À côté de l'évaluation de la fréquence et de la sévérité des symptômes, il existe aussi une évaluation du fardeau (par exemple, échelle de Zarit) et/ou du retentissement des troubles du comportement sur l'aidant (NPI). ). Un tiers des patients présentent des symptômes qui ont une intensité sévère (Eustace et coll., 2002
). Un tiers des patients présentent des symptômes qui ont une intensité sévère (Eustace et coll., 2002 ). La fréquence tend généralement à augmenter avec la sévérité du déficit cognitif même si des pics peuvent survenir à des moments particuliers de l'évolution. Par exemple, les symptômes dépressifs ou l'apathie sont fréquents dans des formes légères à modérées. La majorité des études évaluant la fréquence des SPCD ont été effectuées avec l'Inventaire neuropsychiatrique. Le tableau 9.I
). La fréquence tend généralement à augmenter avec la sévérité du déficit cognitif même si des pics peuvent survenir à des moments particuliers de l'évolution. Par exemple, les symptômes dépressifs ou l'apathie sont fréquents dans des formes légères à modérées. La majorité des études évaluant la fréquence des SPCD ont été effectuées avec l'Inventaire neuropsychiatrique. Le tableau 9.I présente les résultats des principales études européennes. Ces résultats sont équivalents à ceux de l'étude américaine de Mega et coll. (1996
présente les résultats des principales études européennes. Ces résultats sont équivalents à ceux de l'étude américaine de Mega et coll. (1996 ) mais portent sur une population plus importante. Quelle que soit la sévérité, le symptôme le plus fréquemment rencontré est l'apathie, suivi des symptômes dépressifs et de l'anxiété.
) mais portent sur une population plus importante. Quelle que soit la sévérité, le symptôme le plus fréquemment rencontré est l'apathie, suivi des symptômes dépressifs et de l'anxiété. ), réalisée par le groupe de l'European Alzheimer's Disease Consortium (EADC) sur un nombre de patients important (n=2 354), isole 4 syndromes :
), réalisée par le groupe de l'European Alzheimer's Disease Consortium (EADC) sur un nombre de patients important (n=2 354), isole 4 syndromes : ) ont effectué une revue systématique de la littérature afin de réaliser une méta-analyse. Dans un premier temps, 153 études ont été sélectionnées ; seulement 20 d'entre elles présentaient des données suffisantes pour apprécier le niveau de risque associé à la dépression. Ces 20 études fournissent des données sur un échantillon de 102 172 personnes provenant de 8 pays différents.
) ont effectué une revue systématique de la littérature afin de réaliser une méta-analyse. Dans un premier temps, 153 études ont été sélectionnées ; seulement 20 d'entre elles présentaient des données suffisantes pour apprécier le niveau de risque associé à la dépression. Ces 20 études fournissent des données sur un échantillon de 102 172 personnes provenant de 8 pays différents. et 1995
et 1995 ). Ces symptômes ont longtemps été regroupés par erreur sous le cadre des symptômes dépressifs alors que l'apathie diffère de la dépression (Lévy et coll., 1998
). Ces symptômes ont longtemps été regroupés par erreur sous le cadre des symptômes dépressifs alors que l'apathie diffère de la dépression (Lévy et coll., 1998 ), même si les deux lignées symptomatiques peuvent être associées (Robert et coll., 2006a
), même si les deux lignées symptomatiques peuvent être associées (Robert et coll., 2006a ).
). ; Geda et coll., 2004
; Geda et coll., 2004 ; Hwang et coll., 2004
; Hwang et coll., 2004 ). L'analyse précise de la symptomatologie clinique montre que les premiers symptômes neuropsychiatriques observés sont dans le champ de l'apathie (perte d'intérêt, perte d'initiative) mais ne sont pas spécifiquement dépressifs, même quand la dépression est mise au premier plan (Berger et coll., 1999
). L'analyse précise de la symptomatologie clinique montre que les premiers symptômes neuropsychiatriques observés sont dans le champ de l'apathie (perte d'intérêt, perte d'initiative) mais ne sont pas spécifiquement dépressifs, même quand la dépression est mise au premier plan (Berger et coll., 1999 ). Récemment, il a été aussi montré que les patients atteints de MCI et présentant une symptomatologie apathique avaient des performances de mémoire significativement plus faibles que les patients atteints de MCI sans apathie (Robert et coll., 2006b
). Récemment, il a été aussi montré que les patients atteints de MCI et présentant une symptomatologie apathique avaient des performances de mémoire significativement plus faibles que les patients atteints de MCI sans apathie (Robert et coll., 2006b ). Enfin, les symptômes apathiques étaient présents très précocement chez les patients présentant un MCI et qui allaient développer une maladie d'Alzheimer, alors que ce n'était pas le cas pour les symptômes anxieux ou dépressifs (Robert et coll., 2006c
). Enfin, les symptômes apathiques étaient présents très précocement chez les patients présentant un MCI et qui allaient développer une maladie d'Alzheimer, alors que ce n'était pas le cas pour les symptômes anxieux ou dépressifs (Robert et coll., 2006c ).
). ). Parmi ces facteurs, il faut souligner l'importance :
). Parmi ces facteurs, il faut souligner l'importance : ) ;
) ; ) ;
) ; ; Low et coll., 2002
; Low et coll., 2002 ).
). ; Mignéco et coll., 2001
; Mignéco et coll., 2001 ; Benoit et coll., 2002
; Benoit et coll., 2002 ; Benoit et coll., 2005
; Benoit et coll., 2005 ; Holthoff et coll., 2005
; Holthoff et coll., 2005 ; Robert et coll., 2006d
; Robert et coll., 2006d ) ont mis en évidence l'existence d'une relation entre la présence d'apathie et une hypoperfusion prédominant au niveau des régions fronto-médianes (cingulum, région orbito-frontale). D'autres études ont souligné que la présence d'apathie était associée à une augmentation des lésions neuropathologiques au niveau du cingulum antérieur (Marshall et coll., 2006
) ont mis en évidence l'existence d'une relation entre la présence d'apathie et une hypoperfusion prédominant au niveau des régions fronto-médianes (cingulum, région orbito-frontale). D'autres études ont souligné que la présence d'apathie était associée à une augmentation des lésions neuropathologiques au niveau du cingulum antérieur (Marshall et coll., 2006 ), à une plus grande fréquence du gène APOE4 (Monastero et coll., 2006
), à une plus grande fréquence du gène APOE4 (Monastero et coll., 2006 ), et enfin à une atteinte préférentielle des systèmes de neurotransmission cholinergique et dopaminergique (Cummings, 2003
), et enfin à une atteinte préférentielle des systèmes de neurotransmission cholinergique et dopaminergique (Cummings, 2003 ).
). ; Hirono et coll., 1998
; Hirono et coll., 1998 ; Holthoff et coll., 2005
; Holthoff et coll., 2005 ). Les patients présentant une maladie d'Alzheimer et des symptômes dépressifs auraient une plus grande perte cellulaire au niveau du locus coeruleus (Chan-Palay et Asan, 1989
). Les patients présentant une maladie d'Alzheimer et des symptômes dépressifs auraient une plus grande perte cellulaire au niveau du locus coeruleus (Chan-Palay et Asan, 1989 ; Forstl et coll., 1992
; Forstl et coll., 1992 ) et une diminution du taux de recapture de la sérotonine au niveau cortical (Chen et coll., 1996
) et une diminution du taux de recapture de la sérotonine au niveau cortical (Chen et coll., 1996 ), ceci comparativement aux patients sans symptôme dépressif.
), ceci comparativement aux patients sans symptôme dépressif. ; Mega et coll., 2000
; Mega et coll., 2000 ) ainsi qu'une atrophie frontale et temporale plus importante (Geroldi et coll., 2000
) ainsi qu'une atrophie frontale et temporale plus importante (Geroldi et coll., 2000 ). L'atteinte des circuits fronto-sous-corticaux est plus souvent associée à des comportements agités, agressifs, désinhibés ou des symptômes délirants. Un taux plus élevé de dégénérescence neurofibrillaire au niveau orbito-frontal a été mis en relation avec la présence de symptômes psychotiques. Par ailleurs, la densité des plaques séniles et des dépôts neurofibrillaires serait plus élevée dans le prosubicullum et le cortex frontal médian (Tékin et coll., 2001
). L'atteinte des circuits fronto-sous-corticaux est plus souvent associée à des comportements agités, agressifs, désinhibés ou des symptômes délirants. Un taux plus élevé de dégénérescence neurofibrillaire au niveau orbito-frontal a été mis en relation avec la présence de symptômes psychotiques. Par ailleurs, la densité des plaques séniles et des dépôts neurofibrillaires serait plus élevée dans le prosubicullum et le cortex frontal médian (Tékin et coll., 2001 ). Enfin, le déficit cholinergique serait aussi plus prononcé (Matthews et coll., 2002
). Enfin, le déficit cholinergique serait aussi plus prononcé (Matthews et coll., 2002 ).
). ). Parallèlement, les accompagnants de ces patients évaluaient l'intensité du fardeau d'une manière plus importante à l'échelle de Zarit ;
). Parallèlement, les accompagnants de ces patients évaluaient l'intensité du fardeau d'une manière plus importante à l'échelle de Zarit ; ) soutiennent l'idée que les SPCD sont associés avec la charge de soins, la détresse psychologique et la dépression de l'accompagnant. Une autre étude (Sink et coll., 2006
) soutiennent l'idée que les SPCD sont associés avec la charge de soins, la détresse psychologique et la dépression de l'accompagnant. Une autre étude (Sink et coll., 2006 ) a analysé, chez 5 788 patients, les caractéristiques des accompagnants et a mis en évidence une relation indiquant que les accompagnants qui étaient plus jeunes, qui avaient un niveau d'éducation moins élevé, qui étaient moins déprimés, qui ressentaient moins la charge des soins ou qui passaient moins d'heures par semaine à donner des soins, rapportaient plus de SPCD que les autres. Ceci conduit à toujours tenir compte de la dynamique entre le patient et l'accompagnant quand on est amené à évaluer des SPCD ;
) a analysé, chez 5 788 patients, les caractéristiques des accompagnants et a mis en évidence une relation indiquant que les accompagnants qui étaient plus jeunes, qui avaient un niveau d'éducation moins élevé, qui étaient moins déprimés, qui ressentaient moins la charge des soins ou qui passaient moins d'heures par semaine à donner des soins, rapportaient plus de SPCD que les autres. Ceci conduit à toujours tenir compte de la dynamique entre le patient et l'accompagnant quand on est amené à évaluer des SPCD ; ) ont mis en évidence qu'une aggravation de 1 point au NPI est associée avec une augmentation de 247 à 409 $US par an sur les coûts directs de soins pour la maladie d'Alzheimer.
) ont mis en évidence qu'une aggravation de 1 point au NPI est associée avec une augmentation de 247 à 409 $US par an sur les coûts directs de soins pour la maladie d'Alzheimer. ).
). ), il est régulièrement rappelé que le premier traitement des SCPD est non pharmacologique et que ce n'est que dans un deuxième temps que doit intervenir l'approche pharmacologique.
), il est régulièrement rappelé que le premier traitement des SCPD est non pharmacologique et que ce n'est que dans un deuxième temps que doit intervenir l'approche pharmacologique. ).
). ).
). ).
). ). Les recommandations et consensus d'experts indiquent que ce type de traitements peut être bénéfique chez certains patients à certaines périodes de l'évolution. Ces traitements peuvent se décomposer en différentes techniques :
). Les recommandations et consensus d'experts indiquent que ce type de traitements peut être bénéfique chez certains patients à certaines périodes de l'évolution. Ces traitements peuvent se décomposer en différentes techniques : ). Les symptômes les plus particulièrement sensibles sont l'apathie, les symptômes dépressifs, les hallucinations, le délire (Cummings et coll., 2004
). Les symptômes les plus particulièrement sensibles sont l'apathie, les symptômes dépressifs, les hallucinations, le délire (Cummings et coll., 2004 ). Leur efficacité sur les SPCD a été aussi mise en évidence dans la maladie à corps de Lewy (McKeith et coll., 2000
). Leur efficacité sur les SPCD a été aussi mise en évidence dans la maladie à corps de Lewy (McKeith et coll., 2000 ) ou dans les démences vasculaires ou mixtes (Erkinjjuntti et coll., 2002
) ou dans les démences vasculaires ou mixtes (Erkinjjuntti et coll., 2002 ). La mémantine a, de son côté, montré une efficacité sur les symptômes à type d'agitation et d'agressivité (Gauthier et coll., 2005
). La mémantine a, de son côté, montré une efficacité sur les symptômes à type d'agitation et d'agressivité (Gauthier et coll., 2005 ; Cummings et coll., 2006
; Cummings et coll., 2006 ).
). ) concerne les articles publiés entre 1966 et 2004 dans les bases Medline et Cochrane. Pour les neuroleptiques (antipsychotiques typiques), aucune différence entre les divers médicaments n'a été mise en évidence. L'efficacité est limitée et les effets secondaires fréquents. En ce qui concerne les antipsychotiques atypiques, les résultats montrent une efficacité modeste mais statistiquement significative de l'olanzapine et de la rispéridone avec des effets secondaires minimes à faible dose. Ces antipsychotiques seraient associés chez ces patients avec un risque plus élevé d'accidents vasculaires cérébraux.
) concerne les articles publiés entre 1966 et 2004 dans les bases Medline et Cochrane. Pour les neuroleptiques (antipsychotiques typiques), aucune différence entre les divers médicaments n'a été mise en évidence. L'efficacité est limitée et les effets secondaires fréquents. En ce qui concerne les antipsychotiques atypiques, les résultats montrent une efficacité modeste mais statistiquement significative de l'olanzapine et de la rispéridone avec des effets secondaires minimes à faible dose. Ces antipsychotiques seraient associés chez ces patients avec un risque plus élevé d'accidents vasculaires cérébraux. ) a été effectuée chez 17 845 sujets âgés présentant une démence. L'objectif était de comparer l'incidence des hospitalisations pour accident vasculaire cérébral (AVC) chez les patients recevant des antipsychotiques atypiques ou typiques. Après ajustement, les patients utilisant des antipsychotiques atypiques n'avaient pas un risque significativement plus élevé d'AVC comparés à ceux recevant un antipsychotique typique. Une autre méta-analyse (Schneider et coll., 2005
) a été effectuée chez 17 845 sujets âgés présentant une démence. L'objectif était de comparer l'incidence des hospitalisations pour accident vasculaire cérébral (AVC) chez les patients recevant des antipsychotiques atypiques ou typiques. Après ajustement, les patients utilisant des antipsychotiques atypiques n'avaient pas un risque significativement plus élevé d'AVC comparés à ceux recevant un antipsychotique typique. Une autre méta-analyse (Schneider et coll., 2005 ) (Medline 1966-2005 ; Cochrane database) indique que les antipsychotiques pourraient être associés avec une légère augmentation du risque de décès comparativement au placebo.
) (Medline 1966-2005 ; Cochrane database) indique que les antipsychotiques pourraient être associés avec une légère augmentation du risque de décès comparativement au placebo. ; Robert, 2004
; Robert, 2004 ) de privilégier le recours aux inhibiteurs spécifiques de la recapture de la sérotonine, aux antidépresseurs à double action, aux Imao (inhibiteurs de la monoamine oxydase) de nouvelle génération. La présence d'apathie amènera à préférer les antidépresseurs à double action ou un Imao.
) de privilégier le recours aux inhibiteurs spécifiques de la recapture de la sérotonine, aux antidépresseurs à double action, aux Imao (inhibiteurs de la monoamine oxydase) de nouvelle génération. La présence d'apathie amènera à préférer les antidépresseurs à double action ou un Imao. ) qui rassemble 21 articles portant sur le traitement des SPCD, cinq études évaluaient l'effet des antidépresseurs. Les résultats indiquent une efficacité seulement pour la dépression. Ces études ont été dans la plupart des cas réalisées chez des patients en institution et les symptômes n'étaient pas regroupés comme dans les études évaluant la fréquence des SPCD. Enfin, il faut signaler l'existence de deux études contrôlées sur la carbamazépine avec des résultats contradictoires.
) qui rassemble 21 articles portant sur le traitement des SPCD, cinq études évaluaient l'effet des antidépresseurs. Les résultats indiquent une efficacité seulement pour la dépression. Ces études ont été dans la plupart des cas réalisées chez des patients en institution et les symptômes n'étaient pas regroupés comme dans les études évaluant la fréquence des SPCD. Enfin, il faut signaler l'existence de deux études contrôlées sur la carbamazépine avec des résultats contradictoires.