Problématiques de santé publique
2007
16-
Facteurs de risque et facteurs de protection
La liste des facteurs dont l'association avec la maladie d'Alzheimer a fait l'objet d'études est désormais très longue depuis les premiers travaux des années 1980-1990. Même si l'on peut aujourd'hui s'appuyer sur des résultats d'études de cohorte et de premières études randomisées, il est encore difficile d'identifier précisément le ou les facteurs pour lesquels il faut proposer une étude d'intervention. Des déceptions dans ce domaine ont déjà été rencontrées avec, par exemple, le cas des traitements hormonaux de la ménopause (THM). Les résultats des études d'observation, en faveur d'un rôle protecteur des THM (Leblanc et coll., 2001

) sont en discordance avec ceux d'un grand essai randomisé, la WHIMS
(Women's Health Initiative Memory Study) (Shumaker et coll., 2003

et 2004

) qui montre une augmentation du risque de démence avec un type de traitement initié chez des femmes âgées de plus de 65 ans.
La recherche de facteurs de risque modifiables est un des enjeux majeurs de la recherche épidémiologique étiologique dans la maladie d'Alzheimer. Elle est actuellement dominée par des travaux sur les facteurs de risque vasculaires avec une montée en puissance des études sur la nutrition, une bonne part de ces facteurs pouvant se rattacher à des modes de vie. Toutefois, d'autres voies méritent d'être explorées, comme la place des antécédents médicaux ou les expositions à certains facteurs environnementaux.
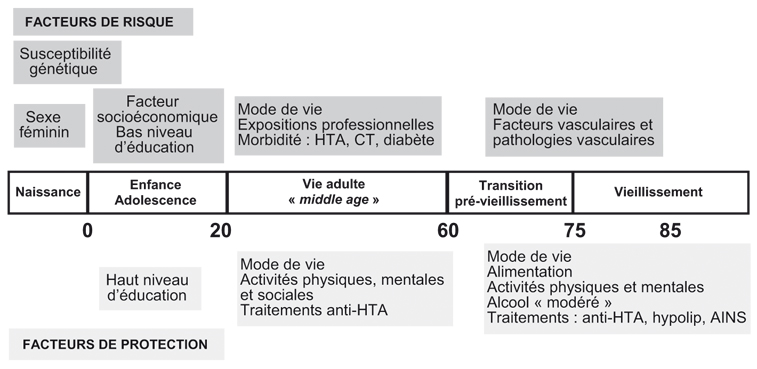
La maladie d'Alzheimer est une maladie du sujet âgé mais on commence à s'intéresser de plus en plus, non pas aux caractéristiques des sujets dans les années précédant le diagnostic, mais plus globalement à la vie entière du sujet, en particulier la période «
midlife », vers 40-50 ans (Fratiglioni et coll., 2004

) (figure 16.1

). Les facteurs pouvant conduire à des maladies chroniques à des âges avancés peuvent avoir leur origine à des périodes précoces de la vie et se cumuler tout au long de celle-ci (Whalley et coll., 2006

). Ces facteurs peuvent aussi avoir des effets différents selon les périodes de la vie comme le suggèrent certains résultats sur l'hypertension artérielle.
Nous n'aborderons pas ici la place des facteurs génétiques traités par ailleurs, mais il faut savoir que de nombreuses études épidémiologiques prennent maintenant systématiquement en compte le phénotype de l'apolipoprotéine E, dont l'allèle ε4 est le seul facteur de risque retrouvé dans toutes les populations. Ce facteur est souvent pris en compte dans les modèles multivariés avec recherche d'éventuelles interactions.
Enfin seront présentées ici des études de cohorte où l'objectif principal est d'étudier les facteurs associés au risque de maladie d'Alzheimer et des travaux où sont examinés les facteurs associés au déclin des fonctions cognitives. Cette dernière approche est plus puissante que la précédente, le nombre de cas incidents de démences n'étant pas nécessairement suffisant pour pouvoir mettre en évidence des facteurs associés à des risques faibles. Même si elle est moins spécifique, les études des facteurs associés au déclin des fonctions cognitives apportent des informations rarement contradictoires avec les résultats des travaux sur les cas de maladie d'Alzheimer incidents. Dans la mesure où des revues de qualité ou des méta-analyses de la littérature ont été publiées récemment pour certains des facteurs étudiés, nous nous référerons à ces travaux sans reprendre le détail de l'ensemble des études.
Facteurs sociodémographiques et mode de vie
Parmi les facteurs sociodémographiques, l'âge demeure le principal facteur de risque de maladie d'Alzheimer. D'autres facteurs sociodémographiques ont été identifiés, tels que le sexe, le niveau d'éducation, la qualité du réseau social et des activités, l'exercice physique et la consommation de tabac ou d'alcool.
Sexe
Les données de prévalence rapportent dans la grande majorité des cas une plus grande fréquence de la démence chez les femmes. En effet, différents auteurs rapportent une prévalence plus élevée de la démence chez les femmes, quelle que soit la population d'origine (Jorm et coll., 1987

; Rocca et coll., 1991

; Bachman et coll., 1992

; Corso et coll., 1992

; Kiyohara et coll., 1994

; Manubens et coll., 1995

; Graves et coll., 1996

; Woo et coll., 1998

; Bowirrat et coll., 2002

; Zhou et coll., 2006

), alors que les études rapportant une prévalence identique dans les deux sexes sont plus rares (Pfeffer et coll., 1987

; Skoog et coll., 1993

; Liu et coll., 1995

; Prencipe et coll., 1996

; Yamada et coll., 1999

; Hebert et coll., 2001

).
Ce résultat peut être lié à différents facteurs. Une durée de la maladie plus longue chez les femmes est évoquée car les femmes atteintes de démence auraient d'après certains travaux une survie plus longue que les hommes déments. Ainsi, un suivi de plus de 500 cas incidents de maladie d'Alzheimer pendant plus de 5 ans rapporte une médiane de survie respectivement de 4,2 ans et 5,7 ans chez les hommes et les femmes (Larson et coll., 2004

). Une plus grande fréquence de facteurs de risque de la maladie chez les femmes, comme, par exemple, des facteurs hormonaux, des facteurs génétiques ou socioculturels comme un bas niveau d'éducation a également été évoquée. Cependant, une analyse des données longitudinales de la cohorte Paquid, ayant pris en compte de façon simultanée le sexe et le niveau d'éducation retrouve une incidence de la maladie plus élevée chez les femmes qui n'est pas expliquée par la différence du niveau d'éducation entre les hommes et les femmes (Letenneur et coll., 1999

).
Cette différence liée au genre n'est pas trouvée de manière unanime dans les études d'incidence avec certaines études qui retrouvent tantôt une incidence plus élevée chez les femmes, tantôt une incidence identique entre les deux sexes. Toutefois, deux méta-analyses (Gao et coll., 1998

; Launer et coll., 1999

) ont montré une incidence plus élevée chez les femmes.
Ce résultat est à moduler selon l'âge des sujets avec une incidence de la démence qui serait plus élevée chez les femmes très âgées mais pas chez les plus jeunes (Fratiglioni et coll., 1997

; Jorm et Jolley, 1998

). Ainsi dans l'étude Paquid, l'incidence de la démence comme de la maladie d'Alzheimer est plus élevée chez les hommes avant 80 ans et plus élevée chez les femmes à partir de 80 ans (tableau 16.I

). Les hypothèses explicatives sont multiples même si un biais de survie sélective ne peut être écarté.
Tableau 16.I Incidence de la démence et de la maladie d'Alzheimer selon l'âge et le sexe d'après les données de la cohorte Paquid (1989-1995) (n=2 881) (d'après Letenneur, 1999 )
)
|
Âge (ans)
|
Hommes Incidence/100 personnes/année
|
Femmes Incidence/100 personnes/année
|
|
Démence
| | |
|
65-69
|
0,35
|
0,18
|
|
70-74
|
0,63
|
0,36
|
|
75-79
|
1,90
|
1,70
|
|
80-84
|
1,93
|
3,30
|
|
85-89
|
2,45
|
3,73
|
|
90 +
|
3,18
|
7,03
|
|
Alzheimer
| | |
|
65-69
|
0,23
|
0,00
|
|
70-74
|
0,31
|
0,31
|
|
75-79
|
1,19
|
1,06
|
|
80-84
|
1,33
|
2,46
|
|
85-89
|
2,14
|
3,44
|
|
90 +
|
2,12
|
6,66
|
Niveau d'éducation
Un bas niveau d'éducation, évalué par le nombre d'années d'éducation formelle ou le plus haut niveau d'étude atteint, est souvent associé à un risque majoré de développer une maladie d'Alzheimer dans les études de cohorte (Sulkava et coll., 1985

; Fratiglioni et coll., 1991

; Korczyn, 1991 ; Hill et coll., 1993

; Stern et coll., 1994

) même si certaines études n'ont pas observé ce lien (O'Connor et coll., 1991

; Beard et coll., 1992

; Cobb et coll., 1995

). Dans certains cas, on trouve une relation dose-effet, avec un risque de maladie d'Alzheimer d'autant plus élevé que le niveau d'éducation est bas (Ott et coll., 1995

). Dans d'autres cas, comme le montrent les données françaises de l'étude Paquid, on trouve un risque accru pour les sujets n'ayant pas obtenu le certificat d'étude (Letenneur et coll., 2000

). Ces résultats sont en accord avec l'hypothèse selon laquelle les sujets ayant un haut niveau d'étude ont une plus grande capacité de réserve cérébrale qui leur permettrait d'exprimer leur maladie différemment (Letenneur et coll., 1999

). Ainsi, cette différence observée serait le témoin d'un biais de diagnostic, les patients avec un bas niveau d'étude étant ceux qui ont de moins bons résultats aux tests neuropsychologiques et qui sont plus facilement repérés et diagnostiqués dans les études. Les sujets ayant un haut niveau d'éducation semblent avoir de meilleures performances à certains tests, notamment ceux explorant les capacités exécutives (Le Carret et coll., 2003

), et leurs capacités de réserve leur permettent d'utiliser par exemple plus de stratégies dans les fonctions de reconnaissance (Stern et coll., 1992

; Mortimer et Graves, 1993

; Satz et coll., 1993

; Letenneur et coll., 2000

). D'autres facteurs de risque évoqués dans la maladie d'Alzheimer seraient associés à cette capacité de réserve, comme un petit périmètre crânien, de moins bonnes performances intellectuelles, associées à une moindre activité intellectuelle au cours de la vie. En revanche, après le diagnostic de maladie d'Alzheimer, un niveau d'éducation élevé pourrait être associé à une vitesse de déclin des fonctions cognitives plus rapide (Scarmeas et coll., 2006

).
Le niveau d'éducation est aussi un témoin du statut socioéconomique de la personne mais des études tendent à démontrer un effet de l'éducation indépendant de celui de la catégorie socio-professionnelle (Helmer et coll., 2001

; Ravaglia et coll., 2002

; Richards et coll., 2004

) ou du niveau de revenus (Evans et coll., 1997

; Karp et coll., 2004

), même si quelques rares travaux ont évoqué l'association de certaines professions (manuelles, agricoles...) avec la survenue d'une maladie d'Alzheimer (Helmer et coll., 2001

; Qiu et coll., 2003a

).
Ce résultat concernant le niveau d'éducation n'est pas constamment retrouvé dans la littérature. Une analyse des données européennes Eurodem trouve une association entre un bas niveau d'éducation et un risque majoré de développer une maladie d'Alzheimer uniquement chez les femmes. Ce résultat pourrait s'expliquer par des facteurs de confusion associés au niveau d'éducation non pris en compte dans les études réalisées en population générale (Letenneur et coll., 2000

). Une autre étude portant sur 143 paires de jumeaux ne montre pas d'association entre le niveau d'éducation et le risque de développer une démence ou une maladie d'Alzheimer. Ainsi, quand les facteurs génétiques et familiaux sont contrôlés, le risque n'est plus significatif (Gatz et coll., 2001

).
On ne dispose pas encore d'analyses « vie entière » permettant de bien appréhender la place dans le vieillissement cérébral des inégalités sociales avec des marqueurs performants. Il semblerait que l'effet du niveau d'éducation se manifeste bien en amont du diagnostic de la maladie, avec chez le sujet normal un risque de conversion vers le stade MCI (
Mild Cognitive Impairment) accru pour les sujets ayant un bas niveau d'éducation (Kryscio et coll., 2006

).
Des travaux ont montré qu'un niveau socioéconomique élevé était associé à une diminution du risque de maladie d'Alzheimer (Stern et coll., 1994

; Evans et coll., 1997

; Letenneur et coll., 1999

) mais ces travaux se limitaient à l'évaluation du niveau socioéconomique au moment de l'apparition de la maladie. Des travaux plus récents viennent de montrer que le niveau socioéconomique en début de vie influence le niveau des fonctions cognitives à un âge avancé mais pas le risque de maladie d'Alzheimer ni le déclin des fonctions cognitives (Wilson et coll., 2005

).
Certains facteurs liés au mode de vie sont évoqués dont le tabagisme pour les facteurs de risque et la consommation modérée d'alcool, la pratique de l'exercice physique ou la richesse des relations ou activités sociales parmi les facteurs potentiellement protecteurs.
Richesse du réseau social et des activités
De nombreux travaux ont évoqué le rôle protecteur de la richesse du réseau social et des activités sociales sur le déclin des fonctions cognitives (Scarmeas et coll., 2001 ; Wilson et coll., 2002

; Barnes et coll., 2004

; Holtzman et coll., 2004

). Une revue de 15 études longitudinales en Europe et aux États-Unis trouve un effet globalement favorable de la richesse des contacts sociaux et des activités, qu'elles soient intellectuelles ou non, sur le déclin des fonctions cognitives ou la survenue d'une démence, parfois d'une maladie d'Alzheimer (Fratiglioni et coll., 2004

). Dans une population âgée, l'effet protecteur sur l'incidence du MCI n'était observé que pour des activités intellectuelles et cet effet était robuste et persistait même après exclusion des sujets développant une démence dans les deux premières années de suivi (Verghese et coll., 2006

).
Le statut marital pouvant être un témoin de la richesse du réseau social, des travaux ont montré qu'il pourrait jouer un rôle protecteur dans la survenue de la maladie d'Alzheimer (Helmer et coll., 1999

; Fratiglioni et coll., 2000

).
D'autres études montrent que des activités de loisirs comme la lecture, le jeu, la danse, le jardinage, le bricolage, les voyages sont associées à un risque moindre de maladie d'Alzheimer ou d'autres démences (Fabrigoule et coll., 1995

). En revanche, des activités moins stimulantes comme la télévision seraient associées à un risque accru d'altération cognitive (Wang et coll., 2006

).
Cependant, on peut difficilement écarter l'hypothèse d'un arrêt de ces activités dans les stades pré-symptomatiques de la maladie conduisant à surestimer l'effet de ces facteurs. En effet, la plupart des travaux concernent des personnes âgées de plus de 65 ans, mais une étude récente a évalué l'effet du niveau d'activité sociale chez 2 513 hommes au cours de la période «
midlife » et plus tard dans la vie, au cours de la période «
late life ». Les auteurs rapportent que le niveau d'activité en «
midlife » seul n'est pas associé au risque de démence, ce qui pourrait être en faveur d'un changement dans le comportement des sujets en phase pré-démentielle (Saczynski et coll., 2006

).
Récemment, une étude a montré que la richesse du réseau social pouvait influencer la relation entre la sévérité des lésions anatomo-pathologiques (en particulier les neurofibrilles) et le niveau de fonctionnement cognitif (Bennett et coll., 2006

).
Il demeure difficile de conceptualiser et de quantifier les activités sociales et le réseau social dans les études épidémiologiques, car au-delà de l'existence même de ces activités, il semble évident que la satisfaction qui leur est liée soit importante à prendre en compte.
Exercice physique
Des études longitudinales récentes réalisées auprès de sujets âgés de 65 ans et plus, en population générale, ont rapporté une association inverse entre la pratique régulière et soutenue d'une activité physique et la survenue d'un déclin cognitif (Yaffe et coll., 2001

; Lytle et coll., 2004

; Van Gelder et coll., 2004

; Weuve et coll., 2004

) ou d'une démence, en particulier de type Alzheimer (Verghese et coll., 2003

; Abbott et coll., 2004

; Podewils et coll., 2005

; Larson et coll., 2006

) (tableaux 16.II

et 16.III

). Ces études sont nombreuses et présentent des qualités méthodologiques certaines (puissance de l'étude, durée de suivi souvent longue, caractère longitudinal de l'analyse).
En revanche, les études d'intervention sont peu nombreuses (Teri et coll., 2003

) et peu d'entre elles ont choisi un critère de jugement cognitif pour étudier l'efficacité d'une activité physique standardisée, et même s'il existe une méta-analyse en faveur de l'activité physique (Heyn et coll., 2004

), il est nécessaire de mettre en place de grandes études interventionnelles pour démontrer réellement cet effet.
Tableau 16.II Études d'observation longitudinales sur l'association entre exercice physique et déclin des fonctions cognitives
|
Référence
|
Population
|
Suivi
|
Activité physique
|
Résultats
|
Yaffe et coll., 2001 
|
n=5 925
>65 ans
Femmes
en population
|
6-8 ans
|
À l'inclusion, données déclarées de distance de marche par semaine
|
Déclin des fonctions cognitives (3 points ou plus au MMSE) Quartile le plus haut de l'exercice
versus le plus bas : –OR=0,66 [0,54-0,82] (1)
|
Lytle et coll., 2004 
|
n=1 146
>65 ans
En milieu rural, MoVIES
|
2 ans
|
À l'inclusion, données déclarées
Fréquence et durée de l'activité physique
|
Déclin des fonctions cognitives (3 points ou plus à 2 ans d'intervalle) Pratique d'un exercice versus non : –OR=0,39 [0,19-0,78] (1)
|
Van Gelder et coll., 2004 
|
n=295
Hommes
survivants
>70 ans
|
10 ans
|
À l'inclusion, données déclarées
Fréquence et durée de l'activité physique
|
Déclin des fonctions cognitives associé seulement à l'intensité de l'exercice
Les sujets qui ont maintenu ou augmenté leur activité ont 3,6 fois moins de risque de décliner
|
Weuve et coll., 2004 
|
n=18 766
70-81 ans
Nurses' Health Study
|
8-15 ans
2 ans d'intervalle
| |
Atteinte cognitive (quintile le plus haut versus le plus bas) : –OR=0,80 [0,67-0,95] (1)
Déclin des fonctions cognitives : –OR=0,80 [0,67-0,95] (1)
|
|
1Après ajustement sur les facteurs de confusion potentiels
|
Tableau 6.III Études d'observation longitudinales sur l'association entre exercice physique et risque de démence ou de maladie d'Alzheimer
|
Référence
|
Population
|
Suivi
|
Activité physique
|
Résultats [IC 95 %]
|
|
* Résultats ajustés sur l'âge et le sexe ; ** Résultats ajustés sur les autres facteurs de confusion potentiels ; *** La référence correspond à une marche importante (>2 miles/jour)
|
Verghese et coll., 2003 
|
n=469 >75 ans En population
|
5,1 ans (médiane) 21 ans au maximum
|
À l'inclusion, données déclarées Fréquence de 11 activités Échelle d'activité-jour par semaine (7 points=activité quotidienne)
|
Démence : RR=0,99 [0,98-1,03]* Pour 1 point d'augmentation
|
Abbott et coll., 2004 
|
n=2 257 >71 ans Hommes en population Honolulu Asia Aging Study
|
6 ans
|
À l'inclusion, données déclarées Distance marchée par jour***
|
Démence RR=1,93 [1,11-3,34]* pour <0,25 miles/j RR=1,75 [1,03-2,99]* pour 0,25-1 miles/j RR=1,33 [0,73-2,45]* pour 1-2 miles/j Alzheimer RR=2,21 [1,06-4,57]* pour <0,25 miles/j RR=1,86 [0,91-3,79]* pour 0,25-1 miles/j RR=1,88 [0,87-4,04]* pour 1-2 miles/j
|
Podewils et coll., 2005 
|
n=3 375 >65 ans Cardiovascular Health Cognition Study (CHCS)
|
5,4 ans
|
À l'inclusion, données déclarées Fréquence et durée de l'activité physique au cours des 2 dernières semaines Nombre d'activités
|
Démence : RR=0,58 [0,41-0,83]* Alzheimer : RR=0,55 [0,34-0,88]* Interaction : association présente seulement chez les non APOE4
|
Larson et coll., 2006 
|
n=1 740 >65 ans En population ACT study Seattle
|
6,2 ans
|
À l'inclusion, données déclarées de fréquence : nombre de jours où ils effectuent 15 mn d'activité Activité régulière : plus de 3 fois par semaine
|
Démence : RR=0,68 [0,48-0,96]* Alzheimer : RR=0,64 [0,43-0,96]** RR=0,69 [0,45-1,05]*
|
Tabac
Les premiers résultats évoquant le rôle protecteur du tabac (Graves et coll., 1991

; Lee, 1994

; Van Duijn et coll., 1994

) sont certainement liés au biais de survie sélective (Riggs et coll., 1993

; Doll et coll., 1994) car ils n'ont pas été confirmés par la suite. En effet, l'analyse de données longitudinales montre plutôt un risque accru chez les fumeurs de développer une démence ou une maladie d'Alzheimer (Hebert et coll., 1992

; Brenner et coll., 1993

; Prince et coll., 1994

; Yoshitake et coll., 1995

; Launer et coll., 1999

; Merchant et coll., 1999

; Cervilla et coll., 2000

). Un auteur a même trouvé une relation dose-effet entre l'exposition tabagique et le risque de maladie d'Alzheimer (Juan et coll., 2004

), alors que d'autres ne trouvaient cette association que chez les sujets non porteurs de l'allèle ApoE4 (Ott et coll., 1998

). Les études portant sur le déclin des fonctions cognitives chez les sujets normaux sont plus rares (Evans et coll., 1993

; Launer et coll., 1996

; Galanis et coll., 1997

) et reposent sur des échantillons de petite taille. Une seule étude de grande envergure ayant suivi 9 209 sujets pendant 2,3 ans rapporte que l'exposition tabagique cumulée, mesurée par le nombre de paquets-années, accélère le déclin cognitif chez les non déments avec une relation dose-effet (Ott et coll., 2004

).
Alcool
C'est à partir des travaux de l'étude Paquid sur le caractère protecteur d'une consommation modérée de vin (Lemeshow et coll., 1998

) que se sont développés de multiples travaux qui, globalement, montrent un effet plutôt protecteur d'une consommation modérée d'alcool, et pas spécifiquement de vin, dans le risque de maladie d'Alzheimer (Letenneur et coll., 2004

). Parmi les explications avancées, cette consommation modérée serait associée à un mode de vie protecteur des consommateurs modérés, à une diminution du risque cardiovasculaire, à une action directe de l'alcool sur le métabolisme de l'acétylcholine ou, plus spécifiquement pour le vin, à un rôle protecteur des composés flavonoïdes (Savaskan et coll., 2003

).
Facteurs de risque vasculaires : tension artérielle, diabète et dyslipidémie
Si l'association entre facteurs vasculaires et démence de type vasculaire – dont un des facteurs de risque est l'hypertension artérielle – est prouvée, celle qui existerait entre facteurs vasculaires et maladie d'Alzheimer est en revanche moins claire. Alors que dans les années 1980, les critères permettant de porter un diagnostic de maladie d'Alzheimer probable excluaient toute pathologie vasculaire, la place des facteurs vasculaires est aujourd'hui davantage mise en avant (Luchsinger et Mayeux, 2004a

) et prise en compte tout au long de la vie. Les études qui disposent de ce type de données correspondent à la poursuite de suivi des grandes cohortes mises en place dans les années 1970-1980 pour étudier l'épidémiologie des maladies cardiovasculaires comme l'étude de Framingham.
Pression artérielle
L'existence d'une relation entre hypertension artérielle (HTA) et lésions neuropathologiques de la maladie d'Alzheimer (atrophie cérébrale, plaques séniles et dégénérescence neurofibrillaire ou DNF) a été décrite avec une approche prospective dans la cohorte HAAS (
Honolulu-Asia Aging Study) (Petrovitch et coll., 2000

). Cette étude montre qu'une augmentation de la pression artérielle systolique (PAS≥160 mmHg) en milieu de vie est associée à un plus faible poids cérébral et à davantage de plaques séniles dans le néocortex et l'hippocampe. Une augmentation de la pression artérielle diastolique (PAD≥95 mmHg) est associée à un plus grand nombre de DNF dans l'hippocampe. Ces résultats sont en accord avec une bonne part de la littérature qui montre une association entre pression artérielle élevée et démence incidente ou déclin des fonctions cognitives (Tzourio et coll., 1999

). La revue de Qiu et coll. (2005

) analyse la littérature en fonction de l'âge auquel la pression artérielle est mesurée et de l'intervalle entre cette mesure et l'évaluation du statut cognitif. Cette revue, très complète sur pression artérielle et traitements anti-hypertenseurs, s'appuie sur les données d'études longitudinales en population et montre que selon la période de la vie considérée, les effets ne sont pas les mêmes. Pratiquement toutes les études rapportent une association entre une pression artérielle élevée mesurée 20 à 30 ans avant l'évaluation cognitive et soit un déclin des fonctions cognitives (7/7 études), soit la survenue d'une démence (4/5 études). Le risque est plus élevé en absence de traitement de l'hypertension. Pour les études où la pression artérielle est estimée en période plus tardive de la vie, les résultats sont contradictoires si l'on s'intéresse au déclin des fonctions cognitives, avec soit une augmentation du risque, soit une courbe en U, soit l'absence d'association. La majorité des études sur les démences ne trouve pas d'association, et un bas niveau de pression artérielle serait même prédicteur de démence après 80 ans (Verghese et coll., 2003

). Une étude chez des sujets de plus de 75 ans a porté sur la pression pulsée (PP=différentiel entre PAS et PAD) (Qiu et coll., 2003b

) et montre une augmentation du risque de démence et de maladie d'Alzheimer dans le tertile supérieur de la population, mais aussi chez les sujets ayant les valeurs les plus basses par rapport au tertile médian. Des mécanismes différents pourraient expliquer cette courbe en U : rigidification artérielle et athérosclérose pour les PP élevées, diminution de la perfusion cérébrale pour les PP basses. Dans la même cohorte (Qiu et coll., 2004

), est décrite une diminution de la pression artérielle dans les 3 ans précédant le diagnostic de démence.
Tant les études d'observation que les données issues d'essais randomisés ne permettent pas de démontrer un effet protecteur des thérapeutiques anti-hypertensives vis-à-vis de la démence et du déclin cognitif post-AVC. Le premier essai randomisé avec un anti-hypertenseur (nitrendipine), l'étude Syst-Eur (Forette et coll., 1998

), avait montré une diminution de l'incidence des démences chez des sujets âgés avec HTA systolique isolée. Chez des sujets âgés de l'étude Progress (Tzourio et coll., 2003

) avec des antécédents d'AVC ou d'accident ischémique transitoire, une réduction significative du risque de déclin cognitif – mais pas de démence – est rapportée chez les sujets traités (perindopril ou indapamide). Dans l'étude Scope (Lithell et coll., 2003

) qui propose un traitement par candesartan chez des sujets âgés avec une HTA modérée, on n'observe pas d'effet significatif sur le score MMSE ou son évolution.
Au total, les relations entre pression artérielle et démence sont complexes ; de nombreux mécanismes d'action ont été proposés pour expliquer les résultats contradictoires. Les résultats des études randomisées avec des protocoles dont l'objectif principal n'était pas d'étudier l'effet sur la démence ou le déclin cognitif sont encore trop limités. Le bénéfice d'un traitement anti-hypertenseur est indéniable pour les maladies cardiovasculaires et les AVC mais pour la cognition il pourrait dépendre de l'âge du sujet, du type de traitement et de nouvelles études d'interventions sont nécessaires, en particulier après 80 ans.
Diabète
Si la description de la plupart des complications liées au diabète est ancienne, de plus en plus de travaux, relativement récents, évoquent l'association possible entre le diabète et la survenue d'une altération des fonctions cognitives et/ou d'une maladie d'Alzheimer (Boyle et coll., 2001

).
Différents mécanismes seraient impliqués avec un effet direct de la vasculopathie diabétique ou un effet indirect favorisant les lésions neuropathologiques de la maladie d'Alzheimer. Ainsi, les produits de la dégradation glucidique seraient impliqués dans la pathogénèse de la maladie d'Alzheimer (Smith et coll., 1996a

et b

; Sasaki et coll., 1998

). Le rôle de l'enzyme de dégradation de l'insuline au niveau cérébral dans la régulation du métabolisme de la protéine bêta-amyloïde est possible et des travaux montrent une interaction avec l'ApoE4 (Selkoe et coll., 2000

; Bian et coll., 2004

).
Une revue récente de la littérature a identifié 14 études longitudinales explorant l'association entre diabète et démence (Biessels et coll., 2006

). L'auteur retrouve une association positive pour le risque de développer une pathologie démentielle (7/10 études), une maladie d'Alzheimer (8/13 études) et une démence vasculaire (6/9 études). Certains de ces travaux sont présentés dans le tableau 16.IV

.
Tableau 16.IV Études d'observation longitudinales sur l'association entre diabète et risque de démence ou de maladie d'Alzheimer
|
Référence
|
Population
|
Suivi
|
Définition du diabète
|
Résultats [IC 95 %]
|
Ott et coll., 1999 
|
n=6 370 >55 ans Étude en population Rotterdam
|
2,1 ans
|
Traitement Glycémie postprandiale >11 mmol/l
|
Démence RR=1,9 [1,3-2,8] Alzheimer RR=1,9 [1,2-3,1] Démence (chez les sujets traités par insuline) RR=4,3 [1,7-10,5]
|
Luchsinger et coll., 2001 
|
n=1 262 >65 ans Étude en population Manhattan
|
4,3 ans
|
Antécédent de diabète Traitement
|
Alzheimer RR=1,3 [0,8-1,9] Démence associée à un AVC RR=3,4 [1,7-6,9]
|
Peila et coll., 2002 
|
n=2 574 hommes >65 ans Étude en population Honolulu
|
3 ans
|
Antécédent de diabète Traitement Glycémie>7 mmol/l
|
Démence RR=1,5 [1,01-2,2] Alzheimer RR=1,8 [1,1-2,9] MA + ApoE4 RR=5,5 [2,2-13,7] Démence vasculaire RR=2,3 [1,1-5,0]
|
Arvanitakis et coll., 2004 
|
n=824 >55 ans Religieuses
|
5,5 ans
|
Antécédent de diabète Traitement
|
Alzheimer RR=1,65 [1,10-2,47] Le diabète atteint différentes fonctions (mémoire épisodique, mémoire de travail, visuospatiale)
|
Beeri et coll., 2004 
|
n=1 892 Hommes Survivants
|
30 ans
|
Antécédent de diabète Traitement Glycémie
|
Démence OR=2,83 [1,40-5,71]
|
Yaffe et coll., 2004 
|
n=7 027 femmes ménopausées avec ostéoporose, incluses dans un essai
|
4 ans
|
Intolérance au glucose 6,11< glycémie<7 mmol/l Diabète Glycémie>7 mmol/l
|
Démence, MCI ou score
Short Blessed>6 RR=1,64 [1,03-2,61] pour les intolérants au glucose RR=1,79 [1,14-2,81] pour les diabétiques Relation dose-effet selon le niveau de glycémie
|
Xu et coll., 2004 
|
n=1 301 >75 ans
|
6 ans
|
Antécédent de diabète Traitement Glycémie>11 mmol/l
|
Démence RR=1,15 [1,0-2,1] Démence vasculaire RR=2,6 [1,2-6,1] Alzheimer RR=1,3 [0,9-2,1]
|
Akomolafe et coll., 2006 
|
n=2 210 70 ans en moyenne Étude en population Framingham
|
8 ans
|
Traitement Glycémie>11,1 mmol/l
|
Alzheimer RR=1,15 [0,65-2,05] Alzheimer RR=2,98 [1,06-8,39] En l'absence d'autres facteurs de risque (apoE4, homocystéine)
|
D'autres travaux longitudinaux montrent un effet du diabète sur le déclin des fonctions cognitives chez des sujets normaux. Certains de ces travaux sont présentés dans le tableau 16.V

.
Tableau 16.V Études d'observation longitudinales sur l'association entre le diabète et le déclin des fonctions cognitives
|
Référence
|
Population
|
Suivi
|
Définition du diabète
|
Résultats
|
|
MMSE : Mini Mental State Examination ; AVLT : Auditory Verbal Learning Test ; DSS : Digit Symbol Substitution ; TRF : Test Retention Faciale ; FTT : Finger Taping test ; TMBT : Trail Making Test part B ; BVRT : Benton Visual Retention Test ; RPM : Raven Progressive Matrices ; DWR : Delayed Word Recall ; WAIS-R : Wechsler Adult Intelligence Scale Revised ; WF : Word Fluency
|
Haan et coll., 1999 
|
n=5 888 65 ans et plus
|
5-7 ans
|
Antécédent de diabète Glycémie>8,3 mmol/l
|
Risque de déclin majoré chez les diabétiques D'autant plus qu'ils sont porteurs de l'ApoE4 Les sujets sont explorés par MMSE, DSS
|
Gregg et coll., 2000 
|
n=9 679 Femmes >65 ans
|
6 ans
|
Antécédent de diabète
|
Risque de déclin majoré chez les diabétiques Ce risque est d'autant plus important que le diabète est ancien Les sujets sont explorés par MMSE, DSS, TMTB
|
Fontbonne et coll., 2001 
|
n=961 MMSE>26 59-71 ans
|
4 ans
|
Antécédent de diabète Glycémie>7 mmol/l
|
Risque de déclin majoré chez les diabétiques Les sujets sont explorés par MMSE, batterie neuropsychologique (AVLT, DSS, TRF, FTT, TMBT, BVRT, RPM)
|
Knopman et coll., 2001 
|
n=10 963 47-70 ans
|
6 ans
|
Antécédent de diabète Glycémie>7 mmol/l Traitement
|
Risque de déclin majoré chez les diabétiques Même chez les sujets jeunes<60 ans Les sujets sont explorés par DWR, DSS, WAIS-R, WF
|
Hassing et coll., 2002 
|
n=258 Sujets très âgés (>80 ans)
|
6 ans
|
Glycémie>6,7 mmol/l
|
Les sujets diabétiques ont un déclin cognitif plus marqué au cours du suivi (p<0,05) Le déclin est d'autant plus important chez les sujets présentant à la fois une hypertension et un diabète Le nombre de perdus de vue limite la portée de ces résultats
|
Logroscino et coll., 2004 
|
n=19 000 Femmes 70-81 ans
|
2 ans
|
Antécédent de diabète Traitement
|
À l'inclusion, les diabétiques ont un niveau de fonctions cognitives plus bas Le risque est d'autant plus élevé que le diabète est ancien et non traité Les sujets sont explorés par les scores moyens aux différents tests : TICS, rappel immédiat et différé, fluence verbale, Digit span
|
D'autres syndromes que le diabète pourraient jouer un rôle et une étude longitudinale rapporte une association entre un hyperinsulinisme et un déclin des fonctions mnésiques. Dans cette étude, le risque de maladie d'Alzheimer doublerait chez les sujets présentant un hyperinsulinisme et le risque serait plus élevé chez les sujets non diabétiques (Luchsinger et coll., 2004a

). Des travaux récents rapportent un risque majoré de maladie d'Alzheimer chez les sujets âgés de 69 à 78 ans présentant un syndrome métabolique, qui reste significatif même après exclusion des sujets diabétiques (Vanhanen et coll., 2006

).
Enfin, dans une population de 506 sujets âgés de 60 à 90 ans, il a été trouvé une association entre l'existence d'un diabète et l'atrophie hippocampique à l'IRM cérébrale et entre la résistance à l'insuline et l'atrophie amygdalienne. Ces résultats étaient indépendants de l'atteinte vasculaire et suggèrent un effet du diabète non seulement sur le risque de démence vasculaire mais aussi sur le risque spécifique de maladie d'Alzheimer (Den Heijer et coll., 2003

).
Dyslipidémie
Le cholestérol est un composant important du cerveau et de nombreux travaux soutiennent l'hypothèse de son rôle dans la formation des plaques amyloïdes (Sambamurti et coll., 2004

). Les études sur les niveaux de cholestérol, le déclin des fonctions cognitives et les démences sont très contradictoires (Shobab et coll., 2005

). De nombreux facteurs expliquent cette hétérogénéité : la période de la vie, le nombre de dosages, la nutrition, les traitements et la susceptibilité génétique (ApoE, récepteurs VLDL
1
Very Low Density Lipoprotein
, LRP
2
LDL Receptor-related Protein
). Comme pour l'HTA, ce serait plutôt les niveaux élevés de cholestérol en milieu de vie qui seraient le plus associés à une augmentation du risque de maladie d'Alzheimer.
Les espoirs soulevés par les premiers résultats d'études cas-témoins montrant une diminution du risque de maladie d'Alzheimer chez les sujets traités par statines ont été rapidement déçus par ceux de trois grandes études longitudinales qui n'ont pas confirmé ce résultat (Li et coll., 2004

; Rea et coll., 2005

; Zandi et coll., 2005

). Les résultats de 3 études randomisées avec différentes statines contre placebo (
HPS Collaborative Group, 2002

; Shepherd et coll., 2002

; Sparks et coll., 2005

) sont négatifs. Mais l'évaluation cognitive n'était pas l'objectif principal de ces trois essais qui n'avaient pas une puissance statistique suffisante pour montrer un effet modéré. De nouvelles études d'intervention sont nécessaires.
Prise en compte simultanée des facteurs de risque vasculaires, score de risque
La prise en compte simultanée des différents facteurs de risque vasculaires est indispensable à la fois pour quantifier leur rôle respectif mais aussi essayer de construire, comme dans les maladies cardiovasculaires, des scores de facteurs de risque. Dans une étude finlandaise (étude CAIDE ou
Cardiovascular Risk Factors, Aging, and Dementia) avec cholestérol et PA mesurés en milieu de vie (Kivipelto et coll., 2001

), les risques de démence associés à l'ApoE4, au cholestérol total (>6,5 mmol/l), à la PAS (>160 mmHg), à la PAD (>95 mmHg) ou aux antécédents d'infarctus du myocarde apparaissent indépendants et sont du même ordre de grandeur avec des
odds ratio entre 2 et 2,8. Seules deux publications portent sur la construction de scores de facteurs de risque. La même équipe finlandaise (Kivipelto et coll., 2006

) vient de proposer un score de prédiction à 20 ans à partir d'un ensemble de facteurs recueillis en milieu de vie. Le score comprend l'âge, le niveau d'éducation, l'hypertension, l'hypercholestérolémie et l'obésité mais n'a pas retenu l'activité physique ni l'ApoE4. Les qualités prédictives de ce score sont correctes, avec une sensibilité de 77 % et une spécificité de 63 %. La construction de ce type de score est complexe (Mitnitski et coll., 2006

) car il est difficile d'intégrer l'évolution de ces différents facteurs avec l'âge sachant que leur évolution joue aussi certainement un rôle dans le risque. De plus, la liste des facteurs à inclure est certainement très longue.
Facteurs liés à la nutrition
Les questions soulevées dans le domaine de la nutrition sont également nombreuses et auraient pu, pour une part, être traitées dans le cadre des facteurs de risque vasculaires. Le vieillissement est associé à une réduction des apports tant en micro- qu'en macro-nutriments mais aussi à des modifications dans l'absorption et le métabolisme des nutriments. Le déclin des fonctions cognitives peut entraîner des changements dans les comportements alimentaires et, de ce fait, être à l'origine de déficiences nutritionnelles. Les études longitudinales sont les plus adaptées pour rechercher les associations. Elles doivent être suffisamment longues pour s'assurer que le comportement alimentaire a bien précédé le déclin cognitif et non l'inverse. Dans les travaux sur la nutrition résumés ici (Luchsinger et Mayeux, 2004b

; Del Parigi et coll., 2006

; Gillette Guyonnet et coll., 2007

), trois approches sont possibles selon que l'on s'intéressera aux :
• apports alimentaires avec évaluation des apports en micro- et macro-nutriments (questionnaire ou enquête alimentaire) ;
• statut biologique pour certains composés : vitamines, acides gras ;
• suppléments alimentaires.
Obésité et indice de masse corporelle
L'éventuelle relation entre le poids et le risque de maladie d'Alzheimer a été analysée grâce à plusieurs études récentes (tableau 16.VI

). Barrett-Connor et ses collaborateurs (1996

) ont été les premiers à évoquer que la perte de poids pouvait précéder le diagnostic de la maladie. En effet, ces auteurs ont suivi durant 20 ans 134 hommes et 165 femmes âgés vivant au domicile. Ils ont évalué leur poids à l'inclusion en 1972-1974, en 1984-1987 et en 1990-1993. Près de 50 % des sujets qui avaient développé une maladie d'Alzheimer avaient perdu en moyenne 5 kg depuis la visite initiale alors que seulement 25 % des sujets sans altération cognitive avaient perdu du poids.
Tableau 16.VI Perte de poids et risque de survenue de la maladie d'Alzheimer
|
Référence
|
Type d’étude
|
Résultats
|
Barrett-Connor et coll., 1996  États-Unis |
Prospectif Suivi sur 20 ans Poids évalué à 3 reprises Diagnostic de maladie d'Alzheimer recherché à la dernière visite Rancho Bernardo Study
|
134 hommes et 165 femmes ont été évalués. Près de 50 % des sujets qui avaient développé une maladie d'Alzheimer avaient perdu en moyenne 5 kg depuis la visite initiale alors que seulement 25 % des sujets sans altération cognitive avaient perdu du poids Les auteurs suggèrent que la perte de poids peut précéder la maladie d'Alzheimer
|
Gustafson et coll., 2003  Suède |
Prospectif Suivi de 18 ans
|
392 sujets non déments ont été suivis de 70 à 88 ans 93 participants ont développé une démence durant le suivi. Les femmes ayant développé une démence ont un IMC plus élevé à 70 ans (27,7 versus 25,7 ; P=0,007), à 75 ans (27,9 versus 25,0 ; P<0,001), et à 79 ans (26,9 versus 25,1 ; P=0,02) par rapport aux autres. La même relation est observée avec la maladie d'Alzheimer. Chez les femmes, un point de plus à l'IMC à l'âge de 70 ans est associé à un risque supplémentaire de 36 % pour la maladie d'Alzheimer Ces données suggèrent que le surpoids peut être un facteur de risque de la maladie d'Alzheimer chez les femmes
|
Nourhashémi et coll., 2003  France |
Prospectif Suivi sur 8 ans Évaluation générale et cognitive à l'inclusion, à 1 an, à 3 ans, à 5 ans et à 8 ans Paquid
|
Cette cohorte représente 3 646 personnes de plus de 65 ans à l'inclusion Les sujets dont l'IMC était inférieur à 21 présentent un risque plus élevé de développer une démence au cours du suivi comparés aux sujets dont l'IMC est compris entre 23 et 26 (OR=1,48 ; IC 95 % [1,08-2,04]). Cette relation n'est pas retrouvée lorsque les démences incidentes à 3 ans sont exclues de l'analyse. Selon les auteurs, ces données suggèrent qu'un IMC bas serait un signe précoce de l'émergence de la maladie plutôt qu'un facteur de risque de démence
|
Buchman et coll., 2005  États-Unis |
Prospectif (suivi moyen de 5,5 ans)
|
918 religieux sans maladie d'Alzheimer à l'inclusion ont été suivis Après ajustement pour l'âge, le sexe et l'éducation, chaque point de moins à l'IMC à l'inclusion est associé à une augmentation de 5 % du risque de maladie d'Alzheimer Une baisse annuelle de 1 point à l'IMC est associée à une augmentation de 35 % du risque de maladie d'Alzheimer La perte de poids est associée à une augmentation du risque de maladie d'Alzheimer
|
Kivipelto et coll., 2005  Finlande |
Prospectif Cardiovascular Risk Factors, Aging, and Dementia (CAIDE)
|
1 449 individus ont été évalués en 1972, 1977, 1982, 1987 et 1998. L'obésité à l'âge adulte (IMC>30 kg/m2) est associée à un plus grand risque de démence et de maladie d'Alzheimer (OR=2,4 ; IC 95 % [1,2-5,1]) Le rôle des facteurs vasculaires est suggéré
|
Stewart et coll., 2005  États-Unis |
Prospectif 6 pesées entre 1965 et 1999 avec recherche de démence à 3 reprises entre 1991 et 1999 Honolulu-Asia Aging Study
|
L'analyse a concerné 1 890 hommes (âgés de 77-98 ans) La comparaison des 2 groupes de patients en fonction de la présence ou non d'une démence montre que la perte de poids survient avant l'apparition de la maladie. Cette relation est aussi vraie pour la maladie d'Alzheimer
|
Whitmer et coll., 2005  États-Unis |
Prospectif
|
L'analyse a concerné 10 276 sujets âgés de 40 à 45 ans (1964-1973). Le diagnostic de démence a été recherché entre 1994 et 2003 L'obésité à l'âge adulte (IMC>30 kg/m2) est associée à un risque de 1,74 (IC 95 % [1,34-2,26]) pour la démence
Un IMC entre 25 et 30 kg/m2 est associé à un risque de 1,55 (IC 65 % [1,22-1,97]) pour la démence
|
Johnson et coll., 2006  Etats-Unis |
Prospectif (suivi moyen de 6 ans)
|
449 sujets âgés non déments à l'inclusion ont été suivis. Le poids a été mesuré tous les ans. Les résultats révèlent une perte de poids significative précédant le diagnostic de maladie d'Alzheimer
|
|
IMC : Indice de masse corporelle
|
Suite à ce travail, d'autres auteurs se sont intéressés aux relations entre l'indice de masse corporelle (IMC) et le risque de démence (Gustafson et coll., 2003

; Nourhashémi et coll., 2003

; Buchman et coll., 2005

; Kivipelto et coll., 2005

; Stewart et coll., 2005

; Whitmer et coll., 2005

). Pour la majorité de ces auteurs, la perte de poids peut représenter un signe précoce de la maladie et peut survenir bien avant le diagnostic (Barrett-Connor et coll., 1996

; Nourhashémi et coll., 2003

; Stewart et coll., 2005

) ; d'autres considèrent qu'un IMC bas est un facteur de risque de maladie d'Alzheimer (Buchman et coll., 2005

). Des travaux plus récents soulignent au contraire la relation positive entre l'obésité et le risque de survenue d'une démence ; ces données suggèrent l'implication des facteurs vasculaires dans l'apparition de la démence et de la maladie d'Alzheimer en particulier (Gustafson et coll., 2003

; Kivipelto et coll., 2005

; Whitmer et coll., 2005

; Gustafson 2006 ; Hayden et coll., 2006

). À ce propos, une étude longitudinale réalisée chez 290 femmes vivant en Suède montre une association entre un IMC élevé et l'atrophie temporale mesurée au scanner (Gustafson et coll., 2004

).
Ainsi, il semble que les deux extrêmes (IMC bas et IMC élevé) soient tous deux associés au risque de démence et de maladie d'Alzheimer. Les hypothèses explicatives sont différentes et dépendent en partie de l'âge au moment duquel les mesures ont été réalisées (Luchsinger et coll., 2007a

).
Vitamine B12, folates et homocystéine
L'association entre une carence en vitamine B12, en vitamine B6 ou en folates et le risque de maladie d'Alzheimer incidente reste incertaine. Le tableau 16.VII

résume ces discordances. Des études chez l'animal suggèrent que le déficit en folates peut être à l'origine d'une amyloïdogénèse (Kruman et coll., 2002

). Par ailleurs, la consommation de folates et d'autres vitamines du groupe B sont des déterminants du taux d'homocystéine. L'homocystéine est un acide aminé soufré impliqué dans le métabolisme de la méthionine et de la cystéine. Il existe une relation inverse entre les taux d'homocystéine et les apports alimentaires ainsi que les taux plasmatiques des vitamines B6, B12 et des folates. L'hyperhomocystéinémie est un facteur de risque vasculaire aussi bien au niveau des artères coronaires et des artères cérébrales que des vaisseaux périphériques. Ces résultats posent la question d'une prévention du déclin cognitif par une diminution de l'homocystéinémie. À ce jour, deux études randomisées contrôlées ont été publiées. Il s'agit dans les 2 cas, d'études menées aux Pays-Bas. Durga et ses collaborateurs (2006

) rapportent l'effet de la prise de 800 µg par jour de folates (
versus placebo) sur les fonctions cognitives de 880 sujets âgés de 50 à 70 ans ayant un taux d'homocystéine sérique supérieur à 13 µmol/l. Cet essai d'une durée de 3 ans révèle une efficacité significative de l'apport en folates sur la mémoire. Les taux d'homocystéine initialement élevés diminuent avec l'apport en folates (Durga et coll., 2006

). Le deuxième essai d'une durée de 24 semaines concerne 195 sujets âgés de plus de 70 ans ayant un déficit en B12 (Eussen et coll., 2006

). L'apport de B12 (1 000 µg par jour) ou de l'association de B12 et de folates (respectivement 1 000 µg et 400 µg par jour) n'a aucune efficacité sur les fonctions cognitives par comparaison au placebo. Actuellement, une étude financée par le
National Institute of Aging (NIA) vise à déterminer si la baisse du taux d'homocystéine a un impact sur l'évolution de l'atteinte cognitive dans la maladie d'Alzheimer (étude Vital :
VITamins to Slow Alzeimer's disease ;
homocysteine Study).
Tableau 16.VII Résumé des études longitudinales analysant la relation entre B12, folates, homocystéine et maladie d'Alzheimer
|
Référence
|
Type d'étude
|
Résultats
|
|
MMSE : Mini Mental State Examination ; TMT : Trail Making Test
|
Crystal et coll., 1994 
|
Suivi de 5 ans Évaluation du taux de B12 sérique n=410 non déments
|
Pas d'étude spécifique concernant la maladie d'Alzheimer car faible nombre mais plutôt démence en général Pas de relation démontrée
|
Kalmijn et coll., 1999 
|
Suivi moyen de 2,7 ans Évaluation du taux d'homocystéine n=702 Âge>55 ans
|
Pas d'association avec déclin cognitif (MMSE)
|
McCaddon et coll., 2001 
|
Suivi de 5 ans Évaluation du taux d'homocystéine n=32 sujets sains Âge de 69 à 80 ans
|
Prédicteur indépendant de la cognition globale, du rappel (p=0,01), de l'orientation (p=0,02), des praxies constructives (p=0,0001)
|
Wang et coll., 2001 
|
Suivi de 3 ans, incidence maladie d'Alzheimer Inclusion : dosage vitamine B12 (2 cut-off : <150 et <250 pmol/l) et folates sériques (2 cut-off : <10 et <12 nmol/l) n=370 non déments Âge>75 ans
|
Comparé à la normale, B12 bas (<150 pmol/l) ou folates <10 nmol/l sont associés à un RR=2,1 [1,2-3,5] pour la maladie d'Alzheimer
|
Seshadri et coll., 2002 
|
Suivi médian de 8 ans Évaluation du taux d'homocystéine n=1 097 (Framingham) Âge moyen=76 ans
|
RR=1,8 [1,3-2,5] pour la maladie d'Alzheimer Augmentation d'1 déviation standard de l'homocystéinémie (log)
|
Dufouil et coll., 2003 
|
Suivi de plus de 4 ans Évaluation du taux d'homocystéine n=1 241 sujets sains Âge moyen=67 ans
|
Hyperhomocystéinémie est prédictrice du déclin cognitif et des fonctions exécutives (MMSE, TMT, Digit symbol)
|
Luchsinger et coll., 2004 
|
Suivi de 3 206 personnes années Évaluation du taux d'homocystéine n=679 sujets sains Âge moyen=76 ans
|
Pas de relation Quartile le plus élevé d'homocystéine, HR pour maladie d'Alzheimer : 1,4 [0,8-2,4]
|
Kado et coll., 2005 
|
Suivi de 7 ans Évaluation des taux d'homocystéine, B6, B12, B9 sériques n=499 non déments Âge moyen=74 ans (70 à 79 ans)
|
Étude du déclin cognitif (bilan à T0 et à 7 ans) Quartile bas de folates : RR=1,6 [1,01-2,31] est associé à de moins bonnes performances cognitives lors du suivi Homocystéine et B12 : non significative
|
Morris et coll., 2005 
|
2-3 évaluations cognitives (1993-2002) sur 6 ans Évaluation par un questionnaire nutritionnel (folates B12) n=3 718 Âge>65 ans
|
Consommation folates élevée est associée à un plus grand risque de déclin (p=0,002) Consommation B12 élevée est associée à un plus faible risque de déclin
|
Ravaglia et coll., 2005 
|
Suivi moyen de 4 ans Évaluation des taux d'homocystéine, de folates et B12 sériques n=816 sujets sains Âge moyen=74 ans
|
Hyperhomocystéinémie (<15 µmol/l), HR pour la maladie d'Alzheimer : 2,11 [1,19-3,76] Folates bas, HR pour la maladie d'Alzheimer : 1,98=[1,15-3,40] B12 bas : pas d'association significative Homocystéine et folates : facteurs indépendants
|
Tucker et coll., 2005 
|
Suivi de 3 ans des fonctions cognitives Évaluation des taux d'homocystéine, de folates, B6 et B12 sériques Enquête nutritionnelle n=321 hommes Âge moyen=67 ans
|
Association négative entre apraxie et homocystéine (p<0,001), folates (p<0,0001), B6 (p<0,01) et B12 (p<0,05) plasmatique ainsi qu'avec les prises alimentaires de chaque vitamine (p<0,05) Association négative entre capacités mnésiques et homocystéine (p<0,05) Pas d'association pour les vitamines (sériques ou apport nutritionnel)
|
Haan et coll., 2007 
|
Suivi de 4,5 ans d'une cohorte d'américains d'origine mexicaine Évaluation des taux d'homocystéine, de folates et de B12 n=1779 Âge à l'inclusion=60 à 101 ans
|
Le taux d'homocystéine élevé est un facteur de risque indépendant de démence et d'altération cognitive
|
Luchsinger et coll., 2007b 
|
Suivi prospectif (6,1 + 3,3 personne-années) Administration d'un questionnaire nutritionnel semi-quantitatif évaluant les apports en folates, B6, B12
|
Le groupe de sujets se situant dans le quartile le plus élevé des apports en folate a un risque diminué de maladie d'Alzheimer (HR=0,5 ; IC 95 % [0,3-0,9]) Aucune relation retrouvée concernant les vitamines B6 et B12
|
Antioxydants
Le cerveau est particulièrement sensible au stress oxydant en raison de sa composition en acides gras poly-insaturés (AGPI) à longues chaînes très sensibles à la peroxydation lipidique (en particulier les AGPI ω3). Dans la maladie d'Alzheimer, la protéine β-amyloïde peut conduire directement à une augmentation de la production de radicaux libres et une augmentation de la lipoperoxydation a été observée (Floyd et Hensley, 2002

). Plusieurs études épidémiologiques de cohorte (Paquid : Commenges et coll., 2000

; Helmer et coll., 2003

; EVA : Berr et coll., 2000

et 2004

; Akbaraly et coll., 2007

;
Rotterdam Study : Engelhart et coll., 2002a

et b

;
Chicago Health and Aging Study : Morris et coll., 2002

) ont montré une relation entre apport en antioxydants et moindre risque de démence ou de déclin cognitif mais avec des discordances. Les résultats sont néanmoins en faveur d'un rôle possible de la vitamine E plus que de la vitamine C, mais aussi des caroténoïdes et du sélénium. Les études d'observation sur les suppléments en vitamines A, E ou C ou en oligoéléments (zinc, sélénium) sont beaucoup plus contradictoires et comportent des biais importants d'indication et de sélection des populations. Les résultats des essais randomisés chez le sujet âgé sain ou avec une maladie d'Alzheimer ou un MCI ne sont pas encore suffisamment convaincants pour préconiser la prise d'antioxydants en prévention du vieillissement cérébral. L'étude de Sano et coll. (1997

) montrant un effet bénéfique de la vitamine E sur l'évolution de la maladie d'Alzheimer n'a pas été confirmée dans une autre population de maladie d'Alzheimer (Onofrj et coll., 2002

). La prise de fortes doses de vitamine E (2 000 UI) n'a eu aucun effet sur la conversion vers la démence après 3 ans de suivi de sujets MCI (Petersen et coll., 2005

). L'association de vitamines E, C et β-carotène avec zinc et cuivre n'a eu aucun effet sur le niveau cognitif final des sujets de l'étude Areds sur la dégénérescence liée à l'âge (Yaffe et coll., 2004

). Enfin, deux essais avec le
Gingko Biloba qui a des propriétés antioxydantes n'ont montré que des effets modestes (LeBars et coll., 1997

) ou nuls (van Dongen et coll., 2003

) sur l'évolution de la démence. Nous attendons les résultats de deux études de prévention, étude Guidage en France et Gem aux États-Unis (DeKosky et coll., 2006

; Vellas et coll., 2006

).
Macronutriments
Les acides gras poly-insaturés (AGPI) se composent de deux grandes familles, les oméga 3 (ω3) et les oméga 6 (ω6). Les poissons gras sont très riches en AGPI oméga 3, constituant lipidique majeur de la membrane des neurones. Outre leur rôle dans la composition et la fluidité des membranes neuronales (Yehuda et coll., 1999

), plusieurs mécanismes pourraient expliquer les effets des AGPI au niveau cérébral. Les AGPI oméga 3 et oméga 6 ont des effets opposés sur le plan cardiovasculaire. Les oméga 3 diminuent le risque d'arythmie cardiaque (Kris-Etherton et coll., 2002

), ce qui expliquerait leur effet positif contre le risque de décès coronarien (Kris-Etherton, 1999

), et ils ont des effets anti-thrombotiques et anti-athérosclérose (Kris-Etherton et coll., 2002

). Inversement, les AGPI oméga 6 ont des effets vasoconstricteurs et pro-thrombotiques (Muskiet et coll., 2004

).
L'effet protecteur de la consommation de poisson sur le risque de démence est décrit chez des sujets âgés dans la
Rotterdam Study (Kalmijn et coll., 1997

; Engelhart et coll., 2002b

), dans l'étude Paquid (Barberger-Gateau et coll., 2002

) et dans l'étude Chap (Morris et coll., 2003

et 2005

). Une autre étude Hollandaise, la
Doetinchem Study, a rapporté un effet protecteur sur le déclin cognitif chez des adultes d'âge moyen, à la fois de la consommation de poisson et d'AGPI oméga 3 à longues chaînes (EPA ou acide eicosapentaénoïque, et DHA ou acide docosahexaénoïque) (Kalmijn et coll., 2004

). Dans l'étude EVA avec des dosages d'acides gras dans les membranes des globules rouges (Heude et coll., 2003

), le risque de déclin des fonctions cognitives est plus élevé chez les sujets ayant des taux élevés d'AGPI oméga 6 et, à l'inverse il diminue pour les sujets avec les taux les plus hauts d'AGPI oméga 3. L'étude américaine Whicap (
Washington Heights Inwood Columbia Aging Project) n'a pas trouvé de relation entre consommation d'AGPI et risque de maladie d'Alzheimer, mais elle a mis en évidence un effet délétère de l'apport énergétique total et de la quantité de lipides ingérés chez les sujets porteurs de l'allèle ɛ4 du gène de l'apolipoprotéine E (Luchsinger et coll., 2002

). Cette dernière étude soulève le problème des interactions complexes entre l'apport nutritionnel et les caractéristiques génétiques, en particulier pour les gènes impliqués dans le métabolisme des lipides et leur transport.
Vers une vision plus globale de la nutrition
L'analyse épidémiologique des relations entre consommation de nutriments et déclin cognitif est complexe et il est très peu probable qu'un seul composé joue un rôle majeur. Beaucoup de questions sont encore à élucider dans ce domaine. La notion de profil alimentaire est à développer dans le cadre de travaux sur le vieillissement. L'intérêt pour le régime méditerranéen vient de travaux convergents montrant une diminution du risque de maladies cardiovasculaires et de la mortalité avec une alimentation favorisant des apports élevés en légumes, fruits et céréales, en graisses insaturées (huile d'olive) et modérément élevés en poisson, des apports moyens en produits laitiers et faibles en viandes et volailles, et enfin une consommation modérée de vin. Une publication dans une population New-Yorkaise (Scarmeas et coll., 2006

) montre que chez des individus ayant un régime proche du régime méditerranéen, le risque de maladie d'Alzheimer est significativement diminué. Cette observation est en accord avec une part des résultats obtenus pour les micro- ou macro-nutriments et souligne la nécessité de considérer les interactions entre ces différents composés.
Facteurs médicaux
Différents facteurs médicaux ont été étudiés afin de déterminer s'ils pouvaient être considérés comme des facteurs de risque de la maladie d'Alzheimer.
Dépression
La dépression est associée à une augmentation du risque de maladie d'Alzheimer même s'il est difficile de préciser si elle représente un véritable facteur de risque ou un prodrome de la maladie. Les symptômes dépressifs sont en effet extrêmement fréquents dans la maladie d'Alzheimer et en particulier dans les stades débutants. Les suivis de cohortes révèlent des résultats discordants. Certaines de ces études montrent une augmentation significative du risque de la maladie d'Alzheimer chez les sujets aux antécédents de dépression (Buntinx et coll., 1996

; Devanand et coll., 1996

; Berger et coll., 1999

; Geerlings et coll., 2000

; Wilson et coll., 2002

; Fuhrer et coll., 2003

; Kessing et coll., 2003

; Zubenko et coll., 2003

; Modrego et Ferrandez, 2004

; Dal Forno et coll., 2005

; Gatz et coll., 2005

) et d'autres ne trouvent aucune relation (Chen et coll., 1999

; Palsson et coll., 1999

; Li et coll., 2001

; Lindsay et coll., 2002

; Steffens et coll., 2004

; Andersen et coll., 2005

). Ces discordances peuvent être expliquées en partie par la variabilité des outils de dépistage de la dépression. Une revue de la littérature et une méta-analyse récente réalisée par Ownby et ses collaborateurs (2006

) suggèrent que la dépression pourrait être un facteur de risque indépendant de la maladie d'Alzheimer (OR=1,90 ; (IC 95 % [1,55-2,33]). Si cela se confirmait, la dépression pourrait être considérée comme un des facteurs de risque modifiables de la maladie d'Alzheimer.
Pathologies cardiaques
Plusieurs équipes ont mis en évidence une association positive entre la fibrillation auriculaire et l'altération des fonctions cognitives (Farina et coll., 1997

; Kilander et coll., 1998

; Sabatini et coll., 2000

) mais aussi la maladie d'Alzheimer (Ott et coll., 1997

; de la Torre et coll., 2006

). Pour certains, l'arythmie par fibrillation auriculaire est un déterminant indépendant d'altération des fonctions cognitives (Farina et coll., 1997

; Sabatini et coll., 2000

). Il est intéressant de souligner que ces résultats persistent même après l'exclusion des patients présentant des lésions cérébrovasculaires. Il est donc probable que le mécanisme thrombo-embolique ne soit pas la seule explication à l'atteinte cognitive (Polidori et coll., 2001

). Le suivi longitudinal moyen de 3 à 4 ans d'une cohorte de 180 sujets atteints de MCI et d'un groupe de 431 sujets témoins montre une relation significative entre la fibrillation auriculaire et l'évolution vers la démence chez les sujets MCI (HR=4,63 ; IC 95 % [1,72-12,46]). Cette relation n'est pas significative dans le groupe des personnes âgées saines (Forti et coll., 2006

). Certains travaux ont également montré une association entre altération cognitive et insuffisance cardiaque (Schall et coll., 1989

; Bornstein et coll., 1995

; Acanfora et coll., 1996

; Zuccala et coll., 1997

; Cacciatore et coll., 1998

). Une étude longitudinale de 9 ans en Suède a permis le suivi d'une cohorte de 1 301 sujets âgés de plus de 75 ans indemnes de démence. Dans ce travail, l'insuffisance cardiaque est non seulement associée à la démence (HR=1,84 ; IC 95 % [1,35-2,51]) mais aussi à la maladie d'Alzheimer (HR=1,80 ; IC 95% [1,25-2,61]) (Qiu et coll., 2006

). D'autres auteurs rapportent également une telle association (de la Torre, 2006

; Polidori et coll., 2006

).
Certains travaux montrent une association significative entre l'insuffisance coronarienne et l'altération cognitive (Aronson et coll., 1990

; Breteler et coll., 1994

) mais tous ne sont pas concordants (Petrovitch et coll., 1998

; Bursi et coll., 2006

). Un travail autopsique récent a permis d'analyser cette relation chez 99 sujets d'âge moyen de 87 ans au moment du décès. Les auteurs observent une relation significative entre la densité des lésions neuropathologiques cérébrales de la maladie d'Alzheimer et l'importance de l'atteinte coronarienne, d'autant plus prononcée que le sujet est porteur d'au moins un allèle de l'APOE4 (Beeri et coll., 2006

).
Pour expliquer l'association de ces différentes cardiopathies avec la maladie d'Alzheimer, diverses hypothèses ont été évoquées, parmi lesquelles la plus importante est l'hypoperfusion cérébrale chronique.
Anémie
L'impact de l'anémie en tant que facteur de risque potentiel de démence reste débattu (Broe et coll., 1990

; Kokmen et coll., 1990

; Milward et coll., 1999

; Beard et coll., 1997

). Les études longitudinales sont rares. Atti et ses collaborateurs (2006

) rapportent une relation positive entre l'anémie et le risque de démence dans une population de 1 377 sujets de plus de 75 ans. Un travail prospectif récent réalisé chez 1 744 sujets de plus de 71 ans vivant à domicile va dans le même sens. En effet, les sujets anémiques sont plus à risque d'altération cognitive (mesurée par le test de Pfeiffer) durant le suivi de 4 ans (p=0,0001) (Denny et coll., 2006

).
Traumatismes crâniens
La relation entre la survenue d'un traumatisme crânien et la maladie d'Alzheimer a été analysée dans de nombreuses études en grande majorité de type cas-témoins (Mortimer et coll., 1985

; Amaducci et coll., 1986

; Chandra et coll., 1987

; Chandra et coll., 1989

; Broe et coll., 1990

; Graves et coll., 1990

; Mortimer et coll., 1991

; Li et coll., 1992

; Van Duijn et coll., 1992

; Fratiglioni et coll., 1993

; Forster et coll., 1995

; Mayeux et coll., 1995

; O'Meara et coll., 1997

; Tsolaki et coll., 1997

; Guo et coll., 2000

). Les études de cohortes sont résumées dans le tableau 16.VIII

. Une méta-analyse publiée en 2003 (Fleminger et coll., 2003

) et une étude prospective analysant les données médicales des vétérans de la 2
e guerre mondiale (Plassman et coll., 2000

) soutiennent l'hypothèse que les traumatismes crâniens peuvent avoir un impact significatif dans le développement de la maladie d'Alzheimer. Sur le plan anatomo-pathologique, des lésions similaires à la maladie d'Alzheimer ont été décrites chez les ex-boxeurs qui ont souffert de micro-traumatismes à répétition. L'analyse des résultats est difficile car il n'y a pas de méthode standardisée pour évaluer la sévérité du traumatisme. Il en est de même pour l'intervalle de temps entre le traumatisme et le début de la maladie.
Tableau 16.VIII Résumé des études de cohortes analysant la relation entre traumatisme crânien et maladie d'Alzheimer
|
Références
|
Type d'étude
|
Patients
|
Résultats-remarques
|
|
* TC : Traumatisme crânien ; ** NS : non significatif
|
Williams et coll., 1991 
|
Cohorte
Suivi 15 000 personnes/années
|
n=821
|
Pas d'association
|
Schofield et coll., 1997 
|
Cohorte
|
n=271
|
RR=5,4 [1,5-19,5]
|
Launer et coll., 1999 
|
Eurodem (méta-analyse de cohortes)
|
n=16 334
|
OR=1,02 [0,68-1,51] pour maladie d'Alzheimer
|
Mehta et coll., 1999 
|
Cohorte
Rotterdam Study
|
n=6 645
|
Pas d'association
|
Nemetz et coll., 1999 
|
Personne ayant eu un TC* entre 1935 et 1984 ; recherche sur base de Rochester Epidemiology Project pour identifier les cas de maladie d'Alzheimer
|
n=1 283 TC
|
Pas d'association mais peut-être que le TC raccourcit le délai
|
Plassman et coll., 2000 
|
Cohorte
Vétérans du WWII, suivi 50 ans
|
n=1 809
|
OR=4,5 [1,8-11,5] pour maladie d'Alzheimer si TC sévère
OR=2,32 [1,04-5,17] si TC modéré
NS** si léger
|
Lindsay et coll., 2002 
|
Cohorte Canadian Study of Health and Aging (CSHA)
|
n=3 455
|
OR=0,87 [0,56-1,36]
|
Himanen et coll., 2006 
|
Étude longitudinale de l'évolution cognitive sur 30 ans après TC
|
n=61 TC
|
Baisse cognitive modérée influencée par l'âge au moment du traumatisme (plus le sujet est jeune et plus c'est réversible) et le sexe (cognition meilleure chez les femmes)
|
Agents infectieux
La relation éventuelle de la maladie d'Alzheimer avec divers agents infectieux a souvent été discutée mais aucune donnée fiable ne permet à ce jour d'apporter une réponse formelle. La presque totalité des travaux correspond à des études cas-témoins. La grande majorité ne montre pas d'association entre cette affection neurodégénérative et les virus HSV1 (
Herpes Simplex Virus type 1) (Jamieson et coll., 1992

; Beffert et coll., 1998

; Hemling et coll., 2003

; Wozniak, 2005

), HSV2 (
Herpes Simplex Virus type 2) (Lin et coll., 2002

), HHV6 (
Herpes Human Virus 6) (Hemling et coll., 2003

), VZV (virus de la varicelle et du zona) (Hemling et coll., 2003

), CMV (cytomégalovirus) (Lin et coll., 2002

) ou encore le
Chlamydiae pneumoniae (Nochlin et coll., 1999

; Gieffers et coll., 2000

; Ring et Lyons, 2000

; Gerard et coll., 2005

). Mais ces résultats ne sont pas partagés par tous (Ball et coll., 2001

; Lin et coll., 2002

). Certains auteurs soulignent la présence de ces agents infectieux préférentiellement chez les sujets porteurs d'au moins un allèle ApoE4 (Itabashi et coll., 1997

; Itzhaki et coll., 1997

; Balin et coll., 1998

; Shipley et coll., 2005

; Itzhaki et coll., 2006

).
Broncho-pneumopathie chronique obstructive et apnée du sommeil
Il semble exister une association entre la broncho-pneumopathie chronique obstructive (BPCO) et l'atteinte de certaines des fonctions cognitives, en particulier la mémoire immédiate et l'attention (Stuss et coll., 1997

), la mémoire verbale (Incalzi et coll., 1993

; Incalzi et coll., 1997

), mais il s'agit d'études cas-témoins pour la très grande majorité ne permettant aucune conclusion fiable et définitive. Certains travaux, cas-témoins pour la plupart, ont étudié les possibles associations entre l'apnée du sommeil et la maladie d'Alzheimer avec des résultats discordants (Foley et coll., 2003

; Dyken et coll., 2004

). Il est à noter que Kadotani et ses collaborateurs (2001

) rapportent une association significative entre apnée du sommeil de l'adulte et l'allèle e4 de l'ApoE dans la population générale.
Autres facteurs
De nombreux travaux ont également recherché des associations entre d'autres facteurs (expositions à certains agents physiques et chimiques, traitements hormonaux substitutifs de la ménopause, anti-inflammmatoires non stéroïdiens) et les maladies neuro dégénératives.
Expositions aux métaux, agents physiques et chimiques
Dans cette analyse de la littérature, on distingue les études sur les expositions environnementales dans un cadre professionnel des études sur d'autres expositions environnementales qui ne sont pas mesurées dans un cadre professionnel.
Expositions professionnelles
À partir de données de neurotoxicité en lien avec des expositions à diverses substances, on suspecte des relations entre différents domaines d'activité professionnelle et les maladies neurodégénératives (maladie d'Alzheimer, maladie de Parkinson, sclérose latérale amyotrophique ou SLA). Toutefois, la littérature n'apporte que relativement peu d'informations sur les relations entre expositions professionnelles et risque de maladie d'Alzheimer. Alors que dans l'étude Paquid (Helmer et coll., 2001

), aucune association entre profession principale et risque de démence ou de maladie d'Alzheimer n'est décrite, une augmentation du risque de démence chez les sujets des plus basses catégories professionnelles a été rapportée dans une population New-Yorkaise (Stern et coll., 1999

). Plus spécifiquement, une association a été rapportée entre travail manuel dans le cadre d'activités de production et maladie d'Alzheimer dans une population suédoise (Qiu et coll., 2003a

).
Ce type d'études est très dépendant du mode de classification des professions et l'interprétation en termes d'exposition est délicate. Ainsi, une profession de catégorie manuelle peut être associée au risque pour des raisons très différentes :
• exposition à des toxiques multiples (métaux lourds, solvants, pesticides, défoliants...) ;
• indicateur de bas niveau socioéconomique ;
• indicateur de comportement ou mode de vie à risque pour la santé ;
• risque lié à des différences initiales dans les capacités cognitives (hypothèse de réserve cérébrale).
Par ailleurs, la majorité des données disponibles ont été obtenues dans le cadre d'études cas-témoins avec un recueil d'exposition auprès d'informants ou à partir d'études sur la mortalité encore plus discutables. Différents facteurs ont été trouvés associés au risque de démence ou de maladie d'Alzheimer : les expositions aux champs magnétiques correspondant à certains métiers de l'électricité, du téléphone, des transports... (Sobel et coll., 1995

; Feychting et coll., 1998

; Savitz et coll., 1998

; Feychting et coll., 2003

; Hakansson et coll., 2003

), ou aux solvants (Kukull et coll., 1995

; Nilson et coll., 2002

), mais les études négatives sont nombreuses. Pour les expositions aux pesticides, des effets modérés ont été décrits en transversal sur les fonctions cognitives (Bosma et coll., 2000

) et, chez les hommes de l'étude Paquid, sur la maladie d'Alzheimer (Baldi et coll., 2003

). Concernant les expositions aux métaux lourds, les études sont globalement négatives (Salib et Hillier, 1996

; Gun et coll., 1997

; Graves et coll., 1998

; Letz et coll., 2000

; Nordberg et coll., 2000

; Gauthier, 2001

).
Autres expositions environnementales
Les effets sanitaires de l'aluminium hydrique sur le fonctionnement cognitif ou la présence d'une démence ont été décrits en population générale ou sur des cas hospitaliers, en Europe et sur le continent Nord Américain (InVS, 2003

). Les études dont la méthodologie est la moins critiquable sont issues de la cohorte Paquid et sont en faveur d'une augmentation du risque de démence ou de maladie d'Alzheimer (Rondeau et coll., 2000

; Rondeau, 2002

), risque estimé entre 1,5 et 2,5 pour une concentration hydrique d'aluminium supérieure à 100 ou 110 mg/l. Mais il n'y a pas d'effet dose, ni de sous-groupe à risque et les limites de ces travaux sont nombreuses : qualité des dosages d'aluminium, hypothèses de stabilité des taux sur des périodes souvent longues, pas de consensus sur la forme aluminium... Le problème de fond de ces résultats reste celui de la plausibilité de l'hypothèse biologique : l'eau ne représente que 5 à 10 % des apports dans l'organisme humain.
L'intérêt récent pour le mercure, dont les sources sont la consommation de poisson, les amalgames dentaires et les vaccins, ne peut être correctement documenté avec les données actuelles (Lund et coll., 2003

; Mutter et coll., 2004

).
Traitements hormonaux substitutifs de la ménopause
Malgré la forte plausibilité biologique d'un rôle neuroprotecteur des œ strogènes, la majorité des essais thérapeutiques n'a pas permis d'établir que le traitement hormonal substitutif de la ménopause (THM) pouvait améliorer de façon significative une maladie d'Alzheimer déjà déclarée (Ancelin et Berr, 2003

; Ancelin et Ritchie, 2005

). Les études épidémiologiques longitudinales suggèrent une réduction de 29 à 44 % du risque de développer la maladie d'Alzheimer chez les femmes traitées (Hogervorst et coll., 2000

; Leblanc, 2002

). Mais, les résultats récents de l'étude randomisée américaine «
Women's Health Initiative Memory Study » sur des femmes post-ménopausées (Shumaker et coll., 2003

et 2004

; Resnick et coll., 2006

) indiquent une augmentation du risque de démence ou de déclin des fonctions cognitives chez les femmes traitées par œ strogènes avec ou sans progestatifs. Tant la population d'étude (femmes à risque cardiovasculaire, de plus de 65 ans au début du traitement, alors que les études d'observation concernaient des femmes traitées au moment de la ménopause) que le type de THM (Premarin+medroxyprogesterone par voie orale) limitent l'extrapolation de ces résultats. Les prescriptions en France privilégient d'autres formes d'œ strogènes et de progestatifs. Mais il n'est pas légitime de considérer aujourd'hui que la prise d'un THM puisse avoir un rôle protecteur dans les démences et la maladie d'Alzheimer. L'analyse de la littérature n'incite pas à proposer la prescription de THM pour la prévention de la maladie d'Alzheimer.
Anti-inflammatoires non stéroïdiens
De nombreux arguments plaident en faveur de l'implication du mécanisme inflammatoire dans la survenue des pathologies neuro-dégénératives et en particulier de la maladie d'Alzheimer. Sur le plan anatomo-pathologique, on observe la présence de réaction inflammatoire au contact des plaques séniles avec activation du complément et des taux élevés de cytokines mais également d'autres marqueurs inflammatoires (McGeer et McGeer, 2001

; Eikelenboom et van Gool, 2004

). Les données épidémiologiques suggèrent un éventuel effet protecteur des anti-inflammatoires non stéroïdiens contre la maladie d'Alzheimer (McGeer et coll., 1996

; Stewart et coll., 1997

; In't Veld et coll., 2001

; Lindsay et coll., 2002

; Zandi, 2002

). L'étude ADAPT (
Alzheimer's Disease Anti-inflammatory Prevention Trial) avait pour but d'évaluer l'efficacité du célécoxib, du naproxène
versus placebo dans la prévention primaire de la maladie d'Alzheimer sur une durée de 7 ans (Martin et coll., 2002

). Cette étude a dû être arrêtée en raison de nombreux effets indésirables. Une intervention en double-aveugle contre placebo visant à évaluer l'efficacité du Rocécoxib dans le MCI (chez 1 457 sujets de plus de 65 ans) sur une durée de 4 ans n'a montré aucune différence significative (Thal et coll., 2005

). L'étude BONSAI (
Biomarkers Of Non-Steroidal Anti-Inflammatories) débutée en octobre 2005 a inclus 40 sujets de plus de 70 ans avec des antécédents familiaux de maladie d'Alzheimer. Le but de l'étude est d'évaluer l'effet de l'ibuprofène sur les biomarqueurs de la maladie à 6 et à 12 semaines. Ce travail, financé par le
National Institute of Aging (NIA), est actuellement en cours. Enfin, un dernier travail randomisé porte sur 138 sujets (âgés de 40 à 90 ans) qui souffrent d'altérations de la mémoire liées à l'âge. Cette étude permet d'évaluer l'efficacité du célécoxib contre le placebo, l'objectif étant de retarder le début de la maladie. Les résultats ne sont pas encore publiés
3
. En conclusion, même si les études observationnelles laissent supposer un effet des anti-inflammatoires non stéroïdiens dans la prévention de la maladie d'Alzheimer, les essais cliniques publiés sont pour le moment non concluants. À la lumière de ces résultats, il n'y a aucune indication à la prescription des anti-inflammatoires non stéroïdiens dans prévention de la maladie d'Alzheimer. Il en est de même pour le traitement de la maladie et le ralentissement de l'évolution (Rogers et coll., 1993

; Scharf et coll., 1999

; Aisen et coll., 2003

; Reines et coll., 2004

; Klegeris et coll., 2005

). D'autres travaux sont en cours et devraient apporter de nouvelles informations.
En conclusion,
dans un domaine où les pistes sont multiples avec maintenant un nombre important d'études longitudinales, il est important de souligner le manque d'études épidémiologiques tenant compte de l'ensemble des facteurs de risques suspectés. La recherche de facteurs de risque, à l'exemple de ce qui a été fait dans le domaine cardio-vasculaire, doit être poursuivie. Les efforts doivent se concentrer sur les facteurs de risque modifiables dans l'objectif de développer des stratégies préventives de la maladie d'Alzheimer. L'étude des facteurs de risque liés au mode de vie doit reposer sur une approche globale de ces facteurs nécessitant la multidisciplinarité des équipes (par exemple : l'étude des facteurs nutritionnels doit inclure un enregistrement de la prise alimentaire et une analyse des comportements alimentaires).
Le temps des actions ne doit plus être reporté. La majorité des essais répertoriés n'avaient pas pour objectif principal l'évaluation cognitive. Concernant les facteurs pour lesquels il existe déjà un faisceau d'arguments, de nouveaux projets doivent être initiés pour évaluer les effets dans deux grands axes très schématiques :
• facteurs modifiés par des thérapeutiques médicales : traitements antihypertenseurs, prise en charge du diabète et, à un moindre degré, de l'hypercholestérolémie ;
• facteurs associés au mode de vie : facteurs nutritionnels via des modifications des habitudes alimentaires, activité physique, activités intellectuelles ou cognitives, réseau social.
Bibliographie
[1] abbott rd,
white lr,
ross gw,
masaki kh,
curb jd,
petrovitch h. Walking and dementia in physically capable elderly men.
Jama. 2004;
292:1447
-1453

[2] acanfora d,
trojano l,
iannuzzi gl,
furgi g,
picone c. The brain in congestive heart failure.
Arch Gerontol Geriatr. 1996;
23:247
-256

[3] aisen ps,
schafer ka,
grundman m,
pfeiffer e,
sano m. Effects of rofecoxib or naproxen vs placebo on Alzheimer disease progression: a randomized controlled trial.
Jama. 2003;
289:2819
-2826

[4] akbaraly nt,
hininger-favier i,
carriere i,
arnaud j,
gourlet v. Plasma selenium over time and cognitive decline in the elderly.
Epidemiology. 2007;
18:52
-58

[5] akomolafe a,
beiser a,
meigs jb,
au r,
green rc. Diabetes mellitus and risk of developing Alzheimer disease: results from the Framingham Study.
Arch Neurol. 2006;
63:1551
-1555

[6] amaducci la,
fratiglioni l,
rocca wa,
fieschi c,
livrea p. Risk factors for clinically diagnosed Alzheimer’s disease: a case-control study of an Italian population.
Neurology. 1986;
36:922
-931

[7] ancelin ml,
berr c. Hormonal replacement therapy and Alzheimer’s disease. All quiet on the western front?.
Psychol Neuropsychiatr Vieil. 2003;
1:251
-257

[8] ancelin ml,
ritchie k. Lifelong endocrine fluctuations and related cognitive disorders.
Curr Pharm Des. 2005;
11:4229
-4252

[9] andersen k,
lolk a,
kragh-sorensen p,
petersen ne,
green a. Depression and the risk of Alzheimer disease.
Epidemiology. 2005;
16:233
-238

[10] aronson mk,
ooi wl,
morgenstern h,
hafner a,
masur d. Women, myocardial infarction, and dementia in the very old.
Neurology. 1990;
40:1102
-1106

[11] arvanitakis z,
wilson rs,
bienias jl,
evans da,
bennett da. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function.
Arch Neurol. 2004;
61:661
-666

[12] atti ar,
palmer k,
volpato s,
zuliani g,
winblad b,
fratiglioni l. Anaemia increases the risk of dementia in cognitively intact elderly.
Neurobiol Aging. 2006;
27:278
-284

[13] bachman dl,
wolf pa,
linn r,
knoefel je,
cobb j. Prevalence of dementia and probable senile dementia of the Alzheimer type in the Framingham Study.
Neurology. 1992;
42:115
-119

[14] baldi i,
lebailly p,
mohammed-brahim b,
letenneur l,
dartigues jf,
brochard p. Neurodegenerative diseases and exposure to pesticides in the elderly.
Am J Epidemiol. 2003;
157:409
-414

[15] balin bj,
gerard hc,
arking ej,
appelt dm,
branigan pj. Identification and localization of Chlamydia pneumoniae in the Alzheimer’s brain.
Med Microbiol Immunol (Berl). 1998;
187:23
-42

[16] ball mj,
mathews r,
steiner i,
hill jm,
wisner tw. Latent HSV 1 virus in trigeminal ganglia: the optimal site for linking prevention of Alzheimer’s disease to vaccination.
Neurobiol Aging. 2001;
22:705
-709

[17] barberger-gateau p,
letenneur l,
deschamps v,
peres k,
dartigues jf,
renaud s. Fish, meat, and risk of dementia: cohort study.
Bmj. 2002;
325:932
-923

[18] barnes ll,
mendes de leon cf,
wilson rs,
bienias jl,
evans da. Social resources and cognitive decline in a population of older African Americans and whites.
Neurology. 2004;
63:2322
-2326

[19] barrett-connor e,
edelstein sl,
corey-bloom j,
wiederholt wc. Weight loss precedes dementia in community-dwelling older adults.
J Am Geriatr Soc. 1996;
44:1147
-1152

[20] beard cm,
kokmen e,
offord kp,
kurland lt. Lack of association between Alzheimer’s disease and education, occupation, marital status, or living arrangement.
Neurology. 1992;
42:2063
-2068

[21] beard cm,
kokmen e,
o’brien pc,
ania bj,
melton lj 3rd. Risk of Alzheimer’s disease among elderly patients with anemia: population-based investigations in Olmsted County, Minnesota.
Ann Epidemiol. 1997;
7:219
-224

[22] beeri ms,
goldbourt u,
silverman jm,
noy s,
schmeidler j. Diabetes mellitus in midlife and the risk of dementia three decades later.
Neurology. 2004;
63:1902
-1907

[23] beeri ms,
rapp m,
silverman jm,
schmeidler j,
grossman ht. Coronary artery disease is associated with Alzheimer disease neuropathology in APOE4 carriers.
Neurology. 2006;
66:1399
-1404

[24] beffert u,
bertrand p,
champagne d,
gauthier s,
poirier j. HSV-1 in brain and risk of Alzheimer’s disease.
Lancet. 1998;
351:1330
-1331

[25] bennett da,
schneider ja,
tang y,
arnold se,
wilson rs. The effect of social networks on the relation between Alzheimer’s disease pathology and level of cognitive function in old people: a longitudinal cohort study.
Lancet Neurol. 2006;
5:406
-412

[26] berger ak,
fratiglioni l,
forsell y,
winblad b,
backman l. The occurrence of depressive symptoms in the preclinical phase of AD: a population-based study.
Neurology. 1999;
53:1998
-2002

[27] berr c,
balansard b,
arnaud j,
roussel am,
alperovitch a. Cognitive decline is associated with systemic oxidative stress: the EVA study. Etude du Vieillissement Arteriel.
J Am Geriatr Soc. 2000;
48:1285
-1291

[28] berr c,
richard mj,
gourlet v,
garrel c,
favier a. Enzymatic antioxidant balance and cognitive decline in aging--the EVA study.
Eur J Epidemiol. 2004;
19:133
-138

[29] bian l,
yang jd,
guo tw,
sun y,
duan sw. Insulin-degrading enzyme and Alzheimer disease: a genetic association study in the Han Chinese.
Neurology. 2004;
63:241
-245

[30] biessels gj,
staekenborg s,
brunner e,
brayne c,
scheltens p. Risk of dementia in diabetes mellitus: a systematic review.
Lancet Neurol. 2006;
5:64
-74

[31] bornstein ra,
starling rc,
myerowitz pd,
haas gj. Neuropsychological function in patients with end-stage heart failure before and after cardiac transplantation.
Acta Neurol Scand. 1995;
91:260
-265

[32] bosma h,
vanboxtel mp,
ponds rw,
houx pj,
jolles j. Pesticide exposure and risk of mild cognitive dysfunction.
Lancet. 2000;
356:912
-913

[33] bowirrat a,
friedland rp,
farrer l,
baldwin c,
korczyn a. Genetic and environmental risk factors for Alzheimer’s disease in Israeli Arabs.
J Mol Neurosci. 2002;
19:239
-245

[34] boyle jp,
honeycutt aa,
narayan km,
hoerger tj,
geiss ls. Projection of diabetes burden through 2050: Impact of changing demography and disease prevalence in the US.
Diabetes Care. 2001;
24:1936
-1940

[35] brenner de,
kukull wa,
van belle g,
bowen jd,
mccormick wc. Relationship between cigarette smoking and Alzheimer’s disease in a population-based case-control study.
Neurology. 1993;
43:293
-300

[36] breteler mm,
claus jj,
grobbee de,
hofman a. Cardiovascular disease and distribution of cognitive function in elderly people: the Rotterdam Study.
BMJ. 1994;
308:1604
-1608

[37] broe ga,
henderson as,
creasey h,
mccusker e,
korten ae. A case-control study of Alzheimer’s disease in Australia.
Neurology. 1990;
40:1698
-1707

[38] buchman as,
wilson rs,
bienias jl,
shah rc,
evans da,
bennett da. Change in body mass index and risk of incident Alzheimer’s disease.
Neurology. 2005;
65:892
-897

[39] buntinx f,
kester a,
bergers j,
knottnerus ja. Is depression in elderly people followed by dementia? A retrospective cohort study based in general practice.
Age Ageing. 1996;
25:231
-233

[40] bursi f,
rocca wa,
killian jm,
weston sa,
knopman ds. Heart disease and dementia: a population-based study.
Am J Epidemiol. 2006;
163:135
-141

[41] cacciatore f,
abete p,
ferrara n,
calabrese c,
napoli c. Congestive heart failure and cognitive impairment in an older population. Osservatorio Geriatrico Campano Study Group.
J Am Geriatr Soc. 1998;
46:1343
-1348

[42] cervilla ja,
prince m,
mann a. Smoking, drinking, and incident cognitive impairment: a cohort community based study included in the Gospel Oak project.
J Neurol Neurosurg Psychiatry. 2000;
68:622
-626

[43] chandra v,
philipose v,
bell pa,
lazaroff a,
schoenberg bs. Case-control study of late onset "probable Alzheimer’s disease".
Neurology. 1987;
37:1295
-1300

[44] chandra v,
kokmen e,
schoenberg bs,
beard cm. Head trauma with loss of consciousness as a risk factor for Alzheimer’s disease.
Neurology. 1989;
39:1576
-1578

[45] chen p,
ganguli m,
mulsant bh,
dekosky st. The temporal relationship between depressive symptoms and dementia: a community-based prospective study.
Arch Gen Psychiatry. 1999;
56:261
-266

[46] cobb jl,
wolf pa,
au r,
white r,
d’agostino rb. The effect of education on the incidence of dementia and Alzheimer’s disease in the Framingham Study.
Neurology. 1995;
45:1707
-1712

[47] commenges d,
scotet v,
renaud s,
jacqmin-gadda h,
barberger-gateau p,
dartigues jf. Intake of flavonoids and risk of dementia.
Eur J Epidemiol. 2000;
16:357
-363

[48] corso ea,
campo g,
triglio a,
napoli a,
reggio a,
lanaia f. Prevalence of moderate and severe Alzheimer dementia and multi-infarct dementia in the population of southeastern Sicily.
Ital J Neurol Sci. 1992;
13:215
-219

[49] crystal ha,
ortof e,
frishman wh,
gruber a,
hershman d,
aronson m. Serum vitamin B12 levels and incidence of dementia in a healthy elderly population: a report from the Bronx Longitudinal Aging Study.
J Am Geriatr Soc. 1994;
42:933
-936

[50] dal forno g,
palermo mt,
donohue je,
karagiozis h,
zonderman ab,
kawas ch. Depressive symptoms, sex, and risk for Alzheimer’s disease.
Ann Neurol. 2005;
57:381
-387

[51] de la torre jc. How do heart disease and stroke become risk factors for Alzheimer’s disease?.
Neurol Res. 2006;
28:637
-644

[52] del parigi a,
panza f,
capurso c,
solfrizzi v. Nutritional factors, cognitive decline, and dementia.
Brain Res Bull. 2006;
69:1
-19

[53] den heijer t,
vermeer se,
van dijk ej,
prins nd,
koudstaal pj. Type 2 diabetes and atrophy of medial temporal lobe structures on brain MRI.
Diabetologia. 2003;
46:1604
-1610. Epub 2003 Nov 1

[54] dekosky st,
fitzpatrick a,
ives dg,
saxton j,
williamson j. The Ginkgo Evaluation of Memory (GEM) study: design and baseline data of a randomized trial of Ginkgo biloba extract in prevention of dementia.
Contemp Clin Trials. 2006;
27:238
-253

[55] denny sd,
kuchibhatla mn,
cohen hj. Impact of anemia on mortality, cognition, and function in community-dwelling elderly.
Am J Med. 2006;
119:327
-334

[56] devanand dp,
sano m,
tang mx,
taylor s,
gurland bj. Depressed mood and the incidence of Alzheimer’s disease in the elderly living in the community.
Arch Gen Psychiatry. 1996;
53:175
-182

[57] doll r,
peto r,
boreham j,
sutherland i. Smoking and dementia in male British doctors: prospective study.
BMJ. 2000;
320:1097
-1102

[58] dufouil c,
alperovitch a,
ducros v,
tzourio c. Homocysteine, white matter hyperintensities, and cognition in healthy elderly people.
Ann Neurol. 2003;
53:214
-221

[59] durga j,
van boxtel mp,
schouten eg,
kok fj,
jolles j. Effect of 3 year folic acid supplementation on cognitive function in older adults: a randomized, double blind, controlled trial.
J Nutr Health Aging. 2006;
10:208

[60] dyken me,
yamada t,
glenn cl,
berger ha. Obstructive sleep apnea associated with cerebral hypoxemia and death.
Neurology. 2004;
62:491
-493

[61] eikelenboom p,
van gool wa. Neuroinflammatory perspectives on the two faces of Alzheimer’s disease.
J Neural Transm. 2004;
111:281
-294. Epub 2003 Dec 3

[62] engelhart mj,
geerlings mi,
ruitenberg a,
van swieten jc,
hofman a. Diet and risk of dementia: Does fat matter? The Rotterdam Study.
Neurology. 2002a;
59:1915
-1921

[63] engelhart mj,
geerlings mi,
ruitenberg a,
van swieten jc,
hofman a. Dietary intake of antioxidants and risk of Alzheimer disease.
Jama. 2002b;
287:3223
-3229

[64] eussen s,
de groot lc,
joosten e,
bloo r,
clarke r. Effect of oral vitamin B12 with or without folic acid on cognitive function in older eople with mild vitamin B12 deficiency: a randomized, placebo-controlled trial.
J Nutr Health Aging. 2006;
10:208

[65] evans da,
beckett la,
albert ms,
hebert le,
scherr pa. Level of education and change in cognitive function in a community population of older persons.
Ann Epidemiol. 1993;
3:71
-77

[66] evans da,
hebert le,
beckett la,
scherr pa,
albert ms. Education and other measures of socioeconomic status and risk of incident Alzheimer disease in a defined population of older persons.
Arch Neurol. 1997;
54:1399
-1405

[67] fabrigoule c,
letenneur l,
dartigues jf,
zarrouk m,
commenges d,
barberger-gateau p. Social and leisure activities and risk of dementia: a prospective longitudinal study.
J Am Geriatr Soc. 1995;
43:485
-490

[68] farina e,
magni e,
ambrosini f,
manfredini r,
binda a. Neuropsychological deficits in asymptomatic atrial fibrillation.
Acta Neurol Scand. 1997;
96:310
-316

[69] feychting m,
pedersen nl,
svedberg p,
floderus b,
gatz m. Dementia and occupational exposure to magnetic fields.
Scand J Work Environ Health. 1998;
24:46
-53

[70] feychting m,
jonsson f,
pedersen nl,
ahlbom a. Occupational magnetic field exposure and neurodegenerative disease.
Epidemiology. 2003;
14:413
-419 ; discussion 427-428

[71] fleminger s,
oliver dl,
lovestone s,
rabe-hesketh s,
giora a. Head injury as a risk factor for Alzheimer’s disease: the evidence 10 years on; a partial replication.
J Neurol Neurosurg Psychiatry. 2003;
74:857
-862

[72] floyd ra,
hensley k. Oxidative stress in brain aging. Implications for therapeutics of neurodegenerative diseases.
Neurobiology of Aging. 2002;
23:795
-807

[73] foley dj,
masaki k,
white l,
larkin ek,
monjan a,
redline s. Sleep-disordered breathing and cognitive impairment in elderly Japanese-American men.
Sleep. 2003;
26:596
-599

[74] fontbonne a,
berr c,
ducimetiere p,
alperovitch a. Changes in cognitive abilities over a 4-year period are unfavorably affected in elderly diabetic subjects: results of the Epidemiology of Vascular Aging Study.
Diabetes Care. 2001;
24:366
-370

[75] forette f,
seux ml,
staessen ja,
thijs l,
birkenhager wh. Prevention of dementia in randomised double-blind placebo-controlled Systolic Hypertension in Europe (Syst-Eur) trial.
Lancet. 1998;
352:1347
-1351

[76] forster dp,
newens aj,
kay dw,
edwardson ja. Risk factors in clinically diagnosed presenile dementia of the Alzheimer type: a case-control study in northern England.
J Epidemiol Community Health. 1995;
49:253
-258

[77] forti p,
maioli f,
pisacane n,
rietti e,
montesi f,
ravaglia g. Atrial fibrillation and risk of dementia in non-demented elderly subjects with and without mild cognitive impairment.
Neurol Res. 2006;
28:625
-629

[78] fratiglioni l,
grut m,
forsell y,
viitanen m,
grafstrom m. Prevalence of Alzheimer’s disease and other dementias in an elderly urban population: relationship with age, sex, and education.
Neurology. 1991;
41:1886
-1892

[79] fratiglioni l,
ahlbom a,
viitanen m,
winblad b. Risk factors for late-onset Alzheimer’s disease: a population-based, case-control study.
Ann Neurol. 1993;
33:258
-266

[80] fratiglioni l,
viitanen m,
von strauss e,
tontodonati v,
herlitz a,
winblad b. Very old women at highest risk of dementia and Alzheimer’s disease: incidence data from the Kungsholmen Project, Stockholm.
Neurology. 1997;
48:132
-138

[81] fratiglioni l,
launer lj,
andersen k,
breteler mm,
copeland jr. Incidence of dementia and major subtypes in Europe: A collaborative study of population-based cohorts. Neurologic Diseases in the Elderly Research Group.
Neurology. 2000;
54:S10
-S15

[82] fratiglioni l,
paillard borg s,
winblad b. An active and socially integrated lifestyle in late life might protect against dementia.
Lancet Neurol. 2004;
3:343
-353

[83] fuhrer r,
dufouil c,
dartigues jf. PAQUID study. Exploring sex differences in the relationship between depressive symptoms and dementia incidence: prospective results from the PAQUID Study.
J Am Geriatr Soc. 2003;
51:1055
-1063

[84] galanis dj,
petrovitch h,
launer lj,
harris tb,
foley dj,
white lr. Smoking history in middle age and subsequent cognitive performance in elderly Japanese-American men. The Honolulu-Asia Aging Study.
Am J Epidemiol. 1997;
145:507
-515

[85] gao s,
hendrie hc,
hall ks,
hui s. The relationships between age, sex, and the incidence of dementia and Alzheimer disease: a meta-analysis.
Arch Gen Psychiatry. 1998;
55:809
-815

[86] gatz m,
svedberg p,
pedersen nl,
mortimer ja,
berg s,
johansson b. Education and the risk of Alzheimer’s disease: Findings from the study of Dementia in Swedish twins.
The Journals of gerontology Series B Psychological sciences and social sciences. 2001;
56:P292
-P300

[87] gatz jl,
tyas sl,
st john p,
montgomery p. Do depressive symptoms predict Alzheimer’s disease and dementia?.
J Gerontol A Biol Sci Med Sci. 2005;
60:744
-747

[88] gauthier e,
fortier i,
courchesne f,
pepin p,
mortimer j,
gauvreau d. Environmental pesticide exposure as a risk factor for Alzheimer’s disease: a case-control study.
Environ Res. 2001;
86:37
-45

[89] geerlings mi,
schmand b,
braam aw,
jonker c,
bouter lm,
van tilburg w. Depressive symptoms and risk of Alzheimer’s disease in more highly educated older people.
J Am Geriatr Soc. 2000;
48:1092
-1097

[90] gerard hc,
wildt kl,
whittum-hudson ja,
lai z,
ager j,
hudson ap. The load of Chlamydia pneumoniae in the Alzheimer’s brain varies with APOE genotype.
Microb Pathog. 2005;
39:19
-26

[91] gieffers j,
reusche e,
solbach w,
maass m. Failure to detect Chlamydia pneumoniae in brain sections of Alzheimer’s disease patients.
J Clin Microbiol. 2000;
38:881
-882

[92] gillette guyonnet s,
abellan van kan g,
andrieu s,
barberger gateau p,
berr c. IANA task force on nutrition and cognitive decline with aging.
J Nutr Health Aging. 2007;
11:132
-152

[93] graves ab,
white e,
koepsell td,
reifler bv,
van belle g. The association between head trauma and Alzheimer’s disease.
Am J Epidemiol. 1990;
131:491
-501

[94] graves ab,
van duijn cm,
chandra v,
fratiglioni l,
heyman a. Alcohol and tobacco consumption as risk factors for Alzheimer’s disease: a collaborative re-analysis of case-control studies. EURODEM Risk Factors Research Group.
Int J Epidemiol. 1991;
202:S48
-S57

[95] graves ab,
larson eb,
edland sd,
bowen jd,
mccormick wc. Prevalence of dementia and its subtypes in the Japanese American population of King County, Washington state. The Kame Project.
Am J Epidemiol. 1996;
144:760
-771

[96] graves ab,
rosner d,
echeverria d,
mortimer ja,
larson eb. Occupational exposures to solvents and aluminium and estimated risk of Alzheimer’s disease.
Occup Environ Medicine. 1998;
55:627
-633

[97] gregg ew,
yaffe k,
cauley ja,
rolka db,
blackwell tl. Is diabetes associated with cognitive impairment and cognitive decline among older women? Study of Osteoporotic Fractures Research Group.
Arch Intern Med. 2000;
160:174
-180

[98] gun rt,
korten ae,
jorm af,
henderson as,
broe ga. Occupational risk factors for Alzheimer disease: A case-control study.
Alz Dis Assoc Disorder. 1997;
11:21
-27

[99] guo z,
cupples la,
kurz a,
auerbach sh,
volicer l. Head injury and the risk of AD in the MIRAGE study.
Neurology. 2000;
54:1316
-1323

[100] gustafson d,
rothenberg e,
blennow k,
steen b,
skoog i. An 18-year follow-up of overweight and risk of Alzheimer disease.
Arch Intern Med. 2003;
163:1524
-1528

[101] gustafson d,
lissner l,
bengtsson c,
bjorklund c,
skoog i. A 24-year follow-up of body mass index and cerebral atrophy.
Neurology. 2004;
63:1876
-1881

[102] haan mn,
shemanski l,
jagust wj,
manolio ta,
kuller l. The role of apoe ε4 in modulating effects of other risk factors for cognitive decline in elderly persons.
JAMA. 1999;
282:40
-46

[103] haan mn,
miller jw,
aiello ae,
whitmer ra,
jagust wj. Homocysteine, B vitamins, and the incidence of dementia and cognitive impairment: results from the Sacramento Area Latino Study on Aging.
Am J Clin Nutr. 2007;
85:511
-517

[104] hakansson n,
gustavsson p,
johansen c,
floderus b. Neurodegenerative diseases in welders and other workers exposed to high levels of magnetic fields.
Epidemiology. 2003;
14:420
-426 ; discussion 427-428

[105] hassing lb,
johansson b,
nilsson se,
berg s,
pedersen nl. Diabete mellitus is a risk factor for vascular dementia, but not for Alzheimer’s disease: a population-based study of the oldest old.
Int Psychogeriatr. 2002;
14:239
-248

[106] hayden km,
zandi pp,
lyketsos cg,
khachaturian as,
bastian la. Vascular risk factors for incident Alzheimer disease and vascular dementia: the Cache County study.
Alzheimer Dis Assoc Disord. 2006;
20:93
-100

[107] hebert le,
scherr pa,
beckett la,
funkenstein hh,
albert ms. Relation of smoking and alcohol consumption to incident Alzheimer’s disease.
Am J Epidemiol. 1992;
135:347
-55

[108] hebert le,
scherr pa,
mccann jj,
beckett la,
evans da. Is the risk of developing Alzheimer’s disease greater for women than for men?.
Am J Epidemiol. 2001;
153:132
-136

[109] helmer c,
damon d,
letenneur l,
fabrigoule c,
barberger-gateau p. Marital status and risk of Alzheimer’s disease: a French population-based cohort study.
Neurology. 1999;
53:1953
-1958

[110] helmer c,
letenneur l,
rouch i,
richardharston s,
barbergergateau p. Occupation during life and risk of dementia in French elderly community residents.
J Neurol Neurosurg Psychiat. 2001;
71:303
-309

[111] helmer c,
peuchant e,
letenneur l,
bourdel-marchasson i,
larrieu s. Association between antioxidant nutritional indicators and the incidence of dementia: results from the PAQUID prospective cohort study.
Eur J Clin Nutr. 2003;
57:1555
-1561

[112] hemling n,
roytta m,
rinne j,
pollanen p,
broberg e. Herpesviruses in brains in Alzheimer’s and Parkinson’s diseases.
Ann Neurol. 2003;
54:267
-271

[113] heude b,
ducimetiere p,
berr c. Cognitive decline and fatty acid composition of erythrocyte membranes--The EVA Study.
Am J Clin Nutr. 2003;
77:803
-808

[114] heyn p,
abreu bc,
ottenbacher kj. The effects of exercise training on elderly persons with cognitive impairment and dementia: a meta analysis.
Arch Phys Med Rehabil. 2004;
85:1694
-1704

[115] hill lr,
klauber mr,
salmon dp,
yu es,
liu wt. Functional status, education, and the diagnosis of dementia in the Shanghai.
Neurology. 1993;
43:138
-145

[116] himanen l,
portin r,
isoniemi h,
helenius h,
kurki t,
tenovuo o. Longitudinal cognitive changes in traumatic brain injury: A 30-year follow-up study.
Neurology. 2006;
66:187
-192

[117] hogervorst e,
williams j,
budge m,
riedel w,
jolles j. The nature of the effect of female gonadal hormone replacement therapy on cognitive function in post-menopausal women: A meta- analysis.
Neuroscience. 2000;
101:485
-512

[118] holtzman re,
rebok gw,
saczynski js,
kouzis ac,
wilcox doyle k,
eaton ww. Social network characteristics and cognition in middle-aged and older adults.
J Gerontol B Psychol Sci Soc Sci. 2004;
59:P278
-P284

[119]heart protection study collaborative group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: a randomised placebo-controlled trial.
Lancet. 2002;
360:7
-22

[120] in’t veld ba,
ruitenberg a,
hofman a,
launer l,
van duijn cm. Non steroidal antiinflammatory drugs and the risk of Alzheimer’s disease.
N Engl J Med. 2001;
345:1515
-1521

[121] incalzi ra,
gemma a,
marra c,
muzzolon r,
capparella o,
carbonin p. Chronic obstructive pulmonary disease. An original model of cognitive decline.
Am Rev Respir Dis. 1993;
148:418
-424

[122] incalzi ra,
gemma a,
marra c,
capparella o,
fuso l,
carbonin p. Verbal memory impairment in COPD: its mechanisms and clinical relevance.
Chest. 1997;
112:1506
-1513

[123] incalzi ra,
gambassi g,
bernabei r. Ruffled hair and fever in an old woman with Alzheimer’s disease.
Aging Clin Exp Res. 2005;
17:62
-66

[124]invs (institut de veille sanitaire). Aluminium : quels risques pour la santé ? Synthèse des études épidémiologiques. Volet épidémiologique de l’expertise collective InVS-Afssa-Afssaps.
Novembre 2003:;
.

[125] itabashi s,
arai h,
matsui t,
higuchi s,
sasaki h. Herpes simplex virus and risk of Alzheimer’s disease.
Lancet. 1997;
349:1102

[126] itzhaki rf,
lin wr,
shang d,
wilcock gk,
faragher b,
jamieson ga. Herpes simplex virus type 1 in brain and risk of Alzheimer’s disease.
Lancet. 1997;
349:241
-244

[127] itzhaki rf,
wozniak ma. Herpes simplex virus type 1, apolipoprotein E, and cholesterol: a dangerous liaison in Alzheimer’s disease and other disorders.
Prog Lipid Res. 2006;
45:73
-90

[128] jamieson ga,
maitland nj,
wilcock gk,
yates cm,
itzhaki rf. Herpes simplex virus type 1 DNA is present in specific regions of brain from aged people with and without senile dementia of the Alzheimer type.
J Pathol. 1992;
167:365
-368

[129] johnson dk,
wilkins ch,
morris jc. Accelerated weight loss may precede diagnosis in Alzheimer disease.
Arch Neurol. 2006;
63:1312
-1317

[130] jorm af,
jolley d. The incidence of dementia: a meta-analysis.
Neurology. 1998;
51:728
-733

[131] jorm af,
korten ae,
henderson as. The prevalence of dementia: a quantitative integration of the literature.
Acta Psychiatr Scand. 1987;
76:465
-479

[132] juan d,
zhou dh,
li j,
wang jy,
gao c,
chen m. A 2-year follow-up study of cigarette smoking and risk of dementia.
Eur J Neurol. 2004;
11:277
-282

[133] kado dm,
karlamangla as,
huang mh,
troen a,
rowe jw,
selhub j,
seeman te. Homocysteine versus the vitamins folate, B6, and B12 as predictors of cognitive function and decline in older high-functioning adults: MacArthur Studies of Successful Aging.
Am J Med. 2005;
118:161
-167

[134] kadotani h,
kadotani t,
young t,
peppard pe,
finn l. Association between apolipoprotein E epsilon4 ans sleep disordered breathing in adults.
JAMA. 2001;
285:2888
-2890

[135] kahana e,
galper y,
zilber n,
korczyn ad. Epidemiology of dementia in Ashkelon: the influence of education.
J Neurol. 2003;
250:424
-428

[136] kalmijn s,
feskens ej,
launer lj,
kromhout d. Polyunsaturated fatty acids, antioxidants, and cognitive function in very old men.
Am J Epidemiol. 1997;
145:33
-41

[137] kalmijn s,
launer lj,
lindemans j,
bots ml,
hofman a,
breteler mm. Total homocysteine and cognitive decline in a community-based sample of elderly subjects: the Rotterdam Study.
Am J Epidemiol. 1999;
150:283
-289

[138] kalmijn s,
van boxtel mp,
ocke m,
verschuren wm,
kromhout d,
launer lj. Dietary intake of fatty acids and fish in relation to cognitive performance at middle age.
Neurology. 2004;
62:275
-280

[139] karp a,
kareholt i,
qiu c,
bellander t,
winblad b,
fratiglioni l. Relation of education and occupation-based socioeconomic status to incident Alzheimer’s disease.
Am J Epidemiol. 2004;
159:175
-183

[140] kessing lv,
nilsson fm. Increased risk of developing dementia in patients with major affective disorders compared to patients with other medical illnesses.
J Affect Disord. 2003;
73:261
-269

[141] kilander l,
andren b,
nyman h,
lind l,
boberg m,
lithell h. Atrial fibrillation is an independent determinant of low cognitive function: a cross-sectional study in elderly men.
Stroke. 1998;
29:1816
-1820

[142] kivipelto m,
helkala el,
laakso mp,
hanninen t,
hallikainen m. Midlife vascular risk factors and Alzheimer’s disease in later life: longitudinal, population based study.
Bmj. 2001;
322:1447
-1451

[143] kivipelto m,
ngandu t,
fratiglioni l,
viitanen m,
kareholt i. Obesity and vascular risk factors at midlife and the risk of dementia and Alzheimer disease.
Arch Neurol. 2005;
62:1556
-1560

[144] kivipelto m,
ngandu t,
laatikainen t,
winblad b,
soininen h,
tuomilehto j. Risk score for the prediction of dementia risk in 20 years among middle aged people: a longitudinal, population-based study.
Lancet Neurol. 2006;
5:735
-741

[145] kiyohara y,
yoshitake t,
kato i,
ohmura t,
kawano h. Changing patterns in the prevalence of dementia in a Japanese community: the Hisayama study.
Gerontology. 1994;
402:29
-35

[146] klegeris a,
mcgeer pl. Non-steroidal anti-inflammatory drugs (NSAIDs) and other anti-inflammatory agents in the treatment of neurodegenerative disease.
Curr Alzheimer Res. 2005;
2:355
-365

[147] knopman d,
boland ll,
mosley t,
howard g,
liao d. Cardiovascular risk factors and cognitive decline in middle-aged adults.
Neurology. 2001;
56:42
-48

[148] kokmen e,
beard cm,
chandra v,
offord kp,
schoenberg bs,
ballard dj. Clinical risk factors for Alzheimer’s disease: a population-based case-control study.
Neurology. 1990;
41:1393
-1397

[149] kris-etherton pm. A new role for diet in reducing the incidence of cardiovascular disease: evidence from recent studies.
Curr Atheroscler Rep. 1999;
1:185
-187

[150] kris-etherton pm,
harris ws,
appel lj,
for the nutrition committee . Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease.
Circulation. 2002;
106:2747
-2757

[151] kruman ii,
kumaravel ts,
lohani a,
pedersen wa,
cutler rg. Folic acid deficiency and homocysteine impair DNA repair in hippocampal neurons and sensitize them to amyloid toxicity in experimental models of Alzheimer’s disease.
J Neurosci. 2002;
22:1752
-1762

[152] kryscio rj,
schmitt fa,
salazar jc,
mendiondo ms,
markesbery wr. Risk factors for transitions from normal to mild cognitive impairment and dementia.
Neurology. 2006;
66:828
-832

[153] kukull wa,
larson eb,
bowen jd,
mccormick wc,
teri l. Solvent exposure as a risk factor for Alzheimer’s disease: a case-control study.
Am J Epidemiol. 1995;
141:1059
-1071 ; discussion 1072-1079

[154] larson eb,
shadlen mf,
wang l,
mccormick wc,
bowen jd,
teri l,
kukull wa. Survival after initial diagnosis of Alzheimer disease.
Ann Intern Med. 2004;
140:501
-509

[155] larson eb,
wang li,
bowen j,
mccormick wc,
teri l,
crane p,
kukull w. Exercise is associated with reduced risk for incident dementia among persons 65 years of age and older.
Ann Intern Med. 2006;
144:73
-81

[156] launer lj,
feskens ej,
kalmijn s,
kromhout d. Smoking, drinking, and thinking. The Zutphen Elderly Study.
Am J Epidemiol. 1996;
143:219
-227

[157] launer lj,
andersen k,
dewey me,
letenneur l,
ott a. Rates and risk factors for dementia and Alzheimer’s disease: results from EURODEM pooled analyses. EURODEM Incidence Research Group and Work Groups. European Studies of Dementia.
Neurology. 1999;
52:78
-84

[158] le carret n,
rainville c,
lechevallier n,
lafont s,
letenneur l,
fabrigoule c. Influence of education on the benton visual retention test performance as mediated by a strategic search component.
Brain Cogn. 2003;
53:408
-411

[159] lebars pl,
katz mm,
berman n,
itil tm,
freedman am,
schatzberg af. A placebo-controlled, double-blind, randomized trial of an extract of Ginkgo biloba for dementia.
Jama. 1997;
278:1327
-1332

[160] leblanc a. Estrogen and Alzheimer’s disease.
Curr Opin Investig Drugs. 2002;
3:768
-773

[161] leblanc es,
janowsky j,
chan bk,
nelson hd. Hormone replacement therapy and cognition: systematic review and meta-analysis.
Jama. 2001;
285:1489
-1499

[162] lee pn. Smoking and Alzheimer’s disease: a review of the epidemiological evidence.
Neuroepidemiology. 1994;
13:131
-144

[163] lemeshow s,
letenneur l,
dartigues jf,
lafont s,
orgogozo jm,
commenges d. Illustration of analysis taking into account complex survey considerations: the association between wine consumption and dementia in the PAQUID study. Personnes Ages Quid.
Am J Epidemiol. 1998;
148:298
-306

[164] letenneur l,
gilleron v,
commenges d,
helmer c,
orgogozo jm,
dartigues jf. Are sex and educational level independent predictors of dementia and Alzheimer’s disease? Incidence data from the PAQUID project.
J Neurol Neurosurg Psychiatry. 1999;
66:177
-183

[165] letenneur l,
launer lj,
andersen k,
dewey me,
ott a. Education and the risk for Alzheimer’s disease: sex makes a difference. EURODEM pooled analyses. EURODEM Incidence Research Group.
Am J Epidemiol. 2000;
151:1064
-1071

[166] letenneur l,
larrieu s,
barberger-gateau p. Alcohol and tobacco consumption as risk factors of dementia: a review of epidemiological studies.
Biomed Pharmacother. 2004;
58:95
-99

[167] letz r,
gerr f,
cragle d,
green rc,
watkins j,
fidler at. Residual neurologic deficits 30 years after occupational exposure to elemental mercury.
Neurotoxicology. 2000;
21:459
-474

[168] li g,
shen yc,
li yt,
chen ch,
zhau yw,
silverman jm. A case-control study of Alzheimer’s disease in China.
Neurology. 1992;
42:1481
-1488

[169] li g,
higdon r,
kukull wa,
peskind e,
van valen moore k. Statin therapy and risk of dementia in the elderly: a community-based prospective cohort study.
Neurology. 2004;
63:1624
-1628

[170] li ys,
meyer js,
thornby j. Longitudinal follow-up of depressive symptoms among normal versus cognitively impaired elderly.
Int J Geriatr Psychiatry. 2001;
16:718
-727

[171] lin wr,
wozniak ma,
cooper rj,
wilcock gk,
itzhaki rf. Herpesviruses in brain and Alzheimer’s disease.
J Pathol. 2002;
197:395
-402

[172] lindsay j,
laurin d,
verreault r,
hebert r,
helliwell b. Risk factors for Alzheimer’s disease: a prospective analysis from the Canadian Study of Health and Aging.
Am J Epidemiol. 2002;
156:445
-453

[173] lithell h,
hansson l,
skoog i,
elmfeldt d,
hofman a. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial.
J Hypertens. 2003;
21:875
-886

[174] liu hc,
lin kn,
teng el,
wang sj,
fuh jl. Prevalence and subtypes of dementia in Taiwan: a community survey of 5297 individuals.
J Am Geriatr Soc. 1995;
43:144
-149

[175] logroscino g,
kang jh,
grodstein f. Prospective study of type 2 diabetes and cognitive decline in women aged 70-81 years.
BMJ. 2004;
328:548. Epub 2004 Feb 23

[176] luchsinger ja,
tang mx,
shea s,
mayeux r. Caloric intake and the risk of Alzheimer disease.
Archives of Neurology. 2002;
59:1258
-1263

[177] luchsinger ja,
mayeux r. Cardiovascular risk factors and Alzheimer’s disease.
Curr Atheroscler Rep. 2004a;
6:261
-266

[178] luchsinger ja,
mayeux r. Dietary factors and Alzheimer’s disease.
Lancet Neurol. 2004b;
3:579
-587

[179] luchsinger ja,
tang mx,
shea s,
mayeux r. Hyperinsulinemia and risk of Alzheimer disease.
Neurology. 2004a;
63:1187
-1192

[180] luchsinger ja,
tang mx,
stern y,
shea s,
mayeux r. Diabetes mellitus and risk of Alzheimer’s disease and dementia with stroke in a multiethnic cohort.
Am J Epidemiol. 2001;
154:635
-641

[181] luchsinger ja,
patel b,
tang mx,
schupf n,
mayeux r. Measures of adiposity and dementia risk in elderly persons.
Arch Neurol. 2007a;
64:392
-398

[182] luchsinger ja,
tang mx,
miller j,
green r,
mayeux r. Relation of higher folate intake to lower risk of Alzheimer disease in the elderly.
Arch Neurol. 2007b;
64:86
-92

[183] lund jp,
mojon p,
pho m,
feine js. Alzheimer’s disease and edentulism.
Age Ageing. 2003;
32:228
-229

[184] lytle me,
vander bilt j,
pandav rs,
dodge hh,
ganguli m. Exercise level and cognitive decline: the MoVIES project.
Alzheimer Dis Assoc Disord. 2004;
18:57
-64

[185] manubens jm,
martinez-lage jm,
lacruz f,
muruzabal j,
larumbe r. Prevalence of Alzheimer’s disease and other dementing disorders in Pamplona, Spain.
Neuroepidemiology. 1995;
14:155
-164

[186] martin bk,
meinert cl,
breitner jc,
adapt research group . Double placebo design in a prevention trial for Alzheimer’s disease.
Control Clin Trials. 2002;
23:93
-99

[187] mayeux r,
ottman r,
maestre g,
ngai c,
tang mx. Synergistic effects of traumatic head injury and apolipoprotein-epsilon 4 in patients with Alzheimer’s disease.
Neurology. 1995;
45:555
-557

[188] mccaddon a,
hudson p,
davies g,
hughes a,
williams jh,
wilkinson c. Homocysteine and cognitive decline in healthy elderly.
Dement Geriatr Cogn Disord. 2001;
12:309
-313

[189] mcgeer pl,
mcgeer eg. Inflammation, autotoxicity and Alzheimer disease.
Neurobiol Aging. 2001;
22:799
-809

[190] mcgeer pl,
schulzer m,
mcgeer eg. Arthritis and anti-inflammatory agents as possible protective factors for Alzheimer’s disease: a review of 17 epidemiologic studies.
Neurology. 1996;
47:425
-432

[191] mehta km,
ott a,
kalmijn s,
slooter aj,
van duijn cm. Head trauma and risk of dementia and Alzheimer’s disease: The Rotterdam Study.
Neurology. 1999;
53:1959
-1962

[192] merchant c,
tang mx,
albert s,
manly j,
stern y,
mayeux r. The influence of smoking on the risk of Alzheimer’s disease.
Neurology. 1999;
52:1408
-1412

[193] milward ea,
grayson da,
creasey h,
janu mr,
brooks ws,
broe ga. Evidence for association of anaemia with vascular dementia.
Neuroreport. 1999;
10:2377
-2381

[194] mitnitski a,
skoog i,
song x,
waern m,
ostling s. A vascular risk factor index in relation to mortality and incident dementia.
Eur J Neurol. 2006;
13:514
-521

[195] modrego pj,
ferrandez j. Depression in patients with mild cognitive impairment increases the risk of developing dementia of Alzheimer type: a prospective cohort study.
Arch Neurol. 2004;
61:1290
-1293

[196] morris mc,
evans da,
bienias jl,
tangney cc,
bennett da. Dietary intake of antioxidant nutrients and the risk of incident Alzheimer disease in a biracial community study.
Jama. 2002;
287:3230
-3237

[197] morris mc,
evans da,
bienias jl,
tangney cc,
bennett da. Consumption of fish and n-3 fatty acids and risk of incident Alzheimer disease.
Arch Neurol. 2003;
60:940
-946

[198] morris mc,
evans da,
tangney cc,
bienias jl,
wilson rs. Fish Consumption and Cognitive Decline With Age in a Large Community Study.
Arch Neurol. 2005;
62:1849
-1853 Epub 2005 Oct 10

[199] mortimer ja,
graves ab. Education and other socioeconomic determinants of dementia and Alzheimer’s disease.
Neurology. 1993;
43:S39
-S44

[200] mortimer ja,
french lr,
hutton jt,
schuman lm. Head injury as a risk factor for Alzheimer’s disease.
Neurology. 1985;
35:264
-267

[201] mortimer ja,
van duijn cm,
chandra v,
fratiglioni l,
graves ab. Head trauma as a risk factor for Alzheimer’s disease: a collaborative re-analysis of case-control studies. EURODEM Risk Factors Research Group.
Int J Epidemiol. 1991;
202:S28
-S35

[202] muskiet fa,
fokkema mr,
schaafsma a,
boersma er,
crawford ma. Is docosahexaenoic acid (DHA) essential? Lessons from DHA status regulation, our ancient diet, epidemiology and randomized controlled trials.
J Nutr. 2004;
134:183
-186

[203] mutter j,
naumann j,
sadaghiani c,
schneider r,
walach h. Alzheimer disease: mercury as pathogenetic factor and apolipoprotein E as a moderator.
Neuro Endocrinol Lett. 2004;
25:331
-339

[204] nemetz pn,
leibson c,
naessens jm,
beard m,
kokmen e. Traumatic brain injury and time to onset of Alzheimer’s disease: a population-based study.
Am J Epidemiol. 1999;
149:32
-40

[205] nilson ln,
sallsten g,
hagberg s,
backman l,
barregard l. Influence of solvent exposure and aging on cognitive functioning: an 18 year follow up of formerly exposed floor layers and their controls.
Occup Environ Medicine. 2002;
59:49
-57

[206] nochlin d,
shaw cm,
campbell la,
kuo cc. Failure to detect Chlamydia pneumoniae in brain tissues of Alzheimer’s disease.
Neurology. 1999;
53:1888

[207] nordberg m,
winblad b,
fratiglioni l,
basun h. Lead concentrations in elderly urban people related to blood pressure and mental performance: results from a population-based study.
Am J Ind Med. 2000;
38:290
-294

[208] nourhashemi f,
deschamps v,
larrieu s,
letenneur l,
dartigues jf,
barberger-gateau p. Body mass index and incidence of dementia: the PAQUID study.
Neurology. 2003;
60:117
-119

[209] o’connor dw,
pollitt pa,
treasure fp. The influence of education and social class on the diagnosis of dementia in a community population.
Psychol Med. 1991;
21:219
-224

[210] o’meara es,
kukull wa,
sheppard l,
bowen jd,
mccormick wc. Head injury and risk of Alzheimer’s disease by apolipoprotein E genotype.
Am J Epidemiol. 1997;
146:373
-384

[211] onofrj m,
thomas a,
luciano al,
iacono d,
di rollo a. Donepezil versus vitamin E in Alzheimer’s disease: Part 2: mild versus moderate-severe Alzheimer’s disease.
Clin Neuropharmacol. 2002;
25:207
-215

[212] ott a,
breteler mm,
van harskamp f,
claus jj,
van der cammen tj. Prevalence of Alzheimer’s disease and vascular dementia: association with education. The Rotterdam study.
Bmj. 1995;
310:970
-973

[213] ott a,
breteler mm,
de bruyne mc,
van harskamp f,
grobbee de,
hofman a. Atrial fibrillation and dementia in a population-based study. The Rotterdam Study.
Stroke. 1997;
28:316
-321

[214] ott a,
slooter aj,
hofman a,
van harskamp f,
witteman jc. Smoking and risk of dementia and Alzheimer’s disease in a population-based cohort study: the Rotterdam Study.
Lancet. 1998;
351:1840
-1843

[215] ott a,
stolk rp,
van harskamp f,
pols ha,
hofman a,
breteler mm. Diabetes mellitus and the risk of dementia: The Rotterdam Study.
Neurology. 1999;
53:1937
-1942

[216] ott a,
andersen k,
dewey me,
letenneur l,
brayne c. Effect of smoking on global cognitive function in nondemented elderly.
Neurology. 2004;
62:920
-924

[217] ownby rl,
crocco e,
acevedo a,
john v,
loewenstein d. Depression and risk for Alzheimer disease: systematic review, meta-analysis, and metaregression analysis.
Arch Gen Psychiatry. 2006;
63:530
-538

[218] palsson s,
aevarsson o,
skoog i. Depression, cerebral atrophy, cognitive performance and incidence of dementia. Population study of 85-year-olds.
Br J Psychiatry. 1999;
174:249
-253

[219] peila r,
rodriguez bl,
launer lj. Type 2 diabetes, APOE gene, and the risk for dementia and related pathologies: The Honolulu-Asia Aging Study.
Diabetes. 2002;
51:1256
-1262

[220] petersen rc,
thomas rg,
grundman m,
bennett d,
doody r. Vitamin E and donepezil for the treatment of mild cognitive impairment.
N Engl J Med. 2005;
352:2379
-2388

[221] petrovitch h,
white l,
masaki kh,
ross gw,
abbott rd. Influence of myocardial infarction, coronary artery bypass surgery, and stroke on cognitive impairment in late life.
Am J Cardiol. 1998;
81:1017
-1021

[222] petrovitch h,
white lr,
izmirilian g,
ross gw,
havlik rj. Midlife blood pressure and neuritic plaques, neurofibrillary tangles, and brain weight at death: the HAAS.
Neurobiol Aging. 2000;
21:57
-62

[223] pfeffer ri,
afifi aa,
chance jm. Prevalence of Alzheimer’s disease in a retirement community.
Am J Epidemiol. 1987;
125:420
-436

[224] plassman bl,
havlik rj,
steffens dc,
helms mj,
newman tn. Documented head injury in early adulthood and risk of Alzheimer’s disease and other dementias.
Neurology. 2000;
55:1158
-1166

[225] podewils lj,
guallar e,
kuller lh,
fried lp,
lopez ol. Physical activity, APOE genotype, and dementia risk: findings from the Cardiovascular Health Cognition Study.
Am J Epidemiol. 2005;
161:639
-651

[226] polidori mc,
marvardi m,
cherubini a,
senin u,
mecocci p. Heart disease and vascular risk factors in the cognitively impaired elderly: implications for Alzheimer’s dementia.
Aging (Milano). 2001;
13:231
-239

[227] polidori mc,
mariani e,
mecocci p,
nelles g. Congestive heart failure and Alzheimer’s disease.
Neurol Res. 2006;
28:588
-594

[228] prencipe m,
casini ar,
ferretti c,
lattanzio mt,
fiorelli m,
culasso f. Prevalence of dementia in an elderly rural population: effects of age, sex, and education.
J Neurol Neurosurg Psychiatry. 1996;
60:628
-633

[229] prince m,
cullen m,
mann a. Risk factors for Alzheimer’s disease and dementia: a case-control study based on the MRC elderly hypertension trial.
Neurology. 1994;
44:97
-104

[230] qiu c,
karp a,
von strauss e,
winblad b,
fratiglioni l,
bellander t. Lifetime principal occupation and risk of Alzheimer’s disease in the Kungsholmen project.
Am J Ind Med. 2003a;
43:204
-211

[231] qiu c,
winblad b,
viitanen m,
fratiglioni l. Pulse pressure and risk of Alzheimer disease in persons aged 75 years and older: a community-based, longitudinal study.
Stroke. 2003b;
34:594
-599

[232] qiu c,
von strauss e,
winblad b,
fratiglioni l. Decline in blood pressure over time and risk of dementia: a longitudinal study from the Kungsholmen project.
Stroke. 2004;
35:1810
-1815 Epub

[233] qiu c,
winblad b,
fratiglioni l. The age-dependent relation of blood pressure to cognitive function and dementia.
Lancet Neurol. 2005;
4:487
-499

[234] qiu c,
winblad b,
marengoni a,
klarin i,
fastbom j,
fratiglioni l. Heart failure and risk of dementia and Alzheimer disease: a population-based cohort study.
Arch Intern Med. 2006;
166:1003
-1008

[235] ravaglia g,
forti p,
maioli f,
sacchetti l,
mariani e. Education, occupation, and prevalence of dementia: findings from the Conselice study.
Dement Geriatr Cogn Disord. 2002;
14:90
-100

[236] ravaglia g,
forti p,
maioli f,
martelli m,
servadei l. Homocysteine and folate as risk factors for dementia and Alzheimer disease.
Am J Clin Nutr. 2005;
82:636
-643

[237] rea td,
breitner jc,
psaty bm,
fitzpatrick al,
lopez ol. Statin use and the risk of incident dementia: the Cardiovascular Health Study.
Arch Neurol. 2005;
62:1047
-1051

[238] reines sa,
block ga,
morris jc,
liu g,
nessly ml. Rofecoxib: no effect on Alzheimer’s disease in a 1-year, randomized, blinded, controlled study.
Neurology. 2004;
62:66
-71

[239] resnick sm,
maki pm,
rapp sr,
espeland ma,
brunner r. Effects of Combination Estrogen Plus Progestin Hormone Treatment on Cognition and Affect.
J Clin Endocrinol Metab. 2006;
doi:10.1210/jc.2005-2097:

[240] richards m,
shipley b,
fuhrer r,
wadsworth me. Cognitive ability in childhood and cognitive decline in mid-life: longitudinal birth cohort study.
Bmj. 2004;
328:552

[241] riggs je. Smoking and Alzheimer’s disease: protective effect or differential survival bias?.
Lancet. 1993;
342:793
-794

[242] ring rh,
lyons jm. Failure to detect Chlamydia pneumoniae in the late-onset Alzheimer’s brain.
J Clin Microbiol. 2000;
38:2591
-2594

[243] rocca wa,
van duijn cm,
clayton d,
chandra v,
fratiglioni l. Maternal age and Alzheimer’s disease: a collaborative re-analysis of case-control studies. EURODEM Risk Factors Research Group.
Int J Epidemiol. 1991;
202:S21
-S27

[244] rogers ma,
simon dg. A preliminary study of dietary aluminium intake and risk of Alzheimer’s disease.
Age Ageing. 1999;
28:205
-209

[245] rogers j,
kirby lc,
hempelman sr,
berry dl,
mcgeer pl. Clinical trial of indomethacin in Alzheimer’s disease.
Neurology. 1993;
43:1609
-1611

[246] rondeau v. A review of epidemiologic studies on aluminum and silica in relation to Alzheimer’s disease and associated disorders.
Rev Environ Health. 2002;
17:107
-121

[247] rondeau v,
commenges d,
jacqmin-gadda h,
dartigues jf. Relation between aluminum concentrations in drinking water and Alzheimer’s disease: an 8-year follow-up study.
Am J Epidemiol. 2000;
152:59
-66

[248] sabatini t,
frisoni gb,
barbisoni p,
bellelli g,
rozzini r,
trabucchi m. Atrial fibrillation and cognitive disorders in older people.
J Am Geriatr Soc. 2000;
48:387
-390

[249] saczynski js,
pfeifer la,
masaki k,
korf es,
laurin d. The effect of social engagement on incident dementia: the Honolulu-Asia Aging Study.
Am J Epidemiol. 2006;
163:433
-440. Epub 2006 Jan 12

[250] salib e,
hillier v. A case-control study of Alzheimer’s disease and aluminium occupation.
Br J Psychiatry. 1996;
168:244
-249

[251] sambamurti k,
granholm ac,
kindy ms,
bhat nr,
greig nh. Cholesterol and Alzheimer’s disease: clinical and experimental models suggest interactions of different genetic, dietary and environmental risk factors.
Curr Drug Targets. 2004;
5:517
-528

[252] sano m,
ernesto c,
thomas rg,
klauber mr,
schafer k. A controlled trial of selegiline, alpha-tocopherol, or both as treatment for Alzheimer’s disease.
N Engl J Med. 1997;
336:1216
-1222

[253] sasaki n,
fukatsu r,
tsuzuki k,
hayashi y,
yoshida t. Advanced glycation end products in Alzheimer’s disease and other neurodegenerative diseases.
Am J Pathol. 1998;
153:1149
-1155

[254] satz p,
morgenstern h,
miller en,
selnes oa,
mcarthur jc. Low education as a possible risk factor for cognitive abnormalities in HIV-1: findings from the multicenter AIDS Cohort Study (MACS).
J Acquir Immune Defic Syndr. 1993;
6:503
-511

[255] savaskan e,
olivieri g,
meier f,
seifritz e,
wirz-justice a,
muller-spahn f. Red wine ingredient resveratrol protects from beta-amyloid neurotoxicity.
Gerontology. 2003;
49:380
-383

[256] savitz da,
loomis dp,
tse ck. Electrical occupations and neurodegenerative disease: analysis of U.S. mortality data.
Arch Environ Health. 1998;
53:71
-74

[257] scarmeas n,
stern y,
tang mx,
mayeux r,
luchsinger ja. Mediterranean diet and risk for Alzheimer’s disease.
Ann Neurol. 2006;
59:912
-921

[258] schall rr,
petrucci rj,
brozena sc,
cavarocchi nc,
jessup m. Cognitive function in patients with symptomatic dilated cardiomyopathy before and after cardiac transplantation.
J Am Coll Cardiol. 1989;
14:1666
-1672

[259] scharf s,
mander a,
ugoni a,
vajda f,
christophidis n. A double-blind, placebo-controlled trial of diclofenac/misoprostol in Alzheimer’s disease.
Neurology. 1999;
53:197
-201

[260] schofield pw,
tang m,
marder k,
bell k,
dooneief g. Alzheimer’s disease after remote head injury: an incidence study.
J Neurol Neurosurg Psychiatry. 1997;
62:119
-124

[261] selkoe dj. The genetics and molecular pathology of Alzheimer’s disease: roles of amyloid and the presenilins.
Neurol Clin. 2000;
18:903
-922

[262] seshadri s,
beiser a,
selhub j,
jacques pf,
rosenberg ih. Plasma homocysteine as a risk factor for dementia and Alzheimer’s disease.
N Engl J Med. 2002;
346:476
-483

[263] shepherd j,
blauw gj,
murphy mb,
bollen el,
buckley bm. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial.
Lancet. 2002;
360:1623
-1630

[264] shipley sj,
parkin et,
itzhaki rf,
dobson cb. Herpes simplex virus interferes with amyloid precursor protein processing.
BMC Microbiol. 2005;
5:48

[265] shobab la,
hsiung gy,
feldman hh. Cholesterol in Alzheimer’s disease.
Lancet Neurol. 2005;
4:841
-852

[266] shumaker sa,
legault c,
rapp sr,
thal l,
wallace rb. Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women: the Women’s Health Initiative Memory Study: a randomized controlled trial.
Jama. 2003;
289:2651
-2662

[267] shumaker sa,
legault c,
kuller l,
rapp sr,
thal l. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study.
Jama. 2004;
291:2947
-2958

[268] skoog i,
nilsson l,
palmertz b,
andreasson la,
svanborg a. A population-based study of dementia in 85-year-olds.
N Engl J Med. 1993;
328:153
-8

[269] smith ma,
tabaton m,
perry g. Early contribution of oxidative glycation in Alzheimer disease.
Neurosci Lett. 1996a;
217:210
-211

[270] smith ma,
sayre lm,
perry g. Diabetes mellitus and Alzheimer’s disease: glycation as a biochemical link.
Diabetologia. 1996b;
39:247

[271] sobel e,
davanipour z,
sulkava r,
erkinjuntti t,
wikstrom j. Occupations with exposure to magnetic fields: a possible risk factor for Alzheimer’s disease.
Am J Epidemiol. 1995;
142:515
-524

[272] sparks dl,
sabbagh mn,
connor dj,
lopez j,
launer lj. Atorvastatin for the treatment of mild to moderate Alzheimer disease: preliminary results.
Arch Neurol. 2005;
62:753
-757

[273] steffens dc,
welsh-bohmer ka,
burke jr,
plassman bl,
beyer jl. Methodology and preliminary results from the neurocognitive outcomes of depression in the elderly study.
J Geriatr Psychiatry Neurol. 2004;
17:202
-211

[274] stern y,
alexander ge,
prohovnik i,
mayeux r. Inverse relationship between education and parietotemporal perfusion deficit in Alzheimer’s disease.
Ann Neurol. 1992;
32:371
-375

[275] stern y,
gurland b,
tatemichi tk,
tang mx,
wilder d,
mayeux r. Influence of education and occupation on the incidence of Alzheimer’s disease.
Jama. 1994;
271:1004
-1010

[276] stern y,
albert s,
tang mx,
tsai wy. Rate of memory decline in AD is related to education and occupation - Cognitive reserve?.
Neurology. 1999;
53:1942
-1947

[277] stewart wf,
kawas c,
corrada m,
metter ej. Risk of Alzheimer’s disease and duration of NSAID use.
Neurology. 1997;
48:626
-632

[278] stewart r,
masaki k,
xue ql,
peila r,
petrovitch h. A 32-year prospective study of change in body weight and incident dementia : the Honolulu-Asia Aging Study.
Arch Neurol. 2005;
62:55
-60

[279] stuss dt,
peterkin i,
guzman da,
guzman c,
troyer ak. Chronic obstructive pulmonary disease: effects of hypoxia on neurological and neuropsychological measures.
J Clin Exp Neuropsychol. 1997;
19:515
-524

[280] sulkava r,
wikstrom j,
aromaa a,
raitasalo r,
lehtinen v. Prevalence of severe dementia in Finland.
Neurology. 1985;
35:1025
-1029

[281] teri l,
gibbons le,
mccurry sm,
logsdon rg,
buchner dm. Exercise plus behavioral management in patients with Alzheimer disease: a randomized controlled trial.
Jama. 2003;
290:2015
-2022

[282] thal lj,
ferris sh,
kirby l,
block ga,
lines cr. A randomized, double-blind, study of rofecoxib in patients with mild cognitive impairment.
Neuropsychopharmacology. 2005;
30:1204
-1215

[283] tsolaki m,
fountoulakis k,
chantzi e,
kazis a. Risk factors for clinically diagnosed Alzheimer’s disease: a case-control study of a Greek population.
Int Psychogeriatr. 1997;
9:327
-341

[284] tucker kl,
qiao n,
scott t,
rosenberg i,
spiro a 3rd. High homocysteine and low B vitamins predict cognitive decline in aging men: the Veterans Affairs Normative Aging Study.
Am J Clin Nutr. 2005;
82:627
-635

[285] tzourio c,
dufouil c,
ducimetiere p,
alperovitch a. Cognitive decline in individuals with high blood pressure: a longitudinal study in the elderly. EVA Study Group.
Epidemiology of Vascular Aging Neurology. 1999;
53:1948
-1952

[286] tzourio c,
anderson c,
chapman n,
woodward m,
neal b. Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease.
Arch Intern Med. 2003;
163:1069
-1075

[287] van dongen m,
van rossum e,
kessels a,
sielhorst h,
knipschild p. Ginkgo for elderly people with dementia and age-associated memory impairment: a randomized clinical trial.
J Clin Epidemiol. 2003;
56:367
-376

[288] van duijn cm,
tanja ta,
haaxma r,
schulte w,
saan rj. Head trauma and the risk of Alzheimer’s disease.
Am J Epidemiol. 1992;
135:775
-782

[289] van duijn cm,
clayton dg,
chandra v,
fratiglioni l,
graves ab. Interaction between genetic and environmental risk factors for Alzheimer’s disease: a reanalysis of case-control studies. EURODEM Risk Factors Research Group.
Genet Epidemiol. 1994;
11:539
-551

[290] van gelder bm,
tijhuis ma,
kalmijn s,
giampaoli s. Physical activity in relation to cognitive decline in elderly men: the FINE Study.
Neurology. 2004;
63:2316
-2321

[291] vanhanen m,
koivisto k,
moilanen l,
helkala el,
hanninen t. Association of metabolic syndrome with Alzheimer disease: a population-based study.
Neurology. 2006;
67:843
-847

[292] vellas b,
andrieu s,
ousset pj,
ouzid m,
mathiex-fortunet h,
guidage study group . The guidage study: methodological issues. a 5-year double-blind randomized trial of the efficacy of egb 761 for prevention of alzheimer disease in patients over 70 with a memory complaint.
Neurology. 2006;
673:S6
-11

[293] verghese j,
lipton rb,
hall cb,
kuslansky g,
katz mj. Low blood pressure and the risk of dementia in very old individuals.
Neurology. 2003;
61:1667
-1672

[294] verghese j,
levalley a,
derby c,
kuslansky g,
katz m. Leisure activities and the risk of amnestic mild cognitive impairment in the elderly.
Neurology. 2006;
66:821
-827. Epub 2006 Feb 8

[295] wang hx,
wahlin a,
basun h,
fastbom j,
winblad b,
fratiglioni l. Vitamin B(12) and folate in relation to the development of Alzheimer’s disease.
Neurology. 2001;
56:1188
-1194

[296] wang l,
larson eb,
bowen jd,
van belle g. Performance-based physical function and future dementia in older people.
Arch Intern Med. 2006;
166:1115
-1120

[297] weuve j,
kang jh,
manson je,
breteler mm,
ware jh,
grodstein f. Physical activity, including walking, and cognitive function in older women.
Jama. 2004;
292:1454
-1461

[298] whalley lj,
dick fd,
mcneill g. A life-course approach to the aetiology of late-onset dementias.
Lancet Neurol. 2006;
5:87
-96

[299] whitmer ra,
gunderson ep,
barrett-connor e,
quesenberry cp jr,
yaffe k. Obesity in middle age and future risk of dementia: a 27 year longitudinal population based study.
BMJ. 2005;
330:1360

[300] williams db,
annegers jf,
kokmen e,
o’brien pc,
kurland lt. Brain injury and neurologic sequelae: a cohort study of dementia, parkinsonism, and amyotrophic lateral sclerosis.
Neurology. 1991;
41:1554
-1557

[301] wilson rs,
barnes ll,
mendes de leon cf,
aggarwal nt,
schneider js. Depressive symptoms, cognitive decline, and risk of AD in older persons.
Neurology. 2002;
59:364
-370

[302] wilson rs,
krueger kr,
kamenetsky jm,
tang y,
gilley dw. Hallucinations and mortality in Alzheimer disease.
Am J Geriatr Psychiatry. 2005;
13:984
-990

[303] woo ji,
lee jh,
yoo ky,
kim cy,
kim yi,
shin ys. Prevalence estimation of dementia in a rural area of Korea.
J Am Geriatr Soc. 1998;
46:983
-987

[304] wozniak ma,
shipley sj,
combrinck m,
wilcock gk,
itzhaki rf. Productive herpes simplex virus in brain of elderly normal subjects and Alzheimer’s disease patients.
J Med Virol. 2005;
75:300
-306

[305] xu wl,
qiu cx,
wahlin a,
winblad b,
fratiglioni l. Diabetes mellitus and risk of dementia in the Kungsholmen project: a 6-year follow-up study.
Neurology. 2004;
63:1181
-1186

[306] yaffe k,
barnes d,
nevitt m,
lui ly,
covinsky k. A prospective study of physical activity and cognitive decline in elderly women: women who walk.
Arch Intern Med. 2001;
161:1703
-1708

[307] yaffe k,
clemons te,
mcbee wl,
lindblad as. Impact of antioxidants, zinc, and copper on cognition in the elderly: a randomized, controlled trial.
Neurology. 2004;
63:1705
-1707

[308] yamada m,
sasaki h,
mimori y,
kasagi f,
sudoh s. Prevalence and risks of dementia in the Japanese population: RERF’s adult health study Hiroshima subjects. Radiation Effects Research Foundation.
J Am Geriatr Soc. 1999;
47:189
-195

[309] yehuda s,
rabinovitz s,
mostofsky di. Essential fatty acids are mediators of brain biochemistry and cognitive functions.
Journal of Neuroscience Research. 1999;
56:565
-570

[310] yoshitake t,
kiyohara y,
kato i,
ohmura t,
iwamoto h. Incidence and risk factors of vascular dementia and Alzheimer’s disease in a defined elderly Japanese population: the Hisayama Study.
Neurology. 1995;
45:1161
-1168

[311] zandi pp,
anthony jc,
hayden km,
mehta k,
mayer l,
breitner jc. Reduced incidence of AD with NSAID but not H2 receptor antagonists: the Cache County Study.
Neurology. 2002;
59:880
-886

[312] zandi pp,
sparks dl,
khachaturian as,
tschanz j,
norton m. Do statins reduce risk of incident dementia and Alzheimer disease? The Cache County Study.
Arch Gen Psychiatry. 2005;
62:217
-224

[313] zhou df,
wu cs,
qi h,
fan jh,
sun xd. Prevalence of dementia in rural China: impact of age, gender and education.
Acta Neurol Scand. 2006;
114:273
-280

[314] zubenko gs,
zubenko wn,
mcpherson s,
spoor e,
marin db. A collaborative study of the emergence and clinical features of the major depressive syndrome of Alzheimer’s disease.
Am J Psychiatry. 2003;
160:857
-866

[315] zuccala g,
cattel c,
manes-gravina e,
di niro mg,
cocchi a,
bernabei r. Left ventricular dysfunction: a clue to cognitive impairment in older patients with heart failure.
J Neurol Neurosurg Psychiatry. 1997;
63:509
-512

→ Aller vers SYNTHESE
 ) sont en discordance avec ceux d'un grand essai randomisé, la WHIMS (Women's Health Initiative Memory Study) (Shumaker et coll., 2003
) sont en discordance avec ceux d'un grand essai randomisé, la WHIMS (Women's Health Initiative Memory Study) (Shumaker et coll., 2003 et 2004
et 2004 ) qui montre une augmentation du risque de démence avec un type de traitement initié chez des femmes âgées de plus de 65 ans.
) qui montre une augmentation du risque de démence avec un type de traitement initié chez des femmes âgées de plus de 65 ans. ) (figure 16.1
) (figure 16.1 ). Les facteurs pouvant conduire à des maladies chroniques à des âges avancés peuvent avoir leur origine à des périodes précoces de la vie et se cumuler tout au long de celle-ci (Whalley et coll., 2006
). Les facteurs pouvant conduire à des maladies chroniques à des âges avancés peuvent avoir leur origine à des périodes précoces de la vie et se cumuler tout au long de celle-ci (Whalley et coll., 2006 ). Ces facteurs peuvent aussi avoir des effets différents selon les périodes de la vie comme le suggèrent certains résultats sur l'hypertension artérielle.
). Ces facteurs peuvent aussi avoir des effets différents selon les périodes de la vie comme le suggèrent certains résultats sur l'hypertension artérielle.
 )
) ; Rocca et coll., 1991
; Rocca et coll., 1991 ; Bachman et coll., 1992
; Bachman et coll., 1992 ; Corso et coll., 1992
; Corso et coll., 1992 ; Kiyohara et coll., 1994
; Kiyohara et coll., 1994 ; Manubens et coll., 1995
; Manubens et coll., 1995 ; Graves et coll., 1996
; Graves et coll., 1996 ; Woo et coll., 1998
; Woo et coll., 1998 ; Bowirrat et coll., 2002
; Bowirrat et coll., 2002 ; Zhou et coll., 2006
; Zhou et coll., 2006 ), alors que les études rapportant une prévalence identique dans les deux sexes sont plus rares (Pfeffer et coll., 1987
), alors que les études rapportant une prévalence identique dans les deux sexes sont plus rares (Pfeffer et coll., 1987 ; Skoog et coll., 1993
; Skoog et coll., 1993 ; Liu et coll., 1995
; Liu et coll., 1995 ; Prencipe et coll., 1996
; Prencipe et coll., 1996 ; Yamada et coll., 1999
; Yamada et coll., 1999 ; Hebert et coll., 2001
; Hebert et coll., 2001 ).
). ). Une plus grande fréquence de facteurs de risque de la maladie chez les femmes, comme, par exemple, des facteurs hormonaux, des facteurs génétiques ou socioculturels comme un bas niveau d'éducation a également été évoquée. Cependant, une analyse des données longitudinales de la cohorte Paquid, ayant pris en compte de façon simultanée le sexe et le niveau d'éducation retrouve une incidence de la maladie plus élevée chez les femmes qui n'est pas expliquée par la différence du niveau d'éducation entre les hommes et les femmes (Letenneur et coll., 1999
). Une plus grande fréquence de facteurs de risque de la maladie chez les femmes, comme, par exemple, des facteurs hormonaux, des facteurs génétiques ou socioculturels comme un bas niveau d'éducation a également été évoquée. Cependant, une analyse des données longitudinales de la cohorte Paquid, ayant pris en compte de façon simultanée le sexe et le niveau d'éducation retrouve une incidence de la maladie plus élevée chez les femmes qui n'est pas expliquée par la différence du niveau d'éducation entre les hommes et les femmes (Letenneur et coll., 1999 ).
). ; Launer et coll., 1999
; Launer et coll., 1999 ) ont montré une incidence plus élevée chez les femmes.
) ont montré une incidence plus élevée chez les femmes.  ; Jorm et Jolley, 1998
; Jorm et Jolley, 1998 ). Ainsi dans l'étude Paquid, l'incidence de la démence comme de la maladie d'Alzheimer est plus élevée chez les hommes avant 80 ans et plus élevée chez les femmes à partir de 80 ans (tableau 16.I
). Ainsi dans l'étude Paquid, l'incidence de la démence comme de la maladie d'Alzheimer est plus élevée chez les hommes avant 80 ans et plus élevée chez les femmes à partir de 80 ans (tableau 16.I ). Les hypothèses explicatives sont multiples même si un biais de survie sélective ne peut être écarté.
). Les hypothèses explicatives sont multiples même si un biais de survie sélective ne peut être écarté.  )
)
 ; Fratiglioni et coll., 1991
; Fratiglioni et coll., 1991 ; Korczyn, 1991 ; Hill et coll., 1993
; Korczyn, 1991 ; Hill et coll., 1993 ; Stern et coll., 1994
; Stern et coll., 1994 ) même si certaines études n'ont pas observé ce lien (O'Connor et coll., 1991
) même si certaines études n'ont pas observé ce lien (O'Connor et coll., 1991 ; Beard et coll., 1992
; Beard et coll., 1992 ; Cobb et coll., 1995
; Cobb et coll., 1995 ). Dans certains cas, on trouve une relation dose-effet, avec un risque de maladie d'Alzheimer d'autant plus élevé que le niveau d'éducation est bas (Ott et coll., 1995
). Dans certains cas, on trouve une relation dose-effet, avec un risque de maladie d'Alzheimer d'autant plus élevé que le niveau d'éducation est bas (Ott et coll., 1995 ). Dans d'autres cas, comme le montrent les données françaises de l'étude Paquid, on trouve un risque accru pour les sujets n'ayant pas obtenu le certificat d'étude (Letenneur et coll., 2000
). Dans d'autres cas, comme le montrent les données françaises de l'étude Paquid, on trouve un risque accru pour les sujets n'ayant pas obtenu le certificat d'étude (Letenneur et coll., 2000 ). Ces résultats sont en accord avec l'hypothèse selon laquelle les sujets ayant un haut niveau d'étude ont une plus grande capacité de réserve cérébrale qui leur permettrait d'exprimer leur maladie différemment (Letenneur et coll., 1999
). Ces résultats sont en accord avec l'hypothèse selon laquelle les sujets ayant un haut niveau d'étude ont une plus grande capacité de réserve cérébrale qui leur permettrait d'exprimer leur maladie différemment (Letenneur et coll., 1999 ). Ainsi, cette différence observée serait le témoin d'un biais de diagnostic, les patients avec un bas niveau d'étude étant ceux qui ont de moins bons résultats aux tests neuropsychologiques et qui sont plus facilement repérés et diagnostiqués dans les études. Les sujets ayant un haut niveau d'éducation semblent avoir de meilleures performances à certains tests, notamment ceux explorant les capacités exécutives (Le Carret et coll., 2003
). Ainsi, cette différence observée serait le témoin d'un biais de diagnostic, les patients avec un bas niveau d'étude étant ceux qui ont de moins bons résultats aux tests neuropsychologiques et qui sont plus facilement repérés et diagnostiqués dans les études. Les sujets ayant un haut niveau d'éducation semblent avoir de meilleures performances à certains tests, notamment ceux explorant les capacités exécutives (Le Carret et coll., 2003 ), et leurs capacités de réserve leur permettent d'utiliser par exemple plus de stratégies dans les fonctions de reconnaissance (Stern et coll., 1992
), et leurs capacités de réserve leur permettent d'utiliser par exemple plus de stratégies dans les fonctions de reconnaissance (Stern et coll., 1992 ; Mortimer et Graves, 1993
; Mortimer et Graves, 1993 ; Satz et coll., 1993
; Satz et coll., 1993 ; Letenneur et coll., 2000
; Letenneur et coll., 2000 ). D'autres facteurs de risque évoqués dans la maladie d'Alzheimer seraient associés à cette capacité de réserve, comme un petit périmètre crânien, de moins bonnes performances intellectuelles, associées à une moindre activité intellectuelle au cours de la vie. En revanche, après le diagnostic de maladie d'Alzheimer, un niveau d'éducation élevé pourrait être associé à une vitesse de déclin des fonctions cognitives plus rapide (Scarmeas et coll., 2006
). D'autres facteurs de risque évoqués dans la maladie d'Alzheimer seraient associés à cette capacité de réserve, comme un petit périmètre crânien, de moins bonnes performances intellectuelles, associées à une moindre activité intellectuelle au cours de la vie. En revanche, après le diagnostic de maladie d'Alzheimer, un niveau d'éducation élevé pourrait être associé à une vitesse de déclin des fonctions cognitives plus rapide (Scarmeas et coll., 2006 ).
). ; Ravaglia et coll., 2002
; Ravaglia et coll., 2002 ; Richards et coll., 2004
; Richards et coll., 2004 ) ou du niveau de revenus (Evans et coll., 1997
) ou du niveau de revenus (Evans et coll., 1997 ; Karp et coll., 2004
; Karp et coll., 2004 ), même si quelques rares travaux ont évoqué l'association de certaines professions (manuelles, agricoles...) avec la survenue d'une maladie d'Alzheimer (Helmer et coll., 2001
), même si quelques rares travaux ont évoqué l'association de certaines professions (manuelles, agricoles...) avec la survenue d'une maladie d'Alzheimer (Helmer et coll., 2001 ; Qiu et coll., 2003a
; Qiu et coll., 2003a ).
). ). Une autre étude portant sur 143 paires de jumeaux ne montre pas d'association entre le niveau d'éducation et le risque de développer une démence ou une maladie d'Alzheimer. Ainsi, quand les facteurs génétiques et familiaux sont contrôlés, le risque n'est plus significatif (Gatz et coll., 2001
). Une autre étude portant sur 143 paires de jumeaux ne montre pas d'association entre le niveau d'éducation et le risque de développer une démence ou une maladie d'Alzheimer. Ainsi, quand les facteurs génétiques et familiaux sont contrôlés, le risque n'est plus significatif (Gatz et coll., 2001 ).
).  ).
). ; Evans et coll., 1997
; Evans et coll., 1997 ; Letenneur et coll., 1999
; Letenneur et coll., 1999 ) mais ces travaux se limitaient à l'évaluation du niveau socioéconomique au moment de l'apparition de la maladie. Des travaux plus récents viennent de montrer que le niveau socioéconomique en début de vie influence le niveau des fonctions cognitives à un âge avancé mais pas le risque de maladie d'Alzheimer ni le déclin des fonctions cognitives (Wilson et coll., 2005
) mais ces travaux se limitaient à l'évaluation du niveau socioéconomique au moment de l'apparition de la maladie. Des travaux plus récents viennent de montrer que le niveau socioéconomique en début de vie influence le niveau des fonctions cognitives à un âge avancé mais pas le risque de maladie d'Alzheimer ni le déclin des fonctions cognitives (Wilson et coll., 2005 ).
).  ; Barnes et coll., 2004
; Barnes et coll., 2004 ; Holtzman et coll., 2004
; Holtzman et coll., 2004 ). Une revue de 15 études longitudinales en Europe et aux États-Unis trouve un effet globalement favorable de la richesse des contacts sociaux et des activités, qu'elles soient intellectuelles ou non, sur le déclin des fonctions cognitives ou la survenue d'une démence, parfois d'une maladie d'Alzheimer (Fratiglioni et coll., 2004
). Une revue de 15 études longitudinales en Europe et aux États-Unis trouve un effet globalement favorable de la richesse des contacts sociaux et des activités, qu'elles soient intellectuelles ou non, sur le déclin des fonctions cognitives ou la survenue d'une démence, parfois d'une maladie d'Alzheimer (Fratiglioni et coll., 2004 ). Dans une population âgée, l'effet protecteur sur l'incidence du MCI n'était observé que pour des activités intellectuelles et cet effet était robuste et persistait même après exclusion des sujets développant une démence dans les deux premières années de suivi (Verghese et coll., 2006
). Dans une population âgée, l'effet protecteur sur l'incidence du MCI n'était observé que pour des activités intellectuelles et cet effet était robuste et persistait même après exclusion des sujets développant une démence dans les deux premières années de suivi (Verghese et coll., 2006 ).
).  ; Fratiglioni et coll., 2000
; Fratiglioni et coll., 2000 ).
). ). En revanche, des activités moins stimulantes comme la télévision seraient associées à un risque accru d'altération cognitive (Wang et coll., 2006
). En revanche, des activités moins stimulantes comme la télévision seraient associées à un risque accru d'altération cognitive (Wang et coll., 2006 ).
).  ).
).  ).
). ; Lytle et coll., 2004
; Lytle et coll., 2004 ; Van Gelder et coll., 2004
; Van Gelder et coll., 2004 ; Weuve et coll., 2004
; Weuve et coll., 2004 ) ou d'une démence, en particulier de type Alzheimer (Verghese et coll., 2003
) ou d'une démence, en particulier de type Alzheimer (Verghese et coll., 2003 ; Abbott et coll., 2004
; Abbott et coll., 2004 ; Podewils et coll., 2005
; Podewils et coll., 2005 ; Larson et coll., 2006
; Larson et coll., 2006 ) (tableaux 16.II
) (tableaux 16.II et 16.III
et 16.III ). Ces études sont nombreuses et présentent des qualités méthodologiques certaines (puissance de l'étude, durée de suivi souvent longue, caractère longitudinal de l'analyse).
). Ces études sont nombreuses et présentent des qualités méthodologiques certaines (puissance de l'étude, durée de suivi souvent longue, caractère longitudinal de l'analyse).  ) et peu d'entre elles ont choisi un critère de jugement cognitif pour étudier l'efficacité d'une activité physique standardisée, et même s'il existe une méta-analyse en faveur de l'activité physique (Heyn et coll., 2004
) et peu d'entre elles ont choisi un critère de jugement cognitif pour étudier l'efficacité d'une activité physique standardisée, et même s'il existe une méta-analyse en faveur de l'activité physique (Heyn et coll., 2004 ), il est nécessaire de mettre en place de grandes études interventionnelles pour démontrer réellement cet effet.
), il est nécessaire de mettre en place de grandes études interventionnelles pour démontrer réellement cet effet. ; Lee, 1994
; Lee, 1994 ; Van Duijn et coll., 1994
; Van Duijn et coll., 1994 ) sont certainement liés au biais de survie sélective (Riggs et coll., 1993
) sont certainement liés au biais de survie sélective (Riggs et coll., 1993 ; Doll et coll., 1994) car ils n'ont pas été confirmés par la suite. En effet, l'analyse de données longitudinales montre plutôt un risque accru chez les fumeurs de développer une démence ou une maladie d'Alzheimer (Hebert et coll., 1992
; Doll et coll., 1994) car ils n'ont pas été confirmés par la suite. En effet, l'analyse de données longitudinales montre plutôt un risque accru chez les fumeurs de développer une démence ou une maladie d'Alzheimer (Hebert et coll., 1992 ; Brenner et coll., 1993
; Brenner et coll., 1993 ; Prince et coll., 1994
; Prince et coll., 1994 ; Yoshitake et coll., 1995
; Yoshitake et coll., 1995 ; Launer et coll., 1999
; Launer et coll., 1999 ; Merchant et coll., 1999
; Merchant et coll., 1999 ; Cervilla et coll., 2000
; Cervilla et coll., 2000 ). Un auteur a même trouvé une relation dose-effet entre l'exposition tabagique et le risque de maladie d'Alzheimer (Juan et coll., 2004
). Un auteur a même trouvé une relation dose-effet entre l'exposition tabagique et le risque de maladie d'Alzheimer (Juan et coll., 2004 ), alors que d'autres ne trouvaient cette association que chez les sujets non porteurs de l'allèle ApoE4 (Ott et coll., 1998
), alors que d'autres ne trouvaient cette association que chez les sujets non porteurs de l'allèle ApoE4 (Ott et coll., 1998 ). Les études portant sur le déclin des fonctions cognitives chez les sujets normaux sont plus rares (Evans et coll., 1993
). Les études portant sur le déclin des fonctions cognitives chez les sujets normaux sont plus rares (Evans et coll., 1993 ; Launer et coll., 1996
; Launer et coll., 1996 ; Galanis et coll., 1997
; Galanis et coll., 1997 ) et reposent sur des échantillons de petite taille. Une seule étude de grande envergure ayant suivi 9 209 sujets pendant 2,3 ans rapporte que l'exposition tabagique cumulée, mesurée par le nombre de paquets-années, accélère le déclin cognitif chez les non déments avec une relation dose-effet (Ott et coll., 2004
) et reposent sur des échantillons de petite taille. Une seule étude de grande envergure ayant suivi 9 209 sujets pendant 2,3 ans rapporte que l'exposition tabagique cumulée, mesurée par le nombre de paquets-années, accélère le déclin cognitif chez les non déments avec une relation dose-effet (Ott et coll., 2004 ).
). ) que se sont développés de multiples travaux qui, globalement, montrent un effet plutôt protecteur d'une consommation modérée d'alcool, et pas spécifiquement de vin, dans le risque de maladie d'Alzheimer (Letenneur et coll., 2004
) que se sont développés de multiples travaux qui, globalement, montrent un effet plutôt protecteur d'une consommation modérée d'alcool, et pas spécifiquement de vin, dans le risque de maladie d'Alzheimer (Letenneur et coll., 2004 ). Parmi les explications avancées, cette consommation modérée serait associée à un mode de vie protecteur des consommateurs modérés, à une diminution du risque cardiovasculaire, à une action directe de l'alcool sur le métabolisme de l'acétylcholine ou, plus spécifiquement pour le vin, à un rôle protecteur des composés flavonoïdes (Savaskan et coll., 2003
). Parmi les explications avancées, cette consommation modérée serait associée à un mode de vie protecteur des consommateurs modérés, à une diminution du risque cardiovasculaire, à une action directe de l'alcool sur le métabolisme de l'acétylcholine ou, plus spécifiquement pour le vin, à un rôle protecteur des composés flavonoïdes (Savaskan et coll., 2003 ).
). ) et prise en compte tout au long de la vie. Les études qui disposent de ce type de données correspondent à la poursuite de suivi des grandes cohortes mises en place dans les années 1970-1980 pour étudier l'épidémiologie des maladies cardiovasculaires comme l'étude de Framingham.
) et prise en compte tout au long de la vie. Les études qui disposent de ce type de données correspondent à la poursuite de suivi des grandes cohortes mises en place dans les années 1970-1980 pour étudier l'épidémiologie des maladies cardiovasculaires comme l'étude de Framingham. ). Cette étude montre qu'une augmentation de la pression artérielle systolique (PAS≥160 mmHg) en milieu de vie est associée à un plus faible poids cérébral et à davantage de plaques séniles dans le néocortex et l'hippocampe. Une augmentation de la pression artérielle diastolique (PAD≥95 mmHg) est associée à un plus grand nombre de DNF dans l'hippocampe. Ces résultats sont en accord avec une bonne part de la littérature qui montre une association entre pression artérielle élevée et démence incidente ou déclin des fonctions cognitives (Tzourio et coll., 1999
). Cette étude montre qu'une augmentation de la pression artérielle systolique (PAS≥160 mmHg) en milieu de vie est associée à un plus faible poids cérébral et à davantage de plaques séniles dans le néocortex et l'hippocampe. Une augmentation de la pression artérielle diastolique (PAD≥95 mmHg) est associée à un plus grand nombre de DNF dans l'hippocampe. Ces résultats sont en accord avec une bonne part de la littérature qui montre une association entre pression artérielle élevée et démence incidente ou déclin des fonctions cognitives (Tzourio et coll., 1999 ). La revue de Qiu et coll. (2005
). La revue de Qiu et coll. (2005 ) analyse la littérature en fonction de l'âge auquel la pression artérielle est mesurée et de l'intervalle entre cette mesure et l'évaluation du statut cognitif. Cette revue, très complète sur pression artérielle et traitements anti-hypertenseurs, s'appuie sur les données d'études longitudinales en population et montre que selon la période de la vie considérée, les effets ne sont pas les mêmes. Pratiquement toutes les études rapportent une association entre une pression artérielle élevée mesurée 20 à 30 ans avant l'évaluation cognitive et soit un déclin des fonctions cognitives (7/7 études), soit la survenue d'une démence (4/5 études). Le risque est plus élevé en absence de traitement de l'hypertension. Pour les études où la pression artérielle est estimée en période plus tardive de la vie, les résultats sont contradictoires si l'on s'intéresse au déclin des fonctions cognitives, avec soit une augmentation du risque, soit une courbe en U, soit l'absence d'association. La majorité des études sur les démences ne trouve pas d'association, et un bas niveau de pression artérielle serait même prédicteur de démence après 80 ans (Verghese et coll., 2003
) analyse la littérature en fonction de l'âge auquel la pression artérielle est mesurée et de l'intervalle entre cette mesure et l'évaluation du statut cognitif. Cette revue, très complète sur pression artérielle et traitements anti-hypertenseurs, s'appuie sur les données d'études longitudinales en population et montre que selon la période de la vie considérée, les effets ne sont pas les mêmes. Pratiquement toutes les études rapportent une association entre une pression artérielle élevée mesurée 20 à 30 ans avant l'évaluation cognitive et soit un déclin des fonctions cognitives (7/7 études), soit la survenue d'une démence (4/5 études). Le risque est plus élevé en absence de traitement de l'hypertension. Pour les études où la pression artérielle est estimée en période plus tardive de la vie, les résultats sont contradictoires si l'on s'intéresse au déclin des fonctions cognitives, avec soit une augmentation du risque, soit une courbe en U, soit l'absence d'association. La majorité des études sur les démences ne trouve pas d'association, et un bas niveau de pression artérielle serait même prédicteur de démence après 80 ans (Verghese et coll., 2003 ). Une étude chez des sujets de plus de 75 ans a porté sur la pression pulsée (PP=différentiel entre PAS et PAD) (Qiu et coll., 2003b
). Une étude chez des sujets de plus de 75 ans a porté sur la pression pulsée (PP=différentiel entre PAS et PAD) (Qiu et coll., 2003b ) et montre une augmentation du risque de démence et de maladie d'Alzheimer dans le tertile supérieur de la population, mais aussi chez les sujets ayant les valeurs les plus basses par rapport au tertile médian. Des mécanismes différents pourraient expliquer cette courbe en U : rigidification artérielle et athérosclérose pour les PP élevées, diminution de la perfusion cérébrale pour les PP basses. Dans la même cohorte (Qiu et coll., 2004
) et montre une augmentation du risque de démence et de maladie d'Alzheimer dans le tertile supérieur de la population, mais aussi chez les sujets ayant les valeurs les plus basses par rapport au tertile médian. Des mécanismes différents pourraient expliquer cette courbe en U : rigidification artérielle et athérosclérose pour les PP élevées, diminution de la perfusion cérébrale pour les PP basses. Dans la même cohorte (Qiu et coll., 2004 ), est décrite une diminution de la pression artérielle dans les 3 ans précédant le diagnostic de démence.
), est décrite une diminution de la pression artérielle dans les 3 ans précédant le diagnostic de démence.  ), avait montré une diminution de l'incidence des démences chez des sujets âgés avec HTA systolique isolée. Chez des sujets âgés de l'étude Progress (Tzourio et coll., 2003
), avait montré une diminution de l'incidence des démences chez des sujets âgés avec HTA systolique isolée. Chez des sujets âgés de l'étude Progress (Tzourio et coll., 2003 ) avec des antécédents d'AVC ou d'accident ischémique transitoire, une réduction significative du risque de déclin cognitif – mais pas de démence – est rapportée chez les sujets traités (perindopril ou indapamide). Dans l'étude Scope (Lithell et coll., 2003
) avec des antécédents d'AVC ou d'accident ischémique transitoire, une réduction significative du risque de déclin cognitif – mais pas de démence – est rapportée chez les sujets traités (perindopril ou indapamide). Dans l'étude Scope (Lithell et coll., 2003 ) qui propose un traitement par candesartan chez des sujets âgés avec une HTA modérée, on n'observe pas d'effet significatif sur le score MMSE ou son évolution.
) qui propose un traitement par candesartan chez des sujets âgés avec une HTA modérée, on n'observe pas d'effet significatif sur le score MMSE ou son évolution. ).
). et b
et b ; Sasaki et coll., 1998
; Sasaki et coll., 1998 ). Le rôle de l'enzyme de dégradation de l'insuline au niveau cérébral dans la régulation du métabolisme de la protéine bêta-amyloïde est possible et des travaux montrent une interaction avec l'ApoE4 (Selkoe et coll., 2000
). Le rôle de l'enzyme de dégradation de l'insuline au niveau cérébral dans la régulation du métabolisme de la protéine bêta-amyloïde est possible et des travaux montrent une interaction avec l'ApoE4 (Selkoe et coll., 2000 ; Bian et coll., 2004
; Bian et coll., 2004 ).
).  ). L'auteur retrouve une association positive pour le risque de développer une pathologie démentielle (7/10 études), une maladie d'Alzheimer (8/13 études) et une démence vasculaire (6/9 études). Certains de ces travaux sont présentés dans le tableau 16.IV
). L'auteur retrouve une association positive pour le risque de développer une pathologie démentielle (7/10 études), une maladie d'Alzheimer (8/13 études) et une démence vasculaire (6/9 études). Certains de ces travaux sont présentés dans le tableau 16.IV .
.  .
.  ). Des travaux récents rapportent un risque majoré de maladie d'Alzheimer chez les sujets âgés de 69 à 78 ans présentant un syndrome métabolique, qui reste significatif même après exclusion des sujets diabétiques (Vanhanen et coll., 2006
). Des travaux récents rapportent un risque majoré de maladie d'Alzheimer chez les sujets âgés de 69 à 78 ans présentant un syndrome métabolique, qui reste significatif même après exclusion des sujets diabétiques (Vanhanen et coll., 2006 ).
).  ).
). ). Les études sur les niveaux de cholestérol, le déclin des fonctions cognitives et les démences sont très contradictoires (Shobab et coll., 2005
). Les études sur les niveaux de cholestérol, le déclin des fonctions cognitives et les démences sont très contradictoires (Shobab et coll., 2005 ). De nombreux facteurs expliquent cette hétérogénéité : la période de la vie, le nombre de dosages, la nutrition, les traitements et la susceptibilité génétique (ApoE, récepteurs VLDL1
, LRP2
). Comme pour l'HTA, ce serait plutôt les niveaux élevés de cholestérol en milieu de vie qui seraient le plus associés à une augmentation du risque de maladie d'Alzheimer.
). De nombreux facteurs expliquent cette hétérogénéité : la période de la vie, le nombre de dosages, la nutrition, les traitements et la susceptibilité génétique (ApoE, récepteurs VLDL1
, LRP2
). Comme pour l'HTA, ce serait plutôt les niveaux élevés de cholestérol en milieu de vie qui seraient le plus associés à une augmentation du risque de maladie d'Alzheimer. ; Rea et coll., 2005
; Rea et coll., 2005 ; Zandi et coll., 2005
; Zandi et coll., 2005 ). Les résultats de 3 études randomisées avec différentes statines contre placebo (HPS Collaborative Group, 2002
). Les résultats de 3 études randomisées avec différentes statines contre placebo (HPS Collaborative Group, 2002 ; Shepherd et coll., 2002
; Shepherd et coll., 2002 ; Sparks et coll., 2005
; Sparks et coll., 2005 ) sont négatifs. Mais l'évaluation cognitive n'était pas l'objectif principal de ces trois essais qui n'avaient pas une puissance statistique suffisante pour montrer un effet modéré. De nouvelles études d'intervention sont nécessaires.
) sont négatifs. Mais l'évaluation cognitive n'était pas l'objectif principal de ces trois essais qui n'avaient pas une puissance statistique suffisante pour montrer un effet modéré. De nouvelles études d'intervention sont nécessaires.  ), les risques de démence associés à l'ApoE4, au cholestérol total (>6,5 mmol/l), à la PAS (>160 mmHg), à la PAD (>95 mmHg) ou aux antécédents d'infarctus du myocarde apparaissent indépendants et sont du même ordre de grandeur avec des odds ratio entre 2 et 2,8. Seules deux publications portent sur la construction de scores de facteurs de risque. La même équipe finlandaise (Kivipelto et coll., 2006
), les risques de démence associés à l'ApoE4, au cholestérol total (>6,5 mmol/l), à la PAS (>160 mmHg), à la PAD (>95 mmHg) ou aux antécédents d'infarctus du myocarde apparaissent indépendants et sont du même ordre de grandeur avec des odds ratio entre 2 et 2,8. Seules deux publications portent sur la construction de scores de facteurs de risque. La même équipe finlandaise (Kivipelto et coll., 2006 ) vient de proposer un score de prédiction à 20 ans à partir d'un ensemble de facteurs recueillis en milieu de vie. Le score comprend l'âge, le niveau d'éducation, l'hypertension, l'hypercholestérolémie et l'obésité mais n'a pas retenu l'activité physique ni l'ApoE4. Les qualités prédictives de ce score sont correctes, avec une sensibilité de 77 % et une spécificité de 63 %. La construction de ce type de score est complexe (Mitnitski et coll., 2006
) vient de proposer un score de prédiction à 20 ans à partir d'un ensemble de facteurs recueillis en milieu de vie. Le score comprend l'âge, le niveau d'éducation, l'hypertension, l'hypercholestérolémie et l'obésité mais n'a pas retenu l'activité physique ni l'ApoE4. Les qualités prédictives de ce score sont correctes, avec une sensibilité de 77 % et une spécificité de 63 %. La construction de ce type de score est complexe (Mitnitski et coll., 2006 ) car il est difficile d'intégrer l'évolution de ces différents facteurs avec l'âge sachant que leur évolution joue aussi certainement un rôle dans le risque. De plus, la liste des facteurs à inclure est certainement très longue.
) car il est difficile d'intégrer l'évolution de ces différents facteurs avec l'âge sachant que leur évolution joue aussi certainement un rôle dans le risque. De plus, la liste des facteurs à inclure est certainement très longue. ; Del Parigi et coll., 2006
; Del Parigi et coll., 2006 ; Gillette Guyonnet et coll., 2007
; Gillette Guyonnet et coll., 2007 ), trois approches sont possibles selon que l'on s'intéressera aux :
), trois approches sont possibles selon que l'on s'intéressera aux : ). Barrett-Connor et ses collaborateurs (1996
). Barrett-Connor et ses collaborateurs (1996 ) ont été les premiers à évoquer que la perte de poids pouvait précéder le diagnostic de la maladie. En effet, ces auteurs ont suivi durant 20 ans 134 hommes et 165 femmes âgés vivant au domicile. Ils ont évalué leur poids à l'inclusion en 1972-1974, en 1984-1987 et en 1990-1993. Près de 50 % des sujets qui avaient développé une maladie d'Alzheimer avaient perdu en moyenne 5 kg depuis la visite initiale alors que seulement 25 % des sujets sans altération cognitive avaient perdu du poids.
) ont été les premiers à évoquer que la perte de poids pouvait précéder le diagnostic de la maladie. En effet, ces auteurs ont suivi durant 20 ans 134 hommes et 165 femmes âgés vivant au domicile. Ils ont évalué leur poids à l'inclusion en 1972-1974, en 1984-1987 et en 1990-1993. Près de 50 % des sujets qui avaient développé une maladie d'Alzheimer avaient perdu en moyenne 5 kg depuis la visite initiale alors que seulement 25 % des sujets sans altération cognitive avaient perdu du poids.  ; Nourhashémi et coll., 2003
; Nourhashémi et coll., 2003 ; Buchman et coll., 2005
; Buchman et coll., 2005 ; Kivipelto et coll., 2005
; Kivipelto et coll., 2005 ; Stewart et coll., 2005
; Stewart et coll., 2005 ; Whitmer et coll., 2005
; Whitmer et coll., 2005 ). Pour la majorité de ces auteurs, la perte de poids peut représenter un signe précoce de la maladie et peut survenir bien avant le diagnostic (Barrett-Connor et coll., 1996
). Pour la majorité de ces auteurs, la perte de poids peut représenter un signe précoce de la maladie et peut survenir bien avant le diagnostic (Barrett-Connor et coll., 1996 ; Nourhashémi et coll., 2003
; Nourhashémi et coll., 2003 ; Stewart et coll., 2005
; Stewart et coll., 2005 ) ; d'autres considèrent qu'un IMC bas est un facteur de risque de maladie d'Alzheimer (Buchman et coll., 2005
) ; d'autres considèrent qu'un IMC bas est un facteur de risque de maladie d'Alzheimer (Buchman et coll., 2005 ). Des travaux plus récents soulignent au contraire la relation positive entre l'obésité et le risque de survenue d'une démence ; ces données suggèrent l'implication des facteurs vasculaires dans l'apparition de la démence et de la maladie d'Alzheimer en particulier (Gustafson et coll., 2003
). Des travaux plus récents soulignent au contraire la relation positive entre l'obésité et le risque de survenue d'une démence ; ces données suggèrent l'implication des facteurs vasculaires dans l'apparition de la démence et de la maladie d'Alzheimer en particulier (Gustafson et coll., 2003 ; Kivipelto et coll., 2005
; Kivipelto et coll., 2005 ; Whitmer et coll., 2005
; Whitmer et coll., 2005 ; Gustafson 2006 ; Hayden et coll., 2006
; Gustafson 2006 ; Hayden et coll., 2006 ). À ce propos, une étude longitudinale réalisée chez 290 femmes vivant en Suède montre une association entre un IMC élevé et l'atrophie temporale mesurée au scanner (Gustafson et coll., 2004
). À ce propos, une étude longitudinale réalisée chez 290 femmes vivant en Suède montre une association entre un IMC élevé et l'atrophie temporale mesurée au scanner (Gustafson et coll., 2004 ).
). ).
). résume ces discordances. Des études chez l'animal suggèrent que le déficit en folates peut être à l'origine d'une amyloïdogénèse (Kruman et coll., 2002
résume ces discordances. Des études chez l'animal suggèrent que le déficit en folates peut être à l'origine d'une amyloïdogénèse (Kruman et coll., 2002 ). Par ailleurs, la consommation de folates et d'autres vitamines du groupe B sont des déterminants du taux d'homocystéine. L'homocystéine est un acide aminé soufré impliqué dans le métabolisme de la méthionine et de la cystéine. Il existe une relation inverse entre les taux d'homocystéine et les apports alimentaires ainsi que les taux plasmatiques des vitamines B6, B12 et des folates. L'hyperhomocystéinémie est un facteur de risque vasculaire aussi bien au niveau des artères coronaires et des artères cérébrales que des vaisseaux périphériques. Ces résultats posent la question d'une prévention du déclin cognitif par une diminution de l'homocystéinémie. À ce jour, deux études randomisées contrôlées ont été publiées. Il s'agit dans les 2 cas, d'études menées aux Pays-Bas. Durga et ses collaborateurs (2006
). Par ailleurs, la consommation de folates et d'autres vitamines du groupe B sont des déterminants du taux d'homocystéine. L'homocystéine est un acide aminé soufré impliqué dans le métabolisme de la méthionine et de la cystéine. Il existe une relation inverse entre les taux d'homocystéine et les apports alimentaires ainsi que les taux plasmatiques des vitamines B6, B12 et des folates. L'hyperhomocystéinémie est un facteur de risque vasculaire aussi bien au niveau des artères coronaires et des artères cérébrales que des vaisseaux périphériques. Ces résultats posent la question d'une prévention du déclin cognitif par une diminution de l'homocystéinémie. À ce jour, deux études randomisées contrôlées ont été publiées. Il s'agit dans les 2 cas, d'études menées aux Pays-Bas. Durga et ses collaborateurs (2006 ) rapportent l'effet de la prise de 800 µg par jour de folates (versus placebo) sur les fonctions cognitives de 880 sujets âgés de 50 à 70 ans ayant un taux d'homocystéine sérique supérieur à 13 µmol/l. Cet essai d'une durée de 3 ans révèle une efficacité significative de l'apport en folates sur la mémoire. Les taux d'homocystéine initialement élevés diminuent avec l'apport en folates (Durga et coll., 2006
) rapportent l'effet de la prise de 800 µg par jour de folates (versus placebo) sur les fonctions cognitives de 880 sujets âgés de 50 à 70 ans ayant un taux d'homocystéine sérique supérieur à 13 µmol/l. Cet essai d'une durée de 3 ans révèle une efficacité significative de l'apport en folates sur la mémoire. Les taux d'homocystéine initialement élevés diminuent avec l'apport en folates (Durga et coll., 2006 ). Le deuxième essai d'une durée de 24 semaines concerne 195 sujets âgés de plus de 70 ans ayant un déficit en B12 (Eussen et coll., 2006
). Le deuxième essai d'une durée de 24 semaines concerne 195 sujets âgés de plus de 70 ans ayant un déficit en B12 (Eussen et coll., 2006 ). L'apport de B12 (1 000 µg par jour) ou de l'association de B12 et de folates (respectivement 1 000 µg et 400 µg par jour) n'a aucune efficacité sur les fonctions cognitives par comparaison au placebo. Actuellement, une étude financée par le National Institute of Aging (NIA) vise à déterminer si la baisse du taux d'homocystéine a un impact sur l'évolution de l'atteinte cognitive dans la maladie d'Alzheimer (étude Vital : VITamins to Slow Alzeimer's disease ; homocysteine Study).
). L'apport de B12 (1 000 µg par jour) ou de l'association de B12 et de folates (respectivement 1 000 µg et 400 µg par jour) n'a aucune efficacité sur les fonctions cognitives par comparaison au placebo. Actuellement, une étude financée par le National Institute of Aging (NIA) vise à déterminer si la baisse du taux d'homocystéine a un impact sur l'évolution de l'atteinte cognitive dans la maladie d'Alzheimer (étude Vital : VITamins to Slow Alzeimer's disease ; homocysteine Study). ). Plusieurs études épidémiologiques de cohorte (Paquid : Commenges et coll., 2000
). Plusieurs études épidémiologiques de cohorte (Paquid : Commenges et coll., 2000 ; Helmer et coll., 2003
; Helmer et coll., 2003 ; EVA : Berr et coll., 2000
; EVA : Berr et coll., 2000 et 2004
et 2004 ; Akbaraly et coll., 2007
; Akbaraly et coll., 2007 ; Rotterdam Study : Engelhart et coll., 2002a
; Rotterdam Study : Engelhart et coll., 2002a et b
et b ; Chicago Health and Aging Study : Morris et coll., 2002
; Chicago Health and Aging Study : Morris et coll., 2002 ) ont montré une relation entre apport en antioxydants et moindre risque de démence ou de déclin cognitif mais avec des discordances. Les résultats sont néanmoins en faveur d'un rôle possible de la vitamine E plus que de la vitamine C, mais aussi des caroténoïdes et du sélénium. Les études d'observation sur les suppléments en vitamines A, E ou C ou en oligoéléments (zinc, sélénium) sont beaucoup plus contradictoires et comportent des biais importants d'indication et de sélection des populations. Les résultats des essais randomisés chez le sujet âgé sain ou avec une maladie d'Alzheimer ou un MCI ne sont pas encore suffisamment convaincants pour préconiser la prise d'antioxydants en prévention du vieillissement cérébral. L'étude de Sano et coll. (1997
) ont montré une relation entre apport en antioxydants et moindre risque de démence ou de déclin cognitif mais avec des discordances. Les résultats sont néanmoins en faveur d'un rôle possible de la vitamine E plus que de la vitamine C, mais aussi des caroténoïdes et du sélénium. Les études d'observation sur les suppléments en vitamines A, E ou C ou en oligoéléments (zinc, sélénium) sont beaucoup plus contradictoires et comportent des biais importants d'indication et de sélection des populations. Les résultats des essais randomisés chez le sujet âgé sain ou avec une maladie d'Alzheimer ou un MCI ne sont pas encore suffisamment convaincants pour préconiser la prise d'antioxydants en prévention du vieillissement cérébral. L'étude de Sano et coll. (1997 ) montrant un effet bénéfique de la vitamine E sur l'évolution de la maladie d'Alzheimer n'a pas été confirmée dans une autre population de maladie d'Alzheimer (Onofrj et coll., 2002
) montrant un effet bénéfique de la vitamine E sur l'évolution de la maladie d'Alzheimer n'a pas été confirmée dans une autre population de maladie d'Alzheimer (Onofrj et coll., 2002 ). La prise de fortes doses de vitamine E (2 000 UI) n'a eu aucun effet sur la conversion vers la démence après 3 ans de suivi de sujets MCI (Petersen et coll., 2005
). La prise de fortes doses de vitamine E (2 000 UI) n'a eu aucun effet sur la conversion vers la démence après 3 ans de suivi de sujets MCI (Petersen et coll., 2005 ). L'association de vitamines E, C et β-carotène avec zinc et cuivre n'a eu aucun effet sur le niveau cognitif final des sujets de l'étude Areds sur la dégénérescence liée à l'âge (Yaffe et coll., 2004
). L'association de vitamines E, C et β-carotène avec zinc et cuivre n'a eu aucun effet sur le niveau cognitif final des sujets de l'étude Areds sur la dégénérescence liée à l'âge (Yaffe et coll., 2004 ). Enfin, deux essais avec le Gingko Biloba qui a des propriétés antioxydantes n'ont montré que des effets modestes (LeBars et coll., 1997
). Enfin, deux essais avec le Gingko Biloba qui a des propriétés antioxydantes n'ont montré que des effets modestes (LeBars et coll., 1997 ) ou nuls (van Dongen et coll., 2003
) ou nuls (van Dongen et coll., 2003 ) sur l'évolution de la démence. Nous attendons les résultats de deux études de prévention, étude Guidage en France et Gem aux États-Unis (DeKosky et coll., 2006
) sur l'évolution de la démence. Nous attendons les résultats de deux études de prévention, étude Guidage en France et Gem aux États-Unis (DeKosky et coll., 2006 ; Vellas et coll., 2006
; Vellas et coll., 2006 ).
). ), plusieurs mécanismes pourraient expliquer les effets des AGPI au niveau cérébral. Les AGPI oméga 3 et oméga 6 ont des effets opposés sur le plan cardiovasculaire. Les oméga 3 diminuent le risque d'arythmie cardiaque (Kris-Etherton et coll., 2002
), plusieurs mécanismes pourraient expliquer les effets des AGPI au niveau cérébral. Les AGPI oméga 3 et oméga 6 ont des effets opposés sur le plan cardiovasculaire. Les oméga 3 diminuent le risque d'arythmie cardiaque (Kris-Etherton et coll., 2002 ), ce qui expliquerait leur effet positif contre le risque de décès coronarien (Kris-Etherton, 1999
), ce qui expliquerait leur effet positif contre le risque de décès coronarien (Kris-Etherton, 1999 ), et ils ont des effets anti-thrombotiques et anti-athérosclérose (Kris-Etherton et coll., 2002
), et ils ont des effets anti-thrombotiques et anti-athérosclérose (Kris-Etherton et coll., 2002 ). Inversement, les AGPI oméga 6 ont des effets vasoconstricteurs et pro-thrombotiques (Muskiet et coll., 2004
). Inversement, les AGPI oméga 6 ont des effets vasoconstricteurs et pro-thrombotiques (Muskiet et coll., 2004 ).
). ; Engelhart et coll., 2002b
; Engelhart et coll., 2002b ), dans l'étude Paquid (Barberger-Gateau et coll., 2002
), dans l'étude Paquid (Barberger-Gateau et coll., 2002 ) et dans l'étude Chap (Morris et coll., 2003
) et dans l'étude Chap (Morris et coll., 2003 et 2005
et 2005 ). Une autre étude Hollandaise, la Doetinchem Study, a rapporté un effet protecteur sur le déclin cognitif chez des adultes d'âge moyen, à la fois de la consommation de poisson et d'AGPI oméga 3 à longues chaînes (EPA ou acide eicosapentaénoïque, et DHA ou acide docosahexaénoïque) (Kalmijn et coll., 2004
). Une autre étude Hollandaise, la Doetinchem Study, a rapporté un effet protecteur sur le déclin cognitif chez des adultes d'âge moyen, à la fois de la consommation de poisson et d'AGPI oméga 3 à longues chaînes (EPA ou acide eicosapentaénoïque, et DHA ou acide docosahexaénoïque) (Kalmijn et coll., 2004 ). Dans l'étude EVA avec des dosages d'acides gras dans les membranes des globules rouges (Heude et coll., 2003
). Dans l'étude EVA avec des dosages d'acides gras dans les membranes des globules rouges (Heude et coll., 2003 ), le risque de déclin des fonctions cognitives est plus élevé chez les sujets ayant des taux élevés d'AGPI oméga 6 et, à l'inverse il diminue pour les sujets avec les taux les plus hauts d'AGPI oméga 3. L'étude américaine Whicap (Washington Heights Inwood Columbia Aging Project) n'a pas trouvé de relation entre consommation d'AGPI et risque de maladie d'Alzheimer, mais elle a mis en évidence un effet délétère de l'apport énergétique total et de la quantité de lipides ingérés chez les sujets porteurs de l'allèle ɛ4 du gène de l'apolipoprotéine E (Luchsinger et coll., 2002
), le risque de déclin des fonctions cognitives est plus élevé chez les sujets ayant des taux élevés d'AGPI oméga 6 et, à l'inverse il diminue pour les sujets avec les taux les plus hauts d'AGPI oméga 3. L'étude américaine Whicap (Washington Heights Inwood Columbia Aging Project) n'a pas trouvé de relation entre consommation d'AGPI et risque de maladie d'Alzheimer, mais elle a mis en évidence un effet délétère de l'apport énergétique total et de la quantité de lipides ingérés chez les sujets porteurs de l'allèle ɛ4 du gène de l'apolipoprotéine E (Luchsinger et coll., 2002 ). Cette dernière étude soulève le problème des interactions complexes entre l'apport nutritionnel et les caractéristiques génétiques, en particulier pour les gènes impliqués dans le métabolisme des lipides et leur transport.
). Cette dernière étude soulève le problème des interactions complexes entre l'apport nutritionnel et les caractéristiques génétiques, en particulier pour les gènes impliqués dans le métabolisme des lipides et leur transport. ) montre que chez des individus ayant un régime proche du régime méditerranéen, le risque de maladie d'Alzheimer est significativement diminué. Cette observation est en accord avec une part des résultats obtenus pour les micro- ou macro-nutriments et souligne la nécessité de considérer les interactions entre ces différents composés.
) montre que chez des individus ayant un régime proche du régime méditerranéen, le risque de maladie d'Alzheimer est significativement diminué. Cette observation est en accord avec une part des résultats obtenus pour les micro- ou macro-nutriments et souligne la nécessité de considérer les interactions entre ces différents composés. ; Devanand et coll., 1996
; Devanand et coll., 1996 ; Berger et coll., 1999
; Berger et coll., 1999 ; Geerlings et coll., 2000
; Geerlings et coll., 2000 ; Wilson et coll., 2002
; Wilson et coll., 2002 ; Fuhrer et coll., 2003
; Fuhrer et coll., 2003 ; Kessing et coll., 2003
; Kessing et coll., 2003 ; Zubenko et coll., 2003
; Zubenko et coll., 2003 ; Modrego et Ferrandez, 2004
; Modrego et Ferrandez, 2004 ; Dal Forno et coll., 2005
; Dal Forno et coll., 2005 ; Gatz et coll., 2005
; Gatz et coll., 2005 ) et d'autres ne trouvent aucune relation (Chen et coll., 1999
) et d'autres ne trouvent aucune relation (Chen et coll., 1999 ; Palsson et coll., 1999
; Palsson et coll., 1999 ; Li et coll., 2001
; Li et coll., 2001 ; Lindsay et coll., 2002
; Lindsay et coll., 2002 ; Steffens et coll., 2004
; Steffens et coll., 2004 ; Andersen et coll., 2005
; Andersen et coll., 2005 ). Ces discordances peuvent être expliquées en partie par la variabilité des outils de dépistage de la dépression. Une revue de la littérature et une méta-analyse récente réalisée par Ownby et ses collaborateurs (2006
). Ces discordances peuvent être expliquées en partie par la variabilité des outils de dépistage de la dépression. Une revue de la littérature et une méta-analyse récente réalisée par Ownby et ses collaborateurs (2006 ) suggèrent que la dépression pourrait être un facteur de risque indépendant de la maladie d'Alzheimer (OR=1,90 ; (IC 95 % [1,55-2,33]). Si cela se confirmait, la dépression pourrait être considérée comme un des facteurs de risque modifiables de la maladie d'Alzheimer.
) suggèrent que la dépression pourrait être un facteur de risque indépendant de la maladie d'Alzheimer (OR=1,90 ; (IC 95 % [1,55-2,33]). Si cela se confirmait, la dépression pourrait être considérée comme un des facteurs de risque modifiables de la maladie d'Alzheimer. ; Kilander et coll., 1998
; Kilander et coll., 1998 ; Sabatini et coll., 2000
; Sabatini et coll., 2000 ) mais aussi la maladie d'Alzheimer (Ott et coll., 1997
) mais aussi la maladie d'Alzheimer (Ott et coll., 1997 ; de la Torre et coll., 2006
; de la Torre et coll., 2006 ). Pour certains, l'arythmie par fibrillation auriculaire est un déterminant indépendant d'altération des fonctions cognitives (Farina et coll., 1997
). Pour certains, l'arythmie par fibrillation auriculaire est un déterminant indépendant d'altération des fonctions cognitives (Farina et coll., 1997 ; Sabatini et coll., 2000
; Sabatini et coll., 2000 ). Il est intéressant de souligner que ces résultats persistent même après l'exclusion des patients présentant des lésions cérébrovasculaires. Il est donc probable que le mécanisme thrombo-embolique ne soit pas la seule explication à l'atteinte cognitive (Polidori et coll., 2001
). Il est intéressant de souligner que ces résultats persistent même après l'exclusion des patients présentant des lésions cérébrovasculaires. Il est donc probable que le mécanisme thrombo-embolique ne soit pas la seule explication à l'atteinte cognitive (Polidori et coll., 2001 ). Le suivi longitudinal moyen de 3 à 4 ans d'une cohorte de 180 sujets atteints de MCI et d'un groupe de 431 sujets témoins montre une relation significative entre la fibrillation auriculaire et l'évolution vers la démence chez les sujets MCI (HR=4,63 ; IC 95 % [1,72-12,46]). Cette relation n'est pas significative dans le groupe des personnes âgées saines (Forti et coll., 2006
). Le suivi longitudinal moyen de 3 à 4 ans d'une cohorte de 180 sujets atteints de MCI et d'un groupe de 431 sujets témoins montre une relation significative entre la fibrillation auriculaire et l'évolution vers la démence chez les sujets MCI (HR=4,63 ; IC 95 % [1,72-12,46]). Cette relation n'est pas significative dans le groupe des personnes âgées saines (Forti et coll., 2006 ). Certains travaux ont également montré une association entre altération cognitive et insuffisance cardiaque (Schall et coll., 1989
). Certains travaux ont également montré une association entre altération cognitive et insuffisance cardiaque (Schall et coll., 1989 ; Bornstein et coll., 1995
; Bornstein et coll., 1995 ; Acanfora et coll., 1996
; Acanfora et coll., 1996 ; Zuccala et coll., 1997
; Zuccala et coll., 1997 ; Cacciatore et coll., 1998
; Cacciatore et coll., 1998 ). Une étude longitudinale de 9 ans en Suède a permis le suivi d'une cohorte de 1 301 sujets âgés de plus de 75 ans indemnes de démence. Dans ce travail, l'insuffisance cardiaque est non seulement associée à la démence (HR=1,84 ; IC 95 % [1,35-2,51]) mais aussi à la maladie d'Alzheimer (HR=1,80 ; IC 95% [1,25-2,61]) (Qiu et coll., 2006
). Une étude longitudinale de 9 ans en Suède a permis le suivi d'une cohorte de 1 301 sujets âgés de plus de 75 ans indemnes de démence. Dans ce travail, l'insuffisance cardiaque est non seulement associée à la démence (HR=1,84 ; IC 95 % [1,35-2,51]) mais aussi à la maladie d'Alzheimer (HR=1,80 ; IC 95% [1,25-2,61]) (Qiu et coll., 2006 ). D'autres auteurs rapportent également une telle association (de la Torre, 2006
). D'autres auteurs rapportent également une telle association (de la Torre, 2006 ; Polidori et coll., 2006
; Polidori et coll., 2006 ).
). ; Breteler et coll., 1994
; Breteler et coll., 1994 ) mais tous ne sont pas concordants (Petrovitch et coll., 1998
) mais tous ne sont pas concordants (Petrovitch et coll., 1998 ; Bursi et coll., 2006
; Bursi et coll., 2006 ). Un travail autopsique récent a permis d'analyser cette relation chez 99 sujets d'âge moyen de 87 ans au moment du décès. Les auteurs observent une relation significative entre la densité des lésions neuropathologiques cérébrales de la maladie d'Alzheimer et l'importance de l'atteinte coronarienne, d'autant plus prononcée que le sujet est porteur d'au moins un allèle de l'APOE4 (Beeri et coll., 2006
). Un travail autopsique récent a permis d'analyser cette relation chez 99 sujets d'âge moyen de 87 ans au moment du décès. Les auteurs observent une relation significative entre la densité des lésions neuropathologiques cérébrales de la maladie d'Alzheimer et l'importance de l'atteinte coronarienne, d'autant plus prononcée que le sujet est porteur d'au moins un allèle de l'APOE4 (Beeri et coll., 2006 ).
). ; Kokmen et coll., 1990
; Kokmen et coll., 1990 ; Milward et coll., 1999
; Milward et coll., 1999 ; Beard et coll., 1997
; Beard et coll., 1997 ). Les études longitudinales sont rares. Atti et ses collaborateurs (2006
). Les études longitudinales sont rares. Atti et ses collaborateurs (2006 ) rapportent une relation positive entre l'anémie et le risque de démence dans une population de 1 377 sujets de plus de 75 ans. Un travail prospectif récent réalisé chez 1 744 sujets de plus de 71 ans vivant à domicile va dans le même sens. En effet, les sujets anémiques sont plus à risque d'altération cognitive (mesurée par le test de Pfeiffer) durant le suivi de 4 ans (p=0,0001) (Denny et coll., 2006
) rapportent une relation positive entre l'anémie et le risque de démence dans une population de 1 377 sujets de plus de 75 ans. Un travail prospectif récent réalisé chez 1 744 sujets de plus de 71 ans vivant à domicile va dans le même sens. En effet, les sujets anémiques sont plus à risque d'altération cognitive (mesurée par le test de Pfeiffer) durant le suivi de 4 ans (p=0,0001) (Denny et coll., 2006 ).
).  ; Amaducci et coll., 1986
; Amaducci et coll., 1986 ; Chandra et coll., 1987
; Chandra et coll., 1987 ; Chandra et coll., 1989
; Chandra et coll., 1989 ; Broe et coll., 1990
; Broe et coll., 1990 ; Graves et coll., 1990
; Graves et coll., 1990 ; Mortimer et coll., 1991
; Mortimer et coll., 1991 ; Li et coll., 1992
; Li et coll., 1992 ; Van Duijn et coll., 1992
; Van Duijn et coll., 1992 ; Fratiglioni et coll., 1993
; Fratiglioni et coll., 1993 ; Forster et coll., 1995
; Forster et coll., 1995 ; Mayeux et coll., 1995
; Mayeux et coll., 1995 ; O'Meara et coll., 1997
; O'Meara et coll., 1997 ; Tsolaki et coll., 1997
; Tsolaki et coll., 1997 ; Guo et coll., 2000
; Guo et coll., 2000 ). Les études de cohortes sont résumées dans le tableau 16.VIII
). Les études de cohortes sont résumées dans le tableau 16.VIII . Une méta-analyse publiée en 2003 (Fleminger et coll., 2003
. Une méta-analyse publiée en 2003 (Fleminger et coll., 2003 ) et une étude prospective analysant les données médicales des vétérans de la 2e guerre mondiale (Plassman et coll., 2000
) et une étude prospective analysant les données médicales des vétérans de la 2e guerre mondiale (Plassman et coll., 2000 ) soutiennent l'hypothèse que les traumatismes crâniens peuvent avoir un impact significatif dans le développement de la maladie d'Alzheimer. Sur le plan anatomo-pathologique, des lésions similaires à la maladie d'Alzheimer ont été décrites chez les ex-boxeurs qui ont souffert de micro-traumatismes à répétition. L'analyse des résultats est difficile car il n'y a pas de méthode standardisée pour évaluer la sévérité du traumatisme. Il en est de même pour l'intervalle de temps entre le traumatisme et le début de la maladie.
) soutiennent l'hypothèse que les traumatismes crâniens peuvent avoir un impact significatif dans le développement de la maladie d'Alzheimer. Sur le plan anatomo-pathologique, des lésions similaires à la maladie d'Alzheimer ont été décrites chez les ex-boxeurs qui ont souffert de micro-traumatismes à répétition. L'analyse des résultats est difficile car il n'y a pas de méthode standardisée pour évaluer la sévérité du traumatisme. Il en est de même pour l'intervalle de temps entre le traumatisme et le début de la maladie. ; Beffert et coll., 1998
; Beffert et coll., 1998 ; Hemling et coll., 2003
; Hemling et coll., 2003 ; Wozniak, 2005
; Wozniak, 2005 ), HSV2 (Herpes Simplex Virus type 2) (Lin et coll., 2002
), HSV2 (Herpes Simplex Virus type 2) (Lin et coll., 2002 ), HHV6 (Herpes Human Virus 6) (Hemling et coll., 2003
), HHV6 (Herpes Human Virus 6) (Hemling et coll., 2003 ), VZV (virus de la varicelle et du zona) (Hemling et coll., 2003
), VZV (virus de la varicelle et du zona) (Hemling et coll., 2003 ), CMV (cytomégalovirus) (Lin et coll., 2002
), CMV (cytomégalovirus) (Lin et coll., 2002 ) ou encore le Chlamydiae pneumoniae (Nochlin et coll., 1999
) ou encore le Chlamydiae pneumoniae (Nochlin et coll., 1999 ; Gieffers et coll., 2000
; Gieffers et coll., 2000 ; Ring et Lyons, 2000
; Ring et Lyons, 2000 ; Gerard et coll., 2005
; Gerard et coll., 2005 ). Mais ces résultats ne sont pas partagés par tous (Ball et coll., 2001
). Mais ces résultats ne sont pas partagés par tous (Ball et coll., 2001 ; Lin et coll., 2002
; Lin et coll., 2002 ). Certains auteurs soulignent la présence de ces agents infectieux préférentiellement chez les sujets porteurs d'au moins un allèle ApoE4 (Itabashi et coll., 1997
). Certains auteurs soulignent la présence de ces agents infectieux préférentiellement chez les sujets porteurs d'au moins un allèle ApoE4 (Itabashi et coll., 1997 ; Itzhaki et coll., 1997
; Itzhaki et coll., 1997 ; Balin et coll., 1998
; Balin et coll., 1998 ; Shipley et coll., 2005
; Shipley et coll., 2005 ; Itzhaki et coll., 2006
; Itzhaki et coll., 2006 ).
). ), la mémoire verbale (Incalzi et coll., 1993
), la mémoire verbale (Incalzi et coll., 1993 ; Incalzi et coll., 1997
; Incalzi et coll., 1997 ), mais il s'agit d'études cas-témoins pour la très grande majorité ne permettant aucune conclusion fiable et définitive. Certains travaux, cas-témoins pour la plupart, ont étudié les possibles associations entre l'apnée du sommeil et la maladie d'Alzheimer avec des résultats discordants (Foley et coll., 2003
), mais il s'agit d'études cas-témoins pour la très grande majorité ne permettant aucune conclusion fiable et définitive. Certains travaux, cas-témoins pour la plupart, ont étudié les possibles associations entre l'apnée du sommeil et la maladie d'Alzheimer avec des résultats discordants (Foley et coll., 2003 ; Dyken et coll., 2004
; Dyken et coll., 2004 ). Il est à noter que Kadotani et ses collaborateurs (2001
). Il est à noter que Kadotani et ses collaborateurs (2001 ) rapportent une association significative entre apnée du sommeil de l'adulte et l'allèle e4 de l'ApoE dans la population générale.
) rapportent une association significative entre apnée du sommeil de l'adulte et l'allèle e4 de l'ApoE dans la population générale. ), aucune association entre profession principale et risque de démence ou de maladie d'Alzheimer n'est décrite, une augmentation du risque de démence chez les sujets des plus basses catégories professionnelles a été rapportée dans une population New-Yorkaise (Stern et coll., 1999
), aucune association entre profession principale et risque de démence ou de maladie d'Alzheimer n'est décrite, une augmentation du risque de démence chez les sujets des plus basses catégories professionnelles a été rapportée dans une population New-Yorkaise (Stern et coll., 1999 ). Plus spécifiquement, une association a été rapportée entre travail manuel dans le cadre d'activités de production et maladie d'Alzheimer dans une population suédoise (Qiu et coll., 2003a
). Plus spécifiquement, une association a été rapportée entre travail manuel dans le cadre d'activités de production et maladie d'Alzheimer dans une population suédoise (Qiu et coll., 2003a ).
).  ; Feychting et coll., 1998
; Feychting et coll., 1998 ; Savitz et coll., 1998
; Savitz et coll., 1998 ; Feychting et coll., 2003
; Feychting et coll., 2003 ; Hakansson et coll., 2003
; Hakansson et coll., 2003 ), ou aux solvants (Kukull et coll., 1995
), ou aux solvants (Kukull et coll., 1995 ; Nilson et coll., 2002
; Nilson et coll., 2002 ), mais les études négatives sont nombreuses. Pour les expositions aux pesticides, des effets modérés ont été décrits en transversal sur les fonctions cognitives (Bosma et coll., 2000
), mais les études négatives sont nombreuses. Pour les expositions aux pesticides, des effets modérés ont été décrits en transversal sur les fonctions cognitives (Bosma et coll., 2000 ) et, chez les hommes de l'étude Paquid, sur la maladie d'Alzheimer (Baldi et coll., 2003
) et, chez les hommes de l'étude Paquid, sur la maladie d'Alzheimer (Baldi et coll., 2003 ). Concernant les expositions aux métaux lourds, les études sont globalement négatives (Salib et Hillier, 1996
). Concernant les expositions aux métaux lourds, les études sont globalement négatives (Salib et Hillier, 1996 ; Gun et coll., 1997
; Gun et coll., 1997 ; Graves et coll., 1998
; Graves et coll., 1998 ; Letz et coll., 2000
; Letz et coll., 2000 ; Nordberg et coll., 2000
; Nordberg et coll., 2000 ; Gauthier, 2001
; Gauthier, 2001 ).
). ). Les études dont la méthodologie est la moins critiquable sont issues de la cohorte Paquid et sont en faveur d'une augmentation du risque de démence ou de maladie d'Alzheimer (Rondeau et coll., 2000
). Les études dont la méthodologie est la moins critiquable sont issues de la cohorte Paquid et sont en faveur d'une augmentation du risque de démence ou de maladie d'Alzheimer (Rondeau et coll., 2000 ; Rondeau, 2002
; Rondeau, 2002 ), risque estimé entre 1,5 et 2,5 pour une concentration hydrique d'aluminium supérieure à 100 ou 110 mg/l. Mais il n'y a pas d'effet dose, ni de sous-groupe à risque et les limites de ces travaux sont nombreuses : qualité des dosages d'aluminium, hypothèses de stabilité des taux sur des périodes souvent longues, pas de consensus sur la forme aluminium... Le problème de fond de ces résultats reste celui de la plausibilité de l'hypothèse biologique : l'eau ne représente que 5 à 10 % des apports dans l'organisme humain.
), risque estimé entre 1,5 et 2,5 pour une concentration hydrique d'aluminium supérieure à 100 ou 110 mg/l. Mais il n'y a pas d'effet dose, ni de sous-groupe à risque et les limites de ces travaux sont nombreuses : qualité des dosages d'aluminium, hypothèses de stabilité des taux sur des périodes souvent longues, pas de consensus sur la forme aluminium... Le problème de fond de ces résultats reste celui de la plausibilité de l'hypothèse biologique : l'eau ne représente que 5 à 10 % des apports dans l'organisme humain. ; Mutter et coll., 2004
; Mutter et coll., 2004 ).
). ; Ancelin et Ritchie, 2005
; Ancelin et Ritchie, 2005 ). Les études épidémiologiques longitudinales suggèrent une réduction de 29 à 44 % du risque de développer la maladie d'Alzheimer chez les femmes traitées (Hogervorst et coll., 2000
). Les études épidémiologiques longitudinales suggèrent une réduction de 29 à 44 % du risque de développer la maladie d'Alzheimer chez les femmes traitées (Hogervorst et coll., 2000 ; Leblanc, 2002
; Leblanc, 2002 ). Mais, les résultats récents de l'étude randomisée américaine « Women's Health Initiative Memory Study » sur des femmes post-ménopausées (Shumaker et coll., 2003
). Mais, les résultats récents de l'étude randomisée américaine « Women's Health Initiative Memory Study » sur des femmes post-ménopausées (Shumaker et coll., 2003 et 2004
et 2004 ; Resnick et coll., 2006
; Resnick et coll., 2006 ) indiquent une augmentation du risque de démence ou de déclin des fonctions cognitives chez les femmes traitées par œ strogènes avec ou sans progestatifs. Tant la population d'étude (femmes à risque cardiovasculaire, de plus de 65 ans au début du traitement, alors que les études d'observation concernaient des femmes traitées au moment de la ménopause) que le type de THM (Premarin+medroxyprogesterone par voie orale) limitent l'extrapolation de ces résultats. Les prescriptions en France privilégient d'autres formes d'œ strogènes et de progestatifs. Mais il n'est pas légitime de considérer aujourd'hui que la prise d'un THM puisse avoir un rôle protecteur dans les démences et la maladie d'Alzheimer. L'analyse de la littérature n'incite pas à proposer la prescription de THM pour la prévention de la maladie d'Alzheimer.
) indiquent une augmentation du risque de démence ou de déclin des fonctions cognitives chez les femmes traitées par œ strogènes avec ou sans progestatifs. Tant la population d'étude (femmes à risque cardiovasculaire, de plus de 65 ans au début du traitement, alors que les études d'observation concernaient des femmes traitées au moment de la ménopause) que le type de THM (Premarin+medroxyprogesterone par voie orale) limitent l'extrapolation de ces résultats. Les prescriptions en France privilégient d'autres formes d'œ strogènes et de progestatifs. Mais il n'est pas légitime de considérer aujourd'hui que la prise d'un THM puisse avoir un rôle protecteur dans les démences et la maladie d'Alzheimer. L'analyse de la littérature n'incite pas à proposer la prescription de THM pour la prévention de la maladie d'Alzheimer. ; Eikelenboom et van Gool, 2004
; Eikelenboom et van Gool, 2004 ). Les données épidémiologiques suggèrent un éventuel effet protecteur des anti-inflammatoires non stéroïdiens contre la maladie d'Alzheimer (McGeer et coll., 1996
). Les données épidémiologiques suggèrent un éventuel effet protecteur des anti-inflammatoires non stéroïdiens contre la maladie d'Alzheimer (McGeer et coll., 1996 ; Stewart et coll., 1997
; Stewart et coll., 1997 ; In't Veld et coll., 2001
; In't Veld et coll., 2001 ; Lindsay et coll., 2002
; Lindsay et coll., 2002 ; Zandi, 2002
; Zandi, 2002 ). L'étude ADAPT (Alzheimer's Disease Anti-inflammatory Prevention Trial) avait pour but d'évaluer l'efficacité du célécoxib, du naproxène versus placebo dans la prévention primaire de la maladie d'Alzheimer sur une durée de 7 ans (Martin et coll., 2002
). L'étude ADAPT (Alzheimer's Disease Anti-inflammatory Prevention Trial) avait pour but d'évaluer l'efficacité du célécoxib, du naproxène versus placebo dans la prévention primaire de la maladie d'Alzheimer sur une durée de 7 ans (Martin et coll., 2002 ). Cette étude a dû être arrêtée en raison de nombreux effets indésirables. Une intervention en double-aveugle contre placebo visant à évaluer l'efficacité du Rocécoxib dans le MCI (chez 1 457 sujets de plus de 65 ans) sur une durée de 4 ans n'a montré aucune différence significative (Thal et coll., 2005
). Cette étude a dû être arrêtée en raison de nombreux effets indésirables. Une intervention en double-aveugle contre placebo visant à évaluer l'efficacité du Rocécoxib dans le MCI (chez 1 457 sujets de plus de 65 ans) sur une durée de 4 ans n'a montré aucune différence significative (Thal et coll., 2005 ). L'étude BONSAI (Biomarkers Of Non-Steroidal Anti-Inflammatories) débutée en octobre 2005 a inclus 40 sujets de plus de 70 ans avec des antécédents familiaux de maladie d'Alzheimer. Le but de l'étude est d'évaluer l'effet de l'ibuprofène sur les biomarqueurs de la maladie à 6 et à 12 semaines. Ce travail, financé par le National Institute of Aging (NIA), est actuellement en cours. Enfin, un dernier travail randomisé porte sur 138 sujets (âgés de 40 à 90 ans) qui souffrent d'altérations de la mémoire liées à l'âge. Cette étude permet d'évaluer l'efficacité du célécoxib contre le placebo, l'objectif étant de retarder le début de la maladie. Les résultats ne sont pas encore publiés3
. En conclusion, même si les études observationnelles laissent supposer un effet des anti-inflammatoires non stéroïdiens dans la prévention de la maladie d'Alzheimer, les essais cliniques publiés sont pour le moment non concluants. À la lumière de ces résultats, il n'y a aucune indication à la prescription des anti-inflammatoires non stéroïdiens dans prévention de la maladie d'Alzheimer. Il en est de même pour le traitement de la maladie et le ralentissement de l'évolution (Rogers et coll., 1993
). L'étude BONSAI (Biomarkers Of Non-Steroidal Anti-Inflammatories) débutée en octobre 2005 a inclus 40 sujets de plus de 70 ans avec des antécédents familiaux de maladie d'Alzheimer. Le but de l'étude est d'évaluer l'effet de l'ibuprofène sur les biomarqueurs de la maladie à 6 et à 12 semaines. Ce travail, financé par le National Institute of Aging (NIA), est actuellement en cours. Enfin, un dernier travail randomisé porte sur 138 sujets (âgés de 40 à 90 ans) qui souffrent d'altérations de la mémoire liées à l'âge. Cette étude permet d'évaluer l'efficacité du célécoxib contre le placebo, l'objectif étant de retarder le début de la maladie. Les résultats ne sont pas encore publiés3
. En conclusion, même si les études observationnelles laissent supposer un effet des anti-inflammatoires non stéroïdiens dans la prévention de la maladie d'Alzheimer, les essais cliniques publiés sont pour le moment non concluants. À la lumière de ces résultats, il n'y a aucune indication à la prescription des anti-inflammatoires non stéroïdiens dans prévention de la maladie d'Alzheimer. Il en est de même pour le traitement de la maladie et le ralentissement de l'évolution (Rogers et coll., 1993 ; Scharf et coll., 1999
; Scharf et coll., 1999 ; Aisen et coll., 2003
; Aisen et coll., 2003 ; Reines et coll., 2004
; Reines et coll., 2004 ; Klegeris et coll., 2005
; Klegeris et coll., 2005 ). D'autres travaux sont en cours et devraient apporter de nouvelles informations.
). D'autres travaux sont en cours et devraient apporter de nouvelles informations.