| |
| Med Sci (Paris). 36(6-7): 616–625. doi: 10.1051/medsci/2020096.La dégénérescence maculaire liée à l’âge: La piste du
fer Yves Courtois,1 Jenny Youale,1 Francine Behar-Cohen,2 and Émilie Picard1* 1Centre de Recherche des Cordeliers, Inserm, Sorbonne Université,
USPC, Université Paris Descartes, Université Paris Diderot,
UMRS1138, 15 rue de
l’École de Médecine, F-75006Paris,
France 2Hôpital Cochin, AP-HP, Assistance Publique-Hôpitaux de
Paris, 24 rue du Faubourg
Saint-Jacques, 75014Paris,
France |

Vignette (Photo © Inserm-Marion Vincent). Le fer est un élément crucial pour le fonctionnement du vivant. Il est impliqué dans de
nombreux processus mais, quand il est sous forme libre, son potentiel d’oxydoréduction
(Fe3++O2-→Fe2++O2) lui confère un rôle
potentiellement toxique. Il en résulte une production excessive d’espèces réactives RO°
(par la réaction de Fenton/Haber-Weiss) qui interagissent avec les lipides, les
protéines, les sucres et les acides nucléiques, perturbant le fonctionnement normal de
la cellule. Son homéostasie est donc finement régulée au niveau de sa disponibilité, de
son transport, de son stockage et de son utilisation [1] (→).
(→) Voir la Synthèse de C. Beaumont, m/s n° 1, janvier 2004, page
68
La rétine est soumise à de nombreux stress, tels que la lumière et l’oxygénation due au
métabolisme oculaire particulièrement élevé. Bien que la présence du fer dans la rétine
soit soupçonnée depuis deux siècles [2], ce n’est que récemment que l’étude de son métabolisme dans la rétine et
de son lien avec de nombreuses maladies, y compris la dégénérescence maculaire liée à
l’âge (DMLA), a réellement été initiée, ouvrant de nouvelles perspectives thérapeutiques
(pour revue voir [3]). |
Le fer est essentiel à la phototransduction et les photorécepteurs
particulièrement sensibles au fer libre Localisation et fonction du fer dans la rétine Les cellules rétiniennes et, plus spécifiquement, les photorécepteurs (PR) et
l’épithélium pigmentaire de la rétine (EPR), ont des besoins importants en fer
en raison de leurs activités métaboliques élevées et de leurs implications dans
le cycle de la phototransduction. En effet, dans l’EPR, le fer participe au
clivage du tout-trans-rétinyl ester en 11-cis rétinol par l’isomérohydrolase
RPE65 ( retinal pigment epithelium 65), lors de la formation du
glutamate par l’aconitase cytosolique et au cours de l’induction de la
mélanogenèse [ 4]. Chez le
poisson zèbre, la liaison du fer ferreux (Fe 2+) à la GCAP5
( guanylate cyclase-activating protein 5) inhibe la
formation de GMP (monophosphate de guanosine) cyclique par la guanylate cyclase
[ 5], ce qui agirait
directement sur la cascade de la phototransduction. La biogénèse constante des
membranes lipidiques constituant les segments externes des PR est un processus
qui dépend du fer [ 4]. Notre équipe a été
la première à révéler la localisation du fer dans l’ensemble de la rétine chez
des rats adultes, avec une concentration plus élevée dans la choroïde, l’EPR
(dans les phagosomes et les mélanosomes[ 6]), et dans les PR (dans les segments internes et associés
aux disques dans les segments externes) [ 7]. Le fer est également présent dans l’humeur aqueuse et le
corps vitré, mais à un plus faible taux que dans le plasma [ 4]. Le taux de fer varie au cours du développement et du vieillissement de la rétine.
En effet, Moos et al. [8] ont montré chez le rat que l’entrée de fer dans la rétine
était très importante durant son développement et sa maturation, diminuait à
l’âge adulte et augmentait de nouveau lors du vieillissement. Avec l’âge, des
dépôts de fer sont retrouvés dans le complexe EPR/choroïde, chez le rat, et dans
le stroma de la choroïde chez les primates non humains, indépendamment de la
concentration de fer sérique. L’augmentation de la concentration en fer avec
l’âge est également observée dans les rétines neurales1, humaines [4]. Homéostasie locale du fer Le besoin continuel de la rétine en fer, ainsi que son extrême sensibilité aux
espèces réactives de l’oxygène, conditionnent la finesse du métabolisme rétinien
du fer. De nombreuses protéines, dont l’expression était auparavant cantonnée au
niveau périphérique, ont été identifiées comme étant également synthétisées
localement dans la rétine (Tableau
I). L’étude de la physiologie rétinienne chez des souris
dont les gènes codant ces protéines ont été invalidés a permis de dégager un
consensus concernant l’homéostasie du fer dans la rétine. Celui-ci se divise en
deux compartiments, localisés dans l’EPR et dans les cellules gliales de Müller.
L’EPR régulerait l’entrée/sortie du fer provenant du réseau choroïdien vers les
PR. Les cellules gliales de Müller 2
réguleraient, elles, l’apport en fer de la rétine externe à partir du réseau de
capillaires rétiniens. Le fer étant principalement localisé dans les PR et
l’EPR, nous nous limiterons à une brève description de l’homéostasie du fer à ce
niveau (Figure 1).
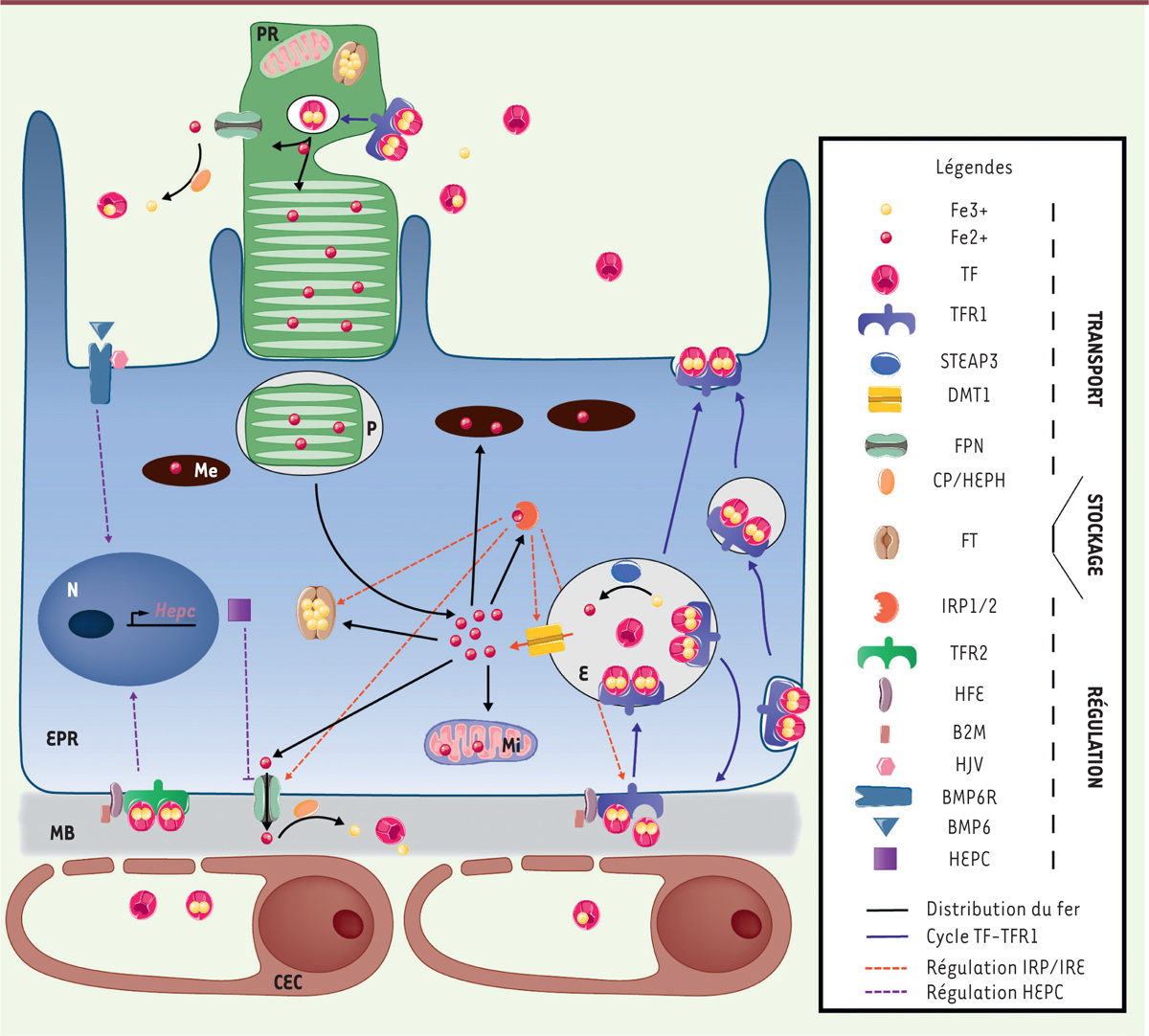
 | Figure 1.
Transport, stockage et régulation du fer dans le
complexe photorécepteurs-épithélium pigmentaire de la
rétine. Le fer Fe3+ lié à la transferrine (TF) est capté
par son récepteur 1 (TFR1) au niveau basolatéral de l’épithélium
pigmentaire de la rétine (EPR). Le complexe TF/TFR internalisé
transite vers le pôle apical ou bien est transporté dans les
endosomes (flèches bleues). Fe3+ y est libéré et réduit
par la métaloréductase STEAP3 en Fe2+ puis exporté dans
le cytosol par le transporteur DMT1 où il constitue le
pool de fer libre. Le fer est ensuite acheminé
vers les organelles en fonction des besoins, soit stocké dans la
ferritine (FT) et les mélanosomes (Me), soit exporté par la
ferroportine (FPN) associée à la ferroxidase céruloplasmine (CP) ou
à l’héphaestine (HEPH) (flèches noires). La quantité de fer
intracellulaire est régulée principalement par deux mécanismes. Dans
la cellule, le fer se lie à IRP1/2 (iron regulatory
protein) qui se fixe sur des séquences régulatrices
(iron responsive element) des ARNm pour moduler
l’expression de DMT1, TFR1, FT et FPN (flèches orange). La synthèse
de l’hepcidine (HEPC) est activée soit par la fixation de BMP6
(bone morphogenetic protein) à ses récepteurs
couplés à l’hémojuvéline (HJV), soit par la liaison de la TF (en
condition de saturation en fer) avec son récepteur 2 (TFR2) couplé à
l’hémochromatose (HFE) et la bêta-2 microglobuline (b2M) (flèches
violettes). L’HEPC interagit avec la FPN et provoque sa dégradation.
La phototransduction opérée au niveau des segments externes des
photorécepteurs (PR) est un processus fortement dépendant du fer.
Grâce à la phagocytose des segments externes des PR, l’EPR recycle
le fer qui rejoint le pool de fer libre. Les PR contrôlent leur
apport en fer via TFR1 et FPN présents au niveau des segments
internes des PR. CEC : cellule endothéliale choroïdienne ; E :
endosome ; EPR : épithélium pigmentaire de la rétine ; MB : membrane
de Bruch ; Me : mélanosome ; MI : mitochondrie ; N : noyaux ; P :
phagosome ; PR : photorécepteur. |
Tableau I.
| |
Protéine |
Expression |
Fonctions |
Modèles murins |
Maladies humaines |
|
Entré/Sortie du fer
|
Transferrine (TF) |
EPR, PR, CGM |
Protéine circulante chélateur du fer ferrique
(Fe3+) extracellulaire |
Hpx
-/- : réduction de l’électrorétinogramme.
Diminution de TF, CP, TFR1 [43] |
Atransferrinémie congénitale héréditaire |
| Récepteur 1 de la transferrine (TFR1) |
EPR, SI, CCG, vaisseaux |
Récepteur membranaire de la TF. |
ND |
|
ND |
| α-synucléine (SNCA) |
EPR, PR, cellules bipolaires, cellules
amacrines, CCG |
Modulation du recyclage du complexe TF-TFR1 |
a-syn
-/- : diminution FT, TFR1 [44] |
|
Maladie de Parkinson ; maladie à corps de Lewy
|
| Lipocaline 2 (LCN2) ou NGAL (neutrophil
gelatinase-associated lipocalin) |
EPR, CGM, rétine |
Protéine extracellulaire qui lie le fer par
l’intermédiaire d’un sidérophore bactérien ou de mammifère
(2,5-dihydroxybenzoic acid).
Récepteur
24p3R |
Lcn2-/-
: expressions de LFT, TF et TFR1 inchangée (données
personnelles) |
|
ND |
| Mégaline ou LRP2 (low-density
lipoprotein receptor-related protein 2) ou
gp300 |
EPR |
Récepteur membranaire multiligands (dont
lipocaline 2, lactoferrine, transferrine), co-récepteur de
la cubuline |
Lrp2F/F
(FoxG1Cre+) : myopie, hypertrophie de
l’EPR (macromélanosome) et dégénérescence de la rétine
[45]. Augmentation de FT et diminution de
TFR1 |
|
Syndrome de Donnai-Barrow : myopie forte,
décollement de rétine |
| Ferroportine (FPN) ou SLC40A1 |
EPR, SI, CPE, CPI, CGM, CER |
Protéine transmembranaire qui exporte le
fer2+ hors de la cellule en coopération avec
CP ou HEPH |
Fpn
C326S : souris résistante à l’HEPC. Augmentation
de FT, dépôts de fer dans l’EPR et la choroïde [46] |
|
Hémochromatose de type 4 |
| Céruloplasmine (CP) |
EPR, CGM |
Ferroxidase extracellulaire ou membranaire
oxydant le Fe2+ en Fe3+. |
Cp
-/-
Heph
sla/sla : néovaisseaux, dépôts sous EPR, morts de
l’EPR et des PR. |
|
Acéruloplasminémie : dépôts de fer dans drusen
et EPR. Phénotype de DMLA [48] |
| Hephaestine (HEPH) |
EPR, PR, CGM |
Ferroxidase extracellulaire. 50% d’homologie
avec CP |
Accumulation de fer dans les PR et l’EPR.
Augmentation de FT, et diminution de TFR1.
Cp
-/-
Heph
F/F(Bestrophin1Cre+) : pas de dépôts
de fer, pas d’atteinte rétinienne [47] |
|
ND |
| DMT1 (Divalent Metal Transporter
1) ou SLC11A2 |
CEC, SI, cellules horizontales, cellules
bipolaires
[49] |
Symport de Fe2 et d’un proton pour
la sortie du fer de l’endosome et du lysosome vers le
cytosol. |
ND |
|
Anémie microcytaire hypochrome |
| APP (Amyloid-beta precursor
protein) |
EPR, SI et SE, CGM, CCG |
Ferroxidase membranaire |
App
-/- : altération du développement synaptique des
neurones intermédiaires [50] |
|
Associé à la maladie d’Alzheimer, à
l’angiopathie cérébrale amyloïde |
|
Entrée/Sortie
du fer
|
ZIP14 (Zinc transporter 14)
SLC39A14 |
CEC, EPR, PR, CGM, CCG CER [51] |
Transporteurs transmembranaires du
Fe2+ assurant l’entrée du fer non lié à la TF
dans le cytosol |
ND |
Hypermanganèsemie ; Hyperostose crânienne
interne. |
| ZIP8 (Zinc transporter 8)
SLC39A8 |
|
|
|
|
Désordre congénital de glycosylation de type
2N |
|
Stockage
|
Ferritine (FT) |
EPR, SI, cellules bipolaires |
Composée de chaînes lourdes (HFT) et légères
(LFT) formant un complexe liant 4 500 Fe3+.
Circulante, cytosolique, nucléaire ou mitochondriale |
Hft
+/- : Sensibilité accrue au stress [52] |
HFT : hémochromatose de type 5
LFT : syndrome
d’hyperferritinémie-cataracte; Neuroferritinopathie (NBIA3)
; déficit en LFT. |
|
Régulation des protéines du fer
|
Récepteur de la Transferrine 2 (TFR2) |
EPR, SI, CPE, CPI |
Récepteur membranaire de la TF qui régule
l’expression de l’HEPC en cas de saturation de la TF en fer
(voie TFR2/HFE). |
ND |
Hémochromatose de type 3 |
| Hémochromatose protéine (HFE) |
EPR |
Protéine membranaire qui se lie, avec β2M à
TFR1 ou TFR2 en fonction de la saturation de la TF |
Hfe
-/- : Hypertrophie/Hyperplasie de l’EPR,
dégénérescence des PR. Augmentation de la FT [53] |
|
Hémochromatose de type 1 : changement de l’EPR,
drusen, altération de la vision [49] |
| β-2-Microglobuline (β2M) |
EPR, SE, SI, CPE, CNI, CPI [54] |
Protéine membranaire qui participe à
l’interaction HFE-TFR1/2 |
ND |
|
Immunodéficience 43 ; Amyloïdose 8. |
| BMP6 (bone morphogenetic protein
6) |
EPR, SI, CPE, CPI, CCG |
Régulation de l’expression de l’HEPC |
Bmp6
-/- : accumulation de fer dans l’EPR et la
rétine. Hypertrophie de l’EPR, dégénérescence des PR.
Diminution de TFR1, et augmentation de LFT [55] |
|
ND |
| Hémojuvéline (HJV) |
EPR, PR, CGM, CCG |
Régulation de l’expression de l’HEPC |
Hjv
-/- : néovascularisation rétinienne, gliose,
rupture de la barrière hémato-rétinienne interne,
dégénérescence des PR. Augmentation de la LFT [56] |
|
Hémochromatose de type 2A |
| TMPRSS6 (serine protease
matriptase-2) |
EPR, CGM, CCG |
Protéine membranaire enzymatique qui clive HJV |
Tmprss6msk/msk : pas d’atteinte
rétinienne [57] ; augmentation HEPC, HJV et
TFR1. |
|
Anémie ferriprive réfractaire |
|
Régulation des protéines du fer
|
Hepcidine (HEPC) |
EPR, IS, CGM, CPE |
Hormone activée par la voie RTF2/HFE, BMP/HJV,
TLR4 et IL6/IL1β en cas : de saturation de la TF ou
d’inflammation |
Hamp
-/- : accumulation de fer dans le complexe
EPR/choroïde et la rétine. Diminution de TFR1 et
augmentation de FPN [9] |
Hémochromatose de type 2B et juvénile |
| IRP1 et 2
(iron regulatory
protein) |
Ubiquitaire |
Se fixe aux IRE (Iron responsive
element) pour la régulation translationnelle de
protéines du fer en fonction du taux de fer intracellulaire |
Ireb1
+/-
Ireb2
-/- : pas d’atteinte rétinienne ; augmentation de
FPN et de LFT [49] |
|
ND |
| HIF 1 et 2
(Hypoxia Inducible
Factor) |
EPR, PR rétine interne
[58] |
Facteur de transcription sensible au taux de
fer et d’oxygène. Se lie au site HRE (Hypoxia
responsive element) de Vegf,
iNOS, HO1,
Tf, Tfr1,
Fpn, Dmt1
|
ND |
|
Erythrocytose familiale (HIF2α) |
Protéines impliquées dans l’homéostasie du fer de la
rétine. La localisation des protéines est
obtenue à partir d’immunomarquages sur des coupes de rétines de
souris/rats. Les modèles murins présentés se limitent à ceux qui ont
des modifications rétiniennes de l’homéostasie du fer et des
anomalies rétiniennes le cas échéant. Les maladies humaines
correspondantes ont été obtenues par une recherche sur le site
UniProt (https://www.uniprot.org). CCG : couche des cellules
ganglionnaires ; CEC : cellule endothéliale choroïdienne ; CER :
cellule endothéliale rétinienne ; CGM : cellule gliale de Müller ;
CNI : couche nucléaire interne ; CPE : couche pléxiforme externe ;
CPI : couche pléxiforme interne ; EPR : épithélium pigmentaire de la
rétine ; PR : photorécepteur ; SI : segments internes ; SE :
segments externes. |
Provenant de la circulation sanguine, le fer majoritairement lié à la
transferrine (TF), est capté par son récepteur, TFR1, qui se localise au niveau
de la membrane basolatérale de l’EPR. Le complexe formé par la TF et son
récepteur est alors internalisé dans un endosome. Le fer libéré sous l’effet de
l’acidification de la vésicule, constitue, dans le cytosol, le pool de fer libre
qui sera soit distribué aux organelles, pour les fonctions physiologiques de la
cellule comme la respiration mitochondriale et la formation des complexes
fer-souffre, soit stocké sous forme de ferritine, soit exporté par la
ferroportine (couplée à une ferroxidase : la céruloplasmine ou l’héphaestine).
Dans les cellules d’EPR humaines en culture, le TFR1 se localise à la fois du
côté basolatéral et apical des cellules, suggérant un mécanisme de transport
baso-apical du fer par transcytose du complexe TF/TFR1 le long des microtubules
via la galectine 4 et la GTPase Rab11a [9]. La présence de TFR1 au niveau des
segments internes des PR (cil connecteur) suggère que la TF synthétisée par la
rétine capte le fer libéré par l’EPR pour le transporter dans les PR. Les principaux mécanismes de régulation de la quantité de fer intra- et
extracellulaire se limitent à deux systèmes extrêmement contrôlés. Le premier
repose sur les iron regulatory proteins (IRP) 1 et 2, des
protéines qui, en fonction de la quantité de fer dans la cellule, le régulent en
se liant à des séquences iron responsive element (IRE)
présentes dans les ARN messagers (ARNm) codant des protéines de l’homéostasie du
fer, telles que la ferroportine, le TFR1, les deux chaînes de la ferritine et
DMT1 (divalent metal transporter 1). Selon la position du site
IRE sur l’ARNm, les IRP contrôlent la traduction en protéine ou la dégradation
de l’ARNm ciblé. Le second système se concentre sur l’hepcidine, une hormone
peptidique qui se lie à la ferroportine et entraîne son internalisation et sa
dégradation. Les PR, l’EPR et les cellules gliales de Müller synthétisent
l’hepcidine [10]. Son
expression est activée par deux voies de signalisation cellulaire qui sont
induites lors d’un excès de fer : la voie du récepteur de la TF 2/protéine de
l’hémochromatose (TFR2/HFE) et la voie BMP6 (bone morphogenetic
protein)/SMAD (mothers against decapentaplegic
homolog). Lorsque le taux de saturation de la TF est élevé au
niveau basolatéral de l’EPR, HFE se dissocie de TFR1 et se lie à TFR2, ce qui
active la transcription de l’hepcidine. BMP6, sécrétée par la rétine et l’EPR,
se lie, au niveau apical de l’EPR, à ses récepteurs couplés à l’hémojuveline
(HJV) afin d’activer la synthèse d’hepcidine. Les hypoxia inducible
factors (HIF)3 interviennent
également comme facteurs de transcription de certains gènes impliqués dans
l’homéostasie du fer, comme Tf, Tfr1,
Dmt1 (divalent metal transporter 1), ainsi que ceux codant
la ferroportine et la céruloplasmine. Ces facteurs se fixent sur un site
spécifique de leurs ARNm, le site hypoxia-responsive element
(HRE). L’expression et la dégradation des HIF dépendent également du fer. En
effet, le Fe2+ est un cofacteur de la prolyl-hydroxylase qui
participe à la dégradation de la sous-unité régulatrice du complexe HIF1α.
Parallèlement, HIF2α possède une séquence IRE qui, en condition d’excès de fer,
se lie à IRP1 et entraîne sa dégradation [11] (→).
(→) Voir la Synthèse de E. Gothié et J. Pouysségur, m/s
n° 1, janvier 2002, page 70
La compréhension du contrôle de l’entrée et de la sortie du fer dans la rétine
selon ses besoins métaboliques, ainsi que le rôle des dérégulations de son
homéostasie dans les maladies rétiniennes restent encore à être explorés. |
Une surcharge oculaire en fer entraîne une dégénérescence de la rétine Une accumulation de fer dans l’œil peut avoir diverses origines, héréditaires ou non,
locales ou systémiques, et entraîner des anomalies rétiniennes. Outre la sidérose et
les hémorragies sous-rétiniennes qui sont les manifestations les plus directes de la
toxicité du fer pour la rétine [12,13], les
maladies héréditaires de surcharge en fer comme les hémochromatoses ou
l’acéruloplasminémie, dues à des mutations de gènes codant les protéines de
l’homéostasie du fer, témoignent également de l’effet délétère de l’accumulation de
fer dans la rétine et l’EPR. Chez les personnes acéruloplasminémiques, qui
présentent un défaut d’exportation du fer, il a été rapporté une accumulation de fer
dans l’EPR, une décoloration jaunâtre du fond d’oeil, une atrophie de l’EPR et des
dépôts de types drusen4 sous la macula. Dans de
multiples modèles animaux, l’invalidation et la mutation de gènes codant les
protéines de l’homéostasie du fer ont montré une accumulation toxique du fer au
niveau de l’EPR et des PR, associée à des anomalies et des dégénérescences
rétiniennes (Tableau I). Les
anémies peuvent être également source de surcharge en fer secondaire, car les
traitements qui s’effectuent soit par supplémentation diététique ou systémique soit
par transfusions, s’accompagnent d’un apport important en fer. Ce dernier s’accumule
dans la rétine et l’EPR, entraînant l’apparition de dommages caractéristiques de la
dégénérescence maculaire liée à l’âge (DMLA) [14]. |
L’accumulation de fer est observée dans de nombreuses maladies oculaires L’augmentation du fer et son rôle dans les processus pathogéniques ont été rapportés
dans de nombreuses maladies oculaires. Le fer favoriserait l’agrégation de
l’α-cristalline au cours du développement de la cataracte, la toxicité du glutamate
dans le glaucome, et la synthèse de rénine dans la rétinopathie diabétique [15]. Bien que cela n’ait pas
encore été décrit chez l’homme, une accumulation du fer et un dérèglement de son
homéostasie sont également observés dans des modèles murins de rétinites
pigmentaires [16].
Récemment, nous avons montré la présence de dépôts de fer dans les rétines et l’EPR
chez des patients présentant un décollement de rétine. Chez ces patients,
l’accumulation de fer dans les liquides oculaires entraîne une saturation de la TF
qui réduit la récupération visuelle post-opératoire. Cette accumulation de fer
entraîne la nécrose rapide des PR qui est suivie d’une apoptose secondaire [17]. |
Implication du fer et de ses effecteurs dans le développement de la DMLA Localisation de l’accumulation de fer et dérégulation de son
homéostasie Les patients atteints de la DMLA précoce, de la forme sèche ou exsudative,
présentent plus de fer dans la macula que les patients sains. Des dépôts de fer
sont retrouvés dans les mélanosomes de la choroïde et de l’EPR, dans la couche
centrale de la membrane de Bruch 5
calcifiée, dans les drusen et au niveau des PR (Figure 2) [ 18]. Une partie de ce fer, retrouvé dans la
rétine pathologique des patients atteints de DMLA, est sous la forme libre
toxique. Le transcriptome de la région maculaire des patients présentant une
DMLA avec une atrophie géographique, montre une augmentation de l’expression de
protéines impliquées dans l’homéostasie du fer, telles que la TF, la ferritine
et la ferroportine, dans la couche des PR et des pieds des cellules gliales de
Müller. La TF est également observée dans les drusen, les PR réimmiscents et
dans la rétine interne. Les quantités d’ARN messagers codant la TF et la
céruloplasmine sont augmentées dans les deux formes avancées de la DMLA [ 14]. Dans le sérum des patients présentant
les différentes formes de DMLA, une augmentation significative de la TF et du
RTF1, ainsi qu’une diminution significative de la concentration en ferritine
soluble, sont observées, tandis que celle du fer est inchangée [ 19].
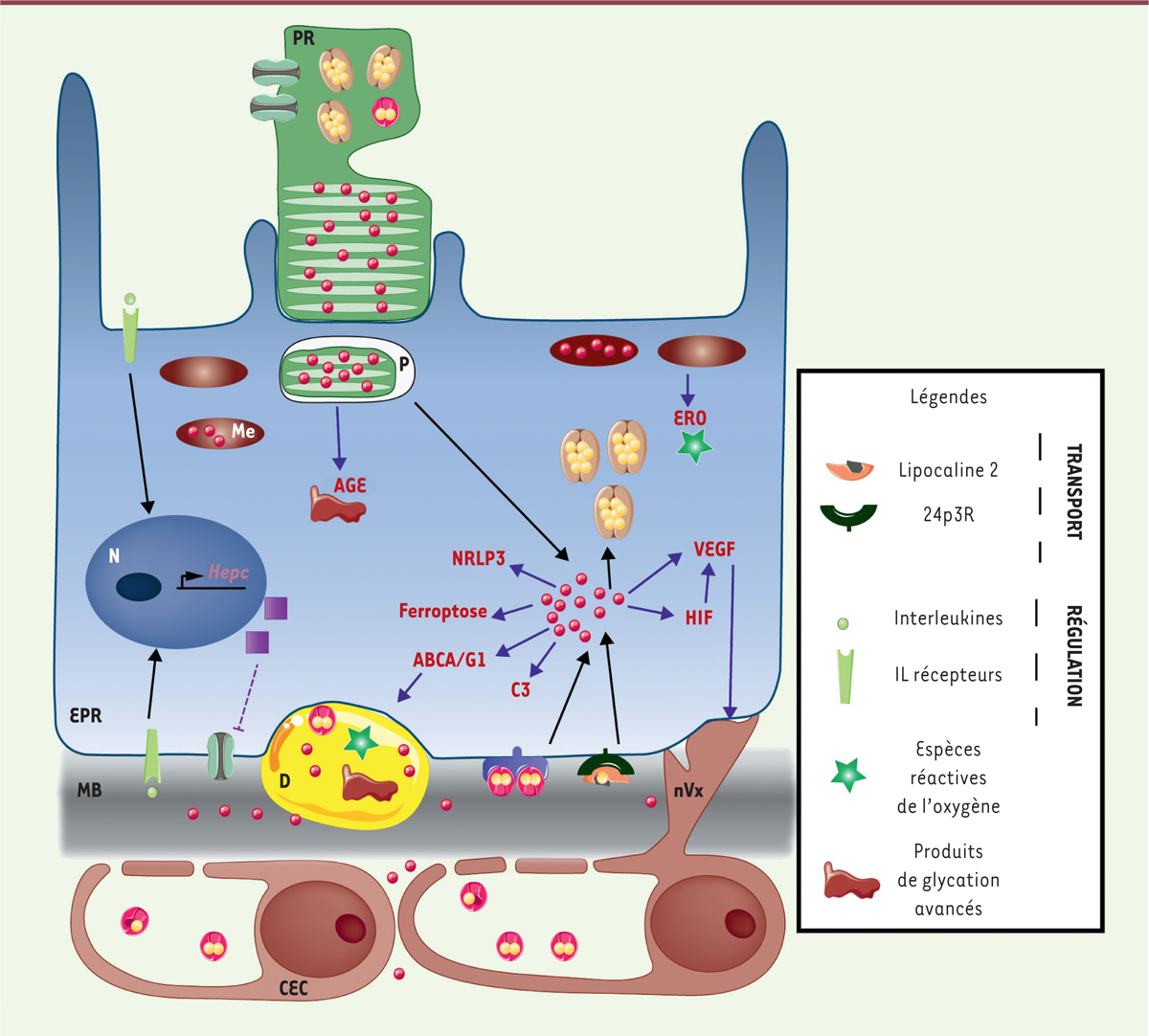
 | Figure 2.
Physiopathologie du fer au cours de la dégénérescence
maculaire liée à l’âge (DMLA) dans le complexe
photorécepteurs-épithélium pigmentaire de la
rétine. Au cours de la DMLA, il y a une accumulation de fer dans les
segments externes des photorécepteurs (PR), dans l’épithélium
pigmentaire de la rétine (EPR) essentiellement au niveau des
mélanosomes (Me), de la membrane de Bruch (MB), des drusen (D) et du
stroma des cellules endothéliales choroïdiennes (CEC). L’excès de
fer favorise l’émergence des marqueurs pathologiques de la DMLA,
stress oxydant, inflammation et angiogenèse. La formation d’espèces
réactives de l’oxygène (ERO) et de produits de glycation avancés
(AGE) ainsi que l’activation de la ferroptose induisent un
environnement pro-oxydant. La formation d’un inflammasome (NLRP3),
l’inhibition des transporteurs de cholestérol, ABCA1/ABCG1,
l’activation de la molécule du complément, C3, induisent un
environnement pro-inflammatoire. Cela entraîne la synthèse
d’interleukines (IL-6 et IL-1β) qui activent la transcription de
l’hepcidine (HEPC), diminuant l’efflux du fer de la cellule et la
synthèse de lipocaline 2 qui, via ses récepteurs
24p3R et mégaline, fait entrer du fer dans l’EPR. La synthèse du
facteur pro-angiogénique VEGF et l’induction des facteurs de
l’hypoxie (HIF) induisent un environnement favorisant la croissance
de néovaisseaux provenant de la choroïde. Me : mélanosome ; N :
noyaux ; nVx : néovaisseaux ; PR : photorécepteur. |
Plusieurs polymorphismes de gènes impliqués dans l’homéostasie du fer ont été
associés à des facteurs de risque de la DMLA : Tfr1,
Tfr2 (association modulée par l’obésité et le tabac) [20],
Dmt1 [21], Irp1 et 2 [21], ainsi que les gènes codant les hèmes
oxygénases 1 et 2 (Ho1/2) [22]. Une récente étude a démontré que le
taux de plusieurs micro-ARN (miARN), petites molécules d’ARN non codant se liant
dans la région 3’UTR des gènes, était modifié dans le sérum de patients atteints
de DMLA, notamment les miARN contrôlant la traduction des protéines TFR1 et DMT1
[23]. Lien entre la surcharge en fer dans la DMLA et sa pathogenèse Il existe de plus en plus d’évidences de l’implication du stress oxydant et de
l’inflammation dans la physiopathologie de la DMLA, et l’accumulation de fer
apparaît comme le point convergent de ces deux mécanismes (Figure 2). La mélanine est capable de lier de grandes quantités de fer, ce qui permet de
préserver l’EPR et la choroïde de l’environnement pro-oxydant généré par
l’exposition à la lumière. Mais avec l’âge, l’accumulation de fer dans les
mélanosomes, associée à une réduction de la quantité de mélanine dans l’EPR,
favorisent la formation de radicaux libres [24]. L’exposition des cellules de l’EPR à
des doses élevées non-létales de fer entraîne une diminution de l’activité
phagocytaire et lysosomale [25]. L’accumulation de produits de dégradation de la vitamine A
(lipofuscine) ainsi favorisée entraîne la formation d’AGE (les produits
terminaux de la glycation) dans les drusen, l’EPR et la membrane de Bruch chez
les patients atteints de DMLA [26]. Dans les maladies dégénératives, l’accumulation de fer induit
une ferroptose, une forme de nécrose nouvellement caractérisée, qui a été
décrite dans des cellules de l’EPR en culture soumises à un stress oxydatif
[27]. L’augmentation de la quantité de fer dans l’EPR favorise l’activation de
l’inflammasome NRLP3 (nucleotide-binding domain leucin-rich
repeat [LRR] and pyrin-containing receptor 3)
via la répression par la riboendonucléase DICER, de la
dégradation des séquences Alu ARN6 [28], la diminution de
l’expression des transporteurs ABCA1/ABCG1 (ATP-binding cassette
A1/G1), augmentant le taux de cholestérol pro-inflammatoire dans la
rétine [29], et la
synthèse du facteur du complément C3, par activation de la voie ERK/SMAD3/CEBPD
[30]
(extracellular signal-regulated kinases/mothers against
decapentaplegic homolog/CCAAT enhancer-binding protein delta), dont
les produits de clivage forment la C5 convertase qui nécessite du fer comme
cofacteur [31]. L’augmentation des réactions inflammatoires a également un effet sur le
métabolisme du fer. Les interleukines 1β et 6, dont les taux sont augmentés chez
les patients atteints de DMLA [32], activent la synthèse de l’hepcidine qui réduit l’exportation du
fer de la cellule. L’expression de la lipocaline 2 est augmentée dans les
cellules inflammatoires présentes dans la rétine et dans la choroïde de ces
patients [33]. Cette
protéine qui lie le fer par l’intermédiaire d’un sidérophore, assure son entrée
ou sa sortie via son récepteur 24p3R et la mégaline, un
récepteur endocytique multiligand [34], qui sont exprimés par l’EPR. L’augmentation du taux de fer dans la rétine pourrait également avoir un rôle
dans le développement des néovaisseaux, en inhibant l’effet anti-angiogénique de
HKA (cleaved high-molecular-weight kininogen)[35]. Cela favorise l’expression du
récepteur du succinate, le GPR91 qui stimule la production des facteurs
pro-angiogéniques, VEGF (vascular endothelial growth factor) et
angiopoïétine [36]. La physiopathologie de la DMLA favorise la mise en place d’un environnement
hypoxique et HIF est l’un des principaux médiateurs de l’adaptation cellulaire à
ces faibles niveaux d’oxygène. Dans l’EPR, l’augmentation de la ferritine
mitochondriale due à l’accumulation de fer favorise la stabilisation d’HIF et
ainsi l’activation de facteurs pro-angiogéniques (VEGF, oxyde nitrique synthase
inductible et hème oxygénase) [37]. |
Stratégie thérapeutique : chélateur chimique versus naturel Dès les années 1970, un chélateur du fer, la déferrioxamine (DFO), a été utilisé chez
l’homme pour diminuer la quantité de « rouille » déposée sur l’œil avec des
résultats satisfaisants. Dans de nombreux modèles de dégénérescence de la rétine
(rétinite pigmentaire ou exposition continue à la lumière), la DFO diminue la charge
en fer et préserve la rétine [38]. D’autres chélateurs, comme le déferriprone, ont montré une
protection significative de la rétine chez des souris dont les mécanismes de
l’homéostasie du fer sont altérés. Ces chélateurs chimiques sont surtout utilisés
chez l’homme pour traiter les hémosidéroses induites par les transfusions
fréquentes. Administrés par voie orale, subcutanée ou intramusculaire, ils sont
néanmoins à l’origine d’un certain nombre de dommages oculaires qui peuvent aller
jusqu’à une détérioration oculaire permanente chez le patient. L’effet toxique
secondaire sur la vision de ces chélateurs provient, sans doute, du fait qu’ils
captent indifféremment le fer en excès de celui qui est nécessaire au fonctionnement
de l’EPR et des PR [14]. Comme le souligne
une revue récente [39],
l’usage de chélateurs chimiques est délicate car pour agir, il est nécessaire 1)
qu’ils ciblent uniquement l’organe ou le tissu qui est atteint par l’excès de fer ;
2) qu’ils présentent une demi-vie suffisante ; 3) qu’ils traversent les différentes
barrières qui entourent le tissu ; et 4) qu’ils soient éliminés rapidement. Des biomolécules généralement issues de plantes, comme le curcumin, les polyphénols
ou les flavonoïdes, sont des chélateurs du fer et ont montré une efficacité dans des
modèles murins de dégénérescences rétiniennes [40, 41]. |
La transferrine : un candidat idéal pour réguler l’homéostasie du fer de la
rétine La TF fait partie de la superfamille des transferrines, qui comprend également la
lactoferrine, la mélanotransferrine et l’ovotransferrine, qui sont retrouvées dans
de nombreuses espèces, aussi bien de mammifères que d’invertébrés. Elle est
constituée de deux lobes chacun liant un atome de fer ferrique (Fe3+)
avec une très grande affinité. Son principal rôle est de maintenir un environnement
exempt de fer libre. La TF est synthétisée par l’EPR, les cellules gliales de
Müller, les PR, et est présente dans l’humeur aqueuse et le corps vitré. Son
expression est amplifiée au cours des réactions inflammatoires ou lors d’une réponse
immunitaire pour augmenter la capacité de séquestration en fer. Un intérêt
thérapeutique a été depuis longtemps attribué à la TF en raison de son pouvoir
anti-microbien et du fait de la présence ubiquitaire de son récepteur TFR1 qui
favorise la pénétration de molécules thérapeutiques qui l’utilisent pour traverser
la barrière hémato-encéphalique. La TF a également été utilisée avec succès chez
l’homme dans des maladies du métabolisme du fer et pour sa capacité cytoprotectrice
[42]. Notre laboratoire s’est intéressé au potentiel de la TF pour le traitement de
maladies rétiniennes. L’administration de la forme sans fer de la TF (apoTF) par
injections intrapéritonéales à des souris rd10, un modèle de rétinite
pigmentaire7,, préserve les PR mieux que
d’autres chélateurs ou anti-oxydants [16].
Injectée dans le corps vitré, elle se retrouve dans l’ensemble de la rétine neurale
(cellules gliales de Müller) et est éliminée, via ses récepteurs,
par l’EPR et la choroïde sans effet immunogénique ni toxique pour la rétine. Dans un
modèle de dégénérescence induite par la lumière, son administration locale permet le
rétablissement de l’homéostasie du fer, la diminution de la réaction inflammatoire,
la réduction de la mort par apoptose, permettant de préserver les PR et de conserver
la fonction visuelle [43]. Dans un modèle
ex vivo de décollement de rétine, la TF stoppe les processus
dégénératifs, qui sont activés par le décollement et l’excès de fer, en réduisant la
nécrose, l’apoptose, la gliose et le stress oxydatif. In vivo, la
TF injectée au moment du décollement réduit l’œdème de la rétine, la mort cellulaire
et préserve les PR. Outre sa capacité à réduire l’accumulation de fer dans la rétine
suite au décollement, la TF agit également sur d’autres voies cellulaires,
probablement en interagissant avec des partenaires moléculaires qui restent à
découvrir [17]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1.
Beaumont
C. Mécanismes
moléculaires de l’homéostasie du fer . Med Sci
(Paris).
2004; ; 20 :
:68.–72. 2.
De Jong
PTVM. A historical
analysis of the quest for the origins of aging macula disorder, the tissues
involved, and its terminology-supplementary issue: ophthalmic
history . Ophthalmol Eye Dis.
2016;; 8s1 :
:OED.S40523.. 3.
Picard
E,
Daruich
A,
Youale
J, et al. From rust
to quantum biology: the role of iron in retina
physiopathology . Cells.
2020; :9.. 4.
Ugarte
M
, Osborne
NN
, Brown
LA
, et al.
Iron, zinc, and copper in retinal physiology and
disease . Surv Ophthalmol.
2013; ; 58 :
:585.–609. 5.
Lim
S
, Scholten
A
, Manchala
G
, et al.
Structural characterization of ferrous Ion binding to retinal
guanylate cyclase activator protein 5 from zebrafish
photoreceptors . Biochemistry.
2017; ; 56 :
:6652.–6661. 6.
Biesemeier
A
, Gouras
P
. Novel organelles in primate retinal
epithelium . Micron.
2016; ; 89 :
:56.–59. 7.
Yefimova
MG
, Jeanny
JC
, Guillonneau
X
, et al.
Iron, ferritin, transferrin, and transferrin receptor in the
adult rat retina . Invest Ophthalmol Vis Sci.
2000; ; 41 :
:2343.–2351. 8.
Moos
T
, Bernth
N
, Courtois
Y
, et al.
Developmental iron uptake and axonal transport in the retina of
the rat . Mol Cell Neurosci.
2011; ; 46 :
:607.–613. 9.
Perez Bay
AE
, Schreiner
R
, Benedicto
I
, et al.
Galectin-4-mediated transcytosis of transferrin
receptor . J Cell Sci.
2014; ; 127 :
:4457.–4469. 10.
Hadziahmetovic
M
, Song
Y
, Ponnuru
P
, et al.
Age-dependent retinal iron accumulation and degeneration in
hepcidin knockout mice . Invest Ophthalmol Vis
Sci.
2011; ; 52 :
:109.–118. 11.
Gothié
E
, Pouysségur
J
. HIF-1: régulateur central de
l’hypoxie . Med Sci (Paris).
2002; ; 18 :
:70.–78. 12.
Xie
H
, Chen
S
. Ocular siderosis . Eye
Sci.
2013; ; 28 :
:108.–112. 13.
Gillies
A
, Lahav
M
. Absorption of retinal and subretinal
hemorrhages . Ann Ophthalmol.
1983; ; 15 :
:1068.–1074. 14.
Shu
W,
Dunaief
JL. Potential
treatment of retinal diseases with iron chelators .
Pharm Basel Switz.
2018; :11.. 15.
Loh
A
, Hadziahmetovic
M
, Dunaief
JL
. Iron homeostasis and eye disease .
Biochim Biophys Acta.
2009; ; 1790 :
:637.–649. 16.
Picard
E
, Jonet
L
, Sergeant
C
, et al.
Overexpressed or intraperitoneally injected human transferrin
prevents photoreceptor degeneration in rd10 mice .
Mol Vis.
2010; ; 16 :
:2612.–2625. 17.
Daruich
A, Le
Rouzic
Q,
Jonet
L, et al. Iron is
neurotoxic in retinal detachment and transferrin confers
neuroprotection . Sci Adv.
2019;; 5 :
:eaau9940.. 18.
Biesemeier
A
, Yoeruek
E
, Eibl
O
, et al.
Iron accumulation in Bruch’s membrane and melanosomes of donor
eyes with age-related macular degeneration . Exp Eye
Res.
2015; ; 137 :
:39.–49. 19.
Čolak
E,
Žorić
L,
Radosavljević
A, et al. The
association of serum iron-binding proteins and the antioxidant parameter
levels in age-related macular degeneration . Curr Eye
Res.
2018;; 43 :
:659.–65. 20.
Wysokinski
D
, Danisz
K
, Pawlowska
E
, et al.
Transferrin receptor levels and polymorphism of its gene in
age-related macular degeneration . Acta Biochim
Pol.
2015; ; 62 :
:177.–184. 21.
Synowiec
E
, Pogorzelska
M
, Blasiak
J
, et al.
Genetic polymorphism of the iron-regulatory protein-1 and -2
genes in age-related macular degeneration . Mol Biol
Rep.
2012; ; 39 :
:7077.–7087. 22.
Synowiec
E
, Szaflik
J
, Chmielewska
M
, et al.
An association between polymorphism of the heme oxygenase-1 and
-2 genes and age-related macular degeneration . Mol
Biol Rep.
2012; ; 39 :
:2081.–2087. 23.
Szemraj
M
, Oszajca
K
, Szemraj
J
, et al.
MicroRNA expression analysis in serum of patients with congenital
hemochromatosis and age-related macular degeneration (AMD) .
Med Sci Monit.
2017; ; 23 :
:4050.–4060. 24.
Różanowski
B,
Burke
JM,
Boulton
ME, et al. Human RPE
melanosomes protect from photosensitized and iron-mediated oxidation but
become pro-oxidant in the presence of iron upon
photodegradation . Invest Ophthalmol Vis Sci.
2008;; 49 :
:2838.–47. 25.
Chen
H
, Lukas
TJ
, Du
N
, et al.
Dysfunction of the retinal pigment epithelium with age: increased
iron decreases phagocytosis and lysosomal activity .
Invest Ophthalmol Vis Sci.
2009; ; 50 :
:1895.–1902. 26.
Ueda
K
, Kim
HJ
, Zhao
J
, et al.
Iron promotes oxidative cell death caused by bisretinoids of
retina . Proc Natl Acad Sci USA.
2018; ; 115 :
:4963.–4968. 27.
Totsuka
K
, Ueta
T
, Uchida
T
, et al.
Oxidative stress induces ferroptotic cell death in retinal
pigment epithelial cells . Exp Eye Res.
2019; ; 181 :
:316.–324. 28.
Gelfand
BD
, Wright
CB
, Kim
Y
, et al.
Iron toxicity in the retina requires alu RNA and the NLRP3
inflammasome . Cell Rep.
2015; ; 11 :
:1686.–1693. 29.
Ananth
S
, Gnana-Prakasam
JP
, Bhutia
YD
, et al.
Regulation of the cholesterol efflux transporters ABCA1 and ABCG1
in retina in hemochromatosis and by the endogenous siderophore
2,5-dihydroxybenzoic acid . Biochim Biophys Acta -
Mol Basis Dis.
2014; ; 1842 :
:603.–612. 30.
Li
Y
, Song
D
, Song
Y
, et al.
Iron-induced local complement component 3 (C3) up-regulation via
non-canonical transforming growth factor (TGF)-beta signaling in the retinal
pigment epithelium . J Biol Chem.
2015; ; 290 :
:11918.–11934. 31.
Vogi
W
, Nolte
R
, Brunahl
D
. Binding of iron to the 5th component
of human complement directs oxygen radical-mediated conversion to specific
sites and causes nonenzymic activation . Complement
Inflamm.
1991; ; 8 :
:313.–319. 32.
Ambati
J
, Atkinson
JP
, Gelfand
BD
. Immunology of age-related macular
degeneration . Nat Rev Immunol.
2013; ; 13 :
:438.–451. 33.
Ghosh
S
, Shang
P
, Yazdankhah
M
, et al.
Activating the AKT2-nuclear factor-κB-lipocalin-2 axis elicits an
inflammatory response in age-related macular degeneration: Lipocalin-2 as an
indicator of early AMD . J Pathol.
2017; ; 241 :
:583.–588. 34.
Schmidt-Ott
KM
, Mori
K
, Li
JY
, et al.
Dual action of neutrophil gelatinase-associated
lipocalin . J Am Soc Nephrol.
2007; ; 18 :
:407.–413. 35.
Coffman
LG
, Brown
JC
, Johnson
DA
, et al.
Cleavage of high-molecular-weight kininogen by elastase and
tryptase is inhibited by ferritin . Am J Physiol Lung
Cell Mol Physiol.
2008; ; 294 :
:L505.–L515. 36.
Gnana-Prakasam
JP
, Ananth
S
, Prasad
PD
, et al.
Expression and iron-dependent regulation of succinate receptor
GPR91 in retinal pigment epithelium . Invest
Ophthalmol Vis Sci.
2011; ; 52 :
:3751.–3758. 37.
Goralska
M
, Ferrell
J
, Harned
J
, et al.
Iron metabolism in the eye: a review . Exp
Eye Res.
2009; ; 88 :
:204.–215. 38.
Li
ZL
, Lam
S
, Tso
MO
. Desferrioxamine ameliorates retinal photic injury
in albino rats . Curr Eye Res.
1991; ; 10 :
:133.–144. 39.
Mobarra
N
, Shanaki
M
, Ehteram
H
, et al.
A review on iron chelators in treatment of iron overload
syndromes . Int J Hematol Oncol Stem Cell
Res.
2016; ; 10 :
:239.–247. 40.
Farajipour
H
, Rahimian
S
, Taghizadeh
M
. Curcumin: a new candidate for retinal disease
therapy? . J Cell Biochem.
2018 ; 10.1002/jcb.2806841.
Majumdar
S
, Srirangam
R
. Potential of the bioflavonoids in the
prevention/treatment of ocular disorders . J Pharm
Pharmacol.
2010; ; 62 :
:951.–965. 42.
Gomme
PT
, McCann
KB
, Bertolini
J
. Transferrin: structure, function and potential
therapeutic actions . Drug Discov Today.
2005; ; 10 :
:267.–273. 43.
Picard
E
, Le Rouzic
Q
, Oudar
A
, et al.
Targeting iron-mediated retinal degeneration by local delivery of
transferrin . Free Radic Biol Med.
2015; ; 89 :
:1105.–1121. 44.
Lederman
M
, Obolensky
A
, Grunin
M
, et al.
Retinal function and structure in the hypotransferrinemic
mouse . Investig Opthalmology Vis Sci.
2012; ; 53 : :605.. 45.
Baksi
S
, Singh
N
. α-Synuclein impairs ferritinophagy in the retinal
pigment epithelium: Implications for retinal iron dyshomeostasis in
Parkinson’s disease . Sci Rep.
2017; ; 7 : :12843.. 46.
Cases
O
, Joseph
A
, Obry
A
, et al.
Foxg1-Cre mediated Lrp2 inactivation in the developing mouse
neural retina, ciliary and retinal pigment epithelia models congenital high
myopia . PLoS One.
2015; ; 10 :
:e0129518.. 47.
Theurl
M
, Song
D
, Clark
E
, et al.
Mice with hepcidin-resistant ferroportin accumulate iron in the
retina . FASEB J.
2016; ; 30 :
:813.–823. 48.
Wolkow
N
, Song
Y
, Wu
TD
, et al.
Aceruloplasminemia: retinal histopathologic manifestations and
iron-mediated melanosome degradation . Arch
Ophthalmol.
2011; ; 129 :
:1466.–1474. 49.
Wolkow
N
, Song
D
, Song
Y
, et al.
Ferroxidase hephaestin’s cell-autonomous role in the retinal
pigment epithelium . Am J Pathol.
2012; ; 180 :
:1614.–1624. 50.
He
X
, Hahn
P
, Iacovelli
J
, et al.
Iron homeostasis and toxicity in retinal
degeneration . Prog Retin Eye Res.
2007; ; 26 :
:649.–673. 51.
Dinet
V
, An
N
, Ciccotosto
GD
, et al.
APP involvement in retinogenesis of mice .
Acta Neuropathol.
2011; ; 121 :
:351.–363. 52.
Sterling
J
, Guttha
S
, Song
Y
, et al.
Iron importers Zip8 and Zip14 are expressed in retina and
regulated by retinal iron levels . Exp Eye
Res.
2017; ; 155 :
:15.–23. 53.
Picard
E
, Ranchon-Cole
I
, Jonet
L
, et al.
Light-induced retinal degeneration correlates with changes in
iron metabolism gene expression, ferritin level, and aging .
Invest Ophthalmol Vis Sci.
2011; ; 52 :
:1261.–1274. 54.
Gnana-Prakasam
JP
, Thangaraju
M
, Liu
K
, et al.
Absence of iron-regulatory protein Hfe results in
hyperproliferation of retinal pigment epithelium: role of cystine/glutamate
exchanger . Biochem J.
2009; ; 424 :
:243.–252. 55.
Martin
PM
, Gnana-Prakasam
JP
, Roon
P
, et al.
Expression and polarized localization of the hemochromatosis gene
product HFE in retinal pigment epithelium . Invest
Ophthalmol Vis Sci.
2006; ; 47 :
:4238.–4244. 56.
Hadziahmetovic
M
, Song
Y
, Wolkow
N
, et al.
Bmp6 regulates retinal iron homeostasis and has altered
expression in age-related macular degeneration . Am J
Pathol.
2011; ; 179 :
:335.–348. 57.
Tawfik
A
, Gnana-Prakasam
JP
, Smith
SB
, et al.
Deletion of hemojuvelin, an iron-regulatory protein, in mice
results in abnormal angiogenesis and vasculogenesis in retina along with
reactive gliosis . Invest Ophthalmol Vis Sci.
2014; ; 55 :
:3616.–3625. 58.
Gnana-Prakasam
JP
, Baldowski
RB
, Ananth
S
, et al.
Retinal expression of the serine protease matriptase-2 (Tmprss6)
and its role in retinal iron homeostasis . Mol
Vis.
2014; ; 20 :
:561.–574. 59.
Kast
B
, Schori
C
, Grimm
C
. Hypoxic preconditioning protects photoreceptors
against light damage independently of hypoxia inducible transcription
factors in rods . Exp Eye Res.
2016; ; 146 :
:60.–71. |