| |
| Med Sci (Paris). 36(6-7): 607–615. doi: 10.1051/medsci/2020095.La thérapie génique des rétinites pigmentaires
héréditaires Jean-Baptiste Ducloyer,1,2* Guylène Le Meur,1,2 Thérèse Cronin,2 Oumeya Adjali,2 and Michel Weber1,2 1Centre hospitalier universitaire de Nantes, Nantes Université,
service d’ophtalmologie, 1 place Alexis Ricordeau, 44093Nantes,
France 2Inserm UMR 1089, thérapie génique translationnelle des maladies
génétiques, IRS 2 - Nantes Biotech, 22 boulevard Benoni Goullin,
44200Nantes,
France |

Vignette (Photo © Inserm - Marion Vincent). La rétine est le tissu neurosensoriel tapissant le fond de l’œil. La transformation du
signal lumineux en un signal électrique est un processus complexe mettant en jeux de
nombreux types cellulaires rétiniens (Figure
1). Le photorécepteur, activé par l’influx lumineux, transmet
l’information visuelle aux cellules bipolaires qui intègrent le signal, avant de le
transmettre aux cellules ganglionnaires, dont les axones constituent le nerf optique.
Deux types de photorécepteurs co-existent : les bâtonnets, disséminées sur tout le fond
de l’œil, assurent la vision périphérique. Leur seuil d’activation permet la vision en
basse luminosité ; les cônes, concentrés dans la macula, assurent l’acuité visuelle, la
stéréoscopie et la vision des couleurs. Situé entre les photorécepteurs et la choroïde,
l’épithélium pigmentaire (EP) est une couche monocellulaire en contact étroit avec les
segments externes des photorécepteurs via leurs microvillosités. L’EP
joue un rôle de barrière hémato-rétinienne, de nutrition et de régénération des
photorécepteurs, et dans le renouvellement du 11-cis retinal1 (étape indispensable du cycle visuel).
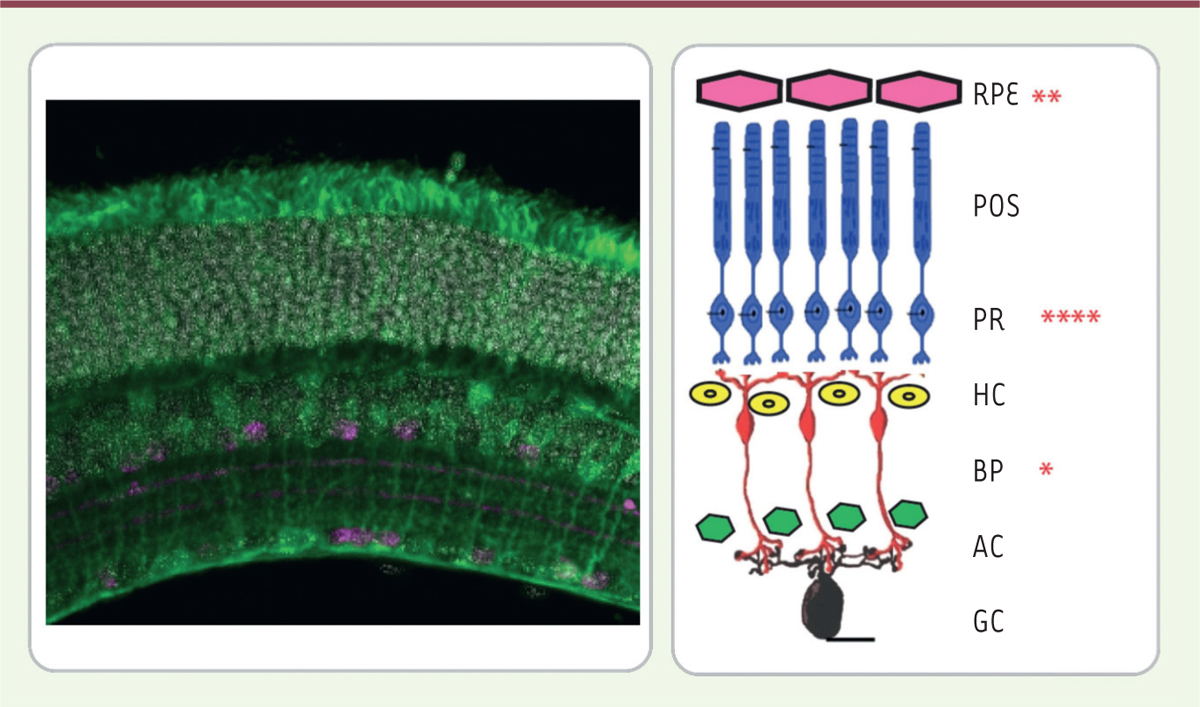
 | Figure 1. Structure de la rétine en microscopie
confocale. RPE : épithélium pigmentaire ; POS : segment
externe des photorécepteurs ; PR : corps cellulaires des photorécepteurs ;
HC : cellules horizontales ; BP : cellules bipolaires ; AC : cellules
amacrines ; GC : cellules ganglionnaires. |
|
Les rétinites pigmentaires Les rétinites pigmentaires (RP) sont des maladies rétiniennes dégénératives
héréditaires qui constituent un ensemble génétiquement hétérogène impliquant plus de
90 gènes2. Elles affectent 1 personne sur 4 000
dans le monde. Elles sont sporadiques dans 30 % des cas et se transmettent le plus
souvent de façon autosomique récessive (dans 50-60 % des cas), parfois autosomique
dominante (30 à 40 % des cas) ou rarement liée à l’X (5 à 15 % des cas) [1]. Les mutations altèrent le
plus souvent les photorécepteurs, parfois les cellules de l’EP. Elles mènent toutes,
à plus ou moins long terme, à la destruction des deux types cellulaires et à la
perte de la fonction visuelle. La baisse de vision se manifeste en général à l’âge
adulte par une héméralopie3, puis une baisse du
champ visuel périphérique (due à la perte des bâtonnets), et tardivement, par une
baisse de l’acuité visuelle et de la vision des couleurs (due à la perte des cônes)
: c’est la forme habituelle de RP de l’adulte ou « rod-cone » (pour
bâtonnet et cône). L’atteinte dans l’ordre inverse, « cone-rod »,
est plus rare. Si l’atteinte est très précoce, elle altère le développement visuel
du nourrisson et se manifeste par une malvoyance et un nystagmus4, dans les six premiers mois de vie : on parle alors
d’amaurose5 congénitale de Leber (ACL). Il
existe cependant un continuum entre ces deux phénotypes, car des enfants peuvent
présenter une forme intermédiaire entre l’ACL et la RP de l’adulte : c’est la
early onset severe retinal dystrophy (EOSRD). L’atteinte est
uniquement oculaire dans 80 % des cas, mais elle peut aussi s’intégrer dans un
ensemble syndromique (ciliopathies, dont les syndromes d’Usher, ou certaines
maladies métaboliques). Ces mladies sont cécitantes et aucun traitement
pharmacologique n’est actuellement disponible pour les guérir ou même stopper leur
évolution. |
Les principes de la thérapie génique La thérapie génique est une stratégie innovante particulièrement intéressante dans
les RP. Elle vise à restaurer la fonction moléculaire déficiente en transférant dans
les cellules cibles un gène thérapeutique. L’apport du gène peut suivre plusieurs
stratégies distinctes : supplémentation, correction, inactivation, inactivation et
supplémentation, compensation. La supplémentation (apport du gène défaillant) est
particulièrement adaptée pour les maladies à transmission récessive. La correction
et l’inactivation d’un gène pathogène est plus pertinente en cas de maladie à
transmission dominante. La compensation correspond, quant à elle, à l’apport d’un
gène différent de celui qui est déficient afin de compenser la perte fonctionnelle.
Cette approche est particulièrement adaptée si le gène malade n’est pas connu ou si
la maladie est à un stade avancé. En effet, le transfert de gènes thérapeutiques n’a
de sens que si les cellules ciblées sont encore présentes et fonctionnelles dans
l’organe concerné. Dans le cas des RP à un stade avancé, où les photorécepteurs et
les cellules de l’EP ont dégénéré, la supplémentation n’aura pas d’effet.
L’optogénétique est une approche de compensation dont l’objectif est de faire
exprimer par d’autres cellules rétiniennes (cellules bipolaires, cellules
ganglionnaires, cônes dormants) des protéines photosensibles à même de restaurer la
transduction du signal lumineux en signal électrique. À ce jour, la preuve du
concept a été obtenue chez l’animal, et deux études de phase I/II chez l’homme sont
en cours [2]. Une autre
approche compensatrice consiste à reprogrammer des cellules gliales de la rétine
afin de stimuler la régénération rétinienne [3]. |
L’œil, un organe cible idéal pour la thérapie génique De petite taille, l’œil peut être traité par de fortes concentrations de vecteurs
délivrées dans un petit volume. Clos et isolé du reste de l’organisme par la
barrière hémato-rétinienne, l’œil est un organe immuno-privilégié, ce qui permet de
limiter la dissémination du vecteur et la réaction immunitaire qu’il pourrait
induire. Constituée de cellules post-mitotiques (i.e. ne se
divisant pas), la rétine permet une expression du gène sur le long terme sans risque
d’intégration accidentelle mutagène en cas de division cellulaire [4] (→).
(→) Voir la Synthèse de A. Rossi et A. Salvetti, m/s n° 2,
février 2016, page 167
La transparence des milieux qui l’entourent rend la rétine accessible à de multiples
examens fonctionnels et d’imagerie non invasive, et permet de suivre la
dissémination et l’activité du gène transduit. L’atteinte bilatérale et relativement
symétrique des RP permet de traiter un seul œil et de le comparer à l’autre œil, qui
sert alors de contrôle. La rétine est facilement accessible chirurgicalement par
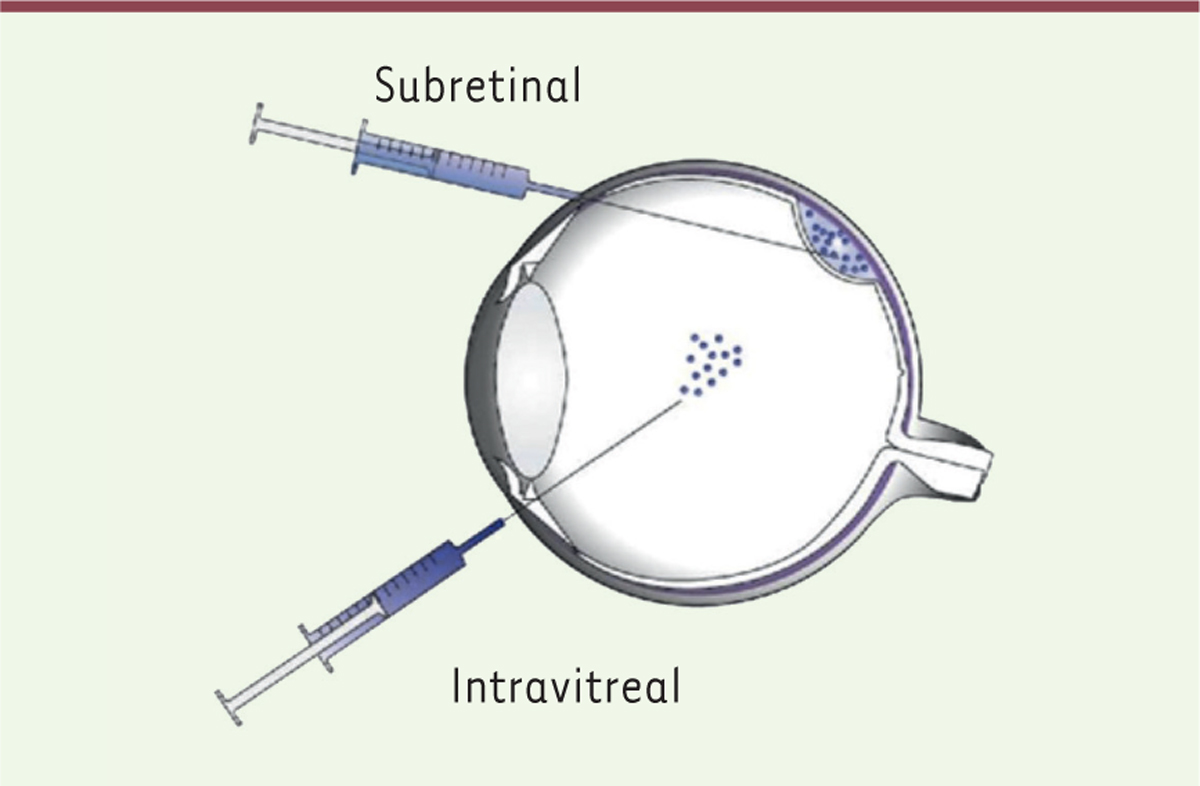
voie intra-vitréenne ou sous-rétinienne (Figure 2). L’injection sous-rétinienne par voie de
vitrectomie6 est une procédure chirurgicale
à risque. Elle est cependant préférée actuellement à la voie intra-vitréenne car la
transduction du gène thérapeutique y est beaucoup plus efficace [5]. Si l’apport du gène thérapeutique
peut s’effectuer ex vivo, (des cellules du patient sont prélevées,
modifiées in vitro, puis réinjectées dans l’organe cible), la
stratégie in vivo (injection du gène directement dans l’organe
cible) est privilégiée en ophtalmologie.
 | Figure 2. Voies d’injection du vecteur : sous-rétinienne ou intra-vitréenne. |
|
Pour atteindre la cellule cible, le gène thérapeutique nécessite un véhicule : le
vecteur. Les vecteurs non viraux synthétiques sont faciles à produire. Ils peuvent
transporter des séquences d’ADN de grande taille et présentent peu de risques de
pathogénicité. Malheureusement, leur efficacité in vivo reste
faible [6]
(→).
(→) Voir le Dossier technique de H. Khabou et D. Dalkara, m/s
n° 5, mai 2015, page 529
Les vecteurs viraux sont par contre beaucoup plus efficaces pour acheminer l’ADN dans
le noyau de cellules hôtes. Pour être efficace et sûr, le « bon vecteur » nécessite
d’être non pathogène, non réplicatif, non immunogène et non intégratif, pour éviter
le risque de mutagenèse. Il doit cibler spécifiquement le type cellulaire désiré et
permettre une expression du gène sur le long cours. Pour obtenir le profil souhaité
en fonction de la maladie et de la cellule cible, il est possible de faire varier de
multiples paramètres : la famille du virus utilisé (herpès, adénovirus, lentivirus),
son sérotype, sa capside, le promoteur du gène thérapeutique qu’il transporte.
Actuellement les virus adéno-associés (AAV) sont les vecteurs les plus utilisés pour
le traitement des maladies rétiniennes. Leur principal défaut est la taille
relativement petite de la cassette d’expression qu’ils sont capables de transporter
et qui ne permet de vectoriser qu’un gène de taille restreinte. Les lentivirus
d’origine équine leur sont parfois préférés, du fait de leur capacité de transport
plus importante [6]. D’autres facteurs entrent
également en compte pour optimiser le transfert du gène : le volume de liquide
injecté, la concentration virale, la voie d’injection, le site d’injection (rétine
saine ou dégénérée), le stade évolutif de la maladie et la gestion de la fenêtre
thérapeutique. |
Intérêts et limites des modèles animaux L’utilisation de modèles animaux est un prérequis, en fonction de leur disponibilité.
Des modèles animaux, sauvages ou mutés, sont disponibles pour de nombreuses
mutations responsables de RP. Les rats et les souris sont très utilisés en première
intention, pour des raisons pratiques et financières. Malheureusement, le faible
ratio cônes/bâtonnets, l’absence de macula et des différences dans la transduction
limitent la pertinence de ces modèles. Le recours à des grands animaux, tels que le
chien et surtout les primates non humains, est nécessaire pour confirmer
l’efficacité et la sécurité du traitement avant d’envisager des essais cliniques
chez l’homme. |
Les études cliniques actuelles sont le plus souvent fondées sur une approche
(supplémentation et/ou inactivation) qui dépend du gène en cause. Nous présentons
ici les résultats des études liées au gène RPE65, seul gène pour
lequel un médicament est disponible. Nous citerons ensuite les avancées réalisées
pour d’autres gènes (Tableau
I).
Tableau I.
| Stratégie |
Maladie |
Gène ciblé |
Vecteur et voie d’injection |
Phase |
Centres |
Références |
| |
|
|
rAAV2/2, SR |
Phase IV, NCT03602820,
NCT00999609 |
Étude Internatio-nale |
[28] |
| |
|
RPE65 |
rAAV2/5, SR |
Phase I/II, NCT02946879 |
Royaume-Uni |
|
| |
|
|
rAAV2/2, SR |
Phase I/II, NCT00643747 |
Royaume-Uni |
|
| |
|
|
rAAV2/4-hRPE65, SR |
Phase I/II, NCT01496040 |
France |
[14] |
| |
|
PDE6A |
rAAV2/8 SR |
fondamentale* |
États-Unis, Allemagne |
[29,30] |
| |
|
PDE6β |
rAAV2/5 SR |
Phase I/II, NCT03328130 |
France |
[31] |
| Supplémentation |
ACL, RP autosomique récessive |
RDH12 |
rAAV2/5, SR scAAV2/8, SR |
fondamentale fondamentale |
Royaume-Uni États-Unis |
[32] [33] |
| |
|
RLBP1 |
rAAV-CPK850, SR |
Phase I NCT03374657 |
Suède |
|
| |
|
Gucy2d |
rAAV2/5, SR |
fondamentale |
États-Unis |
[34] |
| |
|
SPATA7 |
rAAV2/8(Y733F), SR |
fondamentale |
États-Unis |
[35] |
| |
|
Cep290 domains |
rAAV2/8, SR |
fondamentale |
États-Unis |
[36,37] |
| |
|
anti-CEP290(AON) |
rAAV2/9, SR |
fondamentale |
Pays-Bas |
[38] |
| |
|
MERTK |
rAAV2/2, SR |
Phase I NCT01482195 |
Arabie Saoudite |
[39] |
| |
|
Mfrp |
rAAV2/8, SR |
fondamentale |
États-Unis |
[40] |
| |
Syndrome d’Usher de type III |
Clrn1 |
scAAV2quadYF, SR |
fondamentale |
États-Unis, Allemagne |
[41] |
| |
|
|
rAAV2/8 SR |
Phase I/II/III, NCT03116113 |
États-Unis, Royaume-Uni |
|
| Supplémentation |
RP liée à l’X |
RPGR |
rAAV/2 SR − |
Phase I/II, NCT03252847 Phase I/II,
NCT03316560 |
États-Unis, Royaume-Uni
États-Unis |
|
| |
|
|
rAAV2tYF SR, rrAAV2/5, SR |
étude canine |
États-Unis, Royaume-Uni |
[42-45] |
| |
|
shRNA |
scAAV2/5, SR |
étude canine |
États-Unis |
[46] |
| |
RP autosomique dominante |
ZF6-DB |
rAAV2/8, SR |
étude porcine |
Italie |
[47] |
| Inactivation |
|
klf15 |
rAAV2/8, SR |
étude porcine |
Italie |
[48] |
| |
RP inverse « cone-rod » |
S.aureus Cas9 |
− |
étude chez le pri-mate non humain |
États-Unis |
[49] |
| Inactivation et Supplémentation |
RP autosomique dominante |
Rhodopsine (RhoNOVA) |
rAAV2/5, SR |
fondamentale |
États-Unis, Irlande |
[50] |
| Protection |
RP |
STC-1 RdCVF |
rAAV2-tripleYF, IV rAAV92YF, SR |
fondamentale fondamentale |
États-Unis France |
[51] [52] |
| |
|
β-catenin, Otx2, Crx, et
Nrl |
rAAVShH10, IV |
fondamentale |
États-Unis |
[53,54] |
| |
|
Canaux rhodopsine CATCH |
rAAV2.7m8, rAA-V8BP2, SR |
NCT03326336 |
Suisse, France |
[55,56] |
| Reprogrammation |
RP |
Canaux rhodopsine chrim-sonR |
rAAV2/2, IV |
Phase I, NCT03326336 |
États-Unis |
[57] |
| |
|
JAWS |
rAAV2.7m8, SR, IV |
étude chez le pri-mate non humain |
France |
[58] |
Avancées actuelles des recherches en thérapie génique pour
les rétinites pigmentaires, en fonction du gène
causal. Publications ou essais cliniques de moins de
5 ans ou dernière etude publiée dans le domaine. ACL : amaurose
congénitale de Leber ; IV : injection intra-vitréenne ; RP : rétinite
pigmentaire ; SR : injection sous-rétinienne. * : réalisé chez le rat ou
autres petits animaux. |
|
Amaurose congénitale de Leber et RPE65 Le gène RPE65 (retinal pigment epithelium-specific
65) code une rétinoïde isomérohydrolase de 65 kDa. Exprimée dans les
cellules de l’EP, elle est indispensable au cycle de la transduction du signal
visuel en régénérant le 11-cis rétinal après exposition lumineuse. La mutation
bi-allélique de ce gène est responsable de 6 à 16 % des ACL, mais aussi de certaines
EOSRD et RP de l’adulte [7].
Cette forme génétique est un bon candidat car, malgré une baisse sévère de la vision
dès le jeune âge, les cellules rétiniennes sont encore relativement préservées
[8]. Les études
précliniques utilisant l’injection sous-rétinienne du gène thérapeutique
RPE65 dans un vecteur AAV ont été réalisées chez la souris,
puis dans un modèle de chien Briard dépourvu d’expression du gène
(RPE65
-/-). Ces études ont démontré l’amélioration des réponses rétiniennes à
l’électrorétinogramme et de la fonction visuelle grâce à des tests comportementaux
[9-12]. Plusieurs études de phase I/II ont
établi la sécurité de la transduction du gène RPE65 thérapeutique
et ont révélé une amélioration visuelle chez les patients [13-16]. En 2017, Russel et al. ont publié les
résultats d’une étude de phase III, incluant des patients présentant une mutation
bi-allélique du gène RPE65 [17]. C’était la première étude randomisée portant sur une
thérapie génique en ophtalmologie. Vingt patients ont reçu une injection
sous-rétinienne bilatérale de 0,3 ml d’un vecteur AAV2 contenant le gène
thérapeutique RPE65 (voretigene neparvovec, ou
Luxturna®). Ces 20 patients ont présenté une amélioration modérée mais
significative du test de mobilité (critère de jugement principal) par rapport aux
neuf patients témoins. Cette amélioration a été observée dès le trentième jour après
l’injection dans le deuxième œil et est restée stable pendant un suivi de un an. À
un an, 65 % des patients injectés ont réussi le test de mobilité à la plus faible
luminosité (1 Lux), contre aucun dans le groupe témoin. Suite à cette étude, la
food and drug administration (FDA) et la European
medicines agency (EMA) ont donné leur accord pour la commercialisation
du Luxturna® (Spark Therapeutics Inc.). Il est
actuellement commercialisé aux États-Unis, au prix de 850 000 dollars (environ 765
000 euros) pour les deux yeux. En France, ce produit est pris en charge par
l’Assurance maladie et plusieurs patients ont déjà bénéficié de ce traitement dans
des centres de référence, notamment au Centre hospitalier national des Quinze-Vingts
(CHNO XV-XX) et au Centre hospitalier universitaire de Nantes. |
Profil d’efficacité et de sécurité L’ensemble des études précliniques et cliniques ont montré la bonne tolérance de
l’administration sous-rétinienne de vecteurs AAV. Néanmoins, certains points
méritent d’être soulignés. Le risque de mutagenèse par insertion accidentelle du
gène thérapeutique, avec formation de tumeur, a été documenté pour l’AAV dans le
foie de souris nouveau-née [4]. Il semble
cependant limité dans la rétine du fait de l’absence de division cellulaire au sein
de ce tissu. Une toxicité du vecteur est également possible. Elle dépend de la dose
utilisée et du promoteur qui a été choisi our l’expression du gène thérapeutique
[18]. Injecté par voie
sous-rétinienne chez le rat et le chien, le vecteur a pu être retrouvé dans le nerf
optique et les voies visuelles, mais pas dans d’autres organes [19]. La dose de vecteur injectée doit
être limitée au minimum nécessaire. Une attention particulière doit également être
portée sur les résultats visuels à long terme. En effet, certaines études ont révélé
une perte d’efficacité plusieurs années après injection [20, 21]. |
Actuellement, l’injection sous-rétinienne est préférée à l’injection intra-vitréenne,
car elle met le vecteur injecté directement au contact des cellules cibles, ce qui
augmente l’efficacité de vectorisation et diminue les réactions immunitaires et
l’exposition inutile d’autres tissus oculaires. Malheureusement, cette technique est
invasive. Elle nécessite la réalisation d’une vitrectomie par un chirurgien
expérimenté et présente de potentiels effets indésirables : uvéite, cataracte,
déchirure rétinienne, décollement de rétine, endophtalmie, pli maculaire, trou
maculaire [17, 22]. De nouvelles recherches sont donc
nécessaires pour améliorer l’efficacité de la voie intra-vitréenne, la sécurité de
l’injection sous-rétinienne, ou pour développer une voie supra-choroïdienne7 [23]. |
Les autres thérapies géniques de supplémentation Plusieurs études cliniques de phase I/II évaluent actuellement d’autres
traitements de supplémentation ciblant les gènes RPE65,
PDE6b (phosphodiestérase 6b), RLPB1
( retinalaldehyde-binding protein 1) et MERTK
( myeloid-epithelial-reproductive tyrosine kinase)
(Tableau I).
Pour la RP liée à l’X (due à des altérations du gène RPGR
[ retinitis pigmentosa GTPase regulator]), deux études de
phase I/II et une de phase I/II/III sont en cours. L’optogénétique L’optogénétique consiste à faire exprimer par des cellules rétiniennes des
photopigments capables de restaurer la transduction du signal lumineux en signal
électrique. Cette méthode présente l’avantage d’être indépendante de la mutation
causale, et de la fonctionnalité des photorécepteurs et des cellules de l’EP.
Elle serait utilisable à des stades plus avancés d’atrophie rétinienne que pour
les stratégies conventionnelles, tant que les cellules bipolaires et/ou
ganglionnaires sont fonctionnelles. À ce jour, la preuve de concept a été
réalisée chez l’animal et deux études de phase I/II chez l’homme sont
prévues 8, [ 2]. Édition de gène : l’apport du système CRISPR/Cas9 Le système CRISPR/Cas9 ( clustered regularly interspaced short palindromic
repeats/CRISPR-associated protein 9) est une découverte majeure du
XXI e siècle. Il permet de modifier des séquences nucléotidiques.
D’autres techniques d’édition de gène sont également disponibles : l’utilisation
de zinc finger nucleases (ZFN), les transcription
activator-like effector nucleases (TALEN), ou les méganucléases.
Mais le système CRISPR/Cas9 présente plusieurs avantages par rapport à ces
autres techniques : il est plus rapide à modéliser et à produire, plus efficace
et plus spécifique, il permet aussi l’édition simultanée de plusieurs gènes
[ 24]. Des modèles
animaux de RP ont ainsi été développés grâce à ce système. Chez le rat, il
permet d’inactiver, par une injection sous-rétinienne unique, l’expression du
gène RHO qui code la rhodopsine 9, dont l’altération est responsable d’une forme de RP autosomique
dominante [ 25]. Aucune
étude n’a encore exploré cette voie en ophtalmologie. La principale limite du
système CRISPR/Cas9 est une possible coupure double brin de l’ADN sur des sites
non désirés, prévisibles in silico ou non. Ces ciblages
off-targets présentent un risque mutagène qui reste
difficile à maîtriser et qui mérite une surveillance et des précautions
particulières. Induction de cellules pluripotentes in vitro Le développement in vitro de lignées de cellules pluripotentes
hiPSC ( human induced-pluripotent stem cells) à partir de
cellules de patient, offre de nouvelles perspectives [ 26]. Il est désormais possible de
dédifférencier des cellules somatiques d’un patient en cellules pluripotentes
immortalisées, puis de les redifférencier en cellules de l’EP ou, plus
difficilement, en photorécepteurs. Des modèles de rétinites pigmentaires sont
actuellement développés. Ils présentent de nombreux avantages. Ils permettent de
mieux comprendre la pathogenèse de la maladie et de tester de nouvelles
approches thérapeutiques pharmacologiques ou de thérapie génique. Combinée à
l’utilisation du système CRISPR/Cas9, l’induction de cellules pluripotentes
ouvre de nouveaux horizons : cela permettrait notamment de diminuer
significativement le recours aux modèles animaux. Cette technique permet, enfin,
d’envisager de développer une thérapie génique ex vivo, en
greffant des cellules autologues génétiquement modifiées in
vitro. |
Aspects économiques et éthiques Pour trouver sa place dans le système de soin, la thérapie génique doit d’abord
trouver son modèle économique. Ce secteur est particulièrement concerné par la loi
d’Eroom10 qui prédit que le développement
des médicaments sera de plus en plus lent et coûteux. En effet les coûts de
développement et de production des thérapies géniques sont très élevés et
concernent, pour chaque vecteur, uniquement un gène, voire une mutation particulière
d’un gène, et donc peu de patients. On estime ainsi entre 100 et 200 le nombre de
patients atteints (en France) de dégénérescence rétinienne liée à la mutation
bi-allélique du gène RPE65 et seule une partie d’entre eux conserve
suffisamment de rétine fonctionnelle pour que l’injection de Luxturna®
leur soit profitable. Alors faut-il rembourser ce produit ? Oui sans doute, car son
efficacité, même si elle est modeste, a été démontrée et améliore la qualité de vie
des patients, avec une tolérance acceptable. Un signal encourageant fort est donc
donné à la communauté des patients, aux chercheurs, aux donateurs privés et aux
investisseurs ; mais à l’opposé, on pourrait contester ce « oui » en raison du
faible recul que l’on a sur la balance bénéfice/risque et sur le ratio
efficacité/coût qui pourrait s’avérer insuffisant [27]. À noter que les patients qui auront
profité d’une injection du produit ne pourront plus prétendre à être inclus dans un
éventuel essai futur. Quel prix la solidarité nationale est-elle prête à supporter ? En janvier 2019, le
collège de la Haute autorité de santé (HAS) a décidé de mettre en place une
évaluation économique et de santé publique du Luxturna®. Il est donc
susceptible de connaître le même sort que le Glybera®
11, première thérapie génique autorisée en
Europe pour le traitement de déficit familial en lipoprotéine lipase (qui a reçu une
autorisation de mise sur le marché [AMM] en 2012). Le Glybera® n’avait
cependant pas obtenu de remboursement, en raison d’un intérêt clinique insuffisant.
Pour rendre ce modèle viable, il est nécessaire de modifier profondément les
procédés de développement et de fabrication afin de diminuer le coût de fabrication
du produit, de favoriser des stratégies qui permettraient de rendre les produits
confectionnés indépendants de la mutation responsable de la maladie ou d’obtenir des
résultats cliniques qui soient très significatifs [59] (→).
(→) Voir le Repères de A. Fischer et al.,
m/s n° 4, avril 2020, page 389
Une question éthique, est celle du recrutement des patients pour les études
cliniques. Le bénéfice attendu des produits est théoriquement bien supérieur chez
l’enfant, chez lesquels la dégénérescence rétinienne est moins avancée. Limiter les
essais aux adultes pour protéger du risque les enfants est légitime, mais cette
option pourrait conduire à des conclusions erronées quant à l’efficacité du
traitement, uniquement évaluée chez l’adulte et a priori plus
grande chez l’enfant. |
La thérapie génique est une approche thérapeutique révolutionnaire en plein essor,
dont l’efficacité est désormais établie. Bien au-delà du « simple médicament » qui
apporte un gène manquant, de multiples stratégies thérapeutiques sont en cours de
développement et permettront de s’adapter au stade de la maladie, qui est évolutive.
Le diagnostic et le génotypage le plus précocement possible des patients sont une
priorité : ils permettent de proposer des thérapies de supplémentation, d’édition ou
d’inactivation du gène muté pour empêcher la dégénérescence rétinienne. Cette notion
de « fenêtre thérapeutique » est centrale. Elle est bien illustrée par l’intitulé de
l’AMM du Luxturna®, qui réserve le traitement aux patients « possédant
suffisamment de cellules viables ». En cas de perte cellulaire avancée,
l’optogénétique et la reprogrammation cellulaire sont des modalités prometteuses
indépendantes du gène causal. Les perspectives de recherche sont larges et
passionnantes, mais il reste de nombreux défis technologiques, économiques et
éthiques à surmonter avant que la thérapie génique s’installe dans la pratique
médicale. |
Michel Weber est consultant pour Novartis. Michel Weber et Guylène Le Meur
sont actionnaires fondateurs de Horama.
|
Footnotes |
1.
Verbakel
SK
, van Huet
RAC
, Boon
CJF
, et al.
Non-syndromic retinitis pigmentosa . Prog
Retin Eye Res.
2018; ; 66 :
:157.–186. 2.
Simunovic
MP
, Shen
W
, Lin
JY
, et al.
Optogenetic approaches to vision restoration .
Exp Eye Res.
2019; ; 178 :
:15.–26. 3.
Jorstad
NL
, Wilken
MS
, Grimes
WN
, et al.
Stimulation of functional neuronal regeneration from Müller glia
in adult mice . Nature.
2017; ; 548 :
:103.–107. 4.
Rossi
A
, Salvetti
A
. Intégration des vecteurs AAV et mutagenèse
insertionnelle . Med Sci (Paris).
2016; ; 32 :
:167.–174. 5.
Seitz
IP
, Michalakis
S
, Wilhelm
B
, et al.
Superior retinal gene transfer and biodistribution profile of
subretinal versus intravitreal delivery of AAV8 in nonhuman
primates . Invest Ophthalmol Vis Sci.
2017; ; 58 :
:5792.–5801. 6.
Khabou
H
, Dalkara
D
. La conception de vecteurs adaptés à la thérapie
génique oculaire . Med Sci. (Paris).
2015; ; 31 :
:529.–537. 7.
Miraldi
Utz V,
Coussa
RG,
Antaki
F, et al. Gene
therapy for RPE65-related retinal disease .
Ophthalmic Genet.
2018;; 39 :
:671.–7. 8.
Chung
DC
, Traboulsi
EI
. Leber congenital amaurosis: clinical correlations
with genotypes, gene therapy trials update, and future
directions . J Am Assoc Pediatr Ophthalmol
Strabismus.
2009; ; 13 :
:587.–592. 9.
Acland
GM
, Aguirre
GD
, Bennett
J
, et al.
Long-term restoration of rod and cone vision by single dose
rAAV-mediated gene transfer to the retina in a canine model of childhood
blindness . Mol Ther.
2005; ; 12 :
:1072.–1082. 10.
Bennicelli
J
, Wright
JF
, Komaromy
A
, et al.
Reversal of blindness in animal models of Leber congenital
amaurosis using optimized AAV2-mediated gene transfer .
Mol Ther.
2008; ; 16 :
:458.–465. 11.
Le Meur
G
, Stieger
K
, Smith
AJ
, et al.
Restoration of vision in RPE65-deficient Briard dogs using an AAV
serotype 4 vector that specifically targets the retinal pigmented
epithelium . Gene Ther.
2007; ; 14 :
:292.–303. 12.
Jacobson
SG
, Acland
GM
, Aguirre
GD
, et al.
Safety of recombinant adeno-associated virus type 2-RPE65 vector
delivered by ocular subretinal injection . Mol
Ther.
2006; ; 13 :
:1074.–1084. 13.
Jacobson
SG
, Cideciyan
AV
, Ratnakaram
R
, et al.
Gene therapy for Leber congenital amaurosis caused by RPE65
mutations: safety and efficacy in 15 children and adults followed up to 3
years . Arch Ophthalmol.
2012; ; 130 :
:9.–24. 14.
Le Meur
G
, Lebranchu
P
, Billaud
F
, et al.
Safety and long-term efficacy of AAV4 gene therapy in patients
with RPE65 Leber congenital amaurosis . Mol
Ther.
2018; ; 26 :
:256.–268. 15.
Bennett
J
, Wellman
J
, Marshall
KA
, et al.
Safety and durability of effect of contralateral-eye
administration of AAV2 gene therapy in patients with childhood-onset
blindness caused by RPE65 mutations: a follow-on phase 1
trial . Lancet.
2016; ; 388 :
:661.–672. 16.
Bainbridge
JWB
, Smith
AJ
, Barker
SS
, et al.
Effect of gene therapy on visual function in Leber’s congenital
amaurosis . N Engl J Med.
2008; ; 358 :
:2231.–2239. 17.
Russell
S
, Bennett
J
, Wellman
JA
, et al.
Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in
patients with RPE65-mediated inherited retinal dystrophy: a randomised,
controlled, open-label, phase 3 trial .
Lancet.
2017; ; 390 :
:849.–860. 18.
Xiong
W
, Wu
DM
, Xue
Y
, et al.
AAV cis-regulatory sequences are correlated with ocular
toxicity . Proc Natl Acad Sci USA.
2019; ; 116 :
:5785.–5794. 19.
Provost
N
, Le Meur
G
, Weber
M
, et al.
Biodistribution of rAAV vectors following intraocular
administration: evidence for the presence and persistence of vector DNA in
the optic nerve and in the brain . Mol Ther.
2005; ; 11 :
:275.–283. 20.
Jacobson
SG
, Cideciyan
AV
, Roman
AJ
, et al.
Improvement and decline in vision with gene therapy in childhood
blindness . N Engl J Med.
2015; ; 372 :
:1920.–1926. 21.
Bainbridge
JWB
, Mehat
MS
, Sundaram
V
, et al.
Long-term effect of gene therapy on Leber’s congenital
amaurosis . N Engl J Med.
2015; ; 372 :
:1887.–1897. 22.
Ducloyer
JB, Le
Meur
G,
Lebranchu
P, et al. Macular
fold complicating a subretinal injection of voretigene
neparvovec . Ophthalmol Retina.
2019; S2468653019306694.. 23.
Ding
K
, Shen
J
, Hafiz
Z
, et al.
AAV8-vectored suprachoroidal gene transfer produces widespread
ocular transgene expression . J Clin Invest.
2019; ; 130 : 24.
Cai
B
, Sun
S
, Li
Z
, et al.
Application of CRISPR/Cas9 technologies combined with iPSCs in
the study and treatment of retinal degenerative diseases .
Hum Genet.
2018; ; 137 :
:679.–688. 25.
Bakondi
B
, Lv
W
, Lu
B
, et al.
In vivo CRISPR/Cas9 gene editing corrects retinal dystrophy in
the S334ter-3 rat model of autosomal dominant retinitis
pigmentosa . Mol Ther.
2016; ; 24 :
:556.–563. 26.
Castro
AA
, Lukovic
D
, Jendelova
P
, et al.
Concise review: human induced pluripotent stem cell models of
retinitis pigmentosa . Stem Cells.
2018; ; 36 :
:474.–481. 27.
Zimmermann
M
, Lubinga
SJ
, Banken
R
, et al.
Cost utility of voretigene neparvovec for biallelic
RPE65-mediated inherited retinal disease . Value
Health.
2019; ; 22 :
:161.–167. 28.
Smalley
E.
. First AAV gene therapy poised for landmark
approval . Nat Biotechnol.
2017; ; 35 :
:998.–999. 29.
Mowat
FM,
Occelli
LM,
Bartoe
JT, et al. Gene
therapy in a large animal model of PDE6A-retinitis
pigmentosa . Front Neurosci.
2017; :11.. 30.
Occelli
LM
, Schön
C
, Seeliger
MW
, et al.
Gene supplementation rescues rod function and preserves
photoreceptor and retinal morphology in dogs, leading the way toward
treating human PDE6A-retinitis pigmentosa . Hum Gene
Ther.
2017; ; 28 :
:1189.–1201. 31.
Pichard
V
, Provost
N
, Mendes-Madeira
A
, et al.
AAV-mediated gene therapy halts retinal degeneration in
PDE6β-deficient dogs . Mol Ther.
2016; ; 24 :
:867.–876. 32.
Feathers
KL
, Jia
L
, Perera
ND
, et al.
Development of a gene-therapy vector for RDH12-associated retinal
dystrophy . Hum Gene Ther.
2019; ; 30 : 33.
Choi
VW
, Bigelow
CE
, McGee
TL
, et al.
AAV-mediated RLBP1 gene therapy improves the rate of dark
adaptation in Rlbp1 knockout mice . Mol Ther Methods
Clin Dev.
2015; ; 2 : :15022.. 34.
Boye
SL
, Peterson
JJ
, Choudhury
S
, et al.
Gene therapy fully restores vision to the all-cone Nrl(-/-)
Gucy2e(-/-) mouse model of Leber congenital amaurosis-1 .
Hum Gene Ther.
2015; ; 26 :
:575.–592. 35.
Zhong
H
, Eblimit
A
, Moayedi
Y
, et al.
AAV8(Y733F)-mediated gene therapy in a Spata7 knockout mouse
model of Leber congenital amaurosis and retinitis
pigmentosa . Gene Ther.
2015; ; 22 :
:619.–627. 36.
Zhang
W
, Li
L
, Su
Q
, et al.
Gene therapy using a miniCEP290 fragment delays photoreceptor
degeneration in a mouse model of Leber congenital amaurosis .
Hum Gene Ther.
2018; ; 29 :
:42.–50. 37.
Mookherjee
S
, Chen
HY
, Isgrig
K
, et al.
A CEP290 C-terminal domain complements the mutant CEP290 of Rd16
mice In trans and rescues retinal degeneration . Cell
Rep.
2018; ; 25 : (611–23)
:e6.. 38.
Garanto
A
, Chung
DC
, Duijkers
L
, et al.
In vitro and in vivo rescue of aberrant splicing in
CEP290-associated LCA by antisense oligonucleotide delivery .
Hum Mol Genet.
2016; ; 25 :
:2552.–2563. 39.
Ghazi
NG
, Abboud
EB
, Nowilaty
SR
, et al.
Treatment of retinitis pigmentosa due to MERTK mutations by
ocular subretinal injection of adeno-associated virus gene vector: results
of a phase I trial . Hum Genet.
2016; ; 135 :
:327.–343. 40.
Chekuri
A
, Sahu
B
, Chavali
VRM
, et al.
Long-term effects of gene therapy in a novel mouse model of human
MFRP-associated retinopathy . Hum Gene Ther.
2019; ; 30 :
:632.–650. 41.
Dinculescu
A
, Stupay
RM
, Deng
WT
, et al.
AAV-mediated clarin-1 expression in the mouse retina:
implications for USH3A gene therapy . PLoS
One.
2016; ; 11 :
:e0148874.. 42.
Fischer
MD
, McClements
ME
, Martinez-Fernandez de la Camara
C
, et al.
Codon-optimized RPGR improves stability and efficacy of AAV8 gene
therapy in two mouse models of X-linked retinitis
pigmentosa . Mol Ther.
2017; ; 25 :
:1854.–1865. 43.
Wu
Z
, Hiriyanna
S
, Qian
H
, et al.
A long-term efficacy study of gene replacement therapy for
RPGR-associated retinal degeneration . Hum Mol
Genet.
2015; ; 24 :
:3956.–3970. 44.
Giacalone
JC
, Andorf
JL
, Zhang
Q
, et al.
Development of a molecularly stable gene therapy vector for the
treatment of RPGR-associated X-linked retinitis pigmentosa .
Hum Gene Ther.
2019; ; 30 : 45.
Beltran
WA
, Cideciyan
AV
, Boye
SE
, et al.
Optimization of retinal gene therapy for X-linked retinitis
pigmentosa due to RPGR mutations . Mol Ther.
2017; ; 25 :
:1866.–1880. 46.
Cideciyan
AV
, Sudharsan
R
, Dufour
VL
, et al.
Mutation-independent rhodopsin gene therapy by knockdown and
replacement with a single AAV vector . Proc Natl Acad
Sci USA.
2018; ; 115 :
:E8547.–E8556. 47.
Botta
S,
Marrocco
E, de
Prisco
N, et al. Rhodopsin
targeted transcriptional silencing by DNA-binding .
eLife.
2016;; 5 : :e12242.. 48.
Botta
S, de
Prisco
N,
Marrocco
E, et al. Targeting
and silencing of rhodopsin by ectopic expression of the transcription factor
KLF15 . JCI Insight.
2017;; 2. pii:
:96560.. 49.
McCullough
KT
, Boye
SL
, Fajardo
D
, et al.
Somatic gene editing of GUCY2D by AAV-CRISPR/Cas9 alters retinal
structure and function in mouse and macaque . Hum
Gene Ther.
2019; ; 30 :
:571.–589. 50.
Millington-Ward
S
, Chadderton
N
, O’Reilly
M
, et al.
Suppression and replacement gene therapy for autosomal dominant
disease in a murine model of dominant retinitis pigmentosa .
Mol Ther.
2011; ; 19 :
:642.–649. 51.
Roddy
GW
, Yasumura
D
, Matthes
MT
, et al.
Long-term photoreceptor rescue in two rodent models of retinitis
pigmentosa by adeno-associated virus delivery of
Stanniocalcin-1 . Exp Eye Res.
2017; ; 165 :
:175.–181. 52.
Byrne
LC
, Dalkara
D
, Luna
G
, et al.
Viral-mediated RdCVF and RdCVFL expression protects cone and rod
photoreceptors in retinal degeneration . J Clin
Invest.
2015; ; 125 :
:105.–116. 53.
Yao
K
, Qiu
S
, Wang
YV
, et al.
Restoration of vision after de novo genesis of rod photoreceptors
in mammalian retinas . Nature.
2018; ; 560 :
:484.–488. 54.
Jorstad
NL
, Wilken
MS
, Grimes
WN
, et al.
Stimulation of functional neuronal regeneration from Müller glia
in adult mice . Nature.
2017; ; 548 :
:103.–107. 55.
Cronin
T
, Vandenberghe
LH
, Hantz
P
, et al.
Efficient transduction and optogenetic stimulation of retinal
bipolar cells by a synthetic adeno-associated virus capsid and
promoter . EMBO Mol Med.
2014; ; 6 :
:1175.–1190. 56.
Sengupta
A
, Chaffiol
A
, Macé
E
, et al.
Red-shifted channelrhodopsin stimulation restores light responses
in blind mice, macaque retina, and human retina .
EMBO Mol Med.
2016; ; 8 :
:1248.–1264. 57.
Cheong
SK
, Strazzeri
JM
, Williams
DR
, et al.
All-optical recording and stimulation of retinal neurons in vivo
in retinal degeneration mice . PLoS One.
2018; ; 13 :
:e0194947.. 58.
Khabou
H,
Garita-Hernandez
M,
Chaffiol
A, et al.
Noninvasive gene delivery to foveal cones for vision
restoration . JCI Insight.
2018;; 3. pii:
:96029.. 59.
Fischer
A,
Dewatripant
M,
Goldman
M. L’innovation
thérapeutique, à quel prix ?
Med Sci (Paris).
2020;; 36 :
:389.–93. |