La contraction du muscle cardiaque (myocarde) résulte d’une onde de dépolarisation, le potentiel d’action, qui prend naissance dans le nœud sinusal et se propage dans le tissu cardiaque. Le courant calcique de type L, encore appelé ICa,L, intervient durant la phase de plateau du potentiel d’action ventriculaire, et reflète l’entrée de calcium dans le cardiomyocyte. Ce courant déclenche la contraction en provoquant l’ouverture du récepteur-canal de la ryanodine et ainsi la vidange de la réserve d’ions Ca2+ du réticulum sarcoplasmique 1,. Parmi les différents facteurs modulant cette entrée de calcium dans le cardiomyocyte, la stimulation β-adrénergique est la mieux décrite. Lorsque nous sommes soumis à un stress ou un danger, la noradrénaline et l’adrénaline libérées par les fibres du système nerveux sympathique et par les glandes médullosurrénales stimulent la fonction cardiaque par leur effet inotrope positif 2, qui est en partie lié à l’augmentation d’ICa,L. Si ce contrôle de la fonction cardiaque par les catécholamines, mis en jeu dans la réponse comportementale de type « fuite ou combat » (fight or flight), est connu depuis longtemps, le mécanisme de la régulation d’ICa,L lors de ce processus physiologique restait obscur. Il vient d’être mis à jour dans une étude réalisée par Liu et al., publiée dans la revue Nature [1].
L’effet stimulateur des catécholamines sur ICa,L est dû à l’augmentation de la durée d’ouverture du canal CaV1.2 véhiculant ce courant calcique et à un déplacement de son activation (et, moindre, de son inactivation) vers des valeurs plus négatives du potentiel de membrane. Cela se traduit par une augmentation de deux à trois fois de l’amplitude du courant. Les catécholamines, en se fixant aux récepteurs β-adrénergiques (β-aR), activent, par l’intermédiaire d’une protéine Gαs, les adénylate cyclases qui synthétisent l’adénosine monophosphate cyclique (AMPc), dont la cible principale est la protéine kinase dépendante de l’AMPc (PKA) (Figure 1). Bien que la possibilité d’une stimulation directe des canaux calciques par les protéines Gαs ait d’abord été envisagée, il a été clairement établi, il y aura bientôt 30 ans, que cette stimulation implique une phosphorylation par la PKA, qui augmente ICa,L [2]. Depuis lors, l’hypothèse d’une phosphorylation directe du canal CaV1.2 a été explorée par de nombreux chercheurs qui se sont évertués à déterminer quels motifs de ce canal étaient les cibles de la PKA.
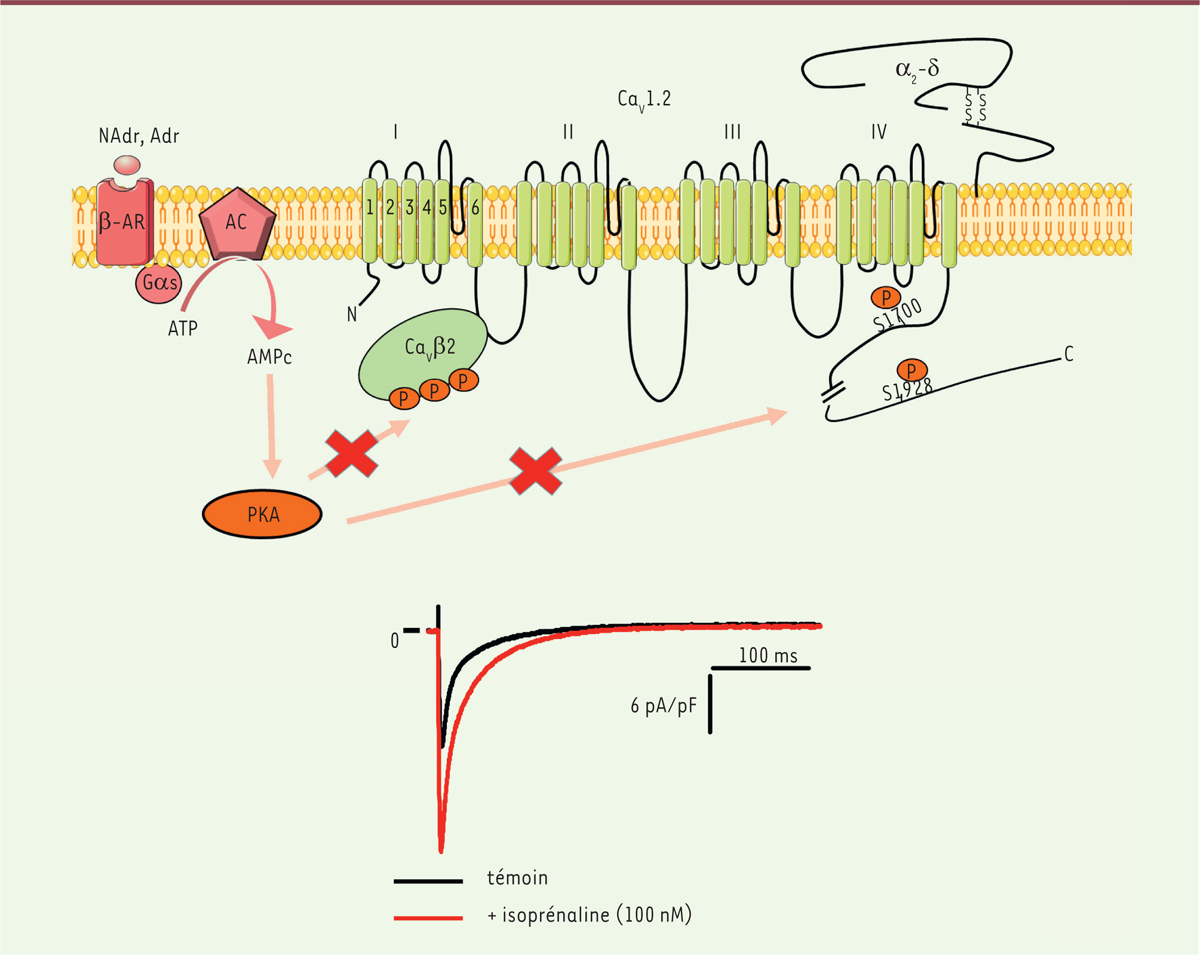
| Figure 1. Représentation schématique de la structure du canal calcique
cardiaque CaV1.2 et de ses sous-unités auxiliaires
(CaVb2
et a2-d), et
de sa régulation b-adrénergique. Dans le cardiomyocyte, la
stimulation des récepteurs β-adrénergiques (β-aR) par la noradrénaline
(NAdr) et l’adrénaline (Adr) active, par l’intermédiaire d’une protéine Gαs,
l’adénylate cyclase qui, à partir d’ATP, synthétise l’adénosine
monophosphate cyclique (AMPc), dont la cible principale est la protéine
kinase dépendante de l’AMPc (PKA). Il avait été proposé que cette kinase
phosphorylait la partie C-terminale de la sous-unité principale
α1C ou la sous-unité CaVβ2 du canal calcique
CaV1.2. En mutant tous les sites cibles potentiels de la
phosphorylation par PKA, Liu et al. démontrent que la
phosphorylation directe de CaV1.2 n’est pas requise pour
augmenter l’amplitude du courant ICa,L lors de
l’activation des β-aR. La partie basse de la figure montre une trace de
courant ICa,L d’un cardiomyocyte de souris,
mesurée grâce à la technique de patch-clamp, en l’absence
(en noir) ou en présence (en rouge) d’isoprénaline. |
CaV1.2 est une protéine multimérique, dont la sous-unité principale, α1C, constitue le pore du canal. Cette protéine de 240 KDa est constituée de quatre domaines hydrophobes, formés de six segments transmembranaires chacun, qui confèrent au canal ses propriétés biophysiques et pharmacologiques. La sous-unité principale α1C est associée à des protéines auxiliaires dont l’une, α2-δ, est largement extracellulaire, et une autre, CaVb2, intracellulaire, se fixe à la boucle intracellulaire située entre les domaines I et II d’α1C (Figure 1). Ces sous-unités auxiliaires sont impliquées dans l’expression du canal CaV1.2 à la membrane plasmique et influencent ses propriétés biophysiques. En particulier, CaVb2 augmente la probabilité d’ouverture du canal et influence la dépendance de son activation et de son inactivation vis-à-vis du potentiel électrique de membrane [3].
Les sous-unités α1C et CaVb2 de CaV1.2 présentent de nombreux sites potentiels de phosphorylation par PKA (Figure 1). Compte tenu de l’implication de CaVb2 dans les propriétés biophysiques du canal, le rôle d’une phosphorylation de cette sous-unité auxiliaire sur trois de ses résidus sérine avait été proposé puis démenti, puisque la suppression de ces sites, par knock-in, chez la souris ne prévient pas la modulation d’ICa,L par la PKA [4]. Le résidu Ser1928, situé dans la partie C-terminale d’α1C, est phosphorylé par la PKA lors d’une stimulation β-aR, et a longtemps été considéré comme le résidu indispensable au contrôle β-adrénergique du canal. Néanmoins, comme pour CaVb2, son importance a été contestée. Le rôle critique de la partie C-terminale d’α1C avait cependant été réaffirmé par l’identification du résidu Ser1700 comme celui qui, lorsqu’il est phosphorylé par la PKA, conduisait à l’augmentation d’ICa,L [5] ; mais là encore, son rôle a ensuite été démenti [6]. Dans leur étude, Liu et al. réfutent définitivement l’hypothèse de l’implication d’une phosphorylation directe des sous-unités du canal CaV1.2 dans sa régulation β-adrénergique. En effet, après avoir remplacé, par mutagénèse dirigée, les 88 résidus sérine et thréonine des sous-unités α1C et CaVb2, cibles potentielles de la PKA, par un résidu alanine (non phosphorylable), ils montrent que le canal muté exprimé dans le cœur de souris répond tout à fait normalement à une stimulation β-adrénergique ou à une élévation de la concentration d’AMPc intracellulaire. Il fallait donc chercher ailleurs, et envisager un partenaire du canal comme cible potentielle de la PKA [1].
Liu et al. ont utilisé une approche originale de protéomique pour rechercher le chaînon manquant à cette modulation du canal. Pour trouver ce partenaire, ils ont associé à CaV1.2 une enzyme permettant la biotinylation de l’ensemble des protéines se trouvant dans un périmètre d’environ 20 nm. Les protéines ainsi étiquetées ont ensuite été identifiées par spectrométrie de masse. Parmi les centaines de protéines ainsi marquées, l’une d’elles, la protéine Rad (Ras-associated with diabetes), est enrichie dans l’environnement du canal en conditions basales, et sa présence est fortement réduite lorsque les échantillons ont été soumis à une stimulation β-adrénergique. Rad est une GTPase connue pour inhiber CaV1.2 par son interaction avec CaVb2 [7]. Cette petite protéine G monomérique, très abondante dans le cœur, avait été identifiée comme un inhibiteur endogène d’ICa,L. En effet, la surexpression du gène codant Rad atténue les effets de la stimulation β-adrénergique sur le couplage excitation-contraction dans les cardiomyocytes [8], tandis que son invalidation augmente ICa,L en lui conférant des caractéristiques similaires à celles du courant stimulé par PKA [9]. De plus, des sites de phosphorylation de Rad par la PKA étaient connus [10]. En résumé, une protéine qui apparaît a posteriori comme le candidat parfait !
Les pièces d’un puzzle déjà présentes dans la littérature ont ainsi été assemblées par Liu et al., qui remettent au centre de cette régulation la sous-unité CaVb2 et l’interaction avec le canal d’une petite protéine G. En utilisant la technique de transfert d’énergie entre protéines fluorescentes (fluorescence resonance energy transfer, FRET), les auteurs montrent que la phosphorylation de Rad par la PKA inhibe son interaction avec CaVb2, ce que confirme la substitution de quatre résidus sérine de Rad, cibles de la PKA, par des résidus alanine, qui prévient la dissociation des deux protéines. De plus, ces mutations empêchent la levée d’inhibition de l’activité de CaV1.2. Les auteurs précisent que deux de ces résidus sérine, situés dans la partie C-terminale de la protéine, sont indispensables non seulement aux effets inhibiteurs de Rad sur ICa,L, mais aussi pour sa dissociation de la membrane, où elle s’associerait avec les phospholipides chargés négativement comme le phosphatidylinositol-4,5-biphosphate (PiP2). Ainsi, d’après ces travaux, en l’absence d’une stimulation β-adrénergique, Rad, ancrée à la membrane plasmique par sa partie C-terminale, séquestrerait la sous-unité CaVb2 du canal CaV1.2. Les catécholamines, en activant la voie AMPc/PKA, permettraient la phosphorylation de Rad, sa dissociation de la membrane plasmique, et libèreraient CaVb2, qui pourrait ainsi augmenter l’activité du canal pour promouvoir l’entrée de calcium dans le cardiomyocyte et contribuer à l’effet inotrope positif de la stimulation β-adrénergique (Figure 2).
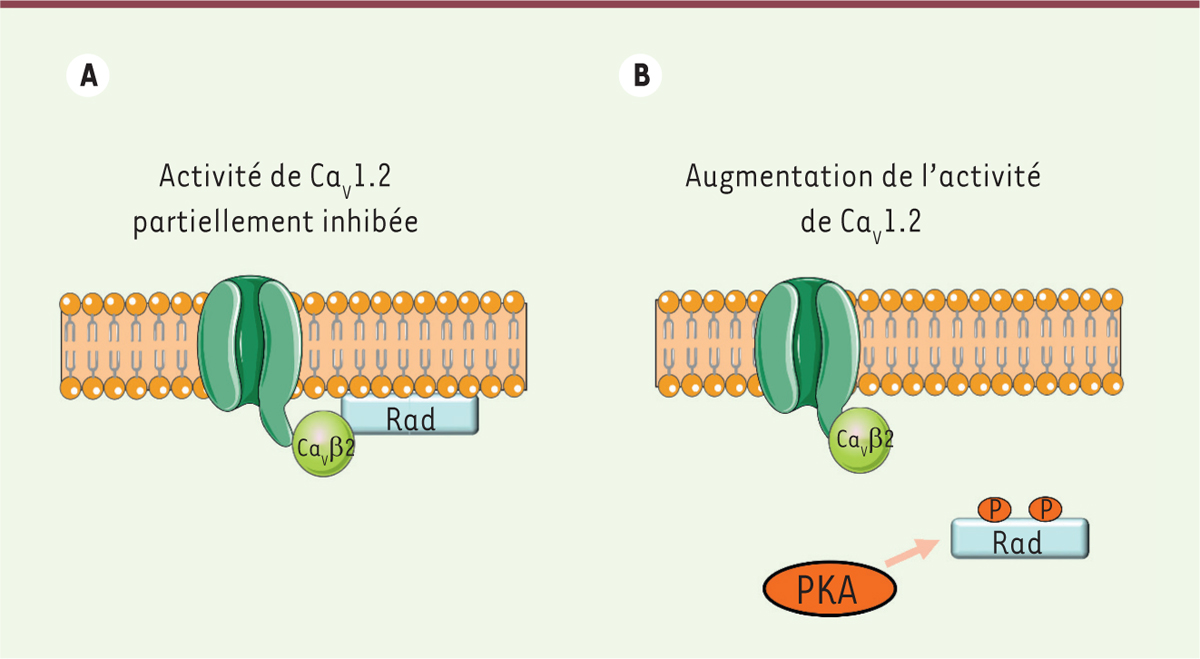
| Figure 2. Régulation b-adrénergique de CaV1.2 impliquant
Rad. Dans le modèle que proposent Liu et
al., la petite protéine G Rad est la cible de la PKA qui
contrôle l’activité de CaV1.2. En l’absence de stimulation
β-adrénergique, Rad est ancrée à la membrane plasmique par sa partie
C-terminale, et se fixe à la sous-unité CaVb2 du canal pour
inhiber son activité. Lorsque la PKA est activée, elle phosphoryle Rad, ce
qui dissocie cette dernière de la membrane plasmique et libère
CaVb2, qui peut ainsi augmenter l’activité du canal pour
promouvoir l’entrée de calcium dans le cardiomyocyte. |
Plus de 50 ans après la découverte de l’augmentation de ICa,L par l’adrénaline [11, 12], il semble donc que Liu et al. ont enfin élucidé le mystère du mécanisme moléculaire de cet effet en identifiant la petite protéine G Rad comme le chaînon manquant dans la régulation de CaV1.2 par la PKA. Certes, les travaux de cette équipe de chercheurs, dirigée par S.O. Marx, ont été réalisés en surexprimant CaV1.2 dans des systèmes hétérologues, ou en introduisant un canal exogène dans le contexte plus physiologique du cardiomyocyte, et ces approches expérimentales sont critiquables. On peut néanmoins raisonnablement espérer que l’analyse de souris « knock-in » chez lesquelles les sites de phosphorylation de Rad par la PKA auront été mutés validera le modèle suggéré par les résultats de cette remarquable étude.
Bien qu’elle semble clore un chapitre important de la recherche concernant le mécanisme du contrôle β-adrénergique d’ICa,L, cette étude ouvre également de nouveaux champs d’exploration. On peut par exemple se demander quels rôles jouent le GTP et l’activité GTPase de Rad dans cette régulation d’ICa,L, et plus largement dans la signalisation par β-aR ? La question du rôle de l’interaction entre Rad et CaVb2 dans le trafic et l’expression fonctionnelle de CaV1.2 à la membrane est posée. Qu’en est-il de cette régulation du fonctionnement des canaux calciques par Rad dans d’autres tissus comme les vaisseaux ? L’interaction de Rad avec CaV1.2 modifie-t-elle ses propriétés pharmacologiques ? Il y a peu d’études concernant le rôle de Rad en conditions pathologiques, mais il semble que son expression est diminuée dans le cœur des patients insuffisants cardiaques à fraction d’éjection3 réduite [13]. Qu’en est-il dans d’autres maladies cardiaques, comme la fibrillation atriale? Peut-on espérer, en ciblant Rad ou son interaction avec CaV1.2, obtenir un effet inotrope positif ou à l’inverse, inhiber une entrée de calcium pro-arythmique ou qui contribue au remodelage cardiaque pathologique ? Peut-on espérer traiter de manière plus spécifique certaines formes d’insuffisance cardiaque en ciblant Rad plutôt qu’en utilisant des médicaments b-bloquants ?