| |
| Med Sci (Paris). 36(5): 525–528. doi: 10.1051/medsci/2020086.Récepteurs purinergiques et fibrose
hépatique Amelle Chouiter,1* Abdel-Rafik Dali,2** and Olivier Dellis3*** 1M1 Biologie-Santé et Magistère de Biologie, Université
Paris-Saclay, 91405Orsay,
France. 2M1 Biologie-Santé, Université Paris-Saclay,
91405Orsay,
France. 3Inserm U1174, Univ. Paris Sud, Université Paris
Saclay, 91405Orsay,
France. |
L’actualité scientifique vue par les étudiants du Master Biologie Santé, module
physiopathologie de la signalisation, Université Paris-Saclay

Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Boris Julien (maître de conférences, université Paris-Sud)
Philippe Robin (maître de conférences, université de Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
karim.benihoud@u-psud.fr
Série coordonnée par Sophie Sibéril. Malgré la très grande capacité de régénération du foie, les fonctions hépatiques sont
dégradées durant l’apparition d’une fibrose faisant suite à une lésion chronique. Cette
fibrose est caractérisée par une accumulation de matrice extracellulaire (MEC) qui est
sécrétée par les myofibroblastes hépatiques [1] issus de la différenciation, induite par la lésion, des cellules
étoilées et/ou des fibroblastes hépatiques [2]. Le remodelage de la MEC par les myofibroblastes repose sur des
interactions intercellulaires, mais également sur la sécrétion de cytokines, de facteurs
de croissance [3] et de molécules
de danger, appelées DAMP (danger-associated molecular pattern), comme
l’ATP qui est libéré par les cellules en apoptose ou en condition de stress. Deux types
de récepteurs de l’ATP coexistent dans le foie, avec des différences d’expression des
différentes isoformes selon le type cellulaire. On distingue ainsi les récepteurs P2X,
qui sont des canaux ioniques directement activés par l’ATP (parmi ceux-ci, P2X4 et P2X7
sont les plus exprimés), et les récepteurs P2Y qui sont des récepteurs métabotropiques
couplés aux protéines G [4]. Alors que, à la suite d’une lésion aiguë, la réparation du foie, par des processus
dépendant de l’ATP est documentée [4, 5], le rôle des récepteurs P2 dans
la fibrogenèse, résultant d’une lésion chronique, a été très peu étudié. Quelques travaux ont néanmoins montré, par invalidation génique ou pharmacologique, que
le récepteur P2X7 était impliqué, selon des mécanismes encore mal compris, dans
l’activation et la différenciation des cellules hépatiques stellaires et des
fibroblastes portaux en myofibroblastes. Des études ont révélé le rôle de ce récepteur
dans la fibrogenèse induite après ligature des voies biliaires [6] ou après traitement au tétrachlorure de carbone
(CCl4) [7,8]. Le rôle de P2X4 dans la fibrogenèse hépatique n’avait en revanche pas encore été étudié
dans ces modèles de lésions hépatiques. Précédemment, l’équipe dirigée par T. Tordjmann
avait mis en évidence une forte expression de P2X4 dans le tissu hépatique, et avait
décrit son rôle dans la régulation de la sécrétion de médiateurs de l’inflammation, de
la réorganisation du cytosquelette et de la formation de dépôts de collagène dans des
sites extra-hépatiques [9]. Dans
un article récent, cette même équipe s’est donc intéressée au rôle des récepteurs P2X4
dans l’acquisition d’un phénotype profibrogène, en étudiant les fonctions des
myofibroblastes [10]. |
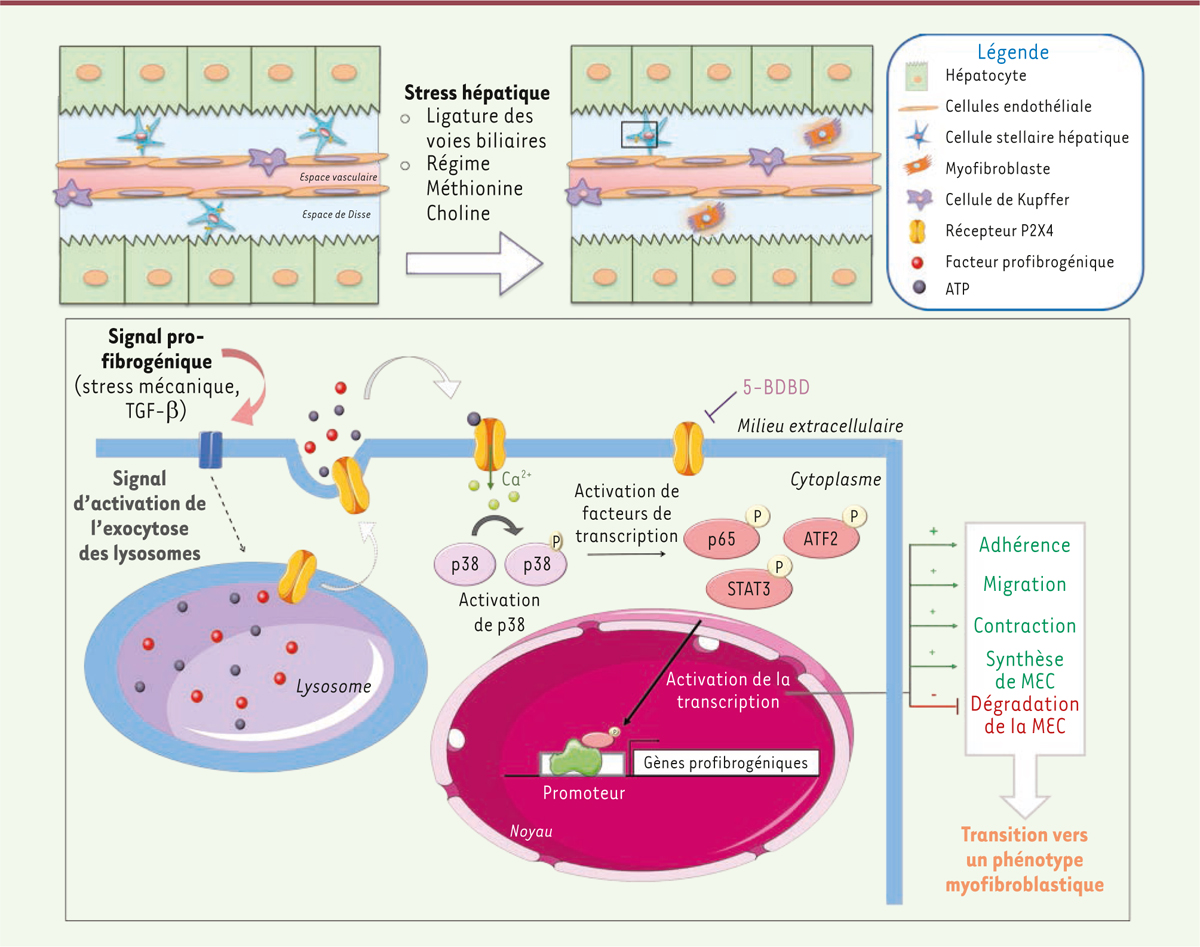
Le récepteur P2X4 a un effet profibrogénique Quinze jours après avoir induit une fibrose hépatique, soit par ligature des voies
biliaires [11], soit en
appliquant un régime alimentaire carencé en méthionine et choline à des souris
[12], les auteurs ont
pu montrer que le foie de souris déficientes pour le gène du récepteur P2X4 (souris
P2X4-KO) exprimait moins de transcrits de collagène par rapport à celui des souris
témoins. Toutefois, l’invalidation de P2X4 entraînant parallèlement
une diminution de l’expression de P2X7, les auteurs ont répété les
mêmes expériences sur des souris P2X7-KO. Dans ce cas, aucune différence de
phénotype n’a été observée chez les souris déficientes pour ce récepteur et
présentant des lésions hépatiques. Il apparaît donc que la diminution de
l’expression de P2X7, observée chez les souris P2X4-KO, n’est pas impliquée dans la
diminution de l’apparition du phénotype profibrogénique que l’on note chez les
souris P2X4-KO. En utilisant des biopsies de foie de patients, les auteurs ont pu,
de plus, montrer une surexpression de P2X4 dans le foie de patients fibrotiques. Ces
résultats suggèrent ainsi que l’expression et l’activation de P2X4 jouent un rôle
important dans l’apparition de la fibrose hépatique. |
P2X4 contribue à l’activation des myofibroblastes hépatiques Les auteurs se sont ensuite intéressés à l’activité des myofibroblastes hépatiques
isolés à partir de souris sauvages ou de souris P2X4-KO. Ils ont alors pu montrer,
par une analyse en western-blot, que la stimulation de
myofibroblastes hépatiques de souris témoins par l’ATP augmente l’expression de
l’a-SMA (a-smooth muscle actin), une isoforme de l’actine des
muscles lisses. Cette surexpression n’est pas retrouvée dans les myofibroblastes
hépatiques des souris P2X4-KO. La protéine a-SMA étant un marqueur de l’activation
des myofibroblastes hépatiques, ce résultat suggère donc un défaut d’activation des
cellules P2X4-KO. Pour le confirmer, les auteurs ont testé la contraction de ces
cellules, ainsi que leurs capacités d’adhérence à la fibronectine et de migration.
Les résultats obtenus montrent que les myofibroblastes hépatiques des souris P2X4-KO
présentent une perte des capacités de contraction et de migration cellulaire et
d’adhérence. Une étude semi-quantitative, par une analyse en
western-blot, détectant différentes protéines de la MEC, a, de
plus, mis en évidence un rôle de P2X4 dans le contrôle de l’équilibre entre synthèse
et dégradation de protéines matricielles. Ces résultats révèlent donc que P2X4 joue
un rôle majeur dans l’activation et les propriétés des myofibroblastes
hépatiques. |
P2X4 permet un influx calcique et l’exocytose de protéines par les
myofibroblastes Le récepteur P2X4 étant un canal cationique permettant l’entrée des ions
Ca2+ dans les cellules, les auteurs ont étudié l’effet du 5-BDBD, un
inhibiteur spécifique de P2X4, sur la mobilisation calcique dans les myofibroblastes
hépatiques de souris témoins et P2X4-KO. Alors qu’une stimulation par l’ATP induit
un influx de Ca2+ dans les myofibroblastes sauvages pouvant être inhibé
par le 5-BDBD, la stimulation des myofibroblastes P2K4-KO n’induit que peu d’influx
de Ca2+ et le 5-BDBD n’a aucune efficacité sur ces cellules. En raison du
défaut de mobilisation du calcium dans les cellules qui n'expriment pas P2X4,
l’exocytose de la fibronectine et du TGF-b, induite par l’ATP, est inhibée dans les
myofibroblastes P2X4-KO. Un dosage de la β-hexosaminidase, une enzyme retrouvée dans
le milieu extracellulaire après sécrétion lysosomale, révèle, par ailleurs, une
altération de l’exocytose des lysosomes. L’ensemble de ces résultats montre donc que
le récepteur P2X4 contrôle les capacités de sécrétion des myofibroblastes. |
P2X4, une cible thérapeutique dans le traitement des maladies chroniques du foie
? Afin de confirmer le rôle de P2X4 dans les fonctions des myofibroblastes hépatiques
in vitro, l’expression de la protéine a-SMA et la capacité de
contraction ont été étudiées en présence de 5-BDBD. Alors que cet inhibiteur n’a
aucun effet sur les myofibroblastes hépatiques des souris P2X4-KO, le 5-BDBD est
capable d’inhiber la surexpression de l’a-SMA et la contraction induite par l’ATP
dans les cellules exprimant le récepteur. In vivo, le traitement de
souris témoins par le 5-BDBD, durant 7 à 15 jours, après ligature des voies
biliaires, réduit fortement la surexpression de l’a-SMA ainsi que l’accumulation de
collagène dans le foie, confirmant que l’inhibition de P2X4 permet de réduire
l’activation des myofibroblastes hépatiques et de protèger le foie de la
fibrose. Cette étude a permis de mettre en évidence l’implication de la voie de signalisation
déclenchée par l’activation du récepteur P2X4 dans le processus de fibrogenèse
hépatique induit de manière chronique. P2X4 activé, via la
sécrétion d’ATP par les lysosomes, permet l’entrée de calcium et, en conséquence,
l’activation de facteurs de transcription impliqués dans la synthèse de facteurs
profibrogéniques, comme la fibronectine (Figure 1). L’inhibition de P2X4 atténue le profil
profibrogénique des myofibroblastes hépatiques durant l’induction de la fibrose.
L’utilisation d’un antagoniste de P2X4 permet donc de contrôler la balance
fibrogénique/fibrolytique. Le récepteur P2X4 constituerait ainsi une cible
thérapeutique intéressante pour lutter contre les maladies chroniques du foie.
 | Figure 1. Voie de signalisation induite par l’activation du récepteur
P2X4 impliquée dans la différenciation des cellules stellaires
hépatiques et des fibroblastes portaux en
myofibroblastes. En condition de stress, les
cellules hépatiques reçoivent différents signaux profibrogéniques
(stress mécanique, TGF-b) capables d’activer l’exocytose des lysosomes
contenant des facteurs profibrogéniques et de l’ATP. L’ATP libéré est
alors capable de se fixer aux récepteurs purinergiques P2X4 exprimés
notamment à la surface des cellules stellaires hépatiques et des
fibroblastes portaux. L’activation du récepteur entraîne un influx
calcique dans ces cellules ainsi que l’activation par phosphorylation de
la MAP kinase p38, et des facteurs de transcription ATF2, START3 et p65
impliqués dans l’activation de gènes profibrogéniques. Ces modifications
de l’expression génique permettent d’augmenter les capacités
d’adhérence, de migration, de contraction et de synthèse de la matrice
extracellulaire (MEC) et de diminuer la dégradation de la MEC par ces
cellules. L’ensemble de ces propriétés est caractéristique d’une
transition vers un phénotype myofibroblastique. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1. Lu
D,
Insel
PA. Cellular
mechanisms of tissue fibrosis. 6. Purinergic signaling and response in
fibroblasts and tissue fibrosis . Am J Physiol-Cell
Physiol.
2014;; 306 :
:C779.–88. 2. KarinD,
KoyamaY,
BrennerD,
et al.
The characteristics of activated portal
fibroblasts/myofibroblasts in liver fibrosis .
Differentiation.
2016; ; 92 :
:84.–92. 3. HicksDF,
GoossensN,
Blas-GarcíaA,
et al.
Transcriptome-based repurposing of apigenin as a potential
anti-fibrotic agent targeting hepatic stellate cells .
Sci Rep.
2017; ; 7 : :42563.. 4. GonzalesE,
JulienB,
Serrière-LanneauV,
et al.
ATP release after partial hepatectomy regulates liver
regeneration in the rat . J Hepatol.
2010; ; 52 :
:54.–62. 5. BesnardA,
GautherotJ,
JulienB,
et al.
The P2X4 purinergic receptor impacts liver regeneration after
partial hepatectomy in mice through the regulation of biliary
homeostasis . Hepatology.
2016; ; 64 :
:941.–953. 6. WuX,
WangY,
WangS,
et al.
Purinergic P2X7 receptor mediates acetaldehyde-induced hepatic
stellate cells activation via PKC-dependent GSK3β pathway .
Int Immunopharmacol.
2017; ; 43 :
:164.–171. 7. HuangY,
LiuW,
XiaoH,
et al.
Matricellular protein periostin contributes to hepatic
inflammation and fibrosis . Am J Pathol.
2015; ; 185 :
:786.–797. 8. TungHC,
LeeFY,
WangSS,
et al.
The beneficial effects of P2X7 antagonism in rats with bile duct
ligation-induced cirrhosis . PLoS One.
2015; ; 10 :
:e0124654.. 9. GarcinI,
TordjmannT.
Calcium signalling and liver regeneration .
Int J Hepatol.
2012; ; 2012 :
:1.–6. 10. Le
GuilcherC,
GarcinI,
DellisO,
et al.
The P2X4 purinergic receptor regulates hepatic myofibroblast
activation during liver fibrogenesis . J
Hepatol.
2018; ; 69 :
:644.–653. 11. Tag
CG,
Sauer-Lehnen
S,
Weiskirchen
S, et al.
Bile duct ligation in Mmice: induction of inflammatory liver
injury and fibrosis by obstructive cholestasis . J
Vis Exp.
2015; :52438.. 12. RinellaME,
EliasMS,
SmolakRR,
et al.
Mechanisms of hepatic steatosis in mice fed a lipogenic
methionine choline-deficient diet . J Lipid
Res.
2008; ; 49 :
:1068.–1076. |