En 2013, nous avons montré pour la première fois que les tumeurs cancéreuses de la prostate sont infiltrées par des fibres nerveuses provenant de l’excroissance d’axones adrénergiques et cholinergiques du système nerveux autonome qui préexistent dans l’organe où la tumeur se développe [1-3] (→).
(→) Voir la Nouvelle de C. Magnon, m/s n° 8-9, août-septembre 2013, page 699
Les fibres nerveuses adrénergiques contrôlent l’initiation tumorale, alors que les fibres nerveuses cholinergiques régulent la dissémination des cellules cancéreuses. Ces deux composantes du système nerveux autonome jouent ainsi des rôles complémentaires favorisant le développement tumoral. Depuis, de nombreuses études ont confirmé nos résultats en montrant que ce processus d’excroissance axonale concerne différents types de tumeurs cancéreuses, telles que les tumeurs du sein, du poumon, de la peau, de l’estomac et du pancréas [4-9]. Ces études définissent les fibres nerveuses comme un nouveau composant du microenvironnement tumoral, au même titre que les cellules immunitaires ou endothéliales. Plus récemment, l’implication de neurones cérébraux glutamatergiques dans le développement des gliomes de haut grade et dans le développement des métastases cérébrales du cancer du sein a été rapportée [10-12].
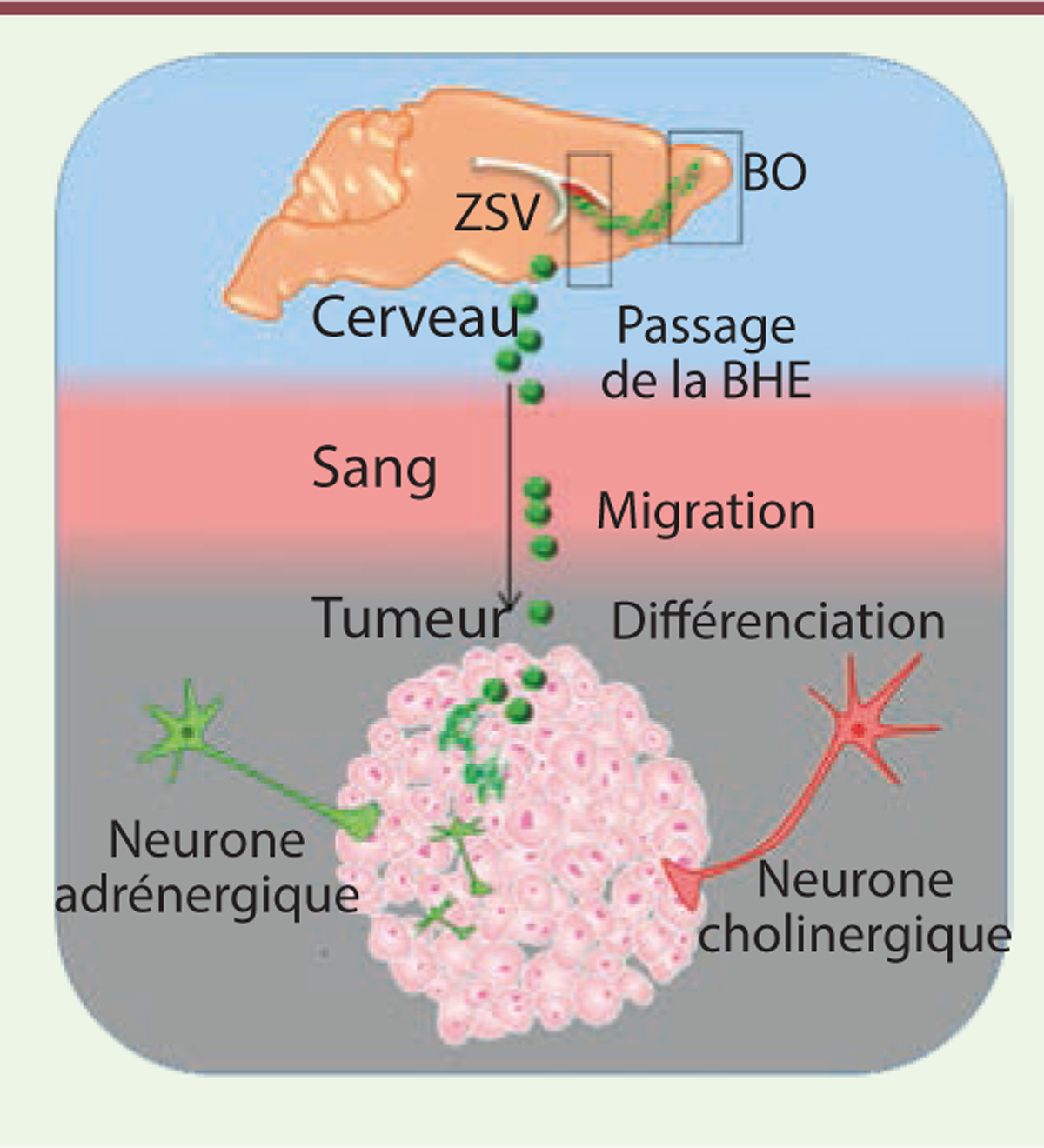
En 2019, nous avons montré que le réseau neuronal adrénergique intra-tumoral peut également provenir de la différenciation de progéniteurs neuronaux grâce à un processus de neurogenèse [13]. Dans le système nerveux central, la neurogenèse désigne la formation de neurones fonctionnels à partir de cellules souches et de progéniteurs neuronaux issus de deux zones neurogéniques du cerveau : la zone sous-ventriculaire (ZSV) et le gyrus denté [14]. L’analyse d’une cohorte de patients atteints d’une hyperplasie bénigne ou d’un cancer (de haut grade ou de bas grade) de la prostate a révélé que les tumeurs cancéreuses primaires de haut grade sont infiltrées par des cellules stromales exprimant des marqueurs de progéniteurs neuronaux du système nerveux central (doublecortine, DCX, et polysialylated-neural cell adhesion molecule, PSA-NCAM), et dont le nombre est associé à l’agressivité et au caractère invasif du cancer. Les résultats de l’étude d’un modèle murin transgénique du cancer de la prostate (Hi-Myc), dans lequel les cellules DCX+ ont été génétiquement marquées par la protéine fluorescente EYFP (enhanced yellow fluorescent protein), suggèrent que les cellules Lin- DCX:EYFP+1, purifiées à partir du microenvironnement tumoral ont un profil transcriptomique similaire à celui des cellules progénitrices neuronales de la ZSV, qui est caractérisé notamment par l’expression de PSA-NCAM, CD24, et de l’EGFR (epidermal growth factor receptor). Une fois mises en culture, ces cellules stromales se différencient en neurones, suggérant la présence de progéniteurs neuronaux au sein du microenvironnement tumoral. Au cours de notre étude chez la souris, nous avons également observé que le nombre de progéniteurs neuronaux issus d’une sous-population de cellules Lin- DCX:EYFP+ de la ZSV décroissait de façon cyclique au cours du développement tumoral. En parallèle, une sous-population de cellules Lin- DCX:EYFP+ du microenvironnement tumoral, phénotypiquement similaire à la sous-population cérébrale de cellules Lin- DCX:EYFP+, s’accroissait au cours du développement de la tumeur cancéreuse. Cela suggérait que cette sous-population cérébrale Lin- DCX:EYFP+ pouvait migrer du cerveau vers la tumeur. Nous avons alors marqué les cellules souches et les progéniteurs neuronaux de la ZSV du cerveau grâce à une injection locale, après repérage stéréotaxique, d’un vecteur lentiviral permettant d’exprimer la protéine fluorescente tdTomato dans les cellules transduites, et avons pu détecter des cellules Lin- tdTomato+ dans le sang circulant et dans le microenvironnement tumoral par cytométrie de flux. Nous avons également montré, par une technique d’immunofluorescence, que la barrière hémato-encéphalique (BHE) de la ZSV d’animaux cancéreux était perméabilisée, contrairement à la BHE d’animaux ne développant pas de tumeur cancéreuse. Ces résultats indiquent qu’une sous-population de progéniteurs neuronaux quitte la ZSV en traversant une BHE localement perméabilisée, pour gagner la circulation sanguine et migrer jusqu’à la tumeur primaire. Dans les tissus tumoraux, ces progéniteurs se différencient en neurones adrénergiques, qui participent aux premières étapes du développement tumoral. L’ablation, systémique ou localisée dans la ZSV, des cellules DCX+ enraye la formation des tumeurs, alors que l’enrichissement du microenvironnement tumoral par transplantation orthotopique2, de cellules Lin- DCX:EYFP+ promeut les premières étapes de la formation d’une tumeur cancéreuse et sa croissance. Cette étude a été étendue au cancer du sein et aux nodules tumoraux métastatiques, suggérant que tout tissu cancéreux en développement a la capacité d’attirer des progéniteurs neuronaux originaires du système nerveux central [13] (Figure 1).
| Figure 1. La neurogenèse du cancer. Grâce à des modèles
murins transgéniques du cancer de la prostate (Hi-MYC) et du cancer du sein
(PyMT), nous avons pu mettre en évidence la migration de cellules
progénitrices Lin- DCX+ (cellules vertes) de la zone
sous-ventriculaire (ZSV) du cerveau vers la tumeur après perméabilisation de
la barrière hémato-encéphalique (BHE) et passage dans la circulation
sanguine. Ces cellules progénitrices infiltrent les tissus tumoraux et s’y
différencient en neurones adrénergiques pour promouvoir les premières étapes
du développement tumoral. Physiologiquement, chez les rongeurs, des
progéniteurs neuronaux migrent de la ZSV jusqu’aux bulbes olfactifs (BO)
pour s’y différencier en interneurones. |
Cette étude révèle un nouveau type de dialogue entre tumeur périphérique et cerveau, par lequel les tissus tumoraux recrutent des cellules progénitrices neuronales de la ZSV du cerveau afin de promouvoir leur développement et leur progression [13]. Une telle relation à distance, qui implique le détournement des cellules d’un organe sain au profit de la tumeur localisée dans un autre organe, n’est pas un phénomène unique en cancérologie. Les tumeurs du poumon, par exemple, ont la capacité d’agir à distance sur la moelle osseuse afin qu’elle produise et libère dans la circulation sanguine une sous-population de granulocytes neutrophiles qui infiltrent le microenvironnement tumoral pour y exercer une activité pro-tumorale [15]. Par ailleurs, le cerveau est connu pour contrôler de nombreuses fonctions physiologiques grâce au système nerveux autonome. Le cerveau reçoit et intègre des signaux environnementaux et des signaux provenant des tissus périphériques, et exerce en retour un contrôle sur les organes, notamment par l’intermédiaire du système nerveux autonome. Par exemple, en réponse à la leptine (une hormone qui contrôle la satiété et le développement de réservoirs adipeux), le cerveau promeut le développement du tissu osseux en agissant sur l’activité des ostéoblastes grâce au réseau neuronal adrénergique du système nerveux autonome [16]. L’intestin et son microbiote fournissent un autre exemple de dialogue complexe entre le cerveau et un organe périphérique [17]. Le cerveau reçoit notamment des signaux provenant de cellules neuroendocrines de l’intestin, en particulier via l’activation des fibres sensitives du nerf vague, et envoie en retour des signaux à l’intestin via le système nerveux autonome (sympathique et parasympathique) ou grâce à l’activation de l’axe hypothalamo-hypophyso-surrénalien. Une perturbation de ce contrôle bidirectionnel entre le cerveau et l’intestin peut entraîner le développement de maladies inflammatoires intestinales. De façon similaire, il existe un contrôle bidirectionnel entre le cerveau et la tumeur cancéreuse. En particulier, certaines perturbations de l’environnement (variations de l’exposition à la lumière ou du régime alimentaire, troubles du sommeil, stress prolongé) peuvent agir sur certains réseaux neuronaux du cerveau et altérer le microenvironnement tumoral au bénéfice des cellules cancéreuses. À titre d’exemple, l’activation des voies de signalisation adrénergique via l’axe sympatho-surrénalien, induite par des conditions expérimentales de stress dans des modèles murins, favorise le développement tumoral et le processus métastatique [3]. Le développement cancéreux peut également être soutenu par l’axe hypothalamo-hypophyso-surrénalien, et la sécrétion de corticoïdes qui en découle, dans certaines conditions de stress [18]. Réciproquement, une tumeur peut perturber le fonctionnement de certains réseaux neuronaux du cerveau, entraînant des troubles du sommeil et un dérèglement de l’horloge biologique.
Notre étude vient à l’appui du concept selon lequel le cancer est une maladie systémique impliquant des interactions complexes entre la tumeur et l’hôte. Afin de construire un microenvironnement dédié à sa croissance et à sa dissémination, la tumeur cancéreuse instaure non seulement un dialogue de proximité avec les fibres nerveuses présentes dans l’organe où elle se développe, mais également un dialogue à distance avec le cerveau afin d’attirer des progéniteurs neuronaux nécessaires à la neurogenèse tumorale. Nos résultats ouvrent un nouveau champ d’étude des mécanismes du cancer et de recherche de thérapies ciblées.