| |
| Med Sci (Paris). 36(4): 376–381. doi: 10.1051/medsci/2020062.Métaux, pollution de l’air et santé Les mousses, des alliées originales en
épidémiologie Caroline Meyer,1 Sébastien Leblond,1 Bénédicte Jacquemin,2 and Émeline Lequy3* 1UMS 2006 PatriNat (patrimoine naturel), Office français de
la biodiversité (OFB), CNRS, Muséum national d’Histoire naturelle
(MNHN), 12 rue
Buffon, F-75005Paris,
France 2Univ Rennes, Inserm, École des hautes études en santé
publique (EHESP), Institut de recherche en santé, environnement et travail
(Irset) - UMR_S 1085, 9
avenue du Pr Léon Bernard, F-35000Rennes,
France 3Inserm UMS 011, 16 avenue Paul Vaillant Couturier,
F-94807Villejuif,
France |

L’air que nous inhalons est constitué d’un cocktail de gaz et de particules dont la
composition et les concentrations varient dans l’espace et le temps [1]. Les polluants atmosphériques sont
définis comme tout gaz ou particules dont la concentration dans l’atmosphère entraîne
des troubles chez les êtres vivants. Ils sont responsables de nombreux problèmes de
santé [2,3] et de millions de décès prématurés dans le
monde1, dont environ 48 000 par an en France
[4]. Pour établir ces
résultats, les études épidémiologiques sur la pollution de l’air nécessitent, entre
autres, des données d’exposition fiables. De plus en plus de données sont rendues
disponibles depuis plusieurs décennies, en raison des améliorations apportées aux
techniques d’analyses et à la modélisation de l’exposition. Les études ont tout d’abord
porté sur les effets sanitaires d’une exposition à des particules atmosphériques, avec
l’analyse de particules de plus en plus fines. Les recherches se focalisent désormais
sur certains de leurs composants [5-7], dont les
métaux, qui sont impliqués dans des mécanismes de stress oxydant et d’inflammation
pouvant expliquer certains effets sanitaires de la pollution de l’air [8]. Au-delà d’une certaine dose, les métaux
deviennent en effet toxiques pour la santé et pour l’environnement [9]. Chez l’homme, cette toxicité a été
révélée à la suite d’expositions accidentelles majeures à de fortes concentrations,
notamment par ingestion, qui se sont traduites par l’apparition de symptômes
particuliers : maladie de Minamata, causée par une exposition au mercure (Hg)2,, maladie d’Itai-Itai, par le cadmium (Cd)3,, ou saturnisme, par le plomb (Pb)4 [10,11]. En milieu
professionnel, les vapeurs de certaines formes de Cd et de nickel (Ni), qui peuvent être
inhalées, sont classées cancérigènes [12]. La question des effets à long terme d’une exposition à de faibles
concentrations de métaux, notamment par inhalation, reste beaucoup moins étudiée.
Certains métaux atmosphériques font l’objet d’une réglementation et d’une surveillance
de leur teneur ambiante par les autorités européennes, comme l’arsenic (As), le Cd, le
Ni, et le Pb, dans les particules atmosphériques de moins de 10 µm de diamètre
(PM10). En France (métropolitaine et Outre-mer), cette surveillance est
assurée par les Agences agréées de surveillance de la qualité de l’air (AASQA), dans un
ensemble restreint de sites (50 pour le Ni, 56 pour le Pb). Ces sites de mesure
demeurent peu nombreux en raison de difficultés techniques (conditions de non
contamination des échantillons et seuils de détection des instruments de mesure actuels)
et du coût d’exploitation. Ils permettent cependant de répondre aux exigences de la
réglementation sur les métaux atmosphériques, sans toutefois apporter les données qui
résulteraient d’un maillage fin et régulier du territoire. Avec d’autres pays européens, la France participe au programme European
Monitoring and Evaluation Programme qui fournit des modélisations des
émissions et des dépôts de plusieurs métaux dans toute l’Europe. Les données obtenues
avec ce programme ne permettent cependant pas d’obtenir une cartographie à fine
résolution des expositions, en raison de la faible représentativité du terrain (mesures
réalisées) ou du maillage trop large (modélisation). La biosurveillance par les mousses
(des végétaux que l’on trouve dans tous les milieux terrestres) propose une alternative
à ces évaluations atmosphériques afin d’estimer l’exposition des populations aux métaux
sur de larges territoires. |
Les mousses bioaccumulatrices des métaux atmosphériques Notions de biosurveillance La biosurveillance est définie comme « l’utilisation de systèmes biologiques
(organismes et communautés d’organismes) pour suivre les changements de
l’environnement dans l’espace et/ou dans le temps » [ 13]. La biosurveillance ne permet pas
nécessairement d’identifier l’origine du polluant qui est mesuré, et certains
organismes peuvent accumuler en grande quantité un ou plusieurs éléments
provenant de leur environnement sans qu’il n’y ait d’impact majeur sur leur
physiologie. On parle alors de bioaccumulateur. C’est le cas, par exemple, des
mousses ou des lichens (résultant d’une symbiose entre un champignon et un
organisme photosynthétique, cyanobactérie ou algue) qui accumulent les éléments
atmosphériques, dont les métaux, à des niveaux supérieurs à ceux des limites de
détection des instruments analytiques actuels. Les mousses : un organisme idéal pour la biosurveillance de la qualité de
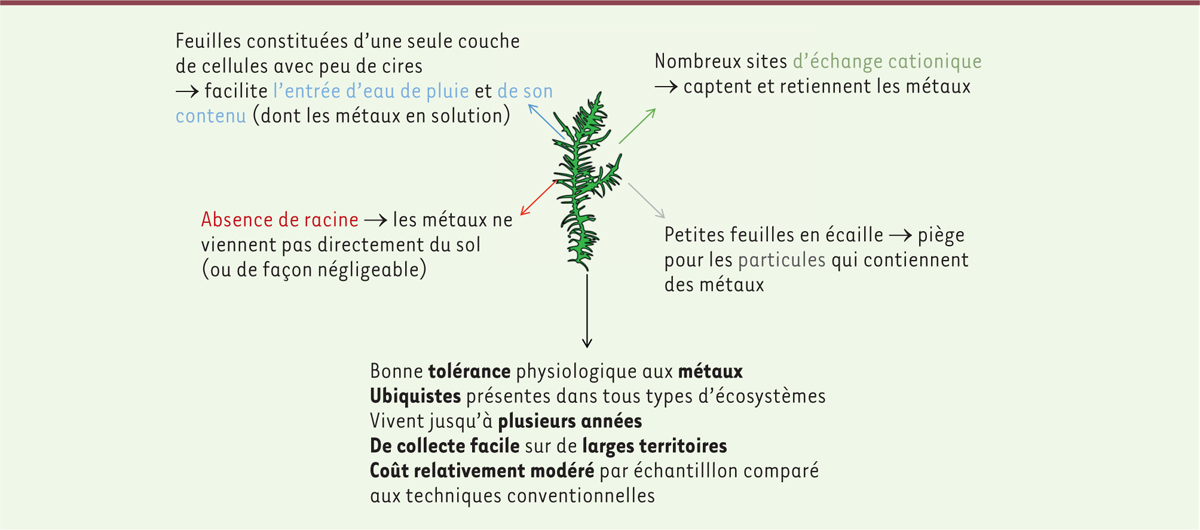
l’air Les mousses sont des organismes végétaux qui colonisent tous les milieux
terrestres. Leurs propriétés morphologiques et physiologiques en font
d’excellents capteurs des contaminants atmosphériques (Figure 1). En effet, l’absence
de racine et de système vasculaire rendent ces végétaux dépendants de
l’atmosphère pour leurs besoins nutritifs. L’absorption des nutriments est
réalisée par toute la surface de la plante. Les mousses captent ainsi
efficacement les éléments indispensables à leur croissance, mais capturent aussi
simultanément un grand nombre d’éléments qui ne leurs sont pas essentiels, ce
qui en fait des organismes de choix pour la biosurveillance de la qualité de
l’air [ 14, 15].
 | Figure 1. Caractéristiques permettant aux mousses d’être de bons
bioaccumulateurs des métaux atmosphériques. |
Les métaux captés par le brin de mousse se localisent différemment selon leurs
caractéristiques physico-chimiques (Figure
1) :
-
les métaux particulaires se trouveront piégés à la surface du brin,
entre les feuilles ;
-
les métaux ioniques, en solution dans l’eau de pluie, rejoindront :
l’espace extracellulaire, sur les sites de fixation de la paroi
cellulaire ; l’espace intercellulaire, sous forme d’ions libres ; ou
le milieu intra-cellulaire.
Généralement, seule la concentration totale en un élément est analysée, sans en
différencier la forme chimique (particulaire ou ionique, état d’oxydation,
etc.). Cette concentration permet d’estimer le niveau global d’exposition de la
mousse de manière intégrée dans le temps. Cette technique est une méthode
relative : elle permet de classer les sites de collecte les uns par rapport aux
autres dans l’espace et le temps, en fonction de la valeur de concentration
mesurée dans les échantillons. Elle n’a pas pour but de se substituer aux
méthodes physico-chimiques, mais elle apporte des informations complémentaires.
Elle permet de collecter des mesures par un maillage dense des territoires sur
lesquels elle est déployée. Depuis le développement de cette technique dans les
années 1960, les mousses ont été utilisées dans le cadre d’études à différentes
échelles : au niveau local, au voisinage de sites industriels ou à l’échelle
régionale, nationale et internationale. |
Un exemple d’utilisation aux niveaux européen et français : l’ICP-Vegetation et
BRAMM Fondé sur des premières campagnes réalisées dans les années 1980 au Danemark et en
Suède, le programme européen Atmospheric heavy metal deposition in Europe
– estimation based on moss analysis a été par la suite étendu à
d’autres pays d’Europe. À partir de 2001, ce programme a été intégré aux activités
de la convention de Genève sur la pollution atmosphérique transfrontière, au travers
de l’ICP-Vegetation (International cooperative programme on effects of air
pollution on natural vegetation and crops). Ce programme de coopération
internationale étudie l’influence des métaux atmosphériques, ozone et azote, sur la
végétation dans plus d’une trentaine de pays. L’un de ses objectifs est de mesurer
les niveaux dits « de fond », c’est-à-dire loin des sources de contamination connues
(comme les grands centres urbains ou les sites industriels), et de suivre les
pollutions à longues distances selon un protocole défini [16]. Répété tous les cinq ans (à plus ou moins
un an près en fonction des pays, en 1990-1991, 1995-1996, 2000-2001, 2005-2006,
2010-2011, 2015-2016, 2020), ce programme a inclus en 2010-2011 environ 4 500 sites
de prélèvement répartis sur 25 pays européens. Douze éléments métalliques
– aluminium (Al), As, Cd, chrome (Cr), cuivre (Cu), fer (Fe), Hg, Ni, Pb, antimoine
(Sb), vanadium (V), zinc (Zn) – sont analysés. Les données obtenues, fournies par
les pays participants, ont ainsi permis de mettre en évidence une diminution au
niveau européen des niveaux de Pb (77 %) et de Cd (51 %) entre 1990 et 2010
(concomitamment avec les baisses des émissions) [17]. La participation française à ce programme date de 1996, dans le cadre du dispositif
BRAMM (Biosurveillance des retombées atmosphériques métalliques par les
mousses)5, coordonné par le Muséum national
d’histoire naturelle. Dans ce dispositif, les concentrations d’au moins 12 métaux
sont évaluées sur plus de 450 sites répartis sur l’ensemble du territoire
métropolitain. La dernière campagne de suivi a eu lieu en 2016. Elle a permis de
mettre en évidence une diminution des niveaux de Pb entre 1996 et 2011 en France,
mais aussi de révéler des variations temporelles moins évidentes pour les autres
métaux (notamment le Cd) [18]. Le dispositif BRAMM permet aussi d’identifier des contrastes
d’exposition au sein de la France métropolitaine, avec des régions plus ou moins
contaminées, comme les bassins industriels et populationnels pour les métaux émis
principalement par les activités humaines [19]. |
Apport des mousses en épidémiologie L’idée d’utiliser des mousses ou des lichens comme « proxy »6 de l’exposition des populations aux métaux atmosphériques
remonte aux années 1980 [20]. Comme les mousses, les lichens se nourrissent des éléments nutritifs
apportés majoritairement par les dépôts atmosphériques et sont, eux aussi, utilisés
comme témoins de la qualité de l’air. Selon les études, ils peuvent être utilisés
comme accumulateur de polluants, ou comme
indicateur d’un niveau de pollution, en fonction de leur
présence ou à cause de leur disparition. Une étude réalisée en 1997 en Vénétie (Italie) [21], a ainsi révélé l’existence d’une
corrélation entre la biodiversité des lichens présents sur les arbres, et la
mortalité de la population par cancer. Cette étude pionnière est restée à un niveau
écologique : elle comparait des données agrégées sur une même échelle géographique,
sur un petit bassin de population. Dans la région du Neiss, entre Allemagne,
République tchèque et Pologne, Wappelhorst et ses collègues ont de même établi des
corrélations entre concentrations de métaux dans les mousses et incidence,
entre 1993 et 1997, de maladies respiratoires (dans le cas du césium, du fer et du
gallium) et maladies cardiovasculaires (pour le thallium) [22]. Aux Pays-Bas, Wolterbeek et Verburg ont
analysé les corrélations entre les concentrations en métaux dosés dans les mousses
et le taux de mortalité, entre 1993 et 1995 [23] : 30 métaux ont été examinés et, après analyse factorielle,
neuf facteurs – assimilés à neuf sources de métaux – ont été corrélés à différentes
causes de décès. Enfin, une étude réalisée au Portugal a exploré les associations
entre les concentrations en métaux dans les lichens et la mortalité par cancer, en
ajustant sur diverses covariables (à un niveau agrégé7) ; les résultats indiquaient des associations positives (mais pas
forcément statistiquement significatives) entre Ni, Pb et V et mortalité par cancer
[24]. Ces travaux n’échappent pas aux limites des études écologiques utilisant des données
agrégées, notamment, l’impossibilité d’ajuster finement sur des variables
individuelles, et les difficultés d’interprétation des résultats au niveau
populationnel et individuel. Elles présentent également certaines limites
méthodologiques : une exposition peu précise avec des données non interpolées ou par
simple pondération inverse, faute de structure spatiale8 ; des méthodes statistiques limitées à la corrélation ou à la
régression linéaire multivariée, pour l’étude portugaise ; des résultats qui ne sont
pas, parfois, concordants entre études (même en analyse univariée pour l’étude
portugaise), ou avec la littérature, en particulier celle portant sur les métaux
classés cancérigènes. Malgré ces limites, les résultats obtenus restent suffisamment
intéressants pour motiver plus de recherches épidémiologiques utilisant les données
de concentrations en métaux obtenues par bioaccumulation par les mousses ou les
lichens. En 2019 [25], une étude a
été réalisée à partir des données épidémiologiques individuelles issues de la
cohorte française GAZEL [26], constituée de 20 000 volontaires9,, et des données de concentration en métaux obtenues entre 1996 et 2011 par
le dispositif BRAMM, à l’échelle de la France métropolitaine (sur environ 500 sites
de collectes sur l’ensemble du territoire métropolitain). Ces données de
concentration établies pour 13 métaux ont été interpolées grâce à une méthode
géostatistique10 , puis corrélées aux
décès identifiés dans la cohorte. Cette étude se voulait une « preuve de concept » quant à l’utilisation, dans une
étude au niveau individuel, des données de biosurveillance issues des mousses en
tant que marqueur d’exposition des populations (Figure 2). Les 13 métaux analysés au cours de 4
campagnes successives réalisées dans le contexte du dispositif BRAMM ont été
regroupés selon deux méthodes : un regroupement supervisé11, fondé sur les données de la littérature, et un regroupement
non-supervisé, déterminé par analyse en composantes principales12. Les deux méthodes distinguent les métaux d’origine
majoritairement anthropiques (comme le Pb et le Cd) des métaux majoritairement
naturels (comme le calcium et le Fe), et, pour l’analyse en composantes principales,
d’un groupe de métaux d’origine marine (comme le Na). L’étude se fonde sur une
analyse de survie selon le modèle de Cox : le modèle utilise l’exposition aux métaux
atmosphériques variant dans le temps, et est ajusté sur les principales covariables
individuelles comportementales (tabac, alcool, etc.) et sociodémographiques (sexe,
niveau d’études, etc.). Les résultats indiquent des associations positives entre
exposition aux métaux d’origine majoritairement anthropique et mortalité due à une
cause sans définition, une cause cardiovasculaire, ou une cause respiratoire.
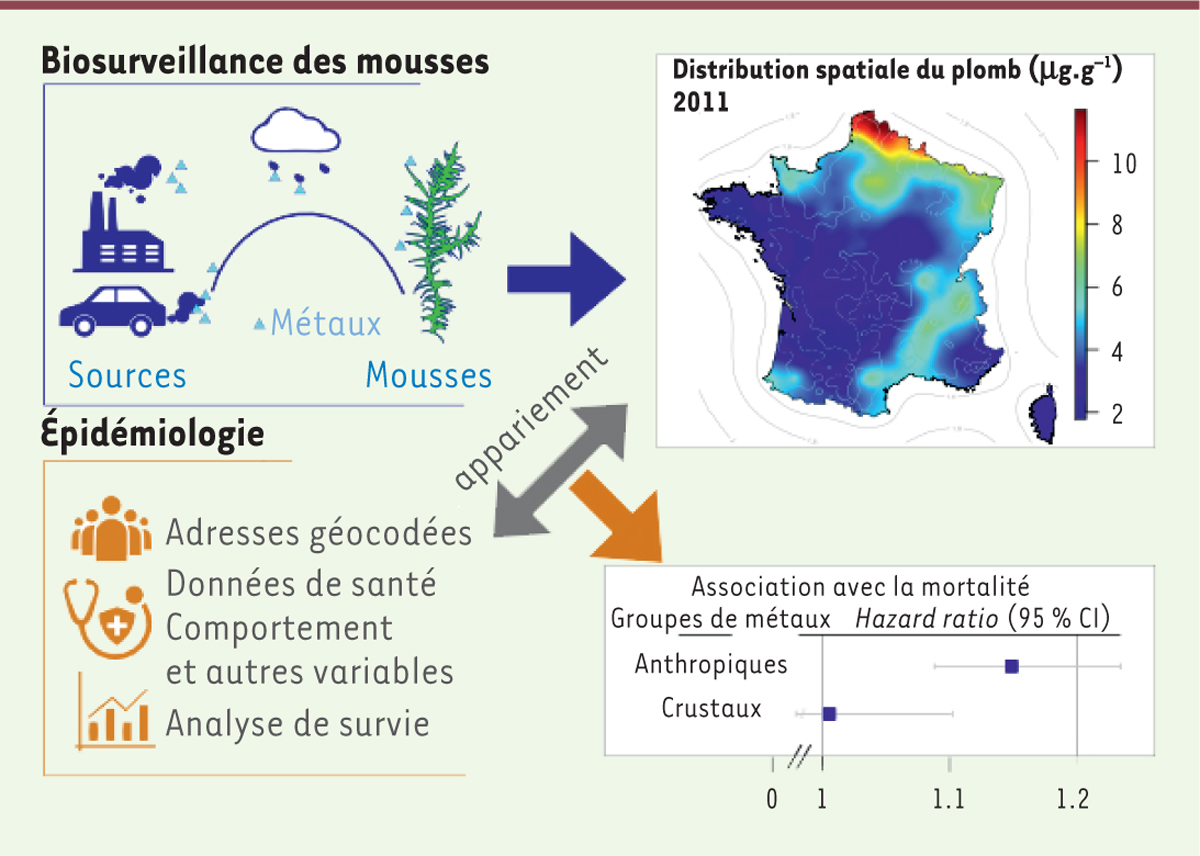
 | Figure 2. Principe général d’appariement des données de
biosurveillance et d’épidémiologie pour analyser les relations
entre exposition aux métaux de l’air et risque de mortalité
naturelle en France. Les métaux sont émis par
diverses sources et transportés dans l’atmosphère avant de se déposer
sur les mousses. Les campagnes de biosurveillance incluent la collecte,
la géolocalisation, et l’analyse des concentrations en métaux dans les
mousses. Ces concentrations peuvent être interpolées sur toute la France
par géostatistique (exemple du plomb en 2011). Ces estimations sont
ensuite attribuées aux adresses des participants de la cohorte GAZEL, et
groupées par analyse en composantes principales. L’analyse de survie
permet d’estimer des associations entre exposition aux métaux et risque
de mortalité, exprimé sous forme de « hazard ratio »,
ou rapport de risque entre les plus et les moins exposés. |
Selon leurs formes d’émissions, les métaux atmosphériques qui sont accumulés par les
mousses peuvent provenir majoritairement de particules, qui sont en elles-mêmes
associées à une mortalité [4]. Pour valider
l’hypothèse que les associations déterminées ont pour origine les métaux constituant
les particules et non les particules qui les contiennent, le modèle a été ajusté aux
valeurs d’exposition aux particules fines, fournies par un modèle développé pour
l’Europe [27].
L’association avec les métaux d’origine anthropique diminue mais persiste, ce qui
met en évidence un effet des métaux indépendant de celui des particules. Comme dans toutes les études observationnelles, la causalité est loin d’être
établie : les métaux peuvent être les marqueurs de sources émettant d’autres
polluants qui ne sont pas évalués à l’heure actuelle, et les mécanismes
physiologiques sur lesquels reposent les relations observées restent mal définis.
Cependant ces études ouvrent la voie à une recherche sur différents problèmes de
santé et invitent à explorer les effets des différents contaminants atmosphériques,
leur synergie, et leurs modes d’action. |
La biosurveillance de la qualité de l’air par les mousses est un outil efficace,
reconnu depuis des décennies en sciences environnementales. Elle peut permettre de
pallier les limites des jeux de données concernant les métaux atmosphériques qui
sont fournis par les méthodes physico-chimiques. Utiliser les données de
biosurveillance par les mousses comme marqueur d’exposition des populations aux
métaux atmosphériques, à un niveau agrégé ou individuel, fournit des résultats
complémentaires aux études sur les particules fines ou sur la pollution de l’air en
général. En termes épidémiologiques, de futures recherches sont nécessaires pour
relier ces valeurs d’expositions aux particules ainsi que pour mieux comprendre les
relations entre les mesures dans les mousses et les effets observés. De nombreux pays européens possèdent des dispositifs de surveillance de la qualité de
l’air fondés sur l’accumulation des métaux par les mousses. Ces données pourraient
être utilisées pour des études épidémiologiques régionales, nationales, voire même
internationales. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Les auteurs bénéficient du soutien financier de l’ADEME, de la Fondation ARC et de
l’ANR.
|
Footnotes |
1.
Vallero
DA
. Fundamentals of air pollution.
2014 ; New York:
Academic Press;
:1000. p 2.
Thurston
GD,
Kipen
H,
Annesi-Maesano
I, et al. A joint
ERS/ATS policy statement: what constitutes an adverse health effect of air
pollution? An analytical framework . Eur Respir
J.
2017; :49.. 4.
Pascal
M
,
de Chanel
PC
, Wagner
V, et al.
The mortality impacts of fine particles in
France . Science Total Environment.
2016; ; 571 :
:416.–425. 5.
Beelen
R
,
Hoek
G
,
Raaschou-Nielsen
O
, et al.
Natural-cause mortality and long-term exposure to particle
components: an analysis of 19 European cohorts within the multi-center
ESCAPE project . Environ Health Perspect.
2015; ; 123 :
:525.–533. 6.
Raaschou-Nielsen
O
,
Beelen
R
,
Wang
M
, et al.
Particulate matter air pollution components and risk for lung
cancer . Environment International.
2016; ; 87 :
:66.–73. 7.
Ostro
B
,
Lipsett
M
,
Reynolds
P
, et al.
Long-term exposure to constituents of fine particulate air
pollution and mortality: results from the California teachers
study . Environ Health Perspect.
2010; ; 118 :
:363.–369. 8.
Kelly
FJ
. Oxidative stress: its role in air pollution and
adverse health effects . Occupational Environmental
Medicine.
2003; ; 60 :
:612.–616. 9.
Gall
JE
,
Boyd
RS
,
Rajakaruna
N
. Transfer of heavy metals through terrestrial food
webs: a review . Environmental Monitoring
Assessment.
2015; ; 187 : :201.. 10.
Andujar
P
,
Bensefa-Colas
L
,
Descatha
A
. Acute and chronic cadmium
poisoning . Rev Med Interne.
2010; ; 31 :
:107.–115. 11.
Bensefa-Colas
L
,
Andujar
P
,
Descatha
A
. Mercury poisoning . Rev
Med Interne.
2011; ; 32 :
:416.–424. 12.
International Agency for Research on Cancer . IARC
monographs on the evaluation of carcinogenic risks to humans.
2016 ; Lyon: :
IARC; 13.
Markert
B
. Definitions and principles for bioindication and
biomonitoring of trace metals in the environment . J
Trace Elements Medicine Biology.
2007; ; 21 : (suppl 1)
:77.–82. 14.
Tyler
G.
. Bryophytes and heavy metals: a literature
review . Botanical J Linnean Society.
1990; ; 104 :
:231.–253. 15.
Bates
JW
. Mineral nutrient acquisition and retention by
bryophytes . J Bryology.
1992; ; 17 :
:223.–240. 16.
Harmens H. Monitoring of atmospheric deposition of heavy metals,
nitrogen and pops in europe using bryophytes. Monitoring manual.
International Cooperative Programme on Effects of Air Pollution on Natural
Vegetation and Crops, 2010.
17.
Harmens
H
,
Norris
DA
,
Sharps
K
, et al.
Heavy metal and nitrogen concentrations in mosses are declining
across Europe whilst some hotspots remain in 2010 .
Environmental Pollution.
2015; ; 200 :
:93.–104. 18.
Lequy
E,
Dubos
N,
Witté
I, et al. Assessing
temporal trends of trace metal concentrations in mosses over France between
1996 and 2011: a flexible and robust method to account for heterogeneous
sampling strategies . Environmental
Pollution.
2017;; 220 ((part B)) :
:828.–36. 19.
Lequy
E
,
Saby
NPA
,
Ilyin
I
, et al.
Spatial analysis of trace elements in a moss bio-monitoring data
over France by accounting for source, protocol and environmental
parameters . Science Total Environment.
2017; ; 590–1 :
:602.–610. 20.
Gailey
FA
,
Lloyd
OL
. Atmospheric metal pollution monitored by
spherical moss bags: a case study of Armadale .
Environ Health Perspect.
1986; ; 68 :
:187.–196. 21.
Cislaghi
C
,
Nimis
PL
. Lichens, air pollution and lung
cancer . Nature.
1997; ; 387 :
:463.–464. 22.
Wappelhorst
O
,
Kühn
I
,
Oehlmann
J
, et al.
Deposition and disease: a moss monitoring project as an approach
to ascertaining potential connections . Science Total
Environment.
2000; ; 249 :
:243.–256. 23.
Wolterbeek
HT
,
Verburg
TG
. Atmospheric metal deposition in a moss data
correlation study with mortality and disease in the
Netherlands . Science Total Environment.
2004; ; 319 :
:53.–64. 24.
Sarmento
S
,
Wolterbeek
HTh
,
Verburg
TG
, et al.
Correlating element atmospheric deposition and cancer mortality
in Portugal: data handling and preliminary results .
Environmental Pollution.
2008; ; 151 :
:341.–351. 25.
Lequy
E
,
Siemiatycki
J
,
Leblond
S
, et al.
Long-term exposure to atmospheric metals assessed by mosses and
mortality in France . Environment
International.
2019; ; 129 :
:145.–153. 26.
Goldberg
M
,
Leclerc
A
,
Zins
M
. Cohort profile update: the GAZEL cohort
study . Int J Epidemiol.
2015; ; 44 :
:77.–77g. 27.
de Hoogh
K
,
Chen
J
,
Gulliver
J
, et al.
Spatial PM2.5, NO2, O3 and BC models for Western Europe -
Evaluation of spatiotemporal stability . Environment
International.
2018; ; 120 :
:81.–92. |