| |
| Med Sci (Paris). 36(4): 316–319. doi: 10.1051/medsci/2020050.Une nouvelle population de cellules dendritiques
sanguines aux propriétés particulières vis-à-vis du VIH-1 Flavien Brouiller,1,2 Nicolas Ruffin,1 and Philippe Benaroch1* 1Institut Curie, PSL* research university, Inserm
U932, 12 rue
Lhomond, 75005Paris,
France 2Sorbonne université, ED394, Paris,
France MeSH keywords: Présentation d'antigène, Cellules sanguines, Séparation cellulaire, Cellules dendritiques, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Cellules souches, immunologie, cytologie, physiologie, sang |
En 2018, environ 38 millions de personnes dans le monde vivaient infectées par le virus
de l’immunodéficience humaine (VIH), dont 1,7 million de personnes nouvellement
infectées (source ONUSIDA). En dépit des politiques de prévention et de l’efficacité des
nouveaux traitements anti-rétroviraux, l’infection par le VIH demeure un enjeu majeur de
santé publique. Le VIH infecte des populations de cellules qui expriment à leur surface la molécule CD4,
nécessaire à l’entrée du virus : lymphocytes T CD4+, macrophages, et cellules
dendritiques (dendritic cells, DC). Ces dernières ont un rôle clé dans
la réponse anti-virale. En effet, elles ont la capacité de rapidement détecter la
présence de microorganismes pathogènes, et de produire alors des cytokines. Elles sont
également cruciales pour la mise en place de la réponse immunitaire adaptative, en
présentant des antigènes dérivés des pathogènes aux lymphocytes T, ce qui déclenche leur
activation [1]. Les DC sont moins
susceptibles à l’infection par le VIH que les lymphocytes T CD4+ ou les
macrophages, mais seraient néanmoins aussi impliquées dans la propagation de l’infection
par transmission du VIH à d’autres cellules [2, 3]. Il est
désormais admis que la transmission du virus de cellule à cellule est très efficace
[4]. La transmission du virus
par les DC peut s’effectuer, soit directement par contact entre cellules et passage de
virions d’une DC infectée à une cellule voisine (infection « en cis »),
soit après capture, sans infection, des particules virales par la DC, qui les transmet
ensuite à d’autres cellules par contact (infection « en trans ») [2]. Dans ce cas, les DC capturent les particules
virales grâce à leur récepteur Siglec-1 (CD169), qui présente une forte affinité pour
des gangliosides abondants sur l’enveloppe des virions [5]. L’hétérogénéité des DC présentes dans le sang a pu être finement analysée récemment grâce
aux techniques de protéomique et de transcriptomique sur cellule unique. Ces études ont
révélé la présence d’une nouvelle population de DC exprimant Siglec-1 de façon
constitutive, appelées pré-DC (ou AS-DC) [6, 7], qui
seraient des précurseurs des DC conventionnelles (cDC), également présentes dans le
sang. Ces dernières contiennent deux sous-populations de cellules (cDC1 et cDC2)
spécialisées dans la présentation antigénique aux lymphocytes T [1]. Enfin, les DC plasmacytoïdes (pDC) constituent une
sous-population de DC spécialisées dans la production de grandes quantités d’interférons
de type I en réponse à la détection de pathogènes [8]. Jusqu’ici, aucune fonction particulière n’avait
été attribuée aux pré-DC. La présence de Siglec-1 à leur surface et la capacité de ce
récepteur à se lier au VIH nous ont incités à analyser les relations des pré-DC avec le
VIH et à les comparer à celles des autres sous-populations de DC [9]. |
Les pré-DC sont susceptibles à l’infection par le VIH Pour cette étude, nous avons purifié, à partir d’échantillons de sang de donneurs
sains, les quatre sous-populations de DC définies précédemment, à savoir les pré-DC,
cDC1, cDC2, et pDC, par une combinaison de tris par billes magnétiques et cytométrie
en flux. En exposant ces sous-populations au VIH-1 in vitro, nous
avons montré que les pré-DC, et dans une moindre mesure les cDC2, sont susceptibles
à l’infection par le VIH qui utilise le corécepteur CCR5 (C-C motif
chemokine receptor 5) pour son entrée dans ces cellules (tropisme R5).
Néanmoins, seules les pré-DC sont infectées par le VIH, qui utilise alors le
corécepteur CXCR4 (C-X-C motif chemokine receptor 4) pour son
entrée dans ces cellules (tropisme X4). Dans ce dernier cas surtout, l’infection des
pré-DC est dépendante de Siglec-1, ce qui n’est pas le cas pour les cDC2. Les pré-DC
comme les cDC2 expriment le facteur SAMHD1 (SAM domain and HD
domain-containing protein 1), qui restreint l’infection. En
contrecarrant l’effet de SAMHD1 grâce à la protéine Vpx du VIH-2, on augmente
fortement les taux d’infection des pré-DC avec les deux types de VIH-1 (tropismes R5
et X4). Nous montrons notamment par microscopie électronique et immuno-marquages
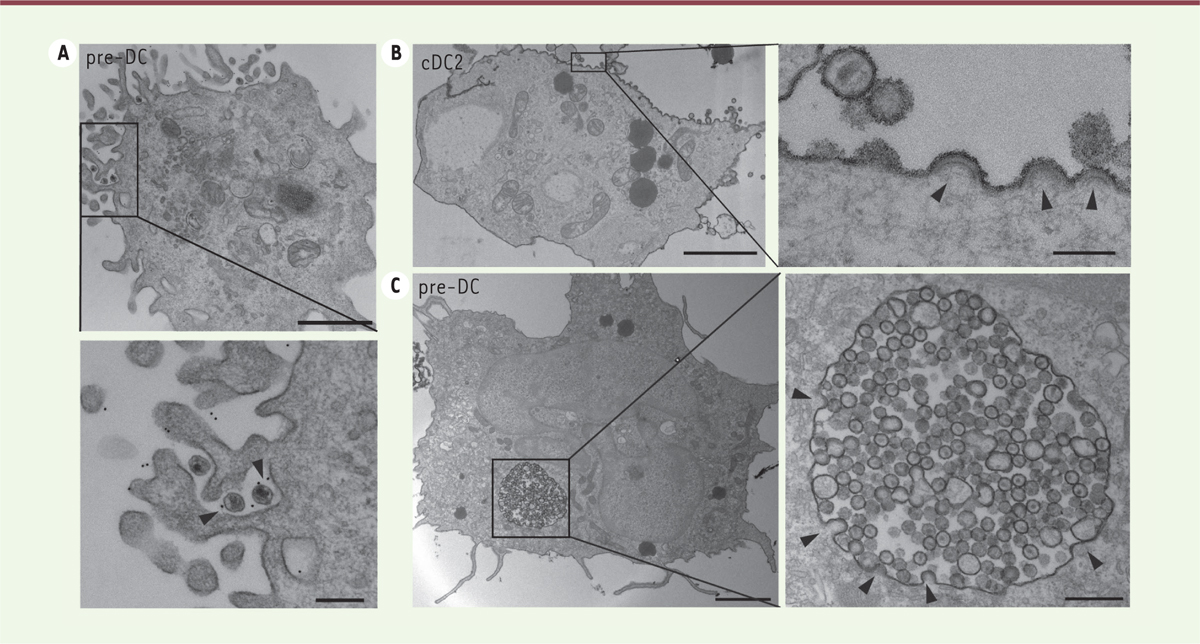
(Figure 1A) que
Siglec-1 est également essentiel pour la capture des particules virales par les
pré-DC. En effet, l’emploi d’un anticorps spécifique de Siglec-1 inhibe à la fois la
capture des particules virales par ces cellules et leur infection. Une fois
infectées, les pré-DC et les cDC2 sont toutes deux capables de produire des nouveaux
virions, qu’elles libèrent dans le milieu extérieur.
 | Figure 1.Les pré-DC capturent le VIH via Siglec-1 et produisent de
nouveaux virions dans des compartiments d’apparence
intracellulaire. A. Analyse par microscopie
électronique et immuno-marquage des pré-DC exposées au VIH-1 pendant
deux heures, fixées, et marquées avec un anticorps monoclonal dirigé
contre Siglec-1 (révélation par la protéine A couplée à des particules
d’or de 5 nm de diamètre). Une coupe Epon (inclusion dans la résine) est
représentée, avec un agrandissement en dessous. Les flèches indiquent un
marquage spécifique de Siglec-1 à l’interface entre le virus et les
invaginations de la membrane plasmique. Barre d’échelle : 2 µm (image du
haut) ou 0,5 µm (image agrandie). B-C.
Coupes Epon des cDC2 (B) et des pré-DC (C) infectées par le VIH-1 à
48 heures. Les cellules ont été fixées en présence de rouge de ruthénium
pour marquer les membranes en contact avec le milieu extracellulaire.
Les flèches indiquent des bourgeonnements viraux. Barre d’échelle : 2 µm
ou 0,15 µm (images agrandies) (figure adaptée d’après [ 9]). |
Les sites de production virale ont été étudiés par une analyse ultra-structurale, qui
a révélé qu’ils sont totalement distincts dans les deux sous-types de DC
(Figures 1B, 1C). Dans les cDC2 infectées par le VIH, les
bourgeonnements viraux s’effectuent de façon très polarisée et uniquement à la
membrane plasmique (Figure
1B), comme c’est le cas dans les lymphocytes T CD4+
infectés. En revanche, dans les pré-DC infectées, les sites de bourgeonnements
viraux sont concentrés dans la membrane limitante de compartiments apparemment
intracellulaires, contenant dans leur lumière de nombreuses particules virales. Ces
compartiments sont connectés au milieu extérieur, comme c’est le cas dans les
macrophages infectés [10].
Cela est attesté par la présence au niveau des membranes de ces compartiments et des
particules virales, d’un colorant ajouté au moment de la fixation des cellules, le
rouge de ruthénium, qui souligne les membranes d’une ombre grisée, sans les
traverser (Figure 1C). Ainsi, les pré-DC exposées à des particules de VIH-1 sont capables de les capturer
via Siglec-1, d’être infectées, et de produire de nouvelles
particules virales qui s’accumulent dans la lumière de compartiments
intracellulaires de façon similaire à ce qui est observé dans les macrophages
primaires infectés par le virus. Les pré-DC peuvent se différencier en cDC2 qui,
après leur infection par le virus, se comportent comme des lymphocytes T en
produisant de nouveaux virions. |
Activées ou non, les pré-DC sont capables de transmettre le VIH-1 à d’autres
cellules En raison de leur susceptibilité au VIH-1 et de leur expression constitutive de
Siglec-1, les pré-DC pourraient participer à la propagation du virus aux lymphocytes
T CD4+. Nous avons montré que l’infection est transmise à des lymphocytes
T CD4+ activés lorsqu’ils sont co-cultivés avec des pré-DC infectées
(infection en cis). Les pré-DC infectées sont donc capables de
produire des particules virales infectieuses. Le VIH-1 parvient à fusionner avec 80 % des pré-DC fraîchement purifiées. Néanmoins,
il est totalement incapable de fusionner lorsque les pré-DC ont été activées au
préalable par des ligands des récepteurs Toll-like. Ainsi, les
pré-DC activées sont totalement résistantes à l’infection, mais elles s’avèrent
toujours capables de capturer, via Siglec-1, des particules
virales, qu’elles parviennent à transmettre à des lymphocytes T CD4+
activés (infection en trans). En employant le VIH-1 comme microorganisme pathogène modèle, notre étude a permis la
première caractérisation fonctionnelle d’une population de DC, les pré-DC, jusque-là
définie essentiellement d’un point de vue ontogénique. L’expression constitutive de
Siglec-1 par les pré-DC leur confère des propriétés uniques de capture, d’infection
et de transmission du VIH-1 par rapport aux autres sous-populations de DC sanguines
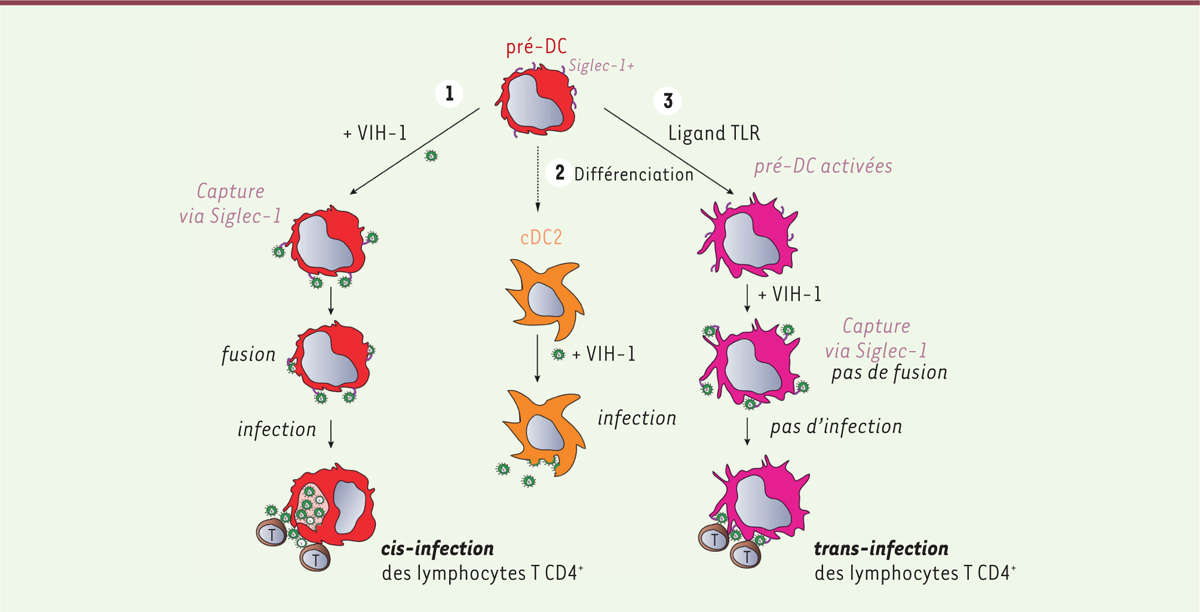
(Figure 2). Il reste
désormais à analyser le rôle des pré-DC dans la mise en place de la réponse
immunitaire antivirale et dans le maintien des différentes sous-populations de DC au
cours de l’infection, ainsi qu’à étudier les mécanismes de fusion avec des
particules virales mis en jeu dans ces différentes sous-populations.
 | Figure 2.Les pré-DC possèdent des propriétés uniques vis-à-vis de
l’infection par le VIH. Différentes situations
sont observées. 1. Les pré-DC peuvent
capturer VIH-1 via Siglec-1, fusionner avec le virus,
et devenir infectées. Elles produisent alors de nouveaux virus dans des
compartiments d’apparence intracellulaire. Les nouveaux virus sont
efficacement transmis en cis aux lymphocytes T
CD4 +. 2. Les pré-DC peuvent
se différencier en cDC2, susceptibles à l’infection par le VIH-1
(tropisme R5). Les cDC2 infectées produisent de nouveaux virus à leur
membrane plasmique. 3. Après activation,
les pré-DC résistent à l’infection par le VIH-1. Elles peuvent néanmoins
encore capturer les particules virales via Siglec-1, et
les transmettent efficacement aux lymphocytes T CD4 + activés.
TLR : Toll-like receptor (figure adaptée d’après [ 9]). |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Ces travaux de recherche ont été soutenus par les subventions suivantes, attribuées à
Philippe Benaroch : ANRS (agence nationale de recherche contre le SIDA et les
hépatites virales) ECTZ72276, Sidaction (Ensemble contre le SIDA) 2018-1-AEQ-11984,
ANR (agence nationale pour la recherche) ANR-10-IDEX-0001-02 PSL et
ANR-11-LABX-0043. Nicolas Ruffin a bénéficié de bourses post-doctorales de l’ANRS et
de la FRM (fondation pour la recherche médicale). Flavien Brouiller bénéficie d’une
bourse doctorale de Sorbonne Université.
|
1.
Schlitzer
A
,
Mcgovern
N
,
Ginhoux
F
. Dendritic cells and monocyte-derived cells: Two
complementary and integrated functional systems .
Semin Cell Dev Biol.
2015; ; 41 :
:9.–22. 2.
Granelli-Piperno
A
,
Delgado
E
,
Finkel
V
, et al.
Immature dendritic cells selectively replicate macrophagetropic
(M-tropic) human immunodeficiency virus type 1, while mature cells
efficiently transmit both M- and T-tropic virus to T cells .
J Virol.
1998; ; 72 :
:2733.–2737. 3.
Mcilroy
D
,
Autran
B
,
Cheynier
R
, et al.
Infection frequency of dendritic cells and CD4+ T
lymphocytes in spleens of human immunodeficiency virus-positive
patients . J Virol.
1995; ; 69 :
:4737.–4745. 4.
Sattentau
Q.
. Avoiding the void: cell-to-cell spread of human
viruses . Nat Rev Microbiol.
2008; ; 6 :
:815.–826. 5.
Izquierdo-Useros
N
,
Lorizate
M
,
Mclaren
PJ
, et al.
HIV-1 capture and transmission by dendritic cells: The role of
viral glycolipids and the cellular receptor Siglec-1 .
PLoS Pathog.
2014; ; 10 :
:e1004146.. 6. See
P,
Dutertre
CA,
Chen
J, et al.
Mapping the human DC lineage through the integration of
high-dimensional techniques . Science.
2017;; 56. pii: eaag3009. doi: 10.1126/science.aag3009.. 7. Villani
AC,
Satija
R,
Reynolds
G, et al.
Single-cell RNA-seq reveals new types of human blood dendritic
cells, monocytes, and progenitors . Science.
2017;; 3. pii: eaah4573. doi: 10.1126/science.aah4573.. 8.
Müller-Trutwin
M
,
Hosmalin
A
. Role for plasmacytoid dendritic cells in anti-HIV
innate immunity . Immunol Cell Biol.
2005; ; 83 :
:578.–585. 9.
Ruffin
N
,
Gea-Mallorquí
E
,
Brouiller
F
, et al.
Constitutive Siglec-1 expression confers susceptibility to HIV-1
infection of human dendritic cell precursors . Proc
Natl Acad Sci USA.
2019; ; 116 :
:21685.–21693. 10.
Hammonds
JE
,
Beeman
N
,
Ding
L
, et al.
Siglec-1 initiates formation of the virus-containing compartment
and enhances macrophage-to-T cell transmission of HIV-1 .
PLoS Pathog.
2017; ; 13 :
:e1006181.. |