| |
| Med Sci (Paris). 36(4): 313–316. doi: 10.1051/medsci/2020048.Un dialogue précoce indispensable entre cellules MAIT
et microbiote Hélène Gilgenkrantz1* 1Centre de recherche sur l’Inflammation, Inserm UMR 1149 -
Université Paris Diderot, Faculté de médecine Xavier-Bichat,
16 rue Henri Huchard,
75018Paris,
France MeSH keywords: Animaux, Communication cellulaire, Croissance et développement, Homéostasie, Humains, Phénomènes du système immunitaire, Activation des lymphocytes, Microbiote, Cellules T invariantes associées aux muqueuses, Peau, Phénomènes physiologiques de la peau, Facteurs temps, Cicatrisation de plaie, immunologie, physiologie, croissance et développement, microbiologie, physiopathologie |
Les cellules MAIT (mucosal-associated invariant T cells) se situent au
carrefour de l’immunité, de l’inflammation, et du microenvironnement microbien.
Fortement représentées dans les tissus jouant un rôle de barrière comme le chorion
(lamina propria) de la muqueuse intestinale ou la peau, elles sont
rapidement activées au contact des bactéries. Elles sont également abondantes dans le
sang ou le foie, où elles représentent respectivement de 10 à plus de 20 % des cellules
T [1, 2]. Si l’abondance des MAIT est très variable d’un
individu à l’autre, leur nombre est en revanche très souvent diminué dans le sang de
patients présentant une maladie à composante immunitaire ou inflammatoire comme le
diabète [3, 4, 14] (→), la cirrhose [5], ou certaines maladies auto-immunes [6].
(→) Voir les Nouvelles de I. Magalhaes et A. Lehuen, m/s n° 8-9,
août-septembre 2015, page 717, et de O. Rouxel et A. Lehuen, m/s
n° 6-7, juin-juillet 2018, page 518
En se fondant sur l’importance de la colonisation intestinale dans le développement du
système immunitaire, une équipe américaine s’est interrogée sur le rôle de la flore
commensale dans l’abondance et la fonction des lymphocytes MAIT. La faible
représentation des cellules MAIT chez la souris et l’absence d’anticorps monoclonal
dirigé contre leur récepteur de l’antigène (T cell receptor, TCR)
rendaient la tâche ardue. L’équipe de Yasmine Belkaid (Bethesda, États-Unis) vient
néanmoins de montrer dans la revue Science que l’exposition intestinale
à certaines espèces de bactéries commensales durant une fenêtre de temps limitée aux
trois premières semaines de vie postnatale déterminait le développement et l’abondance
des cellules MAIT à l’âge adulte, et que les interactions que ces cellules entretiennent
avec la flore bactérienne modulaient leur fonction et avaient une influence sur la
réparation tissulaire [7]. |
Éducation du système immunitaire : le rôle du microbiote Tous les tissus ayant un rôle de barrière sont colonisés par des bactéries qui
permettent la maturation et l’homéostasie du système immunitaire, notamment en
relarguant des métabolites microbiens [3]. En
retour, le système immunitaire est capable de moduler le microbiote et de maintenir
l’intégrité de la fonction barrière du tissu. Ainsi, la colonisation néonatale des
poumons permet à la souris adulte d’induire des lymphocytes T régulateurs et de
promouvoir une tolérance à certains allergènes [8]. De même, la colonisation intestinale
post-natale précoce chez la souris inhibe la prolifération des lymphocytes T
« natural killer » (cellules NKT) et prévient le développement
d’une colite induite [9-10]. Néanmoins, la nature des
antigènes et des signaux impliqués dans ce dialogue restait encore mystérieuse, et
le rôle même des cellules immunitaires dans l‘homéostasie tissulaire était mal
compris. |
Nature et fonction des cellules MAIT Les cellules MAIT ont été décrites il y a presque 20 ans par l’équipe française d’O.
Lantz [11]. Elles
appartiennent à la famille des lymphocytes T non conventionnels et ont, à l’instar
des cellules iNKT (invariant natural killer T cells), la
particularité d’exprimer un récepteur T semi-invariant puisque la chaîne invariante
a (Va7.2-Ja33 chez l’homme et Va19-Ja33 chez la souris) s’associe à un nombre
restreint de chaînes b. La proportion des lymphocytes MAIT sanguins augmente au
cours du développement post-natal, atteint un pic à l’âge adulte, puis a tendance à
diminuer avec l’âge. La maturation des MAIT est dépendante de la molécule non polymorphe MR1
(major histocompatibility complex class I-related protein) de
classe 1b du système majeur d’histocompatibilité, qui est exprimée par différents
types de cellules. Si l’expression de MR1 est nécessaire au développement des MAIT -
les souris déficientes en MR1 en sont en effet dépourvues -, en revanche elle n’est
pas indispensable à leurs fonctions effectrices. Il aura néanmoins fallu attendre
l’année 2012 pour comprendre que les cellules présentatrices d’antigènes (CPA)
utilisaient MR1 pour présenter aux cellules MAIT des antigènes microbiens
particuliers, issus de la voie de synthèse de la vitamine B2 (riboflavine) [12], qui sont hautement
conservés dans différentes espèces de bactéries (entérobactéries, staphylocoques,
mycobactéries, etc.), champignons et levures. Les cellules MAIT ont une fonction effectrice mémoire, et sont activées de deux
façons différentes : soit de façon dépendante de la présentation d’antigènes
microbiens par MR1, soit de façon MR1-indépendante, via certaines
cytokines inflammatoires comme les interleukines (IL) 12 et 18 (Figure 1). Elles répondent alors
très rapidement à ces stimulations en sécrétant des cytokines pro-inflammatoires de
profil TH1/TH17, notamment l’interféron-g (IFN-g), le
tumor necrosis factor-a (TNF-a), l’IL-17 ou l’IL-22, et ont
aussi des fonctions cytotoxiques puisqu’elles libèrent du granzyme B et de la
perforine lorsqu’elles sont activées. Leur capacité sécrétoire varie en fonction des
tissus. La contribution respective des antigènes et des cytokines pour activer les
MAIT est néanmoins encore mal comprise.
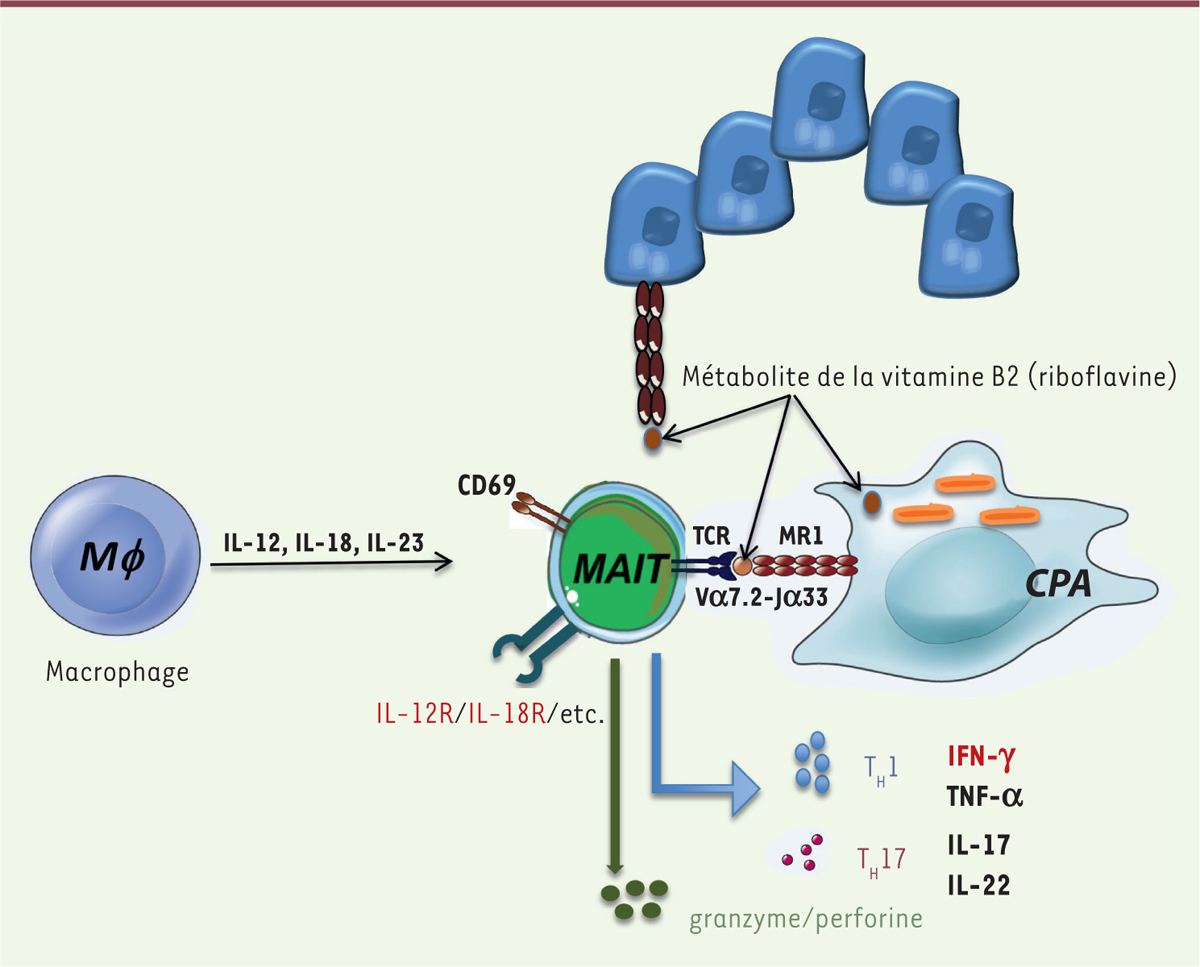
 | Figure 1. Mécanismes d’activation des MAIT. Les lymphocytes MAIT sont
activés par deux voies : (1) par certaines
cytokines sécrétées par les monocytes/macrophages ou par des cellules
épithéliales (IL-12, IL-18, IL-23) ou (2) via la
molécule MR1 du complexe majeur d’histocompatibilité qui active le TCR
semi-invariant des MAIT. Au cours d’une infection par des pathogènes,
les cellules « professionnelles » de la présentation d’antigènes (CPA)
ou les cellules épithéliales peuvent présenter les métabolites
bactériens comme la vitamine B2 (ou riboflavine) via la
molécule MR1. En retour, les cellules MAIT produiront des cytokines
inflammatoires de type TH1 ou TH17 et auront
également des fonctions cytotoxiques en sécrétant granzyme et
perforine. |
|
Homéostasie tissulaire des MAIT : une fenêtre étroite dans le développement
post-natal Comme les autres lymphocytes T, les MAIT se développent dans le thymus, où elles sont
immatures, et acquièrent leurs fonctions effectrices pendant leur développement
[13]. Elles
s’accumulent dans les tissus barrières entre 2 et 3 semaines de vie chez la souris
(Figure 2). Or, si
leur abondance tissulaire est très variable au sein d’une même lignée de souris
élevées en conditions dépourvues de pathogènes spécifiques, cette disparité
disparaît lorsque les souris sont élevées dans une même cage, suggérant le rôle
potentiel du microbiote dans cette variabilité (rappelons que les souris sont
coprophages, ce qui entraîne une homogénéisation de leur microbiote au sein d’un
même élevage). Pour le montrer, les auteurs ont étudié la corrélation entre
l’apparition de bactéries commensales dans l’intestin et la dynamique d’apparition
et de maturation des MAIT dans la peau, où elles représentent jusqu’à 40 % des
lymphocytes Tab chez la souris adulte et 2 % des lymphocytes CD3+ chez
l’homme. En colonisant des souris dépourvues de microbiote (souris
germ-free, GF, ou axéniques) à différents temps après la
naissance par les cinq espèces de bactéries qui sont normalement présentes à cette
période de la vie, les auteurs ont démontré que le développement et l’accumulation
des MAIT dans les tissus nécessitaient une exposition aux germes durant les trois
premières semaines post-natales. Passé ce délai, si les lymphocytes T
helper TH17 sont toujours induits, il existe en
revanche un défaut de représentation et d’activation des cellules MAIT. Parmi ces
cinq espèces bactériennes, Proteus mirabilis suffit à permettre le
développement des MAIT. Ainsi, il est possible de reproduire localement l’exposition
aux antigènes microbiens pendant une période, toutefois restreinte, du développement
post-natal, faute de quoi le développement et la maturation des cellules MAIT seront
définitivement compromis [7].
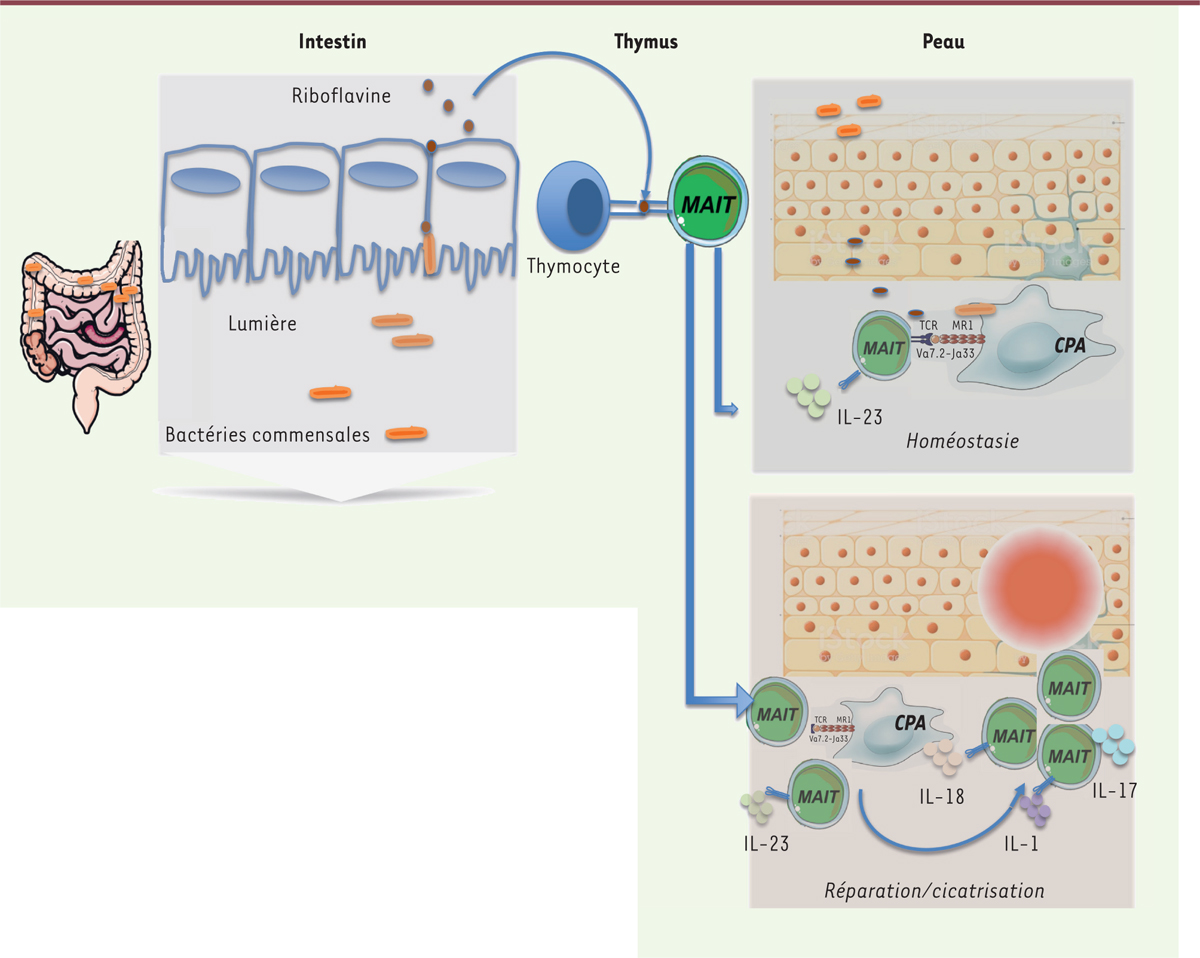
 | Figure 2. La colonisation microbienne précoce détermine l’homéostasie
des MAIT et le dialogue entre MAIT et microbiote module leur
fonction. L’intestin est colonisé précocement en
période post-natale par un microbiote composé de bactéries commensales.
Celles-ci expriment des métabolites dérivés de la riboflavine. Plus ces
bactéries seront nombreuses, plus la représentation des MAIT
tissulaires, ici dans la peau, sera grande. Les MAIT se développent dans
le thymus et requièrent l’IL-23 pour leur accumulation. En cas de lésion
cutanée, les cellules présentatrices d’antigène (CPA) recruteront des
cellules MAIT via MR1 ou via la
sécrétion d’IL-18. Cette activation des MAIT induit la production
d’autres interleukines comme l’IL-17, et améliore la cicatrisation
cutanée. |
|
Activation et rôle des MAIT cutanées dans la réparation tissulaire Les auteurs confirment que les cellules MAIT sont activées localement, soit par des
cytokines, notamment l’IL-1 et l’IL-18, soit par une reconnaissance d’antigènes,
métabolites de la riboflavine, par l’intermédiaire de MR1. Les résultats obtenus
suggèrent que, dans le cadre d’une réponse homéostatique au microbiote, l’activation
des MAIT est strictement dépendante du TCR (Figure 2). Dans la peau, les MAIT sont présentes à
l’interface entre le derme et l’épiderme, avec une majorité dans le derme et à
proximité de la couche basale de l’épiderme. L’analyse du profil transcriptionnel
des MAIT cutanées révèle l’expression de nombreux gènes de réparation tissulaire.
Les MAIT cutanées sont activées localement par les antigènes microbiens de la flore
commensale. Pour déterminer si, à l’instar d’autres lymphocytes ILC
(innate-like cells), les MAIT ont un rôle dans la réparation
tissulaire, un modèle de re-épithélialisation après lésion cutanée a été développé
chez des souris rendues déficientes en MAIT par invalidation du gène codant MR1
(souris Mr1-/-). Ces souris cicatrisent moins rapidement
que des souris témoins. Ce rôle est également souligné par le fait que
l’administration locale d’un antigène microbien dérivé de la riboflavine induit un
afflux de cellules MAIT cutanées et améliore la réparation et la cicatrisation
[7] (Figure 2). La plupart des bactéries commensales de la peau
exprimant des métabolites dérivés de la riboflavine, ces antigènes pourraient
contribuer non seulement à l’homéostasie cutanée, mais également à la réparation
tissulaire en cas de lésion. Ce travail permet de mieux comprendre le dialogue qui se met en place très
précocement au cours de la vie des mammifères entre le système immunitaire et le
microbiote, via la reconnaissance d’antigènes microbiens
spécifiques qui contrôleraient l’homéostasie des MAIT. Il montre également que la
fenêtre temporelle post-natale permettant au microbiote, en particulier aux
bactéries qui synthétisent la riboflavine, de déterminer le nombre et l’activité des
MAIT est restreinte, au moins chez la souris. Cette observation pourrait expliquer
l’abondance très variable des MAIT notée chez l’homme. Néanmoins, dans l’espèce
humaine, les lymphocytes T se développent in utero, et l’empreinte
pourrait se produire avant la naissance. La participation des MAIT à la réparation
tissulaire ouvre des perspectives thérapeutiques intéressantes puisque l’on peut
désormais imaginer que l’administration topique1 de certains antigènes pourrait accélérer la cicatrisation. |
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1.
Chen
P
,
Deng
W
,
Li
D
, et al.
Circulating mucosal-associated invariant T cells in a large
cohort of healthy chinese indiviuals from newborn to
elderly . Front Immunol.
2019; ; 10 : :260.. 2. Ben
Youssef
G,
Tourret
M,
Salou
M, et al.
Ontogeny of human mucosal-associated invariant T cells and
related T cell subsets . J Exp Med.
2018;; 215 :
:459.–79. 3.
Belkaid
Y
,
Hand
TW
. Role of the microbiota in immunity and
inflammation . Cell.
2014; ; 157 :
:121.–141. 4.
Magalhaes
I
,
Lehuen
A
. Les lymphocytes MAIT dans le diabète de type 2 et
l’obésité . Med Sci (Paris).
2015; ; 31 :
:717.–719. 5.
Hegde
P
,
Weiss
E
,
Paradis
V
, et al.
Mucosal-invariant T cells are a profibrogenic immune cell
population in the liver . Nat Commun.
2018; ; 9 : :2146.. 6.
Toubal
A
,
Nel
I
,
Lotersztajn
S
,
Lehuen
A
. Mucosal-associated invariant T cells and
disease . Nat Rev Immunol.
2019; ; 19 :
:643.–657. 7.
Constantinedes
MG
,
Link
VM
,
Tamoutounour
S
, et al.
MAIT cells are imprinted by the microbiota in early life and
promote tissue repair . Science.
2019; ; 366 :
:1.–13. 8.
Gollwitzer
ES
,
Saglani
S
,
Trompette
A
, et al.
Lung microbiota promotes tolerance to allergens in neonates via
PDL-1 . Nat Med.
2014; ; 20 :
:642.–647. 9.
Olszak
T
,
An
D
,
Zeissig
S
, et al.
Microbial exposure during early life has persistent effects on
natural killer T cell function . Science.
2012; ; 336 :
:489.–493. 10.
An
D
,
Oh
SF
,
Olszak
T
, et al.
Sphingolipids from a symbiotic microbe regulate homeostasis of
host intestinal natural killer T cells .
Cell.
2014; ; 156 :
:123.–133. 11.
Treiner
E
,
Duban
L
,
Bahram
S
, et al.
Selection of evolutionarily conserved mucosal-associated
invariant T cells by MR1 . Nature.
2003; ; 422 :
:164.–169. 12.
Kjer-Nielsen
L
,
Patel
O
,
Corbett
AJ
, et al.
MRA présents microbial vitamin B métabolites to MAIT
cells . Nature.
2012; ; 491 :
:717.–723. 13.
Koay
HF
,
Gherardin
NA
,
Enders
A
, et al.
A three stage intrathymic development pathway for the
mucosal-associated invariant T cell lineage . Nat
Immunol.
2016; ; 17 :
:1300.–1311. 14.
Rouxel
O
,
Lehuen
A
. Les cellules MAIT : un lien entre l’intestin et
le diabète de type 1 . Med Sci (Paris).
2018; ; 34 :
:518.–522. |