Les maladies nutritionnelles hépatiques regroupent la maladie alcoolique du foie (MAF) et une maladie que l’on appelle communément la « maladie du foie gras », ou non alcoholic fatty liver disease (NAFLD). Dans ces deux maladies chroniques, le spectre évolutif des lésions hépatiques est assez semblable. On observe d’abord une accumulation de triglycérides au sein du parenchyme hépatique, qui peut évoluer vers une hépatite (hépatite alcoolique pour la MAF, ou stéatohépatite [non alcoholic steatohepatitis, NASH] pour la NAFLD), puis vers une fibrose, et enfin vers une cirrhose, avec ses complications.
La MAF est la principale cause de cirrhose en France, où elle représente un problème majeur de santé publique. Sa forme la plus grave, l’hépatite alcoolique sévère, est associée à un risque élevé de mortalité. La maladie est traitée avec des corticostéroïdes, mais avec une efficacité limitée. La transplantation hépatique est le seul traitement curatif, mais elle n’est accessible qu’à un nombre limité de patients. Pour la NAFLD, malgré de nombreux essais cliniques effectués ces derniers années, les options thérapeutiques sont également limitées, et la transplantation hépatique reste la meilleure option pour les formes avancées [1].
Cependant, ces maladies nutritionnelles hépatiques ne se développent que chez certains patients, ce qui pourrait être expliqué par un polymorphisme génétique. La dernière décennie a permis de montrer que le microbiote1 intestinal était également un acteur clé dans la susceptibilité individuelle à ces maladies (→).
(→) Voir le numéro thématique Le microbiote : cet inconnu qui réside en nous, m/s n° 11, novembre 2016, pages 999-1016
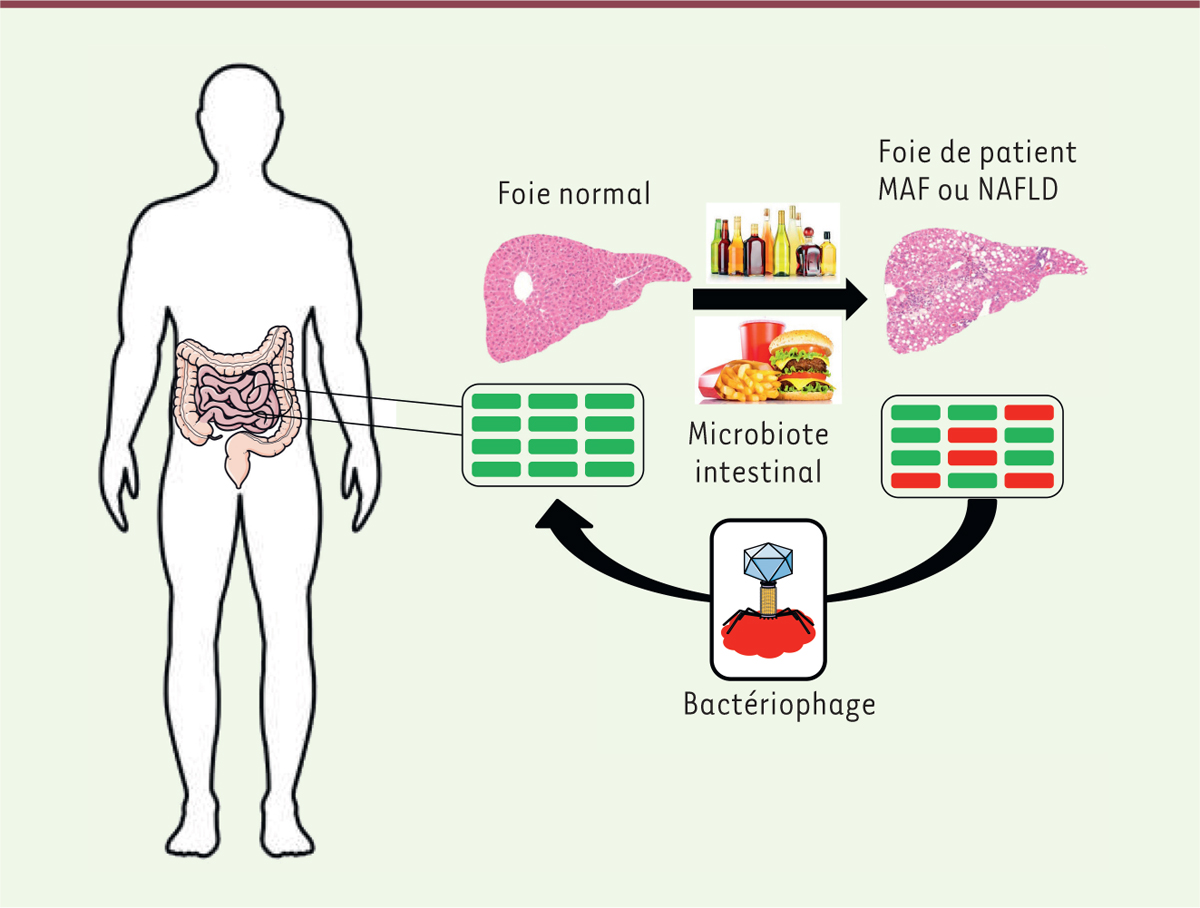
| Figure 1. La phagothérapie pour éradiquer des bactéries intestinales
impliquées dans les maladies nutritionnelles
hépatiques. La maladie alcoolique du foie (MAF) et la
non alcoholic fatty liver disease (NAFLD) présentent la
même évolution physiopathologique. Enterococcus faecalis et
une souche de Klebsiella pneumoniae productrice d’alcool,
surabondantes (rectangles rouges) dans le microbiote intestinal de patients,
ont été identifiées comme contribuant aux lésions du foie, respectivement
dans la MAF et la NAFDL [7,8]. En
effet, dans les deux cas, l’éradication ciblée de la bactérie intestinale
par phagothérapie a permis de prévenir les lésions hépatiques dans des
modèles murins. |
En effet, les patients ayant une MAF ou une NAFLD présentent des modifications spécifiques de leur microbiote en fonction du stade de la maladie [2,3], et nous avons montré que le transfert d’un microbiote intestinal humain spécifique de ces maladies à des souris suffisait à leur transmettre une susceptibilité individuelle à ces maladies [4,4].
Dans ce contexte, plusieurs pistes ont été envisagées pour améliorer le contrôle de ces deux maladies en utilisant comme cible le microbiote intestinal.
- La transplantation fécale, qui est associée à un rapport bénéfice-risque incertain lié au choix du donneur.
- L’identification des bactéries protectrices spécifiques de la MAF ou de la NAFLD, ou d’un microbiote protecteur qui pourrait être administré aux patients comme le serait un probiotique.
-
L’identification des bactéries nocives et leur éradication. Des essais
cliniques utilisant des traitements antibiotiques sont en cours, mais cette
approche manque de spécificité et comporte le risque d’induire des
résistances bactériennes aux antibiotiques. Un ciblage spécifique des
bactéries délétères apparaît donc nettement préférable. Les bactériophages
sont des virus qui infectent les bactéries avec une spécificité liée à
l’espèce bactérienne, offrant ainsi un ciblage spécifique [6]. Leur utilisation
thérapeutique, envisagée depuis longtemps [11-13] (→) pourrait se
révéler pertinente contre la MAF et la NAFLD, comme l’indiquent deux
articles récents qui en ont testé l’efficacité dans des modèles murins
[7,8].
(→) Voir la Chronique génomique de B. Jordan, m/s n° 10, octobre 2019, page 806, la Nouvelle de L. Chaffraingeon et al., m/s n° 6-7, juin-juillet 2019, page 581, et la Synthèse de N. Dufour et L. Debarbieux, m/s n° 4, avril 2017, page 410
En 2017, le groupe dirigé par B. Schnabl (San Diego, États-Unis) avait montré que les patients alcooliques qui consomment des antiacides ont un risque accru de développer des formes sévères de MAF. Ces patients présentaient une augmentation de la proportion d’Enterococcus faecalis au sein de leur microbiote intestinal, et l’administration d’E. faecalis à des souris suffisait à aggraver les lésions hépatiques consécutives à une alcoolisation [9]. En 2019, le même groupe a montré que si cette bactérie commensale représente moins de 0,1 % des bactéries intestinales chez des individus sains, elle est 3 000 fois plus abondante chez des individus souffrant d’une hépatite alcoolique [7]. E. faecalis est une espèce capable de produire une cytolysine, une bactériocine2 responsable de la lyse de bactéries à Gram positif, mais pouvant également induire la lyse de cellules de l’épithélium intestinal. De fait, la présence de cytolysine dans les fèces est corrélée à la mortalité chez les patients ayant une hépatite alcoolique sévère. Afin de démontrer le potentiel thérapeutique de l’éradication de cette bactérie, des souris alcoolisées (correspondant à un modèle murin de MAF) ont été traitées soit avec une souche d‘E. faecalis produisant la cytolysine, soit avec une souche ne produisant pas de cytolysine. Les souris recevant la souche d’E. faecalis produisant la cytolysine ont présenté des lésions hépatiques plus importantes, qu’un traitement par un bactériophage ciblant E. faecalis a permis de faire régresser. Ces résultats mettent en évidence le potentiel thérapeutique de la phagothérapie. Néanmoins, si E. faecalis est surabondante chez 80 % des patients ayant une hépatite alcoolique, elle ne produit la cytolysine que chez 30 % d’entre eux. D’autres bactéries qui pourraient participer à la susceptibilité individuelle du développement d’une MAF et qui pourraient être la cible d’une phagothérapie restent vraisemblablement à identifier.
De fait, les résultats récents obtenus en étudiant une bactérie particulière au cours de la NAFLD renforcent cette hypothèse [8]. En 2013, il avait été montré, dans une cohorte d’adolescents obèses, que les patients ayant une NAFLD/NASH présentaient un microbiote intestinal différent de celui des patients obèses sans NAFLD/NASH. On observait notamment un enrichissement en protéobactéries, un phylum qui comprend une grande diversité d’espèces bactériennes, dont certaines produisent de l’alcool. Effectivement, les concentrations plasmatiques d’alcool étaient plus élevées chez ces patients obèses ayant une NAFLD/NASH, sans qu’une relation de cause à effet ait pu être établie avec la maladie [10]. Grâce à l’étude publiée en 2019 par Yuan et ses collègues, la relation de causalité entre une bactérie productrice d’alcool et la NAFLD est désormais démontrée [8]. L’identification d’une telle bactérie a été faite chez un patient ayant une NASH et présentant un syndrome « d’auto-brasserie ». Ce syndrome extrêmement rare avait précédemment été associé à la sur-représentation d’une levure du genre Saccharomyces. Chez ce patient, le microbiote intestinal présentait une proportion élevée de protéobactéries associée à une concentration plasmatique d’alcool élevée [8]. Parmi les espèces bactériennes surabondantes chez ce patient, les auteurs ont montré que la proportion de Klebsiella pneumoniae, une espèce bactérienne dont différentes souches sont capables de produire de l’alcool (High-alcohol-producing strains of Klebsiella pneumoniae, HiAlc-Kpn), était 800 fois plus élevée que chez les individus sains. De plus, dans une cohorte de patients ayant une NAFLD pour laquelle la maladie hépatique était améliorée par une perte de poids, l’amélioration de la NAFLD a été corrélée à une diminution de la présence de cette espèce bactérienne. Afin de prouver le rôle de cette bactérie dans les lésions hépatiques de NAFLD, deux souches de HiAlc-Kpn ont été isolées du patient atteint du syndrome d’auto-brasserie. La bactérie a été administrée à des souris, qui ont alors développé des lésions hépatiques similaires à celles de souris ayant reçu de l’alcool, prouvant ainsi le rôle causal des souches HiAlc-Kpn dans la NAFLD, et suggérant l’intérêt de supprimer cette bactérie de l’intestin des patients. Des phages ciblant les bactéries HiAlc-Kpn ont donc été administrés aux souris ayant reçu soit les bactéries elles-mêmes, soit une transplantation fécale contenant ces bactéries. L’élimination de ces bactéries par le bactériophage a été étroitement corrélée à une prévention des lésions hépatiques chez les souris traitées. L’éradication de ces bactéries chez des patients ayant une NAFLD/NASH pourrait donc constituer une nouvelle piste de traitement de cette maladie. Néanmoins, il s’avère qu’en dehors du syndrome d’auto-brasserie, la concentration plasmatique d’alcool chez des patients NAFLD et NASH porteurs de ces souches bactériennes est très faible et difficilement quantifiable. Les auteurs ont toutefois démontré qu’un test de stimulation orale au glucose, en fournissant aux bactéries HiAlc-Kpn le substrat pour la synthèse d’alcool, permet d’augmenter le taux d’alcool plasmatique jusqu’à des valeurs mesurables. Ce test peut donc être utilisé pour identifier les patients porteurs de bactéries K. pneumoniae productrices d’alcool.
Ces deux études montrent qu’au-delà de la dysbiose3 intestinale observée chez les patients atteints de MAF ou de NAFDL/NASH, des bactéries bien définies, telles que E. faecalis ou K. pneumoniae, participent à l’apparition des lésions hépatiques. Mais la présence d’E. faecalis ou K. pneumoniae n’est pas retrouvée chez tous les patients, et d’autres bactéries jouant un rôle délétère restent donc sans doute à identifier. La possibilité d’éradiquer ces bactéries avec des bactériophages ouvre un nouveau champ de thérapies ciblées dans ces deux maladies hépatiques.