| |
| Med Sci (Paris). 36(3): 277–279. doi: 10.1051/medsci/2020041.Impact de la phase pré-analytique sur la qualité des
échantillons collectés dans les biobanques Marion Amalfitano,1* Qifeng Dong,1** and Aissata Keita1*** 1MScBiobanks and Complex Data Management, Université Côte
d’Azur, Centre hospitalier universitaire de Nice, Hôpital
Pasteur, Biobanque
BB-0033-00025, Nice, France MeSH keywords: Biobanques, Humains, Phase pré-analytique, Conservation biologique, Contrôle de qualité, Manipulation d'échantillons, normes, statistiques et données numériques, méthodes |
La recherche médicale nécessite un investissement financier important. Une étude réalisée
par Freedman et al. a ainsi estimé cet investissement à 56 milliards de
dollars aux États-Unis en 2015 [1]. Selon ces auteurs, près de 28 milliards ont été investis dans des études
précliniques qui ont conduit à des résultats non reproductibles. Ce problème de
reproductibilité peut avoir pour origine le protocole expérimental, mais également la
qualité des échantillons, non représentative du contexte physiopathologique. Face à ces
problèmes de reproductibilité, les biobanques peuvent être un atout majeur. L’enjeu est
non seulement d’assurer la collection des échantillons en grande quantité, mais
également d’en garantir la conservation par le développement de procédures standardisées
permettant le maintien de l’intégrité de différents types d’échantillons. |
Les étapes clés de la phase pré-analytique La phase pré-analytique comprend toutes les étapes, du prélèvement au traitement de
l’échantillon. Durant ces étapes, le risque de dégradation de la qualité des
échantillons est majeur [2].
Il est donc indispensable de contrôler chacune d’entre elles, et ce, dès que
l’échantillon n’est plus irrigué par la circulation sanguine. Il s’agit de la phase
d’ischémie, divisée en deux parties. La première, l’ischémie chaude, concerne
uniquement les prélèvements lors d’une intervention chirurgicale. Elle commence
lorsque l’échantillon à prélever n’est plus irrigué par la circulation sanguine,
jusqu’au moment où il est totalement retiré de l’organisme. Seul le chirurgien peut
contrôler la durée de cette étape. Suit l’ischémie froide, qui concerne tout
échantillon. Il s’agit alors du transport depuis le lieu du prélèvement jusqu’au
laboratoire d’analyse. Selon la distance parcourue et le moyen de transport utilisé
(tube pneumatique, transport routier ou aérien), la durée d’acheminement peut être
optimisée. La Haute autorité de santé (HAS) recommande un transport « sans rupture
de la chaîne du froid, dans un container refroidi et saturé en vapeur d’azote ou
dans de la carboglace ». Le suivi de ces conditions tout au long du trajet permet
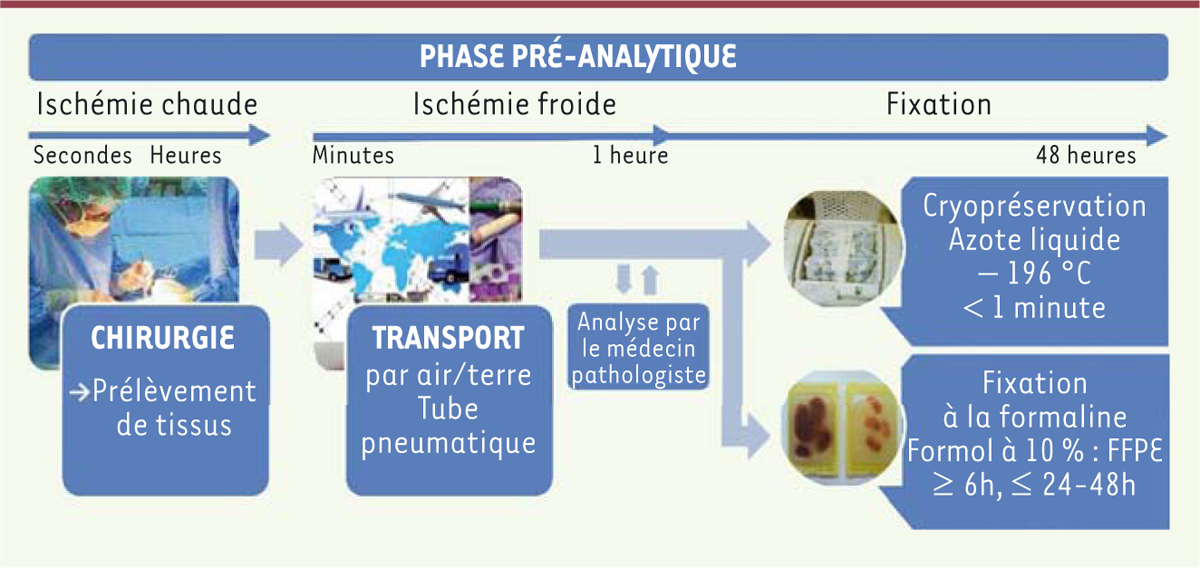
d’assurer un maintien de la qualité durant cette étape (Figure 1).
 | Figure 1. Descriptif des différentes étapes de la phase pré-analytique. Cette
chaîne comprend le prélèvement lors de l’intervention chirurgicale, puis
le transport de l’échantillon jusqu’à la biobanque où il est
cryoconservé ou fixé au formol et inclus en paraffine. |
Dès la réception au laboratoire, l’échantillon est soit fixé au formol et inclus en
bloc de paraffine s’il s’agit d’un prélèvement solide, soit congelé avec une
solution cryoprotectrice [3]
(les tissus solides peuvent également faire l’objet d’une cryoconservation).
L’inclusion en paraffine se fait à température contrôlée selon le point de fusion du
type de paraffine utilisée (polymère, non-polymère et microcristalline),
c’est-à-dire entre 45 °C et 65 °C, dans le but d’éviter toute dégradation des
tissus. Les paraffines recommandées ont un point de fusion entre 55 °C et 58 °C
[4]. Le choix de la solution cryoprotectrice a également une influence sur la qualité des
tissus, concernant notamment les acides nucléiques. Les cryoprotecteurs les plus
utilisés sont le glycérol et le diméthylsulfoxyde. Dans le cas d’extraction d’acides
nucléiques, le kit d’extraction peut également influencer la qualité du produit :
c’est la raison pour laquelle il existe des kits qui favorisent la qualité
d’extraction plutôt que le rendement [5]. Cependant, même si la collection se fait dans des conditions optimales, cela ne
préfigure pas l’interprétabilité des résultats post-analyse, qui dépend de la nature
même de l’échantillon. L’analyse se fait uniquement sur une petite quantité de matière, qui doit être
sélectionnée avec soin pour être représentative de l’état physiopathologique d’un
patient ou représenter les caractéristiques d’un échantillon. Par exemple, dans le
cas d’une biopsie liquide, si trop peu de cellules tumorales circulantes sont
présentes dans le prélèvement sanguin, l’analyse pourrait donner de faux résultats
négatifs. Il en serait de même avec un prélèvement de tissu solide comportant un
grand pourcentage de cellules nécrosées et peu de cellules cancéreuses ou
tumorales. |
Le maintien de la qualité des échantillons durant la période de stockage Après le traitement pré-analytique, la conservation de la qualité est toujours
prioritaire. Dans le cas où la totalité de l’échantillon n’est pas utilisée, il peut
servir à de futures analyses plusieurs années après la collection. C’est la raison
pour laquelle il est important de maintenir la qualité de l’échantillon pendant
toute la durée de la conservation. La fixation et l’inclusion de l’échantillon Les tissus fixés au formol et inclus en bloc de paraffine se gardent à
température ambiante de nombreuses années sans altérer l’intégrité des cellules.
La qualité de l’analyse histologique sera donc préservée. À l’inverse, les
acides ribonucléiques (ARN) sont instables à température ambiante car les
ribonucléases responsables de leur dégradation ne sont inactives qu’à une
température inférieure à -70 °C. Les échantillons servant à l’extraction et
l’analyse de ces ARN sont donc conservés à très basse température dans des
congélateurs spécialisés (à -80 °C) ou en présence d’azote liquide (-196 °C).
Les congélateurs à -80 °C doivent être soumis à des contrôles de maintenance
réguliers pour éviter le déstockage ou la perte des collections en cas de panne
électrique. La HAS recommande également de placer ces congélateurs « dans des
locaux fermant à clé, avec climatisation et systèmes d’alarme efficaces ». Les
réservoirs d’azote liquide doivent être manipulés par des techniciens qualifiés
en raison des risques de brûlure et d’asphyxie, dans une pièce équipée d’un
détecteur du niveau d’oxygène. Enfin, il est possible de conserver les acides nucléiques à température ambiante
grâce à différentes techniques, comme l’utilisation de solutions stabilisantes
qui empêchent la dégradation des acides nucléiques et permettent ainsi une
meilleure conservation des tissus. RNAlater® et DNAstable® sont deux solutions
stabilisantes permettant de conserver les acides nucléiques sur de longues
durées, à température ambiante ou à température de congélation classique (-20 °C
pour préserver l’ARN). RNAlater® permet d’inhiber l’action des RNases dans
l’échantillon. DNAstable® déshydrate l’échantillon pour réduire l’activité
biologique, physique, et chimique dégradant l’ADN. Des solutions alternatives
existent sur le marché (CloneStable®, DNAguard®, RNAstable®). Il existe
également des cartes de collection (Whatman®FTA® card, GenCollect™ DNA card) qui
permettent de conserver les prélèvements liquides. Elles ont pour rôle de lyser
les cellules, de dénaturer les protéines et de protéger l’ADN de la dégradation
[6], en les fixant
sur la matrice protectrice qui recouvre le papier. L’extraction se fait après le
stockage, en découpant une partie du papier imbibé du liquide biologique, puis
en procédant à l’extraction de l’ADN. La lyophilisation est également un procédé
stabilisateur, qui consiste à déshydrater les échantillons par sublimation de
l’eau, à très basses pression et température, pour éviter une dégradation par la
chaleur. Les trois méthodes de conservation précédentes sont cependant moins répandues
dans les biobanques, en raison de leur coût et de leur développement récent, qui
ne permet pas encore de disposer d’un recul suffisant pour évaluer leur
efficacité. De plus, la conservation à très basse température et l’inclusion en
blocs de paraffine sont encore considérées comme les méthodes de référence pour
les analyses génétiques et les analyses histologiques, respectivement. La traçabilité des échantillons Garantir le maintien de l’intégrité de l’échantillon durant toute la période de
conservation est l’une des missions principales des biobanques. Les biobanques
doivent également gérer le suivi, la traçabilité et la mise à disposition des
échantillons. De nombreux laboratoires sont dotés d’un système de gestion informatisée appelé
Laboratory information management system (LIMS),
indispensable à la gestion de grands nombres d’échantillons. Le LIMS, système
datant de la fin des années 1970, permet de suivre toutes les étapes à partir de
la collecte des échantillons et de gérer les informations qui leur sont
associées - cliniques, médicales, personnelles - en les stockant dans une base
de données afin d’assurer une meilleure traçabilité des échantillons. Le LIMS
gère la confidentialité des données et leur sécurité. Il assure la sauvegarde de
documents et une distribution sécurisée des échantillons et des données
associées entre des institutions de recherche collaborative, tout en respectant
le cadre réglementaire et éthique [7]. En France, les biobanques peuvent acquérir une certification particulière (norme
NF-S96-900), propre aux structures ayant une activité de centre de ressources
biologiques (CRB). Cette norme fournit des exigences pour le système de gestion
de la qualité des CRB afin de faciliter l’acquisition, la validation, la
conservation et la distribution des ressources biologiques en garantissant
l’assurance qualité et la traçabilité des échantillons. Pour répondre aux
critères de ces normes, ces structures peuvent s’appuyer sur un système de
management de la qualité (SMQ), répondant aux exigences de
la certification ISO 9001, et fondé notamment sur la mise en place de procédures
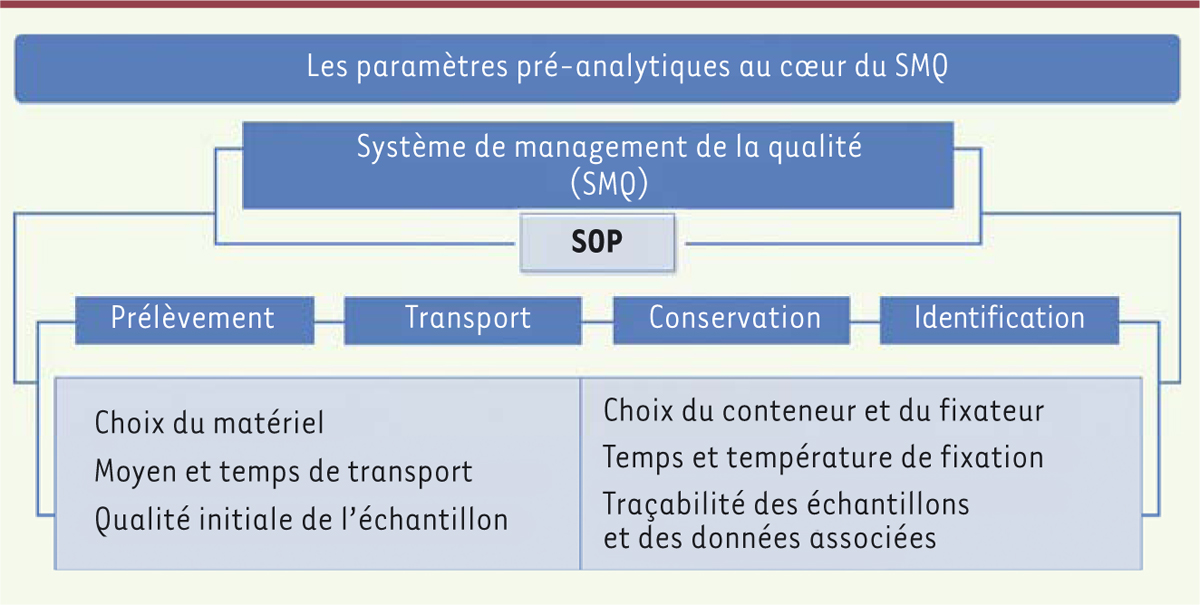
standardisées et d’audits (Figure
2).
 | Figure 2. Les activités du système de management de la qualité (SMQ).
L’harmonisation des protocoles est encadrée par les procédures
opérationnelles standard (standard operating
procedures, SOP) à toutes les étapes de la chaîne
pré-analytique. |
Grâce à un haut niveau de standardisation et des procédures normalisées partagées
entre les différents centres, le réseau européen de biobanques BBMRI-ERIC met en
place ses propres routines de validation. Cela permet de créer des centres
experts de biobanques, en phase avec les avancées de la recherche pharmaceutique
ou médicale, et des techniques analytiques. |
1.
Freedman
LP,
Cockburn
IM,
Simcoe
TS. The economics of
reproducibility in preclinical research . PLoS
Biol.
2015; ; 13 :
:e1002165.. 2.
Gaye
A,
Peakman
T,
Tobin
MD,
Burton
PR. Understanding
the impact of pre-analytic variation in haematological and clinical
chemistry analytes on the power of association studies .
Int J Epidemiol.
2014; ; 43 :
:1633.–1644. 3.
Gaffney
E,
Riegman
P,
Grizzle
W,
Watson
P. Factors that
drive the increasing use of FFPE tissue in basic and translational cancer
research . Biotech Histochem.
2018; ; 93 :
:373.–386. 4.
Engel
KB,
Moore
HM. Effects of
preanalytical variables on the detection of proteins by immunohistochemistry
in formalin-fixed, paraffin-embedded tissue . Arch
Pathol Lab Med.
2011; ; 135 :
:537.–543. 5.
Watanabe
M,
Hashida
S,
Yamamoto
H, et al.
Estimation of age-related DNA degradation from formalin-fixed and
paraffin-embedded tissue according to the extraction
methods . Exp Ther Med.
2017; ; 14 :
:2683.–2688. 6.
Rahikainen
AL,
Palo
JU, de
Leeuw
W, et al.
DNA quality and quantity from up to 16 year old post-mortem blood
stored on FTA cards . Forensic Sci Int.
2016; ; 261 :
:148.–153. 7.
Bianchi
V,
Ceol
A,
Ogier
AG, et al.
Integrated systems for NGS data management and analysis: open
issues and available solutions . Front Genet.
2016; ; 7 : :75.. |