La force des biobanques réside dans leurs collections à grande échelle. Ces
échantillons constituent un matériel précieux sur lesquels pourront être appliquées
les techniques futures, qui permettront de nouvelles découvertes. Encore faut-il que
l’activité des biobanques perdure. Le premier défi de la biobanque est d’inventer
son propre modèle économique et de se doter des outils de gestion efficaces pour que
son activité soit pérenne. Son second défi est d’encourager le don d’échantillons
auprès de l’individu et plus largement de la population. Nous développerons en
premier lieu la priorité d’autonomie financière des biobanques, et ensuite, les
défis sociétaux auxquels elles font face.
Dans un paysage scientifique international, les biobanques doivent assurer leur
développement économique. Une biobanque doit trouver l’équilibre financier qui
couvre ses coûts sans pour autant réaliser de bénéfice. Ce paradoxe apparent est par
ailleurs abordé [10]
(→).
(→) Voir la Nouvelle de H. Squalli et al., page 282 de ce
numéro
Cette nouvelle discipline – Biobankonomics - répond aux questions
fondamentales de l’analyse économique [7]. Quels sont les coûts ? Quels sont les financements ? Quels
sont les indicateurs de performance ? Le nombre d’échantillons conservés dans la
biobanque est-il le meilleur indicateur de son activité ? Nous expliquerons les
outils de gestion spécifique et proposerons des solutions pour optimiser la
durabilité des biobanques [10].
Depuis une vingtaine d’années, la Communauté Européenne soutient le développement des
biobanques. Le programme Horizon 2020 pour la recherche et l’innovation (2014-2020)
a établi trois priorités pour un financement à hauteur de 80 milliards d’euros :
l’excellence scientifique, la primauté industrielle, et les défis sociétaux. Le
premier de ces défis concerne la santé, le changement démographique et le bien-être.
Le financement de 7,472 milliards d’euros est fléché pour la recherche biomédicale
et la santé humaine [8]. La
participation des biobanques y est inscrite (Programme de travail 2018-2020) en
termes de collaboration avec les registres, les référentiels et les infrastructures
de recherche.
Dans le domaine des biobanques, la standardisation des procédures et des principes
éthiques sont étudiés par la société internationale pour les référentiels
biologiques et environnementaux (International society for biological and
environmental repositories, ISBER). Le guide de bonnes pratiques de
l’ISBER partage les stratégies reconnues par la communauté scientifique, et aide les
utilisateurs dans les démarches d’accréditation selon des standards nationaux ou
internationaux [9]. Ces
procédures standardisées dédiées à la gestion d’informations des biobanques seront
développées par ailleurs [11] (→).
(→) Voir la Nouvelle de C. Le Queau et al., page
285 de ce numéro
Au-delà des enjeux technologiques, les enjeux sociétaux sont à considérer et
prioritairement la protection de l’individu. Un point sur l’accès à l’information
concernant l’individu, le recueil de son consentement, et la garantie de la
confidentialité des données fera l’objet de l’article par Messaoudi et
al. dans ce numéro [12] (→).
(→) Voir page 279 de ce numéro
Cette étape franchie, l’individu est assuré que ses données personnelles resteront
strictement confidentielles.
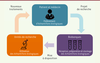 | Figure 1. Les acteurs du projet de recherche biomédicale. Le médecin prélève
l’échantillon biologique en s’assurant du consentement du patient. Cet
échantillon est traité et conservé par la biobanque. Le chercheur
utilisera cet échantillon et les données associées à cet échantillon
dans le cadre d’un projet de recherches biomédicales. |