| |
| Med Sci (Paris). 36(3): 225–230. doi: 10.1051/medsci/2020024.La sphère orale, cible et marqueur de l’exposition
environnementale I. Défauts du développement dentaire Sylvie Babajko,1* Véronique Gayrard,2 Sophia Houari,1 Ai Thu Bui,1 Robert Barouki,3 Karen Niederreither,4 Jean-Baptiste Fini,5 Elisabeth Dursun,6 and Xavier Coumoul3 1Centre de Recherche des Cordeliers, Inserm UMRS 1138,
Université de Paris, Sorbonne Université, 15 rue de l’École de Médecine,
75006, Paris,
France 2Toxalim, INRA, Université de Toulouse,
31000Toulouse,
France 3Inserm UMRS 1124, Université de Paris,
75006Paris,
France 4Université de Strasbourg, 67000Strasbourg,
France 5Muséum National d’Histoire Naturelle, CNRS UMR
7221, 75006Paris,
France 6Unité de Recherche en Biomatériaux Innovants et Interfaces
EA4462, Université Paris Descartes, Montrouge ; Hôpital Henri Mondor,
AP-HP, 94010Créteil,
France |

Vignette (Photo © Inserm - Bertrand Kerebel). Les tissus dentaires peuvent non seulement être la cible des facteurs environnementaux
mais également servir de marqueurs précoces et sont facilement accessibles et exposés à
ces agents. La compréhension et la caractérisation de l’impact environnemental dans la
sphère orale aidera à prévenir de multiples pathologies non seulement dans cette cavité,
mais également des pathologies plus éloignées dont le lien avec l’homéostasie orale
commence à peine à être exploré. |
Facteurs environnementaux contaminants La cavité orale est contaminée par une variété de facteurs environnementaux qui sont
regroupés, pour certains, sous le terme de « contaminants alimentaires », lorsque
les individus ne les identifient pas et subissent leurs contaminations : par
exemple, les mycotoxines produites par des champignons. D’autres, nommés « toxiques
», correspondent à des contaminants qui ont été consommés sciemment, en ayant
connaissance de leurs effets secondaires ou de la prise de risque associé à leur
consommation, comme l’alcool, le tabac, certains médicaments, voire le sucre
lorsqu’il est pris en excès. La contamination d’un aliment peut également survenir
au cours des différentes étapes de sa fabrication : les denrées produites peuvent en
effet avoir été originellement contaminées par la présence de composés introduits
involontairement dans les sols (pour les cultures) ou dans la chaîne alimentaire
(pour l’élevage et la production industrielle), comme les dioxines, les biocides,
les plastifiants, entre autres. Les produits phytosanitaires (ou pesticides dont les
fongicides, les herbicides, les insecticides, etc.) sont, eux, communément utilisés
au cours du processus de production : récolte, conservation des fruits, légumes et
céréales (qui seront utilisés ou non pour l’élevage). Les procédés utilisés pour la
confection des produits (fumage et cuisson) peuvent également engendrer la
néo-synthèse de molécules qui s’avèrent nocives pour la santé, comme les
hydrocarbures polycycliques (HAP) ou l’acrylamide, désormais identifiée comme un
produit cancérogène. L’acrylamide est en effet produite par réaction de glycation
des produits lors de leur chauffage ou cuisson. Les processus de conditionnement,
quant à eux, peuvent provoquer le transfert de bisphénols et de phtalates du produit
d’emballage vers l’aliment. Tous ces xénobiotiques sont fortement suspectés
d’induire des pathologies métaboliques, malignes et auto-immunes chez l’adulte, mais
aussi des pathologies du développement touchant le fœtus, via la
mère, ou le jeune enfant. La prévalence de ces pathologies non-infectieuses étant en
augmentation constante depuis les dernières décennies, notamment chez les sujets
jeunes, la connaissance, voire la maîtrise, de ces facteurs étiologiques
apparaissent donc indispensables. Les questions qui portent sur leur capacité de
perturbation et leurs mécanismes d’action au sein de la cavité orale se posent ainsi
légitimement et devraient faire l’objet de recherches particulières ces prochaines
années. |
L’émail dentaire marqueur des conditions environnementales Le développement dentaire et, en particulier, la synthèse de l’émail suivent une
séquence d’événements moléculaires et cellulaires parfaitement ordonnés dans
l’espace et le temps [1]. On
distingue trois phases majeures dans l’amélogenèse1 : la prolifération et le recrutement des cellules souches ; la
secrétion, au cours de laquelle les protéines matricielles amélaires déterminent
l’épaisseur de l’émail et aident à sa minéralisation ; et la maturation qui voit la
quasi-totalité de ces protéines amélaires dégradées pour laisser l’espace rendu
libre pour la croissance des cristaux d’apatite et la minéralisation complète de
l’émail [2] (→),
tissu le plus minéralisé de l’organisme recouvrant la couronne dentaire. Lorsque ce
processus s’achève, la dent est prête à faire son éruption dans la cavité orale. Les
améloblastes sont perdus au cours de cette dernière étape, ce qui rend toute
atteinte future de l’émail irréparable et donc irréversible. Ainsi, les
perturbations exogènes touchant les améloblastes ou les régulations endogènes de
leur activité et de leur survie, peuvent conduire à des stigmates amélaires, témoins
de ces perturbations. Ces stigmates pourront ainsi aider à reconstituer l’historique
des expositions et contaminations que les améloblastes ont subies (Figure 1).
(→) Voir la Synthèse de G. Lignon et al.,
m/s n° 5, mai 2015, page 515
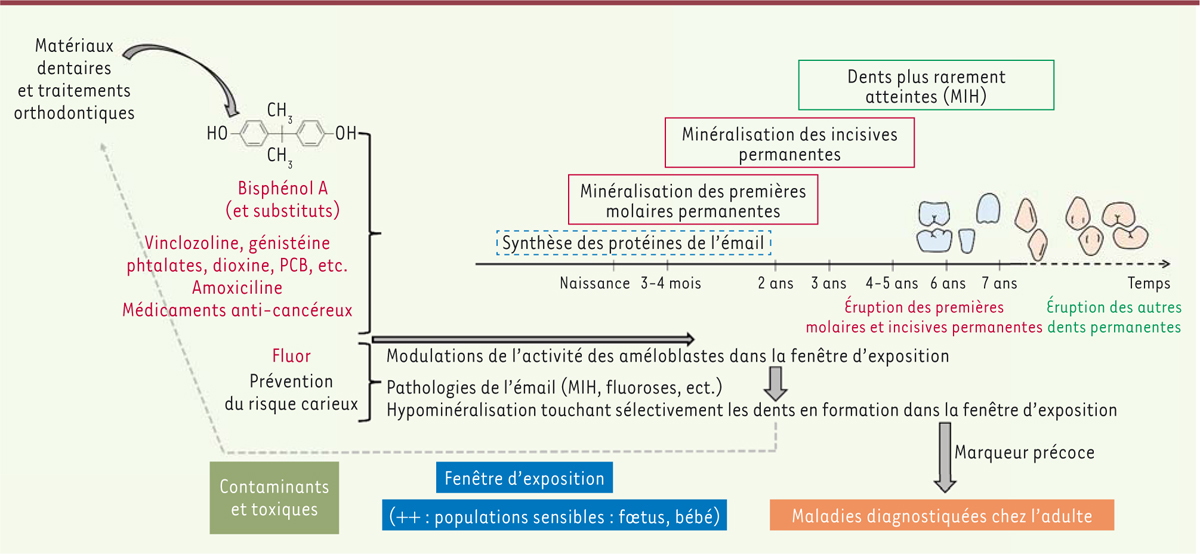
 | Figure 1. Fenêtre d’exposition et sélectivité des atteintes de l’émail dentaire.
L’exposition à divers facteurs environnementaux peut altérer l’activité
des améloblastes, cellules en charge de la synthèse de l’émail, et
générer des défauts amélaires irréversibles sur les dents se formant au
cours de cette période d’exposition. Le développement dentaire s’étale
de la vie fœtale à 4-7 ans après la naissance, période de susceptibilité
maximale aux toxiques environnementaux dont l’exposition peut être
déterminante pour l’état de santé chez l’adulte. Les hypominéralisations
amélaires résultantes sont traitées par des matériaux qui peuvent
libérer des monomères de bisphénols pouvant à leur tour contribuer au
développement de maladies. La dent peut donc servir de marqueur précoce
d’exposition à ces agents. |
Le développement de chaque dent a été décrit dans le détail en fonction du temps
[3]. Cela permet de
définir assez précisément la fenêtre de temps d’exposition aux agents qui ont altéré
sélectivement le développement de certaines dents. Le développement de l’émail
dentaire s’effectue au cours des deux derniers trimestres de la vie fœtale et entre
4 et 6 ans après la naissance, soit une fenêtre de temps déterminante pour l’état de
santé futur de l’adulte [4].
L’ensemble de ces caractéristiques propres et uniques de l’émail confèrent à ce
tissu des propriétés de traceur d’exposition aux agents qui ont pu perturber sa
synthèse, mais aussi altérer la santé d’un individu, comme cela semble le cas des
perturbateurs endocriniens [5]. |
Comment certains agents perturbateurs endocriniens peuvent-ils causer des défauts
de l’émail ? Le concept de « perturbateur endocrinien » a vu le jour au début des années 1990 à la
suite de la conférence de Winspread2 [6]. Des chercheurs travaillant
dans deux champs disciplinaires jusqu’alors distincts, l’écotoxicologie et
l’endocrinologie, ont, au cours de cette conférence, confronté leurs données et ont
ainsi identifié des molécules capables d’interférer à la fois sur la santé humaine
et sur l’environnement. Le répertoire de cette famille de molécules perturbatrices
reste, encore aujourd’hui, mal défini et est en constante évolution ; il fait
d’ailleurs l’objet d’une mission confiée à l’Agence nationale de sécurité sanitaire
de l’alimentation, de l’environnement et du travail (ANSES), dans le cadre de la
deuxième stratégie nationale d’identification des perturbateurs endocriniens
(SNPE2). Il existe néanmoins plusieurs listes, établies par les organisations et
agences gouvernementales de par le monde (dont la TEDX List), et publications [7] qui identifient et
regroupent ces molécules dont l’activité et l’impact en santé restent vivement
débattus. D’après la définition de l’Organisation mondiale de la santé (OMS) datant
de 2002 et toujours en vigueur, les perturbateurs endocriniens (PE) sont des
molécules, ou mélanges de molécules exogènes, qui sont capables d’interférer avec le
système endocrinien d’un organisme ou de ses descendants. Les PE peuvent être
naturels (phyto-œstrogènes, mycotoxines) ou manufacturés (retardateurs de flamme,
filtres ultra-violets, pesticides, conservateurs, plastifiants, etc.). Ils sont
largement utilisés par les industriels de la cosmétique, du médicament, de
l’agro-alimentaire, de l’équipement et, de ce fait, ils se retrouvent aujourd’hui
omniprésents dans notre environnement quotidien. Les contaminations sont
majoritairement orales, à travers l’alimentation. Bien que d’usage, de structure et
de fonction différents, la plupart de ces PE présentent des propriétés structurales
et biochimiques qui leur permettent de franchir passivement les membranes des
cellules, mais aussi la barrière placentaire, ce qui justifie les précautions
particulières à prendre à l’égard des femmes enceintes. Ce point est d’autant plus
important que la plupart de ces molécules sont prises en charge et inactivées par
différentes isoformes de UDP-glucuronosyl-transférases (UGT) hépatiques, des enzymes
qui assurent la glucuronoconjugaison des métabolites endogènes (bilirubine,
stéroïdes) et des xénobiotiques, permettant leur élimination urinaire [8]. Les PE inhibent l’activité
et l’expression de ces enzymes. Et en raison de son immaturité hépatique, ils sont
éliminés moins efficacement chez le fœtus que chez l’adulte [9] et se concentrent ainsi davantage dans un
organisme jeune [8, 10]. Une contamination massive des populations (plus de 90 % des individus) a été mise en
évidence pour les dizaines de PE les plus répandus (ou les plus recherchés) [11]. Et de nombreuses études
épidémiologiques récentes établissent un lien entre le degré de contamination des
populations et l’incidence de malformations du tractus génital, de l’obésité, de
troubles du comportement, de certains cancers hormono-dépendants (pour ne citer que
les études les plus fréquentes) [5].
L’exposition aux PE constitue d’ailleurs la principale hypothèse expliquant
l’inquiétante baisse de fertilité masculine à l’échelle mondiale. Leur activité
n’est plus discutée aujourd’hui dans la communauté scientifique et médicale ; elle a
été largement démontrée expérimentalement. Les enjeux actuels visent à établir
précisément les liens entre les résultats obtenus expérimentalement sur l’animal et
les données épidémiologiques, et portent sur l’impact sanitaire des combinaisons de
PE lorsqu’ils sont utilisés à faibles doses (effet cocktail). Parmi les 1 491 molécules présentant une activité de PE (référencées dans la TEDX
List de Juin 2019), le bisphénol A (BPA) apparaît comme exemplaire, tant il a été
étudié dans diverses conditions expérimentales et cliniques. C’est d’ailleurs une
des seules molécules manufacturées non médicamenteuses classée par l’Autorité
européenne de sécurité alimentaire (EFSA) comme un PE avéré pour la santé (en 2017)
et l’environnement (en 2018). De nombreuses données expérimentales obtenues chez le
rongeur permettent d’identifier les conséquences pathologiques liées à l’exposition
au BPA, conséquences sans doute identiques chez l’homme. Ainsi, chez le rat, les
défauts de l’émail d’animaux exposés au BPA à faible dose durant la vie fœtale
présentent de nombreuses similarités avec l’émail des enfants présentant une
hypominéralisation des molaires et incisives (MIH) [12], une pathologie de l’émail décrite
seulement en 2001 [13] et
dont les facteurs étiologiques demeurent encore obscurs [14]. Dans cette pathologie, les dents atteintes
présentent des opacités localisées reflétant une hypominéralisation dont la sévérité
peut être évaluée : les dents se développant les premières sont atteintes
préférentiellement, l’émail est poreux et capable d’accumuler de l’albumine
(Figure 1). Les PE
dont l’activité est similaire à celle du BPA s’avèrent donc des candidats
intéressants comme facteurs potentiellement aptes à générer une MIH. Des études
confortent cette hypothèse, notamment celles montrant des hypominéralisations de
l’émail consécutives à l’exposition chronique de rongeurs à la vinclozoline, la
génistéine, les phtalates ou la dioxine (Figure 1) [15, 16], ou associant hypominéralisations de l’émail et contaminations par la
dioxine et par les polychlorobiphényles (PCB) chez l’homme [16, 17]. La comparaison des défauts dentaires obtenus après exposition à ces
différents PE révèle des caractéristiques physiopathologiques qui leur sont
spécifiques, suggérant un mode d’action et des cibles cellulaires et moléculaires
propres à chaque PE ou à chaque mélange de PE. Ces différences posent ainsi des
questions quant à l’hétérogénéité des MIH : cette pathologie pourrait, en fait,
regrouper des anomalies de l’émail différentes, affectant une variété de dents plus
étendue que celle proposée initialement [18]. Cette hétérogénéité pourrait avoir pour origine des
combinaisons variables d’expositions aux agents causaux, regroupant non seulement
des PE mais aussi, possiblement, des antibiotiques et des médicaments dans un
contexte environnemental et génétique particulier, encore inconnu, et qui
favoriserait l’action de ces molécules [14,
19]. Les améloblastes expriment la plupart des récepteurs des hormones stéroïdiennes
[20], ceux-là même qui
sont impliqués dans les effets physiopathologiques des PE. D’ailleurs, la synthèse
de l’émail est modulée par les androgènes [21] et par la vitamine D [22]. Les rétinoïdes, métabolites de la vitamine
A, ont également été impliqués dans la régulation de l’amélogenèse [23]. Il a en effet été montré que des
souris exposées durant la vie fœtale à un excès d’acide rétinoïque présentaient une
quantité d’émail dentaire réduite et un os très altéré. La compréhension des mécanismes d’action de ces molécules perturbatrices devrait
permettre de mettre fin à la controverse qui oppose chercheurs, industriels,
politiques et agences sanitaires en raison d’enjeux économiques et idéologiques
contradictoires [24]. En
attendant un éclairage objectif, les coûts de santé en lien avec les maladies
associées à l’exposition à ces PE ont été évalués [25] : la seule exposition prénatale au BPA a
été identifiée comme associée probablement à 42 400 cas d’obésité de l’enfant en
Europe, avec un coût global estimé à 1,54 milliard d’euros. |
La cavité orale siège d’un cercle vicieux Certains matériaux dentaires couramment utilisés en dentisterie conservatrice et pour
des traitements orthodontiques libèrent des monomères de BPA (Figure 1) [26]. Une prise de conscience des
chirurgiens-dentistes demandant aux fabricants la liste des constituants des
matériaux qu’ils utilisaient, a conduit ces derniers à rechercher de nouvelles
formulations et procédures d’utilisation tendant à réduire la quantité de monomères
de BPA potentiellement libérés. Aucun de ces biomatériaux ne renferme de BPA à
l’état pur, mais la plupart d’entre eux sont synthétisés à partir de monomères qui
sont dérivés du BPA, ou à partir d’autres monomères pouvant présenter une
cytotoxicité [27]. Il est
donc indispensable de connaître la composition et de maîtriser les protocoles
d’utilisation de ces matériaux qui sont couramment employés pour le traitement des
caries, notamment dans le cas de MIH, afin de briser un cercle vicieux pouvant
s’installer entre exposition du patient et traitement de ses maladies qui sont
elles-mêmes associées à cette exposition, d’autant que ces molécules peuvent
présenter des activités non monotones, avec des effets importants à très faibles
doses [28], et passer la
barrière sublinguale [29]. La découverte du passage sublingual du BPA chez le chien interroge en effet sur
l’impact chronique de ce contaminant, utilisé à faibles doses, sur la cavité
buccale. Elle met en évidence une possible contamination systémique à d’autres
tissus cibles, via la circulation sanguine [5]. Ce passage sublingual peut ainsi se produire chez les
individus qui ont été soignés pour des caries depuis plusieurs années avec des
composites dentaires qui étaient moins contrôlés qu’aujourd’hui et manipulés selon
des procédures moins bien identifiées qu’à l’heure actuelle. Ce possible passage
dans la circulation sanguine pourrait expliquer les taux circulants de BPA qui
s’avèrent bien supérieurs aux valeurs prédites en fonction des données moyennes de
contaminations et de l’intense métabolisation du BPA en BPA glucuronide par le foie.
La clairance du BPA reste néanmoins importante chez l’homme : on estime que moins de
0,5 % de la quantité ingérée accède à la circulation sanguine générale sous forme
active. Mais ce pourcentage atteint près de 60 % pour le bisphénol S (BPS), un des
substituts du BPA, en raison d’une absorption intestinale plus importante et surtout
d’un métabolisme hépatique plus modéré [30]. La substitution du BPA par le BPS est donc préoccupante :
elle risque d’accroître encore l’exposition interne des individus. Il est donc
nécessaire de connaître les mécanismes d’action de ces molécules de substitution
proposées par les industriels afin d’appréhender leurs possibles effets sur la
santé. |
Le fluor : des effets bénéfiques et des effets secondaires Le fluor est l’une des molécules en contact chronique avec la cavité buccale. Capable
de (re)minéraliser l’émail en surface et d’inhiber les énolases bactériennes à
l’origine des caries, il est, de ce fait, couramment utilisé pour prévenir ces
dommages. Pourtant, l’exposition à un excès de fluor peut conduire au développement
de fluoroses dentaires et osseuses, des pathologies qui avaient été identifiées dès
la première moitié du XXe siècle [31]. La fluorose dentaire est, comme la MIH, une pathologie du
développement de l’émail, qui, comme cette dernière, provoque des tâches opaques
blanchâtres à brunâtres, ce qui peut, dans certains cas, poser des problèmes de
diagnostic entre les deux pathologies. La fluorose touche moins de 3 % des enfants
en France, mais près de 200 millions de personnes dans le monde, réparties dans 25
pays [32]. La dose de fluor
prophylactique est évaluée à 0,05 mg/kg/j. Mais une dose supérieure à 0,1 mg/kg/j
expose à un risque de fluorose. Or, il est fréquent que la teneur en fluor de l’eau
de boisson, notamment certaines eaux minérales, soit comprise entre 0,3 à 0,5 mg par
litre, des doses susceptibles d’induire une fluorose. En plus de ses propriétés extracellulaires qui sont bien documentées, des données
récentes rapportent des effets intracellulaires du fluor, avec la modulation
d’expression de gènes dans l’épithélium dentaire, mais aussi dans d’autres tissus
(Figure 1).
L’exposition au fluor a ainsi été associée à des effets dépassant le cadre buccal et
les tissus minéralisés, dont des effets neurotoxiques et une diminution du quotient
intellectuel [33, 34], des perturbations de
l’axe androgénique [35] (le
fluor est répertorié comme un PE dans la TEDX List), et une augmentation des
processus inflammatoires [36]. L’implication des récepteurs des hormones stéroïdiennes
(progestérone et androgènes) dans les mécanismes d’action du fluor sur les
améloblastes [37] laisse
ainsi suspecter de fortes interactions entre fluor et PE. D’ailleurs, le fluor et le
BPA peuvent avoir des effets complémentaires et additionnels comme perturbateurs de
l’amélogénèse [38]. Ceci
pourrait expliquer l’accroissement de la sensibilité au fluor et une augmentation
des fluoroses dans la population [39]. Le fluor réduit également la capacité des cellules à stocker le
fer, en diminuant notamment la quantité de chaînes lourdes de ferritine [40]. Cette action sur le
stockage du fer peut avoir de nombreuses conséquences sur les processus cellulaires
qui l’impliquent, tels que le stress oxydant et la prolifération cellulaire.
L’ensemble de ces données amène à reconsidérer la nécessité de supplémenter les
individus en fluor en tenant compte de l’évolution des modes de vie et de l’accès à
des aliments naturellement riches en fluor (le thé par exemple). |
Les défauts dentaires résultant d’expositions à des agents environnementaux
pourraient être utilisés comme marqueurs précoces d’exposition, voire marqueurs de
pronostic de maladies associées à ces expositions et diagnostiquées plus tard,
souvent durant la vie adulte, alors que les défauts dentaires sont observés dès
l’enfance au moment de l’éruption dentaire. En effet, l’émail des dents temporaires
est synthétisé depuis la vie fœtale et celui des dents permanentes, depuis la
naissance jusqu’à l’adolescence. On sait par ailleurs que les conditions périnatales
sont déterminantes pour la santé du futur adulte. L’émail dentaire pourrait donc en
être le reflet très précoce. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1.
Lacruz
RS,
Habelitz
S,
Wright
JT,
Paine
ML. Dental enamel
formation and implications for oral health and disease .
Physiol Rev.
2017; ; 97 :
:939.–993. 2.
Lignon
G, de la
Dure-Molla
M,
Dessombz
A,
Berdal
A,
Babajko
S. L’émail : un
autoassemblage unique dans le monde du minéral . Med
Sci (Paris).
2015; ; 31 :
:515.–521. 3.
AlQahtani
SJ,
Hector
MP,
Liversidge
HM. Brief
communication: the London atlas of human tooth development and
eruption . Am J Phys Anthropol.
2010; ; 142 :
:481.–490. 4.
Bertagnolli
M,
Luu
TM,
Lewandowski
AJ, et al.
Preterm birth and hypertension: is there a link? .
Curr Hypertens Rep.
2016; ; 18 : :28.. 5.
Gore
A,
Chappell
V,
Fenton
S, et al.
EDC-2: The endocrine society’s second scientific statement on
endocrine-disrupting chemicals . Endocr Rev.
2015; ; 36 :
:E1.–150. 6.
Colborn
T.. Pesticides-how
research has succeeded and failed to translate science into policy:
endocrinological effects on wildlife . Environ Health
Perspect.
1995; ; 103 :
:81.–85. 7.
Karthikeyan
BS,
Ravichandran
J,
Mohanraj
K,
Vivek-Ananth
RP,
Samal
A. A curated
knowledgebase on endocrine disrupting chemicals and their biological
systems-level perturbations . Science Total
Environm.
2019; ; 692 :
:281.–296. 8.
Corbel
T,
Perdu
E,
Gayrard
V, et al.
Conjugation and deconjugation reactions within the fetoplacental
compartment in a sheep model: a key factor determining bisphenol A fetal
exposure . Drug Metab Dispos.
2015; ; 43 :
:467.–476. 9.
Du
Z,
Cao
YF,
Li
SN, et al.
Inhibition of UDP-glucuronosyltransferases (UGTs) by phthalate
monoesters . Chemosphere.
2018; ; 197 :
:7.–13. 10.
Beszterda
M,
Franski
R. Endocrine
disruptor compunds in environment: as a danger for children
health . Pediatr Endocrinol Diabetes Metab.
2018; ; 24 :
:88.–95. 11.
Pirard
C,
Sagot
C,
Deville
M,
Dubois
N,
Charlier
C. Urinary levels of
bisphenol A, triclosan and 4-nonylphenol in a general Belgian
population . Environ Int.
2012;; 48 :
:78.–83. 12.
Jedeon
K, De la
Dure-Molla
M,
Brookes
SJ, et al.
Enamel defects reflect perinatal exposure to bisphenol
A . Am J Pathol.
2013; ; 183 :
:108.–118. 13.
Weerheijm
KL,
Jalevik
B,
Alaluusua
S. Molar-incisor
hypomineralisation . Caries Res.
2001; ; 35 :
:390.–391. 14.
Alaluusua
S.. Aetiology of
molar-Incisor hypomineralisation: a systematic review .
Eur Arch Paediatr Dent.
2010; ; 11 :
:53.–58. 15.
Jedeon
K,
Marciano
C,
Loiodice
S, et al.
Enamel hypomineralization due to endocrine
disruptors . Connect Tissue Res.
2014; ; 55 :
:43.–47. 16.
Alaluusua
S,
Calderara
P,
Gerthoux
PM, et al.
Developmental dental aberrations after the dioxin accident in
Seveso . Environ Health Perspect.
2004; ; 112 :
:1313.–1318. 17.
Jan
J,
Sovcikova
E,
Kocˇan
A,
Wsolova
L,
Trnovec
T. Developmental
dental defects in children exposed to PCBs in eastern
Slovakia . Chemosphere.
2007; ; 67 :
:350.–354. 18.
Mittal
N. Phenotypes of
enamel hypomineralization and molar incisor hypomineralization in permanent
dentition: identification, quantification and proposal for
classification . J Clin Pediatr Dent.
2016; ; 40 :
:367.–374. 19.
Serna
C,
Vicente
A,
Finke
C,
Ortiz
AJ. Drugs related to
the etiology of molar incisor hypomineralization: a systematic
review . J Am Dent Assoc.
2016; ; 147 :
:120.–130. 20.
Houari
S,
Loiodice
S,
Jedeon
K, et al.
Expression of steroid receptors in ameloblasts during
amelogenesis in rat incisors . Front Physiol.
2016; ; 7 : :503.. 21.
Jedeon
K,
Loiodice
S,
Salhi
K, et al.
Androgen receptor involvement in rat amelogenesis: an additional
way for endocrine-disrupting chemicals to affect enamel
synthesis . Endocrinology.
2016; ; 157 :
:4287.–4296. 22.
Papagerakis
P,
Hotton
D,
Lezot
F, et al.
Evidence for regulation of amelogenin gene expression by
1,25-dihydroxyvitamin D(3) in vivo . J Cell
Biochem.
1999; ; 76 :
:194.–205. 23.
Morkmued
S,
Laugel-Haushalter
V,
Mathieu
E, et al.
Retinoic acid excess impairs amelogenesis inducing enamel
defects . Front Physiol.
2017; ; 7 : :673.. 24.
Vandenberg
LN,
Hunt
PA,
Gore
AC. Endocrine
disruptors and the future of toxicology testing - lessons from
CLARITY-BPA . Nat Rev Endocrinol.
2019; ; 15 :
:366.–374. 25.
Trasande
L,
Zoeller
RT,
Hass
U, et al.
Estimating burden and disease costs of exposure to
endocrine-disrupting chemicals in the European union .
J Clin Endocrinol Metab.
2015; ; 100 :
:1245.–1255. 26.
Olea
N,
Pulgar
R,
Pérez
P, et al.
Estrogenicity of resin-based composites and sealants used in
dentistry . Environ Health Perspect.
1996; ; 104 :
:298.–305. 27.
Dursun
E,
Fron-Chabouis
H,
Attal
JP,
Raskin
A. Bisphenol A
release: survey of the composition of dental composite
resins . Open Dent J.
2016; ; 10 :
:446.–453. 28.
Zoeller
RT,
Vandenberg
LN. Assessing
dose-response relationships for endocrine disrupting chemicals (EDCs): a
focus on non-monotonicity . Environ Health.
2015; ; 14 : :42.. 29.
Gayrard
V,
Lacroix
MZ,
Collet
SH, et al.
High bioavailability of bisphenol A from sublingual
exposure . Environ Health Perspect.
2013; ; 121 :
:951.–956. 30.
Gayrard
V,
Lacroix
MZ,
Grandin
FC, et al.
Oral systemic bioavailability of bisphenol A and bisphenol S in
pigs . Environ Health Perspect.
2019; ; 127 :
:77005.. 31.
Fejerskov
O,
Larsen
MJ,
Richards
A,
Baelum
V. Dental tissue
effects of fluoride . Adv Dent Res.
1994; ; 8 :
:15.–31. 32.
Rasool
A,
Farooqi
A,
Xiao
T, et al.
A review of global outlook on fluoride contamination in
groundwater with prominence on the pakistan current
situation . Environl Geochem Health.
2018; ; 40 :
:1265.–1281. 33.
Bashash
M,
Marchand
M,
Hu
H, et al.
Prenatal fluoride exposure and attention deficit hyperactivity
disorder (ADHD) symptoms in children at 6–12 years of age in Mexico
City . Environ Int.
2018; ; 121 :
:658.–666. 34.
Green
R,
Lanphear
B,
Hornung
R, et al.
Association between maternal fluoride exposure during pregnancy
and IQ scores in offspring in Canada . JAMA
Pediatr.
2019; ; 173 :
:940.–948. 35.
Yang
L,
Jin
P,
Wang
X, et al.
Fluoride activates microglia, secretes inflammatory factors and
influences synaptic neuron plasticity in the hippocampus of
rats . Neurotoxicology.
2018; ; 69 :
:108.–120. 36.
Duan
L,
Zhu
J,
Wang
K, et al.
Does fluoride affect serum testosterone and androgen binding
protein with age-specificity? A population-based cross-sectional study in
Chinese male farmers . Biol Trace Elem Res.
2016; ; 174 :
:294.–299. 37.
Le
MH,
Nakano
Y,
Abduweli
Ugyghurturk D,
Zhu
L, Den
Besten
PK. Fluoride alters
Klk4 expression in maturation ameloblasts through androgen and progesterone
receptor signaling . Front Physiol.
2017;; 8 : :925.. 38.
Jedeon
K,
Houari
S,
Loiodice
S, et al.
Chronic exposure to bisphenol A exacerbates dental fluorosis in
growing rats . J Bone Miner Res.
2016; ; 31 :
:1955.–1966. 39.
Beltran-Aguilar
ED,
Barker
L,
Dye
BA. Prevalence and
severity of dental fluorosis in the United States,
1999–2004 . NCHS data brief.
2010; ; 53 :
:1.–8. 40.
Houari
S,
Picard
E,
Wurtz
T, et al.
Disrupted iron storage in dental fluorosis .
J Dent Res.
2019; ; 98 :
:994.–1001. |