Chez les eucaryotes, le noyau est entouré d’une enveloppe nucléaire constituée d’une double couche lipidique qui le sépare du cytoplasme. Les échanges entre le compartiment nucléaire et le cytoplasme se font par l’intermédiaire des pores nucléaires (nuclear pore complexes, ou NPC), des structures macromoléculaires complexes enchâssées dans l’enveloppe nucléaire et qui contrôlent le transport nucléo-cytoplasmique [1]. Si la diffusion passive de petites molécules (< 40 kDa) à travers les NPC est possible sans reconnaissance spécifique, le passage de molécules plus grandes requiert la participation de facteurs de transport nucléaire (nuclear transport factors, ou NTF) qui font partie de la famille des caryophérines [2]. Parmi celles-ci, on distingue les importines, qui assurent un transport vers le noyau, et les exportines qui permettent la sortie vers le cytoplasme. Leur fonction de transporteur est assurée par leur capacité unique à interagir avec des substrats comportant des signaux d’adressage spécifiques (signal de localisation nucléaire, NLS, ou signal d’export nucléaire, NES), et avec les composants protéiques du NPC appelés nucléoporines. C’est en couplant le transport à une réaction énergétique assurée par un gradient de concentration de la protéine RanGTP entre le cytoplasme et le noyau, que les NTF parviennent à imposer des localisations différentielles à leur substrat. Le transport nucléo-cytoplasmique est essentiel à l’homéostasie de la cellule, et sa dérégulation est impliquée dans différents cancers, dans des maladies auto-immunes, et dans le vieillissement [3].
Parmi la multitude de virus qui menacent l’intégrité des cellules eucaryotes, certains doivent accéder au compartiment nucléaire pour se répliquer. Par exemple, les herpèsvirus, le virus de la grippe, les adénovirus, et le virus de l’immunodéficience humaine (VIH) détournent à leur profit la machinerie cellulaire des NPC pour atteindre le noyau [4, 5]. Les mécanismes impliqués sont différents d’un virus à l’autre, ce qui souligne sans doute la plasticité et la redondance fonctionnelle des importines et des nucléoporines dans le transport nucléo-cytoplasmique. Dans le cas du VIH, plus de 600 articles ont déjà été publiés avec les mots clés « VIH » et « import nucléaire » depuis le papier princeps démontrant que l’entrée du VIH dans le noyau se fait par l’intermédiaire des NPC et requiert de l’énergie [6].
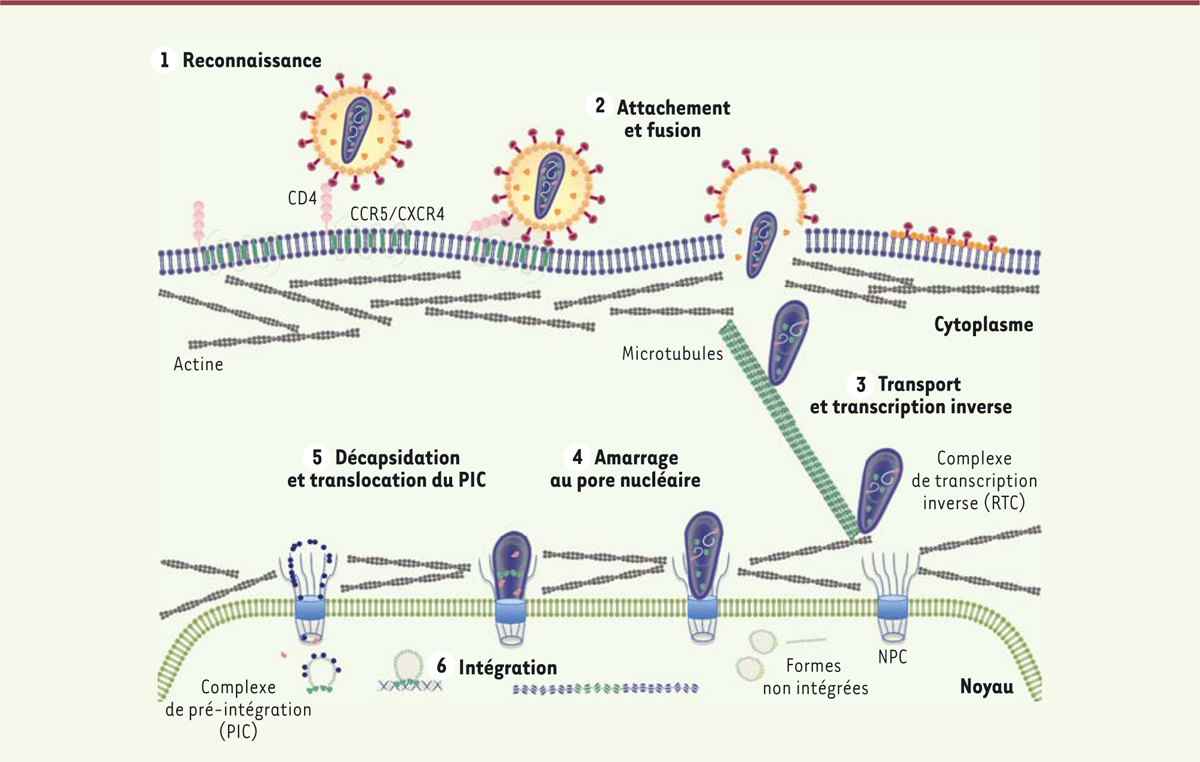
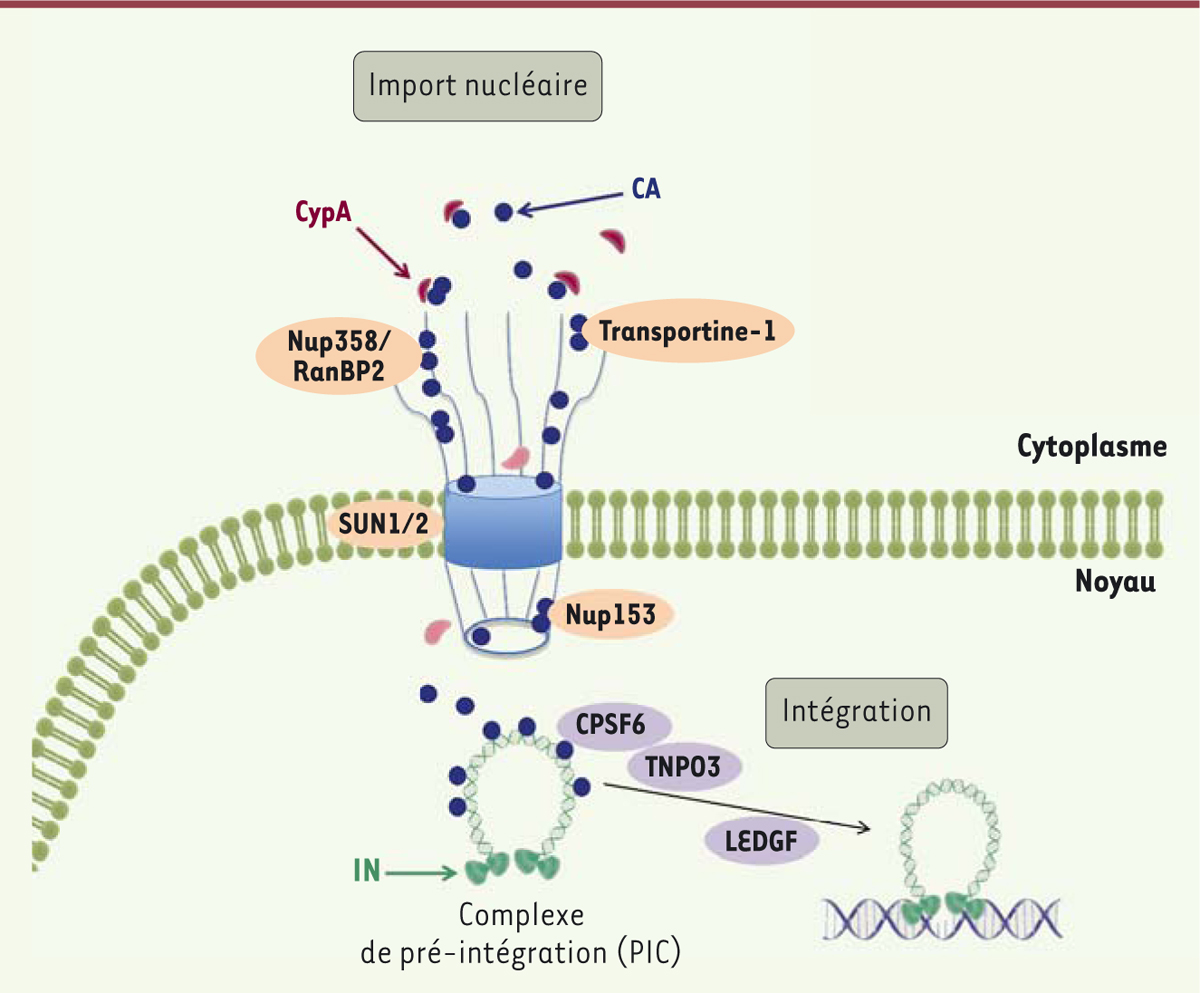
Après son entrée dans la cellule, le VIH traverse le cytoplasme rapidement (quelques minutes) pour atteindre l’enveloppe nucléaire, où il se positionne sur un NPC, encore « habillé » de sa capside [7, 8] (Figure 1). Le maintien d’une capside intègre dans le cytoplasme et lorsque le VIH se trouve au NPC permet notamment au virus de dissimuler son génome viral, empêchant ainsi sa reconnaissance par les récepteurs cytosoliques de l’immunité innée [9]. Il semblerait que le VIH soit alors contraint d’attendre plusieurs heures (entre 4 et 8 heures) au niveau du NPC afin de permettre à son génome ARN d’être rétro-transcrit en ADN double-brin (étape indispensable à l’intégration dans la chromatine), et à sa capside de subir les modifications structurales nécessaires à son passage par le NPC. Le complexe de pré-intégration (PIC) du VIH traverse le NPC en interagissant avec de nombreuses molécules de l’enveloppe nucléaire et du NPC [10, 11] (Figure 2). Une fois dans le noyau, le génome viral s’intègre dans le génome de la cellule, et l’infection devient alors irréversible.
| Figure 1. Étapes précoces de l’infection par le VIH-1. Le virus entre dans la cellule
par reconnaissance de son récepteur CD4 et de corécepteurs CCR5 ou CXCR4.
Une fois la fusion des membranes virale et plasmique effectuée, la cage de
capside est relarguée dans le cytoplasme et transportée le long des réseaux
d’actine et de tubuline. La transcription inverse, qui convertit l’ARN viral
en ADN double brin, débute dès l’entrée dans la cellule et se poursuit après
amarrage au pore nucléaire (NPC). Le maintien de la capside durant les
étapes précoces de l’infection permet au virus d’interagir avec le
cytosquelette et les filaments cytoplasmiques du NPC, tout en dissimulant le
génome viral vis-à-vis des récepteurs cytosoliques de l’immunité innée. Le
désassemblage de la capside au NPC après synthèse de l’ADN viral est indiqué
à titre représentatif d’un consensus actuel entre chercheurs, mais il est à
noter que certains travaux favorisent la notion d’un désassemblage
progressif durant le transport vers le NPC, ou au contraire d’une
décapsidation tardive pendant la translocation par le NPC. Après la
translocation dans le noyau, l’ADN viral associé à des protéines virales et
cellulaires s’intègre dans l’ADN de la cellule hôte pour permettre la
production de nouveaux virions. |
| Figure 2. Co-facteurs du NPC, de l’enveloppe nucléaire, et de la famille des
caryophérines qui contribuent à l’import nucléaire de VIH-1. Le schéma
distingue les facteurs cellulaires participant à l’import nucléaire (en
rose) de ceux impliqués dans l’intégration (en violet), même si la plupart
ont des effets sur plusieurs étapes précoces de l’infection, notamment sur
la stabilité de la capside, l’amarrage des complexes au NPC, l’import
nucléaire du PIC, et l’intégration. CA, protéine de capside ; IN, intégrase
virale. |
Plusieurs importines pourraient participer à l’entrée du VIH par les NPC. Historiquement, de nombreuses études ont montré que des protéines virales comportant des NLS (matrice, protéine virale R, intégrase) pouvaient interagir avec une importine-β, soit par l’intermédiaire d’une importine-α (voie d’importation classique), soit directement (e.g., importine 7, transportine 3/TNPO3) [12]. Toutefois, il n’est pas admis que l’import de ces protéines virales, souvent observé hors du contexte d’une infection virale, soit nécessaire ni même concomitant à l’entrée du génome viral dans le noyau. Par ailleurs, la participation directe d’importines-β dans la translocation du PIC proprement dite reste controversée puisqu’elles peuvent par ailleurs contrôler la localisation de facteurs cellulaires essentiels à l’infection. Récemment, plusieurs études ont montré que le maintien de l’intégrité de la capside virale est essentiel à l’efficacité d’import nucléaire du PIC, et au choix de sites d’intégration dans le génome de la cellule infectée après translocation nucléaire [13, 14] (Figure 2). Nous avons alors fait l’hypothèse que la caryophérine responsable de l’entrée du VIH dans le noyau devait se lier à la fois à la capside et à la machinerie du pore nucléaire, connectant ainsi décapsidation et import nucléaire.
Dans un travail récemment publié dans la revue Nature Microbiology [15], nous avons montré que l’import nucléaire de VIH-1 s’effectue grâce à une interaction directe entre la capside du virus et l’importine-β2 (aussi appelée transportine-1, TRN-1 ou TNPO1). Tout d’abord, nous avons observé que la diminution des niveaux de la transportine-1 par ARN interférence induisait une baisse de l’infection par VIH-1 dans plusieurs types cellulaires, y compris dans les principales cellules cibles du virus, les lymphocytes T CD4+. Des ARN interférents dirigés contre d’autres importines-β, telles que la transportine-2, TNPO3 ou l’importine 7, ont un effet moindre voire nul sur l’infection. Par ailleurs, une analyse protéomique des fractions cytosolique et nucléaire n’a pas révélé d’accumulation de co-facteurs importants pour la stabilité de la capside virale, excluant ainsi un effet indirect éventuel.
Nous avons par la suite montré que la transportine-1 interagit avec la capside de VIH-1 dans des cellules infectées, ainsi qu’in vitro en l’absence de tout autre intermédiaire protéique, démontrant ainsi une interaction directe. La reconnaissance de la capside se fait par un NLS atypique présent sur une boucle exposée de la protéine de capside (correspondant aux acides aminés en positions 84 à 100), et similaire aux NLS identifiés pour les autres substrats décrits pour la transportine-1. Ce NLS, lorsqu’il est greffé à une protéine fluorescente normalement cytoplasmique, confère à cette protéine une localisation nucléaire. Par ailleurs, nous avons identifié la glycine en position 89 de la protéine de capside comme étant critique pour la reconnaissance par la transportine-1 et la localisation nucléaire. En ce qui concerne le VIH-2, qui est moins pathogène et moins transmissible que VIH-1, cette glycine n’occupe pas la même position sur la capside et le virus semble ne pas dépendre de la transportine-1 pour l’infection. Toutefois, un repositionnement expérimental de la glycine sur la boucle exposée de la protéine de capside de VIH-2 rend l’infection par ce virus dépendante de la transportine-1 [15].
L’interaction de la transportine-1 avec la capside de VIH-1 conduit à des réarrangements structuraux importants, qui peuvent être observés in vitro par microscopie à force atomique en présence de transportine-1 recombinante. Dans des cellules infectées, la transportine-1 favorise la décapsidation de VIH-1, et ainsi l’entrée du génome viral dans le noyau. La transportine-1 transporte également la capside dans le noyau, vraisemblablement sous forme désassemblée. Ainsi, la transportine-1 pourrait importer l’ensemble du PIC viral en reconnaissant la protéine de capside, qui emporterait avec elle le génome viral.
Ces travaux ont montré que la perte de la capside virale et l’import nucléaire du génome de VIH-1 sont coordonnés par un transporteur du pore nucléaire, la transportine-1, et ont ainsi permis de mieux comprendre les étapes qui contrôlent l’entrée du VIH dans le noyau des cellules cibles. Étonnamment, la transportine-1 a aussi été identifiée comme favorisant le désassemblage et l’import nucléaire de l’adénovirus [16] et du virus de la grippe [17], ce qui permet d’envisager le développement de médicaments antiviraux à large spectre qui cibleraient l’entrée de virus dans le noyau.