2007
→ Aller vers ANALYSE
Les études épidémiologiques mettent en évidence l'influence de facteurs mésologiques sur la croissance (taille) et la maturité (âge de la puberté) d'une population. Elles servent à situer les enfants sortant de la normalité, aussi bien en excès qu'en insuffisance. Il est généralement admis que les changements de conditions environnementales, et surtout de nutrition, sont les causes principales des changements séculaires de la taille à l'âge adulte.
Les liens entre l'évolution séculaire de la taille adulte et celle de l'âge de la puberté ont été largement étudiés ces dernières années. Une diminution particulièrement importante de l'âge des premières règles est observée dans la plupart des pays occidentaux. Cependant, la variabilité interindividuelle peut atteindre 4-5 ans et dépend de facteurs génétiques et environnementaux et probablement des interactions entre ces deux types de facteurs.
De très nombreux travaux indiquent l'existence d'une relation étroite entre masse adipeuse et puberté. Les filles en surpoids présentent une maturation sexuelle plus précoce que les filles minces. Cependant, la question se pose de savoir si c'est la surcharge pondérale qui induit une maturation sexuelle précoce, ou si au contraire, une maturation sexuelle précoce peut, par elle-même, être responsable d'une prise de poids excessive. À l'inverse, les études montrent une relation négative entre masse adipeuse et maturation sexuelle chez les garçons. Des études en cours tentent d'élucider le rôle de la leptine, en relation avec la masse adipeuse, dans la maturation sexuelle normale, aussi bien chez les garçons que chez les filles. Si le signal initiateur de la puberté reste inconnu, la séquence des changements hormonaux majeurs peut être abordée chez l'animal. Les modèles animaux permettent également d'étudier les effets de stress précoces au niveau des principaux axes endocriniens impliqués dans la croissance et le développement pubertaire.
Tendances séculaires de la croissance
Les études épidémiologiques de la croissance sont indispensables pour évaluer les influences de facteurs environnementaux et pour situer l'état de santé d'un individu et d'une population. En termes individuels, les enquêtes de croissance permettent de situer les enfants sortant de la normalité, aussi bien en excès qu'en insuffisance. Elles permettent d'aborder des problèmes aussi divers que celui de l'obésité, des carences nutritionnelles, des maladies ou des syndromes génétiques, des différences socioéconomiques, voire même l'impact de facteurs psychologiques.
L'analyse détaillée de la croissance et du développement se fait essentiellement à partir de données longitudinales, c'est-à-dire des données sérielles du même sujet, permettant d'établir la courbe de croissance individuelle. Ces données permettent, par exemple, d'évaluer les vitesses de croissance et donc la dynamique de la croissance.
La majorité des études de croissance en population sont en fait transversales, c'est-à-dire réalisées à partir de mesures uniques prises chez des sujets différents à chaque âge. Les résultats de ces études transversales permettent d'estimer la tendance centrale d'une population et la variation de données de croissance à chaque âge. C'est également à partir de données transversales que des normes de croissance (ou courbes de référence) peuvent être établies illustrant la croissance « moyenne » et les limites de la variation « normale » dans une population. Ces études transversales de la croissance sont donc intéressantes au niveau épidémiologique et au niveau de l'analyse de l'influence des facteurs génétiques et mésologiques, c'est-à-dire d'environnement au sens large.
La France ne possède pas de références récentes ni transversales, ni longitudinales. Les courbes de références généralement utilisées sont celles produites dans l'étude de Sempé et collaborateurs publiée en 1979, avec des enfants nés de 1953 à 1960 et suivis jusqu'à 21 ans. Des études transversales ou longitudinales récentes concernant des données d'enfants nés après les années 1960 manquent.
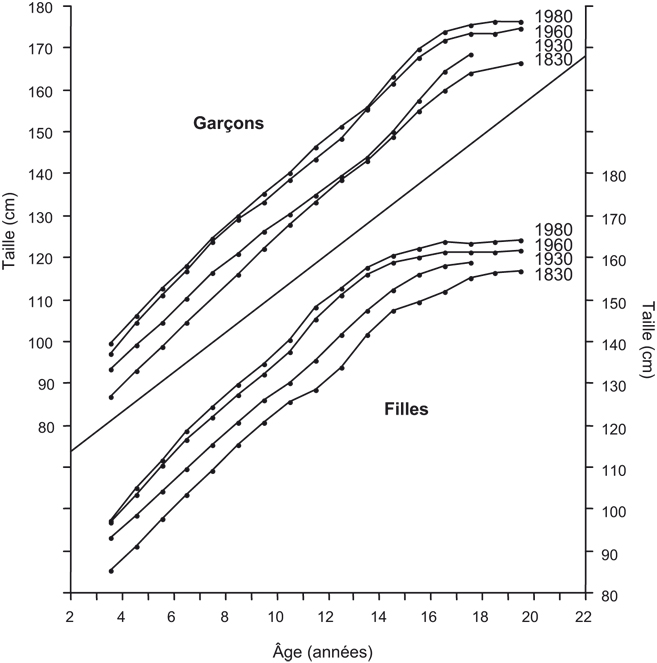
Nous savons que des changements de la croissance en liaison avec les processus d'industrialisation et de modernisation s'observent dans tous les pays européens : il s'agit de changements dits séculaires observés depuis le XIX
e siècle, avec une croissance et un développement plus rapides, des tailles moyennes plus élevées et une maturation plus précoce. Mais, le phénomène est variable d'un pays à l'autre et ne se réalise pas de manière linéaire. Actuellement, l'évolution séculaire de la taille à l'âge adulte se ralentit ou est même stoppée dans certains pays européens comme en Belgique par exemple : deux raisons peuvent expliquer cette décélération soit que les conditions mésologiques sont devenues optimales pour l'expression complète du génotype, soit que les conditions mésologiques cessent de s'améliorer dans les dernières décennies.

Avec l'évolution séculaire de la taille, il est normal d'observer des changements de poids, aussi bien chez les enfants que les adultes. À partir des années 1980, une tendance vers un alourdissement relatif semble refléter l'épidémie croissante d'obésité observée dans le monde occidental.
En Europe, l'évolution séculaire de la croissance est clairement en relation avec l'industrialisation et les changements associés des modes de vie : cela explique que les changements séculaires n'aient pas débuté à la même époque dans les différents pays européens, au XIXe siècle en Angleterre et en Belgique par exemple, seulement au début du XXe siècle en France et même plus tard en Espagne.
Ces évolutions différentielles amènent également des variations géographiques. L'analyse de moyennes de taille masculine par département en France montre une hétérogénéité interdépartementale de taille avec un gradient nord-est vers sud-ouest, des tailles les plus élevées au nord et nord-est vers les moins élevées au sud et sud-ouest. De plus, une augmentation plus élevée est observée entre 1960 et 1989 pour les départements où la taille moyenne était initialement moins élevée, résultant donc en une diminution de l'hétérogénéité interdépartementale en 1989. Mais nous ne disposons pas de résultats plus récents.
Il est généralement admis que des changements observés au niveau de la croissance et du développement sont de bons indicateurs des conditions de vie d'une société, et en particulier de la situation nutritionnelle et sanitaire. L'évolution séculaire traduit les conditions de santé d'une population et met aussi en évidence des inégalités de santé au sein d'une même population. Des mesures régulières du statut de croissance dans une population restent donc importantes puisqu'elles sont un outil sensible en santé publique.
Tendances séculaires de l'âge de la puberté
La croissance durant la puberté représente 15 à 20 % de la taille atteinte à l'âge adulte. Les liens entre l'évolution séculaire de la taille adulte et celle de l'âge de la puberté ont été largement étudiés ces dernières années. Différents facteurs génétiques et environnementaux ont été explorés dans leurs relations avec l'âge du développement pubertaire.
La puberté correspond à l'activation de la fonction hypothalamo-hypophyso-gonadique, aboutissant au développement complet des caractères sexuels, à l'acquisition de la taille définitive, de la fonction de reproduction et de la fertilité. Les différents stades du développement pubertaire sont définis selon la classification de Tanner portant sur les caractères sexuels secondaires.
Classification de Tanner des stades de développement pubertaire
|
Stades de développement pubertaire
|
|
Pilosité pubienne garçons et filles
|
|
P1 Absence de pilosité
P2 Quelques poils longs sur le pubis
P3 Pilosité pubienne au dessus de la symphyse
P4 Pilosité pubienne fournie
P5 La pilosité s'étend à la racine des cuisses et s'allonge vers l'ombilic chez le garçon
|
|
Développement mammaire
|
|
S1 ou B1 Absence de développement mammaire
S2 ou B2 Petit bourgeon mammaire avec élargissement de l'aréole
S3 ou B3 La glande mammaire dépasse la surface de l'aréole
S4 ou B4 Développement maximum du sein (apparition d'un sillon sous-mammaire), saillie de l'aréole et du mamelon sur la glande
S5 ou B5 Aspects adulte, disparition de la saillie de l'aréole
|
|
Développement des organes génitaux externes du garçon
|
|
G1 Testicules et verge de taille infantile
G2 Augmentation du volume testiculaire de 4 à 6 ml (L 25 à 30 mm)
G3 Continuation de l'accroissement testiculaire de 6 à 12 ml (L 30-40 mm), accroissement de la verge
G4 Accroissement testiculaire de 12 à 16 ml (L 40-50 mm) et de la verge
G5 Morphologie adulte
|
Chez la fille, la première manifestation pubertaire est le développement des glandes mammaires qui commence en moyenne à partir de 10,5/11 ans. Viennent ensuite le développement de la pilosité pubienne et axillaire, les modifications de la vulve et enfin les premières règles (ménarche) qui apparaissent en moyenne autour de 13 ans, entre 2 et 2,5 ans après l'apparition des premiers signes pubertaires. Leur date de survenue est considérée comme physiologique entre 10 et 15,5 ans. La puberté chez la fille se situe pour un âge osseux de 11 ans (10 à 12 ans) correspondant à l'apparition du sésamoïde du pouce.
Chez le garçon, le premier signe de puberté est l'augmentation du volume testiculaire qui se produit en moyenne vers l'âge de 12-13 ans. Les autres signes de maturation pubertaire sont le développement de la pilosité pubienne et axillaire, l'augmentation de la taille de la verge. La puberté chez le garçon se situe pour un âge osseux de 13 ans correspondant à l'apparition du sésamoïde du pouce.
L'estimation de l'âge moyen de la puberté dans une population pose différents problèmes méthodologiques liés principalement aux modes de recueil des données et aux stades considérés. En Europe, l'âge des premières règles est en moyenne à 12 ans en Italie, 12,6 ans en France et 13,5 ans en Allemagne. Concernant les garçons, différentes études américaines et européennes s'accordent sur un âge moyen de 11,6 ans pour le stade G2.
Entre le milieu du XIX
e siècle et le milieu du XX
e
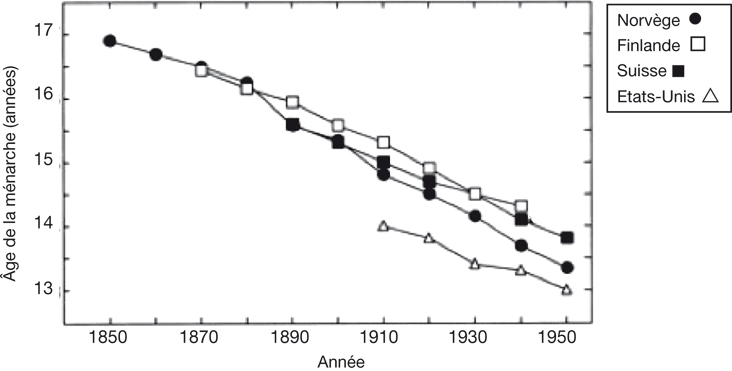
siècle, l'âge moyen des premières règles a particulièrement diminué, passant de 17 ans à 14 ans aux États-Unis et dans plusieurs pays de l'Europe de l'Ouest. Cependant, la courbe de cette évolution varie d'un pays à l'autre : une diminution de 0,3 an par décennie a été calculée pour les données norvégiennes et finlandaises et dans les études prospectives américaines. En France, la diminution est estimée à 0,175 an par décennie.
Il faut noter l'existence d'un gradient nord-sud au XIXe siècle avec un âge de ménarche plus bas dans les pays du sud de l'Europe (France) que dans les pays du nord (Scandinavie). Mais, les études réalisées après 1960 dans ces pays tendent à montrer, une stabilisation voire un arrêt de cette évolution. Cependant, dans d'autres pays (Inde, Chine, Bulgarie) la diminution est aussi importante qu'elle l'était dans les pays occidentaux avant 1960. Ces évolutions sont en concordance avec l'évolution des conditions de vie dans les différents pays. L'évolution séculaire de l'âge des premières règles serait associée à l'élévation de l'indice de masse corporelle.
D'autres études se sont intéressées à l'évolution séculaire de marqueurs tels que le développement mammaire (filles) ou des organes génitaux (garçons). En Suède et en Grande-Bretagne, le développement mammaire est plus précoce en 1980 que dans les années 1960 ou 1970. Ces données soulignent d'une part l'existence de variations d'un pays à l'autre et d'autre part montrent l'importance du marqueur utilisé pour évaluer l'évolution de l'âge de la puberté (ménarche, différents stades de Tanner).
Les études épidémiologiques ont tenté d'isoler différents facteurs corrélés avec des variations de l'âge de la puberté, essentiellement chez les filles. Les filles vivant dans des milieux dits « privilégiés » au sein de pays en voie de développement (Asie, Afrique, Amérique du sud) ont un âge moyen de la ménarche comparable à celui des filles des pays occidentaux du pourtour méditerranéen mais différent de celui des filles vivant dans les mêmes pays dans des conditions moins privilégiées. Ceci indique bien l'influence des conditions socioéconomiques. Une relation entre le poids corporel et l'âge de survenue de la puberté a été suggérée par différentes études. Les filles qui ont une puberté précoce sont plus souvent obèses que les filles qui ont une puberté tardive alors que l'inverse est observé chez les garçons. Un indice de masse corporelle élevé dès 36 mois est associé avec une puberté précoce chez les filles américaines.
Des situations de stress physique et psychologique peuvent entraîner un retard pubertaire et un renversement de la tendance séculaire comme cela a été observé en temps de guerre en Croatie et en Bosnie. Cependant, d'autres situations de stress peuvent à l'inverse induire une puberté précoce (immigration, adoption, attachement parental insecure). La différence d'impact des composants de la situation de stress suggère une hétérogénéité de la réponse neuroendocrine à ces différents facteurs.
De nombreuses études se sont intéressées aux relations entre l'exposition fœtale et périnatale à des produits chimiques perturbateurs endocriniens (pesticide DDT) et la puberté précoce. Mais, il est difficile d'isoler les agents chimiques présents dans l'environnement pour connaître leurs effets respectifs sur le système endocrinien. D'autres facteurs évoqués (poids de naissance, conditions de luminosité ou climatiques, difficultés scolaires...) nécessiteraient de nouvelles études.

Au total, l'âge de la puberté est un processus physiologique complexe soumis à tout un spectre de facteurs en intercorrélation.
Relation entre puberté et obésité
De très nombreux travaux indiquent l'existence d'une relation étroite entre masse adipeuse et puberté. On sait depuis longtemps que le déclenchement de la puberté dépend des conditions nutritionnelles, et que les situations de carence alimentaire sont associées à un retard de puberté. On peut par ailleurs remarquer que l'obésité chez l'enfant est en augmentation constante dans la plupart des pays occidentaux et, que dans le même temps, on observe une diminution de l'âge d'apparition de la puberté. Un certain nombre d'études épidémiologiques indiquent que les deux phénomènes sont très probablement liés.
Si l'existence d'un lien entre masse adipeuse et puberté semble bien établie, la relation de causalité entre surcharge pondérale et puberté reste assez mal définie. Les études ne permettent pas de déterminer si la pré-existence d'un surpoids favorise une puberté précoce, ou si, au contraire, les changements hormonaux accompagnant la puberté sont responsables de l'augmentation de masse adipeuse. En effet, certains travaux suggèrent que la maturation sexuelle serait responsable, via une augmentation des stéroïdes sexuels, d'une prise de poids excessive chez les filles ayant une puberté précoce.
Il faut en outre remarquer que la plupart des travaux concernant les relations entre obésité et puberté ont été réalisés chez des filles. Ceci est probablement dû aux difficultés associées à l'évaluation de la maturité sexuelle des garçons dans les études épidémiologiques. Les quelques études réalisées chez les garçons indiquent que la relation entre maturité précoce et obésité est totalement inversée chez ces derniers par rapport aux filles.
Enfin, la découverte de la leptine, en 1994, a permis d'éclairer d'un jour nouveau les relations entre le tissu adipeux, l'axe hypothalamo-hypophysaire et la puberté. Ainsi, la mise en évidence, en 1998, de patients obèses ayant une déficience congénitale en leptine ou en son récepteur, a permis de démontrer que cette hormone, produite par le tissu adipeux, joue un rôle très important dans la mise en place de la fonction de reproduction. En outre, le traitement à la leptine, pendant 18 mois, d'un jeune homme adulte déficient en leptine et jusque-là impubère, a permis d'induire une puberté complète, démontrant que la leptine joue un rôle permissif très important. Cependant, des enfants obèses traités à la leptine ne font pas de puberté précoce, indiquant que le signal « leptine », n'est pas, par lui-même, suffisant pour déclencher la puberté à un âge pré-pubertaire.
La littérature concernant les relations entre obésité et puberté indique clairement, chez les filles, l'existence d'une corrélation positive entre surcharge pondérale et maturation sexuelle précoce. La difficulté à déterminer le sens de la relation entre surcharge adipeuse et maturation sexuelle suggère qu'il s'agit d'une relation bidirectionnelle, dans laquelle l'accumulation de graisse au moment de la puberté pourrait dépendre des hormones sexuelles (les niveaux d'œstrogènes), mais la quantité de graisse accumulée pourrait elle-même précipiter la maturation sexuelle. En effet, le tissu adipeux pourrait se comporter comme une glande hormonale secondaire, capable d'influencer la synthèse et la libération d'hormones comme les œstrogènes, qui agiraient directement sur la maturation sexuelle. Enfin, la mise en évidence d'un rôle crucial de la leptine, qui est nécessaire mais non suffisante, pour une maturation sexuelle normale, aussi bien chez les garçons que chez les filles, souligne l'importance du tissu adipeux dans le déclenchement de la puberté.
Aspects génétiques de la croissance
L'héritabilité (h2) est une mesure statistique quantitative qui permet d'estimer, pour un trait donné, la contribution de la composante génétique. En d'autres termes, cette donnée définit à un moment donné et sur une population donnée la part respective des gènes et de l'environnement. L'étude d'un trait complexe se heurte généralement précisément à la difficulté d'évaluer son héritabilité. Une autre difficulté est liée à la caractérisation précise du trait (phénotype) étudié ; la définition même du phénotype est en effet souvent incertaine pour de nombreux traits complexes. Quand il s'agit d'un trait quantitatif, les variations éventuelles de la valeur mesurée chez un même individu (ou toute erreur de mesure) contribuent à sous-estimer l'implication des facteurs génétiques.
Cependant, la taille est un des traits complexes dont l'étude soulève le moins de difficultés. Sa mesure est extrêmement facile, fiable et précise ; il s'agit d'une donnée stable sur une longue période de la vie. La mesure de la taille est donc facilement réalisable en routine, avec peu de moyens, sur de grands échantillons de population. À l'échelle de la population, la taille adulte suit une distribution normale, suggérant l'interaction de plusieurs facteurs.
Sur la base de plusieurs observations cliniques, physiologiques et pathologiques, il est bien établi que plusieurs gènes contribuent à déterminer la taille d'un individu. De très nombreux gènes ont en effet été associés à des anomalies de la croissance chez l'homme et il est donc possible que des polymorphismes (variations nucléotidiques) de certains de ces gènes contribuent à la taille des individus à l'échelle de la population. Le rôle des chromosomes sexuels dans le déterminisme de la taille moyenne est essentiel, comme l'attestent le dimorphisme sexuel de la taille au cours du processus de croissance ou la taille anormale de patients présentant des anomalies des gonosomes. L'importance de facteurs génétiques est par ailleurs suggérée par la variabilité de la taille moyenne des individus selon leur origine ethnique.
D'autres types d'étude ont permis de cerner la composante génétique. Selon les études d'adoption menées dans plusieurs pays (États-Unis, Canada, Danemark, Suède, Finlande), les corrélations intrafamiliales sont bien plus fortes entre les enfants et leurs parents biologiques qu'entre les individus adoptés et leur famille d'accueil. Les études de germains dans de nombreuses populations comme par exemple aux États-Unis, en France, au Brésil, en Norvège, suggèrent une forte héritabilité. La première étude rigoureuse de jumeaux a été réalisée en 1959 sur une population de conscrits suédois ; elle a permis d'estimer l'héritabilité de la taille à 0,60. Depuis, d'autres études menées aux États-Unis ou en Finlande ont retrouvé des valeurs plus élevées d'héritabilité (0,80). Par ailleurs, les données récentes d'héritabilité issues des différents criblages du génome réalisés pour identifier des régions génomiques potentiellement importantes dans la détermination de la taille confirment ces travaux (héritabilité de 0,69 à 0,95).
La comparaison de cohortes de jumeaux dans 8 pays (Australie, Danemark, Finlande, Italie, Pays-Bas, Norvège, Suède, Royaume-Uni) a fourni des résultats intéressants sur la variation de la taille moyenne selon les populations. Les valeurs les plus élevées sont observées aux Pays-Bas (184 cm en moyenne pour les hommes et 171 cm en moyenne pour les femmes) et les valeurs les plus basses en Italie (177 cm en moyenne pour les hommes et 163 cm en moyenne pour les femmes). L'évolution séculaire du gain de taille ayant été similaire dans tous ces pays, il est probable que la différence observée est liée aux facteurs génétiques. Chez les femmes, l'héritabilité apparaît plus faible ; les facteurs environnementaux semblent donc jouer un rôle plus important dans le déterminisme de la taille.
De nombreuses études épidémiologiques ont montré une forte association entre la taille ou le poids de naissance et la taille dans l'enfance, à l'adolescence et à l'âge adulte. Ainsi, une étude menée chez 40 000 hommes jeunes met en évidence une différence moyenne de 7 cm entre des hommes ayant eu un poids de naissance inférieur à 2 500 g et ceux ayant eu un poids de naissance supérieur à 4 500 g. De même, les auteurs observent une différence moyenne proche de 10 cm entre les hommes ayant une taille à la naissance de 48 cm et ceux ayant une taille de 55 cm. Une autre étude menée chez des jumeaux montre que chez les paires de jumeaux dizygotes et monozygotes, le jumeau ayant le poids ou la taille de naissance le plus bas a la plus petite taille à l'âge adulte. Ainsi, un écart du poids de naissance de 1 kg entre deux jumeaux dizygotes est associé à une différence de taille ultérieure de 4,3 cm.
Trois principales approches sont utilisées pour identifier les variants génétiques modulant la taille : le séquençage de gènes candidats, les études d'association et les études de liaison par criblage du génome.
Des centaines de syndromes répertoriés dans le registre OMIM
1
http:/www.ncbi.nlm.nih.gov/omim
(
Online Mendelian in Man) sont associés à une très petite taille. Quelques unes de ces maladies sont dues à des mutations d'un seul gène. Ainsi, la majorité des retards de croissance de cause endocrinienne est liée à un déficit de l'hormone de croissance (isolé ou combiné à d'autres déficits d'hormones hypophysaires) ou à un défaut d'action. Les quelques mutations moléculaires identifiées touchent des gènes exprimés le long de l'axe somatotrope (gène codant l'hormone de croissance, son récepteur...) ainsi qu'un nombre grandissant de facteurs de transcription (HESX1, LHX3, LHX4, PROP1, POU1F1, SOX3, SOX2...). D'autres mutations de nombreux gènes impliqués dans la formation osseuse sont responsables d'une dysplasie squelettique retentissant sur la taille. Les principaux gènes en cause sont
FGFR3 et
COL1A1. Les anomalies du gène
SHOX, localisé sur le chromosome X, sont probablement plus fréquentes. Elles ont été impliquées chez les sujets présentant un syndrome de Turner mais également chez des patients au diagnostic de petite taille idiopathique.
Bien que les données sur les mutations responsables d'anomalies sévères de la croissance soient encore très fragmentaires, elles sont essentielles pour comprendre la physiopathologie de plusieurs maladies rares, et surtout à l'échelle individuelle, pour assurer une meilleure prise en charge des patients et de leur famille. Mais ces travaux sont aussi essentiels pour guider, à l'échelle d'une population, les études visant à mettre en évidence des variants moléculaires plus communs, aux effets bien moins importants, et pouvant contribuer à la détermination d'un trait complexe comme la taille. Les gènes déjà impliqués dans des maladies monogéniques représentent en effet autant de candidats à analyser pour tenter d'expliquer les variations de la taille dans une population donnée.
La plupart des études d'association reposent précisément sur l'analyse de ces gènes candidats ; des études d'association à l'échelle du génome entier sont cependant de plus en plus envisageables du fait de l'avènement des cartes de polymorphismes ADN à haute densité et des développements technologiques récents qui permettent un génotypage à haut débit.
Les études d'association reposent typiquement sur la comparaison de la fréquence de certains allèles (à un ou plusieurs locus) entre une population de patients et une population témoin. Ces études sont particulièrement intéressantes pour détecter des variants communs aux effets génétiques modestes. Cependant, pour espérer mettre en évidence de tels effets, elles nécessitent de grands échantillons, ce qui est rarement réalisé. Aussi, les résultats de ces études sont rarement répliqués.
Une association a été rapportée entre des variants communs d'une douzaine de gènes et la taille : LH-β (Luteinizing Hormone-β) ; COLI A1 (Collagen I A1) ; VDR (Vitamin D Receptor) ; ESR1 (Estrogen receptor) ; DRD2 (D2 Dopamine Receptor) ; IGF-1 (Insulin-like Growth Factor 1) ; CYP17 (Cytochrome P450c17α) ; CYP19 (Aromatase) ; chromosome Y ; PTHR1 (PTH/PTHrP Receptor) ; GH1 (Growth Hormone 1) ; PPARγ (Peroxisome Proliferator-Activated Receptor-γ). Ces variants ont été recherchés dans des gènes présentant des mutations sévères responsables de syndromes déjà évoqués caractérisés par une petite taille, ainsi que dans d'autres gènes considérés comme de bons candidats. Plusieurs de ces gènes ont été aussi associés à un autre trait complexe, l'âge de la puberté, dont l'héritabilité est également élevée.
Les études de liaison ont été largement utilisées pour identifier de nombreux gènes impliqués dans des maladies de transmission mendélienne. De telles approches restent également intéressantes pour l'analyse d'un trait complexe à forte héritabilité comme la taille. Ce trait a donc fait l'objet de nombreuses études ; en particulier, une équipe a réanalysé les données d'études de liaison par criblage du génome complet de quatre populations d'individus adultes pour lesquelles le génotype et la taille étaient disponibles. Les auteurs ont mis en évidence une liaison impliquant les trois régions chromosomiques suivantes : 7q31.3-36, 12p11.2-q14 et 13q32-33 ; une quatrième région 6q24-25 a donné des résultats proches du seuil de significativité. De manière encourageante, les données concernant les chromosomes 6, 7 et 12 ont été répliquées indépendamment par d'autres équipes. Quatre autres régions (9q22, Xq24, 6p21 et 2q21) ont également été repérées et une relation d'épistasie a été mise en évidence entre deux de ces locus (6p21 et 2q21) qui influencerait la taille adulte dans l'échantillon testé.
Les études de liaison et d'association sont des approches particulièrement prometteuses pour l'identification et la caractérisation de la composante génétique d'un trait complexe à forte héritabilité comme la taille. Comprendre les fondements génétiques des anomalies de la croissance reste un enjeu essentiel non seulement pour identifier des gènes dont certains variants contribueraient à la variation de la taille à l'échelle des populations, mais surtout pour une meilleure prise en charge des patients et de leur famille.
Aspects génétiques de l'âge de puberté
L'âge normal du début de la puberté est compris dans un intervalle dépendant du sexe (8 à 13 ans chez la fille et 9 à 14 ans chez le garçon). La période de latence entre la naissance et l'initiation de la puberté correspond à l'enfance chez l'espèce humaine ou à la période d'immaturité sexuelle dans le reste du monde animal. Il existe une étroite corrélation entre durée de vie, temps de gestation et âge de la puberté chez les mammifères, ce qui suggère que ces trois repères temporels sont dépendants les uns des autres. L'enfance est une période cruciale durant laquelle survient la maturation neuronale des fonctions supérieures et cognitives. La réactivation de l'axe gonadotrope résulte également d'un processus de maturation neuronale dont la chronologie est certainement déterminée durant la vie fœtale ou à la naissance.
L'analyse du déterminisme génétique de l'âge de la puberté nécessite une méthodologie difficile à mettre en œuvre. La puberté est un processus physiologique dont le déterminisme génétique est certain, bien que l'importance des facteurs de l'environnement dans la reproduction des mammifères soit également reconnue. Le déterminisme génétique de l'âge de la puberté a été démontré dans plusieurs études dont les premières datent de 1929. Une corrélation élevée mère-fille de l'âge de la puberté est décrite dans des études rétrospectives. Néanmoins, ces études soulèvent le problème des analyses d'un événement survenu plusieurs années auparavant et parfois mal défini. Il existe un biais possible sur l'âge si l'événement est daté en fonction de l'année civile de naissance et non en fonction de l'âge réel. Afin de lever l'erreur sur l'appréciation rétrospective, des études longitudinales ont été menées. Elles ont confirmé le fort déterminisme génétique de l'âge de la puberté.
Le deuxième écueil de ces travaux de corrélation est le manque de spécificité de la variable « ménarche » pour déterminer l'âge de la puberté. La ménarche est le témoin d'un processus d'interactions hormonales complexes qui dépendent de la production endogène des hormones stéroïdes sexuelles, de la sensibilité des tissus périphériques à ces hormones mais également de facteurs « pertubateurs » exogènes ayant une activité de type stéroïde. Cette « pollution » par des composés exogènes est également vraie pour l'appréciation du développement des seins. En plus de ce phénomène, l'obésité qui intervient également sur l'âge de la puberté dans les pays développés est un autre facteur diminuant la fiabilité de l'analyse. Certaines études ont contourné ce problème en assimilant la puberté à une variable dynamique définie par un score qui prend en compte plusieurs paramètres du développement pubertaire. Ces travaux ont confirmé voire augmenté la part des facteurs génétiques dans le déterminisme de l'âge de la puberté. De plus, cette variable dynamique a réhabilité la pertinence de l'analyse rétrospective.
Le troisième point concerne la taille des populations étudiées. Il s'agit de méga-analyses sur plusieurs années demandant un effort financier important qui sont difficiles à mettre en place.
Définir de nouvelles constantes biologiques de l'initiation de la puberté est un besoin urgent pour étudier la part des facteurs génétiques et environnementaux. Les changements somatiques survenant durant la puberté sont le reflet de profondes modifications hormonales. Pour beaucoup d'entre elles, il est difficile de faire la part entre la cause et la conséquence du processus pubertaire. Durant la puberté, il survient un pic de croissance dit « pic de croissance pubertaire » dont les mécanismes sont mal définis. Ce pic n'est pas entièrement dépendant des hormones sexuelles. Il est probablement le reflet de la maturation neuronale de l'axe somatotrope en partie dépendante de celle survenant sur l'axe gonadotrope. Le déterminisme génétique de ces variations biologiques au cours de la puberté a été modélisé dans un nombre assez restreint de travaux. Ce point est important pour mieux définir les variations normales et trouver des marqueurs biologiques des phases initiales de la puberté voire de la phase pré-pubertaire. Ces marqueurs seraient plus faciles à analyser pour les travaux d'épidémiologie et de veille sanitaire.
Il existe également un intérêt diagnostique à développer de nouveaux marqueurs de l'initiation de la puberté. L'analyse du retard pubertaire tente de différencier le retard pubertaire simple, sans retentissement ultérieur sur la fertilité, du déficit gonadotrope définitif responsable d'infertilité définitive. Ce point est une cause fréquente de consultations dans les services d'endocrinologie pédiatrique. Pour un enfant présentant un retard pubertaire isolé, il n'existe pas aujourd'hui de marqueur clinique ou biologique prédictif de l'évolution vers une puberté normale. Seule l'analyse de génétique moléculaire permet de conclure lorsqu'une mutation est caractérisée.
L'analyse des modèles monogéniques des maladies de l'initiation de la puberté constitue une stratégie pour mieux comprendre la physiologie de la puberté. La puberté dépend de la réactivation de l'axe gonadotrope vers l'âge de 7-8 ans. L'absence de réactivation de l'axe gonadotrope est responsable d'un retard pubertaire voire d'une absence complète de puberté et par conséquent d'une infertilité à l'âge adulte. À l'inverse, une activation accélérée est responsable de puberté précoce. Le retard pubertaire est souvent syndromique mais des formes isolées sont également décrites. Ces dernières représentent une importante source d'informations pour mieux comprendre le rôle des protéines connues ou en définir de nouvelles jouant un rôle majeur dans l'initiation de la puberté. Ces travaux sur la génétique du retard pubertaire isolé n'expliquent pas les formes sporadiques pourtant majoritaires.
La puberté précoce centrale isolée est une pathologie complexe dont l'origine génétique demande à être modélisée précisément. Plusieurs arguments suggèrent un modèle génétique multifactoriel. La description des facteurs favorisant la puberté précoce est absolument capitale pour mieux comprendre les mécanismes physiologiques et physiopathologiques de la puberté.
La génétique peut apporter des éléments concernant les conséquences à long terme des maladies de l'initiation de la puberté. En effet, l'axe gonadotrope est l'élément clé de la reproduction. L'analyse des mécanismes de l'initiation de la puberté permet de décrire de nouveaux systèmes hormonaux également importants chez l'adulte. Or, plusieurs cancers dépendent directement des hormones sexuelles. Il semble exister une corrélation entre cancer du sein et âge de la puberté. Ce point soulève plusieurs questions en santé publique. La baisse séculaire de l'âge de la puberté pourrait-elle expliquer en partie l'augmentation de la prévalence du cancer du sein dans les pays développés ? Existe-t-il un lien entre les facteurs génétiques prédisposant à une puberté avancée et ceux favorisant la survenue d'un cancer dépendant des hormones sexuelles ? De nouveau, la problématique est centrée sur la description de nouveaux marqueurs génétiques ou biologiques de l'initiation de la puberté.
Aspects neuroendocriniens de la puberté et de la croissance et rôle de la leptine
Il est maintenant établi que l'initiation de la puberté est déterminée par des événements qui prennent place dans le cerveau et que la présence des gonades n'est pas requise pour ce processus. Cette activation qui s'opère au niveau central conduit à une augmentation synchronisée de la sécrétion pulsatile de gonadolibérine ou GnRH (Gonadotropin Releasing Hormone) par une poignée de neurones spécialisés localisés dans l'hypothalamus. La sécrétion de GnRH stimule la synthèse et la libération d'hormone lutéinisante (LH) et d'hormone folliculostimulante (FSH). Ces hormones sont alors libérées dans la circulation générale et atteignent les gonades pour y réguler leur développement et la sécrétion des stéroïdes gonadiques. En retour, ces hormones stéroïdes promeuvent la croissance des organes sexuels secondaires et entraînent l'apparition de dimorphismes sexuels (tels que la distribution des graisses, la masse musculaire, le développement de la poitrine, le ton de la voix).
Chez la femme, les premiers signes hormonaux de la puberté sont détectés à l'âge de 8-10 ans et se traduisent par l'apparition d'un rythme circadien de sécrétion de gonadotropines (avec des taux de LH plus élevés pendant le sommeil). La première menstruation survient en moyenne à l'âge de 12 ans, et la première ovulation a lieu 6 à 12 mois plus tard.
Il est de plus en plus évident que l'élément déclencheur de la puberté ne réside pas dans la propriété intrinsèque des neurones à GnRH à sécréter leur neurohormone de manière épisodique, mais résulte plutôt du développement postnatal du cerveau qui conduit à la maturation des réseaux de neurones et de cellules gliales (cellules non-neuronales du système nerveux, tels que les astrocytes) qui leur sont fonctionnellement associées. Il est connu depuis de nombreuses années que les neurones à GnRH reçoivent des informations émanant d'autres neurones par l'intermédiaire de contacts synaptiques. La modification de la nature de ces signaux « extérieurs », telle que la perte des influx trans-synaptiques inhibiteurs sur les neurones à GnRH pourrait constituer l'élément déclencheur de l'augmentation de la sécrétion de GnRH nécessaire à la survenue de la puberté. Ce « frein central » de la puberté s'exerce pleinement pendant la période juvénile du développement postnatal, empêchant une augmentation prématurée de la sécrétion de GnRH. Une vue alternative, mais non exclusive, propose que l'activation pubertaire de la sécrétion de GnRH soit plutôt provoquée par une augmentation des influx excitateurs qui sont principalement véhiculés par les neurones utilisant l'acide aminé glutamate comme neurotransmetteur. Des études récentes montrent qu'en plus de ce contrôle neuronal, les cellules gliales et les facteurs de croissance qu'elles produisent jouent un rôle fondamental dans ce processus facilitateur par lequel l'hypothalamus contrôle la sécrétion de GnRH pendant le développement sexuel.
Existe-t-il des voies de communication capables de coordonner les influx neuronaux et gliaux facilitant la sécrétion de GnRH lors de l'initiation de la puberté ? Des études récentes démontrent que les acides aminés excitateurs tels que le glutamate pourraient être impliqués dans ce processus. Ainsi, la communication entre les astrocytes et les réseaux neuronaux qui utilisent les acides aminés excitateurs comme mode de signalisation pourrait représenter un mécanisme fondamental utilisé par le cerveau neuroendocrine pour contrôler l'apparition de la puberté. L'identification de nouvelles molécules impliquées dans la régulation de la communication entre neurones et cellules gliales pendant la période du développement postnatal conduisant à la puberté d'une part, et l'identification de gènes contrôlant l'horloge pubertaire d'autre part, seront un sujet majeur d'investigations dans les années à venir.
Des travaux récents suggèrent le rôle de la leptine dans la croissance et dans la survenue de la puberté. Les premières observations montrant que des restrictions alimentaires retardent l'apparition de la puberté ou altèrent la fonction de reproduction adulte ont conduit à émettre l'hypothèse que les individus devaient atteindre une masse corporelle critique et/ou acquérir une certaine quantité de masse adipeuse pour permettre la survenue de la puberté. D'un point de vue biologique, la puberté représente une période de la vie où croissance rapide et maturation sexuelle sont associées. Ces deux processus sont très certainement régulés par des facteurs métaboliques périphériques qui renseignent l'organisme sur la taille du corps et son contenu en cellules adipeuses. Même si, comme il a été mentionné précédemment, le signal initiateur de puberté reste inconnu, l'enchaînement séquentiel de changements hormonaux majeurs impliquant différents systèmes, tels que la leptine et l'activation des axes gonadotrope (impliqué dans la puberté) et somatotrope (impliqué dans la croissance) pourrait en être à l'origine.
Différentes études réalisées sur l'animal ont permis d'éclaircir cette séquence complexe d'événements hormonaux. Par exemple, l'administration de leptine restaure les déficits de la fonction de reproduction chez les souris génétiquement déficientes en leptine (ob/ob : souris obèses et infertiles) et accélère la maturation sexuelle et la survenue de la puberté chez les souris sauvages.
Chez l'homme, les taux de leptine circulante augmentent progressivement au fur et à mesure que la maturation pubertaire progresse, avec toutefois un clair dimorphisme entre garçons et filles. Il est intéressant de noter qu'il existe chez les filles une corrélation entre la mise en place de la ménarche et les taux de leptine sériques : une concentration seuil de leptine est nécessaire pour la survenue de la ménarche chez les filles. Ainsi, une déficience en leptine pourrait être la cause primaire du retard pubertaire et de la survenue de la ménarche chez les enfants en sous-nutrition. Les quelques cas de patients présentant une déficience ou une résistance à la leptine, liées à une mutation du gène de la leptine ou de son récepteur, montrent que cette hormone est indispensable au bon déroulement du processus pubertaire. En effet, les patientes atteintes de ce déficit présentent une aménorrhée primaire et aucun développement pubertaire, alors que les garçons souffrent d'un hypogonadisme hypothalamique. Cependant, d'autres travaux suggèrent que la leptine aurait un rôle « permissif » plutôt que « déclencheur » sur le processus de maturation sexuelle. La leptine jouerait donc un rôle critique au cours du développement postnatal sur la survenue de la puberté en permettant non seulement la maturation des projections métaboliques, mais aussi de celles qui sont impliquées dans le contrôle de la fonction de reproduction. L'ensemble de ces travaux suggère aussi que toute perturbation dans la survenue du pic de leptine néonatal pourrait altérer l'établissement des circuits hypothalamiques régulant la prise alimentaire et la fonction de reproduction.
Influence des stress précoces sur la puberté et la croissance
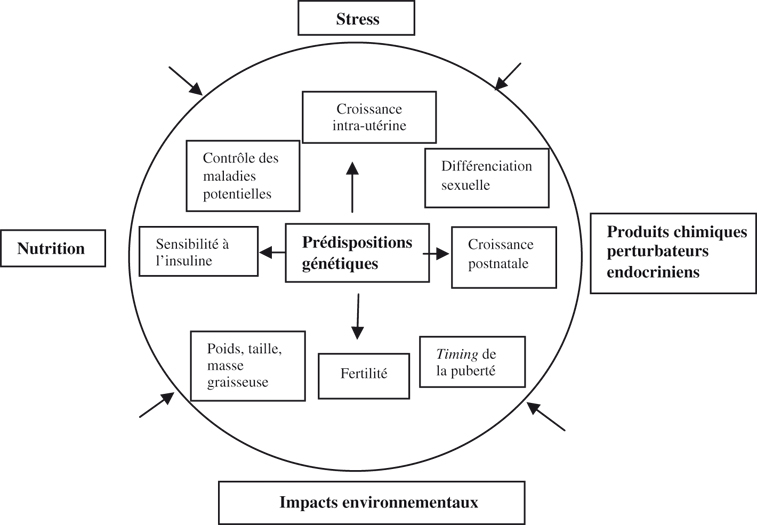
La capacité d'un organisme à s'adapter à son environnement est d'une importance vitale et les altérations de cette capacité de l'organisme à répondre à des agents stressants, comme par exemple des réponses inadéquates, excessives ou prolongées, peut conduire à « une charge allostatique » (coût infligé à l'organisme pour le maintien de la stabilité) et au développement de pathologies. Bien que beaucoup de personnes qui vivent des événements stressants ne développent pas de pathologies, le stress semble être un facteur déclencheur chez ceux qui ont une vulnérabilité particulière, déterminée par des facteurs génétiques ou des expériences précoces.
Le rôle des événements adverses sur le circuit neuroendocrinien des réponses adaptatives au stress et ses conséquences à long terme sur les principaux axes endocriniens impliqués dans la croissance et le développement pubertaire des individus ont fait l'objet de travaux.
L'hyperactivation chronique de l'axe hypothalamo-hypophyso-surrénalien (HPA ou HHS, axe du stress) peut être déterminée par de nombreux facteurs génétiques et environnementaux. La période périnatale, la petite enfance, l'enfance et l'adolescence sont des périodes d'accroissement de la plasticité du système lié au stress et sont par conséquent particulièrement sensibles aux stress. Le système hormonal, à des stades précoces de la vie peut avoir un impact structurant et des effets à long terme, souvent pour la vie entière de l'individu. Chez l'adulte, une hyper-cortisolémie conduit à la suppression des fonctions reproductives, thyroïdiennes, de croissance et d'immunité.
Afin de mieux comprendre les mécanismes impliqués dans les effets à long terme d'expériences précoces et pour pallier les difficultés de la recherche en population humaine dans ce domaine particulier (études longitudinales), différents modèles de stress prénatals chez l'animal ont été développés. Ces travaux montrent que l'axe hypothalamo-hypophyso-surrénalien de la descendance est durablement affecté par un stress prénatal, ce qui se traduit par différents phénomènes : une sécrétion prolongée de corticostérone lors de l'exposition à un stress à l'âge adulte ; des effets plus marqués chez la femelle que chez le mâle ; des altérations des rythmes circadiens ; une élévation des taux plasmatiques de noradrénaline indiquant une activation plus grande du système nerveux sympathique.
Les stress prénatals ou les événements périnatals précoces ont une influence non seulement sur l'axe hypothalamo-hypophyso-surrénalien mais aussi sur d'autres facteurs endocriniens comme les hormones sexuelles. En effet, un stress prénatal pendant la période critique de la différenciation hypothalamique a des effets négatifs sur la croissance testiculaire de l'embryon et sur la fonction reproductive future. Le stress prénatal altère le comportement sexuel des mâles en supprimant le pic de production de testostérone lors du développement qui est nécessaire pour la masculinisation du cerveau et des comportements.
Peu de choses sont connues sur l'influence des événements périnatals sur l'axe des facteurs de croissance. La séparation maternelle chez les rats augmente l'activité de l'axe hypothalamo-hypophyso-surrénalien chez les petits et induit une hyposécrétion de l'hormone de croissance. L'administration de facteurs de libération de l'hormone de croissance annule la suppression de la sécrétion de l'hormone de croissance induite par la séparation maternelle chez les petits rats.
Le développement de nouveaux modèles animaux d'altération de la croissance et de la différenciation sexuelle par des manipulations de l'environnement précoce ou des modifications génétiques devrait permettre de tester différentes hypothèses concernant la régulation de ces fonctions physiologiques importantes. Cette stratégie aidera à clarifier la question des différences individuelles par rapport à l'impact du stress sur la croissance et la reproduction et à élucider les mécanismes qui lient le système du stress aux altérations de la croissance et de la reproduction. Une voie importante pour de futures recherches est de déterminer les mécanismes par lesquels le stress précoce exerce un effet à long terme.
Différents travaux ont montré une évolution séculaire avec une croissance et un développement plus rapides, des tailles moyennes plus élevées et une maturation plus précoce. La majeure partie de cette évolution séculaire de la taille adulte est atteinte dès l'âge de 2 ans. L'accélération de la croissance implique un raccourcissement de la période totale de croissance. Ainsi, de nos jours, l'âge du pic de croissance pubertaire est plus précoce et la taille adulte est atteinte plus tôt.
Une meilleure compréhension des liens entre l'initiation de la puberté, les facteurs d'environnement et la survenue de maladies touchant la croissance et/ou la maturation sexuelle passe nécessairement par la mise en place d'études épidémiologiques longitudinales à grande échelle comprenant une approche clinique, biologique et génétique.
Le développement de nouveaux modèles d'étude des anomalies de la croissance et de la différenciation sexuelle (en particulier modèles animaux génétiquement modifiés et/ou exposés à divers facteurs d'environnements à différents stades du développement) devrait permettre de tester plusieurs hypothèses concernant la régulation de ces fonctions physiologiques importantes.
La recherche française manque de projets coordonnés sur la croissance, la puberté, la nutrition et leurs relations. Pourtant, ces travaux en réseau permettraient des avancées dans la connaissance des mécanismes impliqués dans ces processus physiologiques et pathologiques et pourraient avoir des retombées importantes en santé publique. De telles thématiques pourraient par exemple s'inscrire dans un programme de l'ANR intitulé « Le développement postnatal : déterminants génétiques et environnementaux » et intégrer les recommandations de recherche énoncées ci-dessous.
Développer une étude en population française sur la taille et le poids
La France ne possède pas de références récentes concernant des données transversales ou longitudinales représentatives de la population. Il est pourtant généralement admis que des changements observés au niveau de la croissance et du développement sont de bons indicateurs des conditions de vie d'une société, et en particulier de la situation nutritionnelle et sanitaire d'une population. Suivre les paramètres de croissance en fonction du temps permet de traduire les conditions de santé d'une population tout en révélant les inégalités de santé au sein d'une même population. Des mesures régulières du statut de croissance d'une population restent donc importantes puisqu'elles représentent un outil sensible en santé publique.
Le groupe d'experts recommande de développer cet outil en France au moins en termes de taille et de poids, tout en tenant compte des variations géographiques et de l'origine des familles.
Deux types d'études s'imposent : une étude transversale permettant d'établir les références manquantes en France ; une étude longitudinale pouvant affiner ces références qui peuvent être couplées à des données biologiques, physiologiques et génétiques, ainsi qu'à de nouveaux marqueurs à déterminer.
Rechercher des marqueurs biologiques des phases précoces de la puberté
Les indicateurs de l'initiation normale de la puberté sont encore aujourd'hui mal définis. Cette situation est préjudiciable à la prise en charge des anomalies de la puberté. Le groupe d'experts préconise une recherche de marqueurs biologiques qui seront des indicateurs fiables de l'initiation de la puberté pour chacun des deux sexes. Ces indicateurs pourront être utiles dans le cadre d'études épidémiologiques pour rechercher des interactions entre croissance, puberté et environnement. Ils pourront également être utiles dans la prise en charge des patients concernés par un trouble pubertaire.
Développer des études sur la dynamique de la puberté et ses conséquences
Des travaux prenant en compte la dynamique pubertaire seraient l'occasion de définir un score et qui, si possible, serait facile à utiliser en pratique de ville.
Le groupe d'experts recommande de mettre en place une étude sur l'évolution de l'âge de la puberté en France en relation avec des modifications de l'environnement (nutrition, exposition aux perturbateurs endocriniens, modes de vie...). Un effort important doit être fait pour évaluer les possibles perturbateurs endocriniens. Le groupe d'experts recommande d'étudier spécifiquement le lien entre les perturbateurs endocriniens, l'âge de la puberté et la survenue de cancers hormono-dépendants.
L'augmentation de la prévalence de l'obésité dans les pays occidentaux et l'avancée en âge de la puberté soulèvent l'interrogation du lien entre ces deux phénomènes. En effet, malgré une relation mise en évidence entre surcharge adipeuse et précocité de la puberté chez la femme, la causalité et le sens de cette relation restent à démontrer. Chez l'homme, cette question reste posée. Il faut rappeler que cette difficulté est liée à l'absence de marqueurs fiables de l'initiation de la puberté. Le groupe d'experts recommande de poursuivre les recherches dans ce domaine (en particulier à l'aide de modèles animaux judicieusement choisis).
Améliorer les connaissances sur la génétique de l'initiation de la puberté
La puberté est un processus physiologique. Très peu de gènes contribuant à l'initiation de la puberté ont été identifiés aujourd'hui. L'analyse du déterminisme génétique de l'âge de la puberté nécessite une méthodologie difficile à mettre en œuvre. Travailler sur la puberté revient à augmenter les connaissances sur les mécanismes de régulation de la reproduction à l'âge adulte.
Le groupe d'experts recommande d'envisager un travail de grande ampleur permettant de modéliser le déterminisme génétique de l'âge de la puberté et d'identifier les facteurs génétiques impliqués. Ces études pourraient apporter des éléments d'informations sur le lien entre l'âge de la puberté, les facteurs de l'environnement et les cancers hormono-dépendants. Ces travaux pourraient également être sources de nouvelles pistes thérapeutiques.
Améliorer les connaissances sur la génétique des anomalies de la croissance
Les connaissances sur la génétique d'un trait complexe tel que la croissance des individus (taille) sont encore très fragmentaires, alors que différentes études, dont celles menées chez les jumeaux, démontrent bien l'importance des facteurs génétiques. Les interactions entre facteurs environnementaux et facteurs génétiques mériteraient d'être étayées. Par ailleurs, les liens entre la dynamique de la croissance et le cancer sont encore peu étudiés.
Le groupe d'experts recommande de poursuivre les études visant à identifier des gènes clés intervenant dans les maladies de la croissance. Comme cela a déjà été montré, l'identification de ces gènes peut avoir d'importantes implications cliniques (non seulement sur le plan du diagnostic, mais aussi en termes pronostique et thérapeutique). Cependant, du fait des connaissances actuelles, peu de patients sont directement concernés par ces progrès qui, par ailleurs, contribuent à améliorer la compréhension de la physiologie de la croissance. En parallèle, compte tenu des implications diagnostiques et thérapeutiques, il est important d'encourager les recherches visant à identifier de nouveaux marqueurs de la secrétion d'hormone de croissance (GH). La pertinence des nombreux tests utilisés tant en France qu'à l'étranger, reposant essentiellement sur l'évaluation des taux circulants de GH sous diverses stimulations pharmacologiques, est en effet très discutable.
Améliorer les connaissances sur la maturation neuroendocrinienne postnatale
L'activation des axes gonadotrope (impliqué dans la puberté) et somatotrope (impliqué dans la croissance) après la naissance résulte d'un processus mal connu de maturation neuroendocrinienne. Ces mécanismes semblent très dépendants de l'environnement postnatal. Par exemple, l'importance de l'environnement nutritionnel est souligné par des travaux montrant que la leptine, lors d'une fenêtre temporelle critique, possède une fonction organisatrice au niveau central. Les effets de l'environnement postnatal mériteraient d'être étudiés tant d'un point de vue expérimental qu'épidémiologique en utilisant des marqueurs adaptés.
Le rôle des événements adverses sur le circuit neuroendocrinien des réponses adaptatives au stress et ses conséquences à long terme sur les principaux axes endocriniens impliqués dans la croissance et le développement pubertaire des individus a fait l'objet de travaux. L'hyperactivation chronique de l'axe hypothalamo-hypophyso-surennalien peut être déterminée par de nombreux facteurs génétiques et environnementaux. La période périnatale, la petite enfance, l'enfance et l'adolescence sont des périodes d'accroissement de la plasticité du système lié au stress et sont par conséquent particulièrement sensibles aux stress. Le système hormonal, à des stades précoces de la vie, peut avoir un impact structurant et des effets à long terme souvent pour la vie entière de l'individu. Chez l'adulte, une hyper-cortisolémie conduit à la suppression des fonctions reproductives, thyroïdiennes, de croissance et d'immunité. L'effet du stress sur la neurogénèse peut également être étudié dans les études expérimentales.

 siècle, l'âge moyen des premières règles a particulièrement diminué, passant de 17 ans à 14 ans aux États-Unis et dans plusieurs pays de l'Europe de l'Ouest. Cependant, la courbe de cette évolution varie d'un pays à l'autre : une diminution de 0,3 an par décennie a été calculée pour les données norvégiennes et finlandaises et dans les études prospectives américaines. En France, la diminution est estimée à 0,175 an par décennie.
siècle, l'âge moyen des premières règles a particulièrement diminué, passant de 17 ans à 14 ans aux États-Unis et dans plusieurs pays de l'Europe de l'Ouest. Cependant, la courbe de cette évolution varie d'un pays à l'autre : une diminution de 0,3 an par décennie a été calculée pour les données norvégiennes et finlandaises et dans les études prospectives américaines. En France, la diminution est estimée à 0,175 an par décennie.
 Au total, l'âge de la puberté est un processus physiologique complexe soumis à tout un spectre de facteurs en intercorrélation.
Au total, l'âge de la puberté est un processus physiologique complexe soumis à tout un spectre de facteurs en intercorrélation.