| |
| Med Sci (Paris). 36(2): 171–174. doi: 10.1051/medsci/2020017.L’alamandine, une nouvelle molécule d’intérêt
thérapeutique contre l’hypertrophie cardiaque Aboubacar Sidiki Kibarou Coulibaly,1* Caroline Deriaz,1** and Philippe Robin2*** 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay Cedex,
France 2Institut des sciences du vivant Frédéric Joliot, CEA
Saclay, 91190Gif sur Yvette,
France |

Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Boris Julien (maître de conférences, université Paris-Sud)
Philippe Robin (maître de conférences, université de Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
karim.benihoud@u-psud.fr
Série coordonnée par Sophie Sibéril. Les maladies cardiovasculaires sont responsables d’un décès sur trois dans le monde, avec
une prévalence croissante en Occident. Malgré de nombreuses avancées thérapeutiques,
elles restent une des principales causes de mortalité en France, et il est nécessaire de
poursuivre les recherches sur ces maladies pour réduire davantage leur apparition et
leur létalité. La plupart de ces pathologies sont dues à des plaques d’athérome formées
dans les artères ou à des anomalies de la pression artérielle, phénomènes dans lesquels
le système hormonal rénine-angiotensine (RAS) est souvent impliqué [1]. Le RAS est un système conservé au cours
de l’évolution chez les vertébrés. Il joue un rôle crucial dans certaines pathologies
cardiovasculaires, telles que l’hypertension, l’insuffisance cardiaque et
l’athérosclérose [2]. Les
composants du RAS sont l’angiotensinogène, une α-2-globuline produite principalement par
le foie, ainsi que la rénine, une enzyme exprimée dans le rein et libérée dans le sang
en cas de baisse de la pression artérielle. Le clivage de l’angiotensinogène par la
rénine forme l’angiotensine I, qui sera clivée par l’enzyme de conversion de
l’angiotensine (ACE) en angiotensine II (ANG-II), octapeptide biologiquement actif
agissant sur des récepteurs transmembranaires AT(angiotensin
receptor)-1 et AT-2, appartenant à la famille des récepteurs couplés aux
protéines G [3]. L’ANG-II, par
l’intermédiaire de son récepteur AT-1, a un effet vasoconstricteur et joue un rôle
majeur dans la régulation de la tension artérielle et l’homéostasie cardiovasculaire
[4]. L’ANG-II est également
impliquée dans l’hypertrophie des cardiomyocytes, de manière directe et indirecte à
travers son effet hypertenseur, conduisant à une augmentation des risques
cardiovasculaires [5]. En
clinique, les stratégies mises en place pour lutter contre les maladies
cardiovasculaires, en particulier l’hypertension artérielle, visent généralement à
inhiber l’activité d’ACE ou à bloquer le récepteur AT-1 pour inhiber la synthèse
d’ANG-II ou bloquer ses effets [6]. L’ANG-II n’est pas le seul peptide actif du RAS. En effet, ANG-II peut être transformée
en Angiotensine 1-7 [ANG-(1-7], sous l’action de l’ACE2, une autre enzyme de conversion
du RAS. L’ANG-(1-7) possède des effets opposés à ceux de l’ANG-II, tels que la
vasodilatation [3]. Récemment, l’alamandine, un
heptapeptide dont la séquence est proche de celle de l’ANG-(1-7), a été décrite par
l’équipe de Lautner [7]. Elle
peut être générée par la décarboxylation1, de
l’ANG-(1-7) [2]. Il a été montré qu’elle exerce
des actions vasodilatatrices et anti-hypertensives via le récepteur
MrgD (Mas-related G-protein-coupled receptor member D), un récepteur
couplé aux protéines G apparenté à Mas, un récepteur activé par l’ANG-(1-7) [1, 2]
(Figure 1). Toutefois, la
sélectivité de ces deux peptides vis-à-vis des récepteurs MrgD et Mas n’est pas
clairement établie. À ce jour, l’alamandine a été retrouvée chez le rat, la souris et
l’homme. Elle produit des effets physiologiques similaires à ceux de l’ANG-(1-7) au sein
du système cardiovasculaire : production de monoxyde d’azote (NO) dans les
cardiomyocytes et les artères, et vasodilatation des artères. Il est également
intéressant de noter que les patients néphropathiques présentent une concentration
plasmatique accrue d’alamandine, ce qui suggère que ce peptide pourrait avoir, comme
l’ANG-(1-7), un rôle important en situation physiopathologique [6]. L’alamandine pourrait donc, comme l’ANG-(1-7), avoir un effet
bénéfique sur le système cardiovasculaire et en particulier s’opposer au développement
de l’hypertrophie cardiaque. Pour évaluer cette hypothèse et comprendre le mode d’action
de l’alamandine, l’équipe de Silvia Guatimosim a choisi de travailler sur des cellules
musculaires cardiaques (cardiomyocytes) de souris fraîchement isolées.
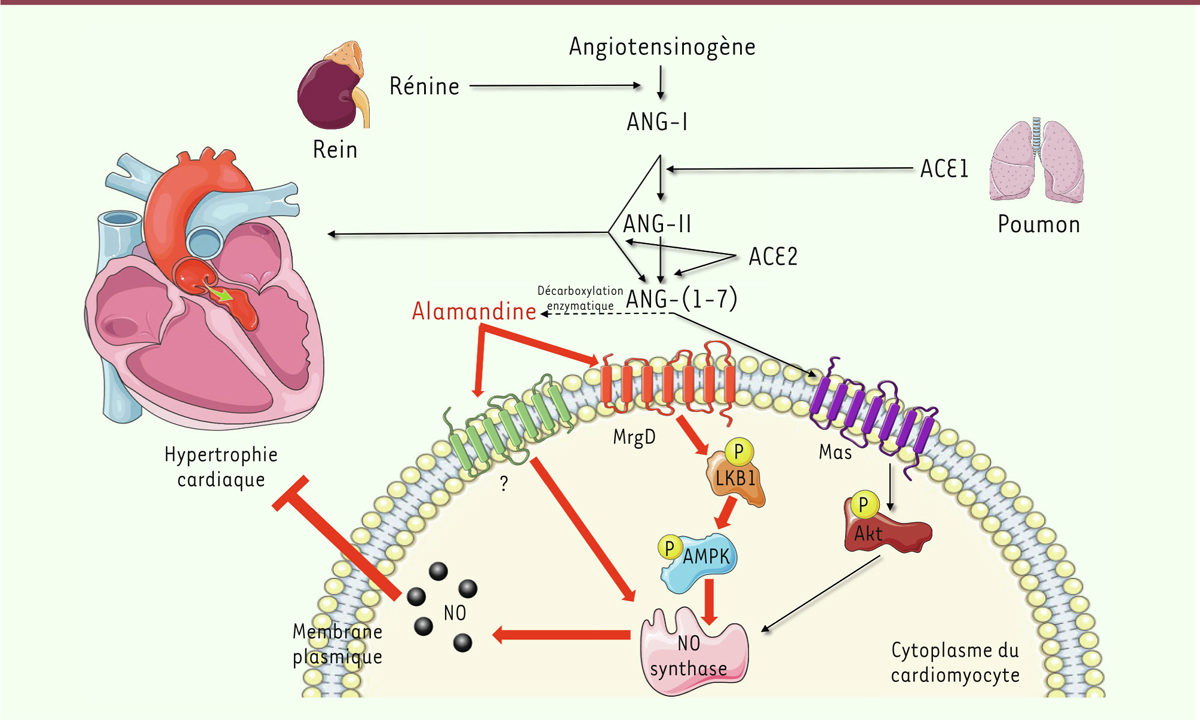
 | Figure 1. Voie de signalisation de l’alamandine au sein du système rénine-angiotensine
et son rôle dans l’inhibition des effets hypertrophiques d’ANG-II sur les
cardiomyo cytes. Le système rénine-angiotensine permet la production
d’angiotensine II (ANG-II), exerçant un rôle vasoconstricteur et
hypertrophique sur les cellules cardiaques. L’ANG-II peut être transformée
en angiotensine 1-7 [ANG-(1-7)] qui agit comme un vasodilatateur via le
récepteur Mas et la voie de signalisation Akt/PKB. L’alamandine, peptide
dérivé de l’ANG-(1-7), agit via le récepteur MrgD et la voie LKB1/AMPK pour
activer eNOS et libérer du NO (monoxyde d’azote) dans la cellule ce qui
limite l’hypertrophie des cellules cardiaques (cette figure a été créée en
utilisant les modèles « Servier Medical Art » - https://smart.servier.com) |
|
L’alamandine induit une production de NO dans les cardiomyocytes via le récepteur
MrgD et l’AMPK Dans un premier temps, De Jesus et al. se sont intéressés à la voie
de signalisation déclenchée par l’alamandine dans les cardiomyocytes isolés, et
l’ont comparée à celle de l’ANG-(1-7). Ils ont observé que l’alamandine, comme
l’ANG-(1-7), induit une production de NO, mais par des voies de signalisation
différentes et par le biais de protéines kinases différentes : LKB1 (liver
kinase B1) et AMPK (AMP-activated protein kinase) pour
l’alamandine, et Akt/PkB (protéine kinase B) pour l’ANG-(1-7). L’activation de ces
protéines a été mise en évidence en caractérisant leur état de phosphorylation par
western-blot. Si les voies de signalisation respectivement mises en jeu par l’alamandine et
l’ANG-(1-7) sont différentes, cela peut s’expliquer par l’activation de récepteurs
différents par les deux peptides. Pour vérifier cette hypothèse, les auteurs ont
utilisé des cardiomyocytes issus de souris transgéniques dont les gènes codant le
récepteur Mas ou le récepteur MrgD ont été invalidés. Ils ont alors observé que tous
les effets de l’alamandine, à savoir la production de NO et la phosphorylation de
LKB1 et AMPK, étaient préservés dans les cardiomyocytes n’exprimant pas le récepteur
Mas. À l’inverse, tous ces effets étaient perdus dans les cellules cardiaques
dépourvues du récepteur MrgD. L’alamandine exerce donc ses effets par
l’intermédiaire du récepteur MrgD et non par le récepteur Mas. Cette conclusion a
été confirmée par une approche pharmacologique dans laquelle le récepteur MrgD des
cardiomyocytes était bloqué par un de ses antagonistes, la D-proline. En utilisant
de l’alamandine couplée à une molécule fluorescente, les auteurs ont également
montré que celle-ci se fixait de manière spécifique aux cardiomyocytes normaux mais
aussi à ceux issus des souris transgéniques n’exprimant pas le récepteur Mas. Au
contraire, dans les cardiomyocytes n’exprimant pas le récepteur MrgD, la liaison de
l’alamandine fluorescente était fortement réduite. Toutefois, il a été observé que
l’invalidation du gène codant le récepteur MrgD n’abolissait pas totalement la
liaison de l’alamandine aux cardiomyocytes, suggérant l’existence d’un autre
récepteur pour l’alamandine dans les cardiomyocytes, mais cela reste à
démontrer. |
L’alamandine joue un rôle anti-hypertrophique sur les cardiomyocytes en
s’opposant aux effets de l’ANG-II Après avoir établi les mécanismes d’action de l’alamandine, les chercheurs se sont
intéressés à ses effets physiologiques, relayés par l’augmentation de NO dans les
cardiomyocytes sous son action. Ils se sont plus précisément penchés sur les effets
hypertrophiques de l’ANG-II, dont l’inhibition pourrait être une stratégie
thérapeutique dans les maladies cardio-vasculaires. Pour évaluer l’hypertrophie des
cardiomyocytes, l’actine (protéine très abondante dans les cellules musculaires et
permettant leur contraction) a été marquée dans les cellules grâce à des anticorps
spécifiques. L’hypertrophie cellulaire est caractérisée par une augmentation de la
surface moyenne d’une cellule, observable au microscope. Les auteurs ont alors
observé que, contrairement à l’ANG-II, l’alamandine ne provoquait pas d’effet
hypertrophique et était même capable d’inhiber l’effet de l’ANG-II. Pour s’assurer
que ce blocage de l’action de l’ANG-II par l’alamandine empruntait bien la voie de
signalisation précédemment mise en évidence, les chercheurs ont utilisé la
D-proline, antagoniste du récepteur MrgD, ainsi que des inhibiteurs spécifiques de
l’AMPK et de la eNOS, enzyme responsable de la synthèse du NO. En présence de ces
agents pharmaceutiques, l’alamandine n’était plus capable d’inhiber l’effet
hypertrophique de l’ANG-II, prouvant ainsi que la voie mise en jeu par l’alamandine,
faisant intervenir le récepteur MrgD, les protéine kinases LKB1 et AMPK, aboutissant
à la synthèse de NO, est capable d’inhiber l’hypertrophie des cardiomyocytes. |
Les travaux réalisés par de Jesus et al. montrent, pour la première
fois, par des approches génétiques et pharmacologiques, que l’alamandine agit
via le récepteur MrgD pour induire un effet
anti-hypertrophique, et donc cardioprotecteur, dans les cardiomyocytes de souris
(Figure 1). Cet effet
de protection passe par l’activation de la voie de signalisation impliquant les
protéines kinases LKB1 et AMPK régulant la synthèse de NO par la eNOS. Ces résultats
font du récepteur MrgD une nouvelle cible thérapeutique potentielle, et de
l’alamandine une molécule d’intérêt pour le traitement de l’hypertrophie
cardiaque. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1.
Qaradakhi
T
,
Apostolopoulos
V
,
Zulli
A
. Angiotensin (1–7) and alamandine: similarities
and differences . Pharmacol Res.
2016; ; 111 :
:820.–826. 2.
Hrenak
J
,
Paulis
L
,
Simko
F
. Angiotensin A/alamandine/MrgD axis: another clue
to understanding cardiovascular pathophysiology . Int
J Mol Sci.
2016; ; 17 :
:1.–9. 3.
Sampaio
WO
,
Souza dos Santos
RA
,
Faria-Silva
R
, et al.
Angiotensin-(1–7) through receptor Mas mediates endothelial
nitric oxide synthase activation via Akt-dependent pathways .
Hypertension.
2007; ; 49 :
:185.–192. 4.
Li
R
,
Mi
X
,
Yang
S
, et al.
Long-term stimulation of angiotensin II induced endothelial
senescence and dysfunction . Exp Gerontol.
2019; ; 119 :
:212.–220. 5.
Sadoshima
J
,
Xu
Y
,
Slayter
HS
,
Izumo
S
. Autocrine release of angiotensin II mediates
stretch-induced hypertrophy of cardiac myocytes in vitro .
Cell.
1993; ; 75 :
:977.–984. 6.
Lautner
RQ
,
Villela
DC
,
Fraga-Silva
RA
, et al.
Discovery and characterization of alamandine: a novel component
of the renin-angiotensin system . Circ Res.
2013; ; 112 :
:1104.–1111. 7.
Jesus
ICG
,
Scalzo
S
,
Alves
F
, et al.
Alamandine acts via MrgD to induce AMPK/NO activation against ANG
II hypertrophy in cardiomyocytes . Am J Physiol Cell
Physiol.
2018; ; 314 :
:C702.–C711. |