Vignette (Photo © Michel Tauc).
La privation d’oxygène est délétère pour l’organisme humain et la recherche clinique est confrontée à un formidable défi face aux troubles physiologiques liés à l’ischémie. Dans tous les cas, c’est l’arrêt de l’apport sanguin aux tissus cibles qui déclenche des processus irréversibles de mort cellulaire pouvant conduire à une dégradation dramatique de l’autonomie cognitive ou motrice des patients. Cet arrêt de l’approvisionnement des tissus peut être programmé, comme dans le cas de la greffe d’organes et de chirurgie aortique, ou physiopathologique, comme lors de la survenue d’un accident vasculaire cérébral (AVC) ou d’un infarctus coronarien. Malgré un nombre élevé d’essais cliniques, il s’avère que, jusqu’à présent, aucun traitement pharmacologique ne s’est révélé réellement efficace. Si l’on prend le cas de l’AVC, qui est une des causes majeure de mortalité, le seul traitement appliqué reste la thrombolyse, avec des fenêtres d’utilisation temporelle très étroites associées à des risques hémorragiques importants.
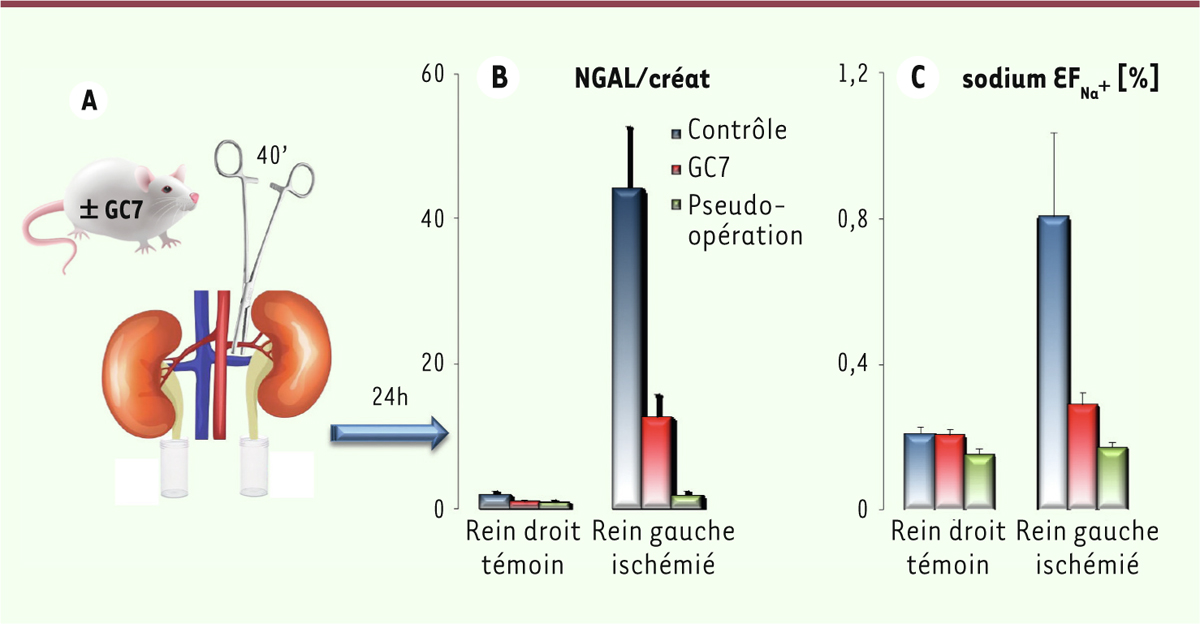
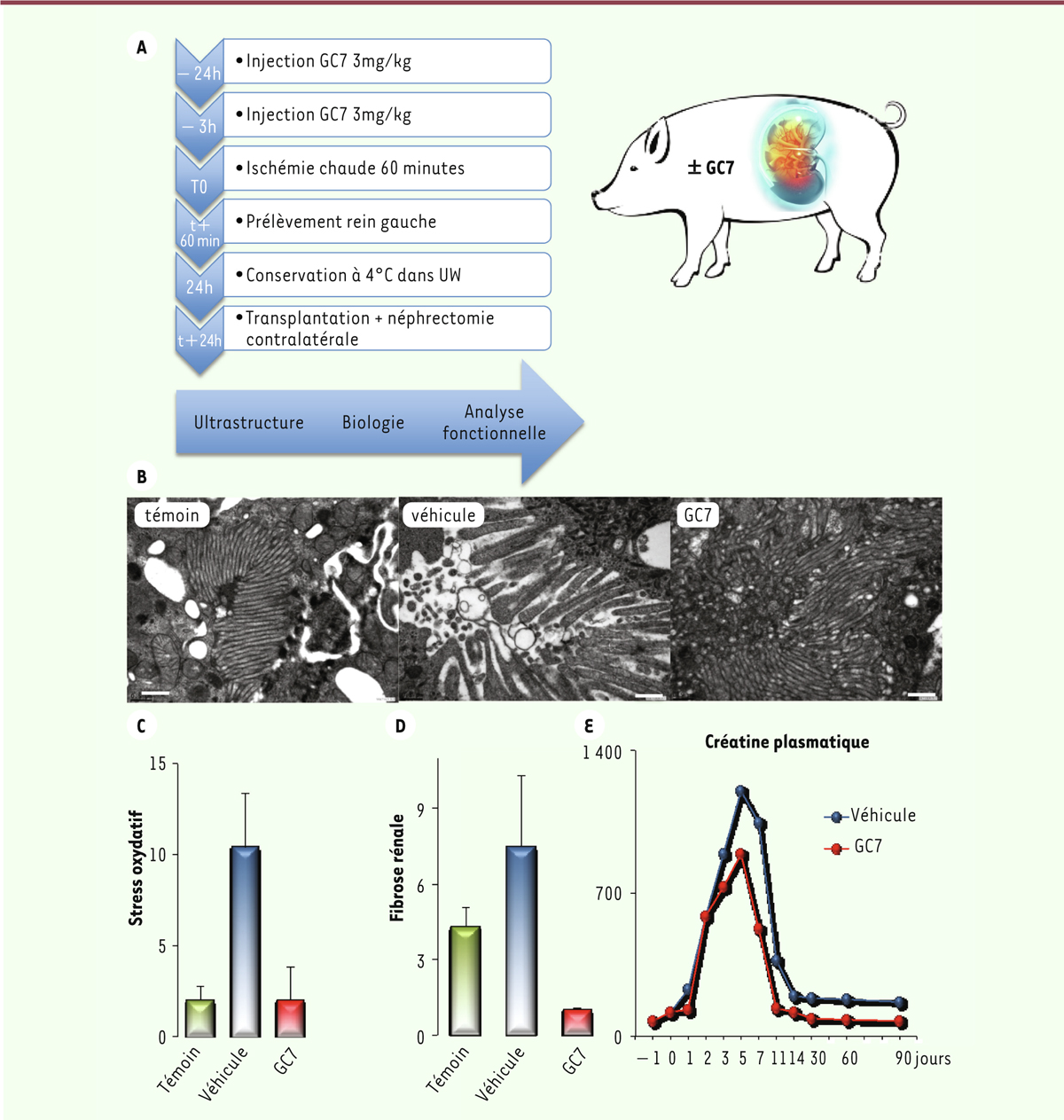
Si l’on considère le cas de la transplantation, qui est un standard en cas d’insuffisance organique terminale, elle a pris un tel essor que l’on bascule inexorablement vers un contexte de pénurie nécessitant d’élargir la fenêtre de choix en sélectionnant des greffons à critères élargis. Ces organes, considérés comme « limites », sont plus sensibles à l’ischémie et leur reprise fonctionnelle dépend de leur préservation ex vivo. Si la réhabilitation ex vivo des organes [1] peut pallier parfois ce problème d’utilisation de greffons normalement exclus, il n’existe aucun protocole pharmacologique à ciblage précis capable d’augmenter le temps de survie de ceux-ci malgré les progrès effectués sur les liquides de préservation. On peut malgré tout citer la technique qui consiste à pré-conditionner les organes par des ischémies courtes, capables de stimuler des voies endogènes de résistance [2]. Mais si l’on a obtenu des résultats positifs, cette technique reste difficile à appliquer chez le patient. Devant ce blocage conceptuel, il était pertinent de rechercher un nouveau paradigme sur la résistance à l’hypoxie et l’ischémie afin d’identifier de nouvelles cibles situées très en amont et capables de bloquer très tôt les processus conduisant à la mort cellulaire et organique.
Pour contourner cette impasse, le retour à des organismes modèles peut, de par leur relative simplicité d’utilisation et leur moindre complexité, apporter des réponses innovantes. Cet abord réductionniste a, par le passé, permis l’élaboration de nouveaux concepts biologiques. Si l’on remonte dans le temps, et si l’on prend l’exemple du cerveau, le mollusque gastéropode marin Aplysia californica, pourtant très éloigné de la physiologie des mammifères, pris comme animal modèle par Ladislav Tauc [3], a une histoire vénérable en tant que modèle de fonctionnement du système nerveux et plus spécialement de la transmission synaptique [4], avec une importance particulière dans les études sur l’apprentissage et la mémoire. D’ailleurs en 2000, Eric Richard Kandel, un neurophysiologiste, a partagé avec Arvid Carlsson, Paul Greengard et Eric Kandel1, le prix Nobel de physiologie ou médecine pour ses travaux sur les bases moléculaires de la mémoire à court terme et de la mémoire à long terme qu’il avait conduits sur l’aplysie.
En ce qui concerne l’ischémie, le retour à un organisme modèle a récemment permis un progrès prometteur : il était raisonnable d’émettre l’hypothèse que, comme l’oxygène est nécessaire à tous les organismes aérobies sur terre, du plus simple au plus complexe, des mécanismes de défense contre son appauvrissement au sein des cellules se sont mis en place très tôt et sont restés conservés au cours de l’évolution. En 2006, Vigne et Frelin [5] ont développé une nouvelle approche physiologique de l’hypoxie chez la drosophile, un insecte qui partage nombre de processus biologiques avec les vertébrés. Sa relative simplicité et son cycle biologique court, associés à de grandes facilités d’élevage, dénuées de tout risque d’agressivité ou de transmission de maladies, en ont fait un incontournable outil pour la communauté scientifique dans les domaines du développement, du vieillissement, de la mémoire et de l’apprentissage, des rythmes circadiens ou encore du cancer.
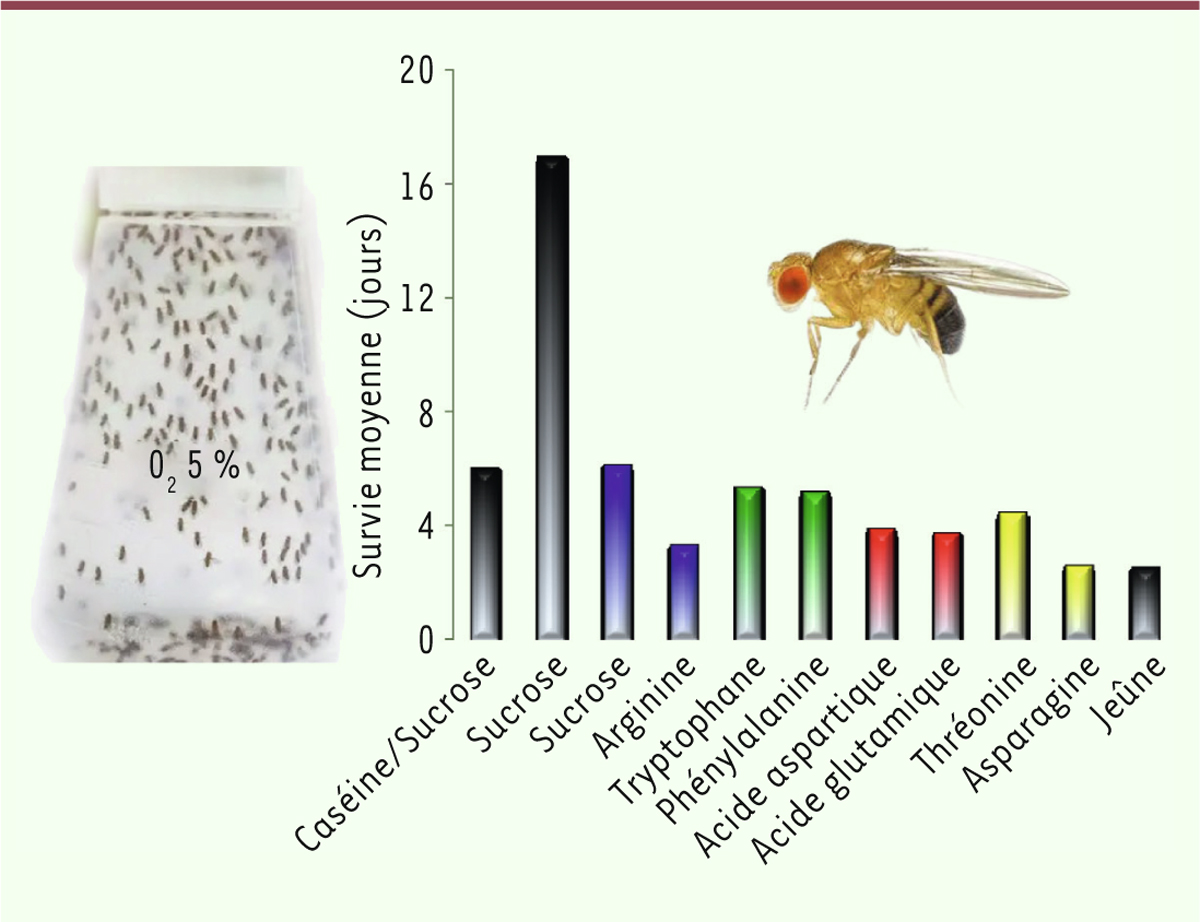
On savait qu’une restriction alimentaire augmentait la durée de vie des drosophiles [6,7]. Aussi, y a-t-il une relation entre régime alimentaire et résistance à l’hypoxie chez la drosophile ? C’est la question que se sont posés Vigne et Frelin. Dans une atmosphère appauvrie en oxygène (5 % O2), les drosophiles nourries avec un régime équilibré en protéines (10 % de levures ou 10 % de caséine) et en carbohydrates (10 % de sucrose), ont une durée de vie moyenne de 6 jours (Figure 1). Ces mêmes mouches, nourries uniquement avec une solution de sucrose, voient leur durée de vie moyenne passer à plus de 16 jours. Il apparaît donc clairement que les protéines sont toxiques pour les drosophiles maintenues en hypoxie chronique, et que ce n’est pas l’apport calorique qui est en cause, mais bien la nature protéique de leur régime alimentaire [7].
| Figure 1. Indice de survie des mouches en hypoxie en fonction du régime alimentaire.
Les mouches ont été nourries avec un régime à 10 % de sucrose supplémenté
avec des acides aminés (10 mM) représentatifs de leur classe et les courbes
de survie ont été déterminées dans des conditions hypoxiques chroniques (5 %
d’O2). L’histogramme représente les longévités moyennes. Les
barres noires montrent les situations de contrôle qui correspondent à un
régime équilibré en protéines et sucre, un régime en pur sucrose et des
conditions de jeûne. Des codes de couleur ont été utilisés pour étiqueter
les acides aminés basiques (bleu), les acides aminés hydrophobes (vert) les
acides aminés acides (rouge) et les acides aminés hydrophiles neutres
(jaune). |
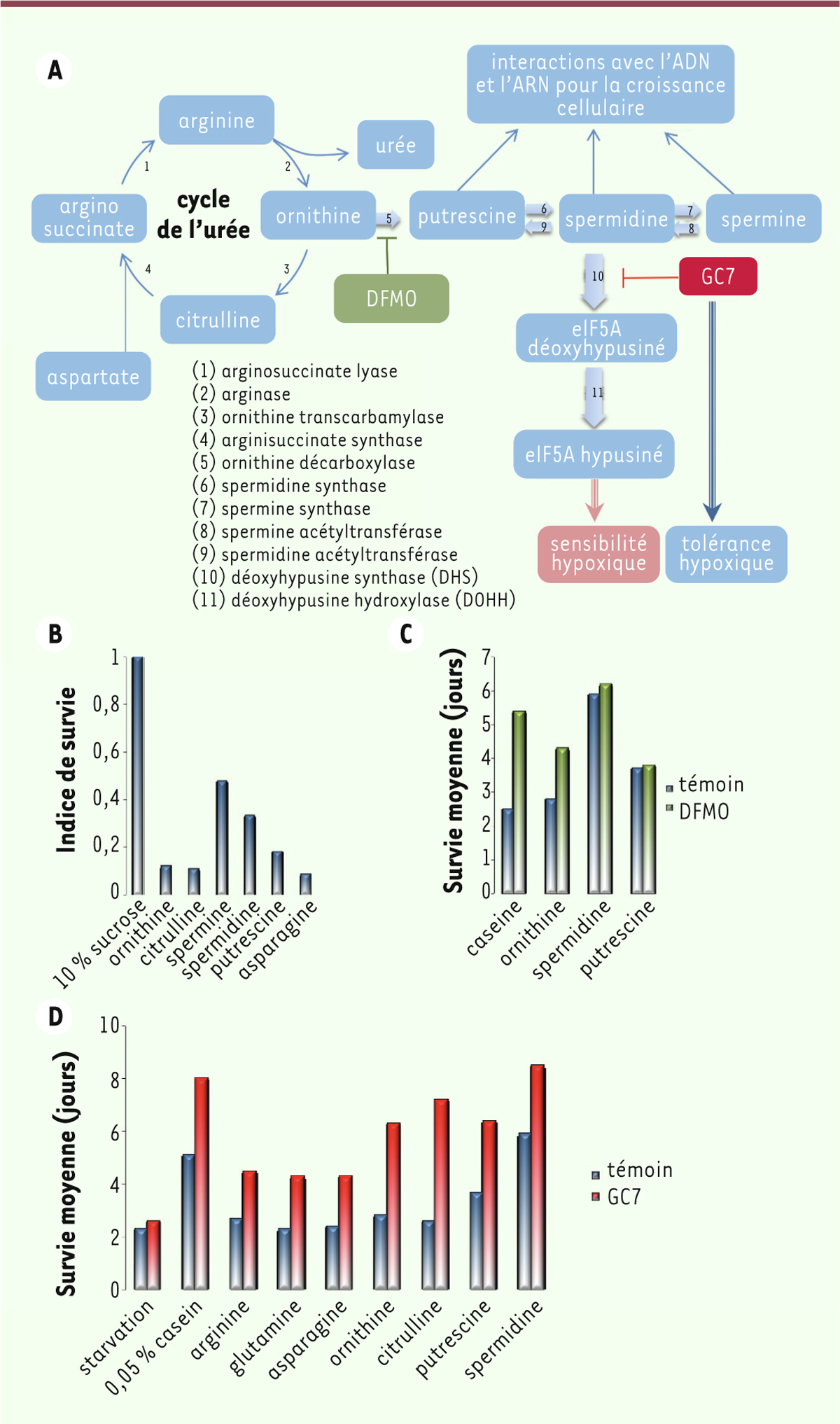
Les mouches ont ensuite été alimentées par un régime constitué de 10 % de sucrose complémenté par 10 mM de n’importe quel acide aminé contenu dans un hydrolysat de caséine. Dans ces conditions, quel que soit l’acide aminé ajouté, celui-ci réduit la tolérance hypoxique des drosophiles (Figure 1). Tous les acides aminés testés nécessitent une atmosphère hypoxique pour que leur toxicité soit observée ; ils restent sans effet en condition normoxique. Ces données ne permettent malheureusement pas de relier l’effet de raccourcissement de la durée de vie induit par ces acides aminés à une quelconque structure spécifique, charge ou hydrophobicité. Aussi, leur effet négatif nécessite d’être relié à une voie métabolique qui leur soit commune. Le cycle de l’urée (Figure 2A) est ainsi potentiellement un bon candidat : c’est la voie catabolique qu’empruntent tous les acides aminés et dont un des rôles est l’élimination de l’azote excédentaire sous forme d’urée [8]. Ce cycle est aussi à l’origine de la biosynthèse des polyamines, molécules essentielles pour la vie, la croissance et la division cellulaire. Une des hypothèses émises est donc que ces polyamines interviendraient dans le mécanisme de toxicité induite par les protéines. Cette hypothèse a été confirmée. En effet, en ajoutant des polyamines (spermine ou spermidine) à un régime uniquement sucré, la longévité des drosophiles maintenues en hypoxie diminue [9] (Figure 2B).
| Figure 2. Représentation schématique du nouveau concept pharmacologique de protection
de l’ischémie et effets des inhibiteurs DFMO et GC7. A. Le
cycle de l’urée génère des polyamines à partir de l’ornithine via
l’ornithine décarboxylase (5) qui est inhibée par le DFMO
(α-difluorométhylornithine). La voie des polyamines passe par la spermidine
qui est à l’origine de la synthèse du facteur d’initiation de la traduction
5A (eIF5A). L’activation de eIF5A nécessite l’action successive de la DHS
(10) et de la DOHH (11). L’action du GC7, inhibiteur compétitif de la DHS et
donc de l’activation de eIF5A, induit la tolérance hypoxique et ischémique.
B. Effets des intermédiaires du cycle de l’urée et des
polyamines ajoutés à un régime uniquement sucré sur l’indice de survie de
drosophiles maintenues en hypoxie chronique (5 % d’O2).
C. Effet du DFMO sur la survie moyenne des drosophiles
maintenues en hypoxie et dont le régime sucré contient les éléments cités.
D. Effet du GC7 sur la survie moyenne des drosophiles
maintenues en hypoxie et dont le régime sucré contient les éléments
cités. |
Dans la voie de biosynthèse des polyamines, l’ornithine décarboxylase est une enzyme clé. Elle est située très en amont de la voie de biosynthèse des polyamines et l’α-difluorométhylornithine (DFMO) en est un inhibiteur sélectif (Figure 2A). L’ajout de DFMO à un régime protéiné protège les drosophiles des effets néfastes de l’hypoxie. Inversement, l’ajout de putrescine ou de spermidine en présence de DFMO abolit son effet protecteur (Figure 2C). Le découplage du cycle de l’urée de la synthèse des polyamines est donc bien, ici, impliqué dans la tolérance hypoxique.
Une des branches de la voie des polyamines fournit de la spermidine pour l’hypusination (une modification post-traductionnelle2) du facteur d’initiation de la traduction 5A (eIF5A) (Figure 1A). eIF5A est la seule protéine connue pour contenir l’acide aminé hypusine qui y est incorporé par l’intermédiaire de 2 réactions enzymatiques successives : la déoxyhypusine synthase qui transfère le résidu 4-aminobutyl de la spermidine sur le groupe aminé d’une lysine spécifique de la forme inactive de eIF5A, et la déoxyhypusine hydroxylase qui hydroxyle la forme déoxyhypusinée de eIF5A pour donner sa forme active hypusinée [10]. Cette chaîne enzymatique peut être bloquée spécifiquement dans sa première étape par un dérivé guanylé du 1,7 diaminoheptane : le GC7 (Figure 1) [11]. Or, le GC7 ajouté à une alimentation protéique, ou une alimentation sucrée additionnée avec de la spermidine ou de la spermine, augmente la longévité moyenne des mouches maintenues en hypoxie (Figure 2D) [9].
Le blocage spécifique de l’activation de eIF5A induit donc une importante tolérance hypoxique chez la drosophile. Ce nouveau concept donne un éclairage nouveau sur les voies moléculaires potentielles impliquées dans la gestion de l’oxygène par les eucaryotes.