L’anorexie mentale est une forme grave de trouble du comportement alimentaire (TCA), qui met souvent en jeu le pronostic vital [1-3]. Sa pathogenèse implique des facteurs socioculturels et psychopathologiques, mais aussi biologiques. En effet, des dysrégulations d’adipocytokines périphériques, de peptides gastro-intestinaux, ou de neurotransmetteurs centraux ont été rapportées [4]. Une prise en charge précoce des individus atteints, très majoritairement de sexe féminin, est un facteur important du pronostic. D’où l’intérêt d’évaluer la contribution possible de techniques non invasives d’imagerie cérébrale, comme celles utilisant la résonance magnétique nucléaire, pour un diagnostic précoce de la maladie.
L’imagerie par résonance magnétique (IRM), non invasive et non irradiante, est une technique de choix pour étudier, en recherche clinique, les changements morphologiques et fonctionnels de la région hypothalamique au cours des TCA [5]. Actuellement, il est possible d’étudier les sous-régions et les différents noyaux hypothalamiques en IRM « à haut champ » (3 teslas) [6]. On peut ainsi déterminer leur éventuelle contribution, agoniste ou antagoniste, dans la dérégulation de la balance énergétique chez les individus souffrant d’anorexie mentale.
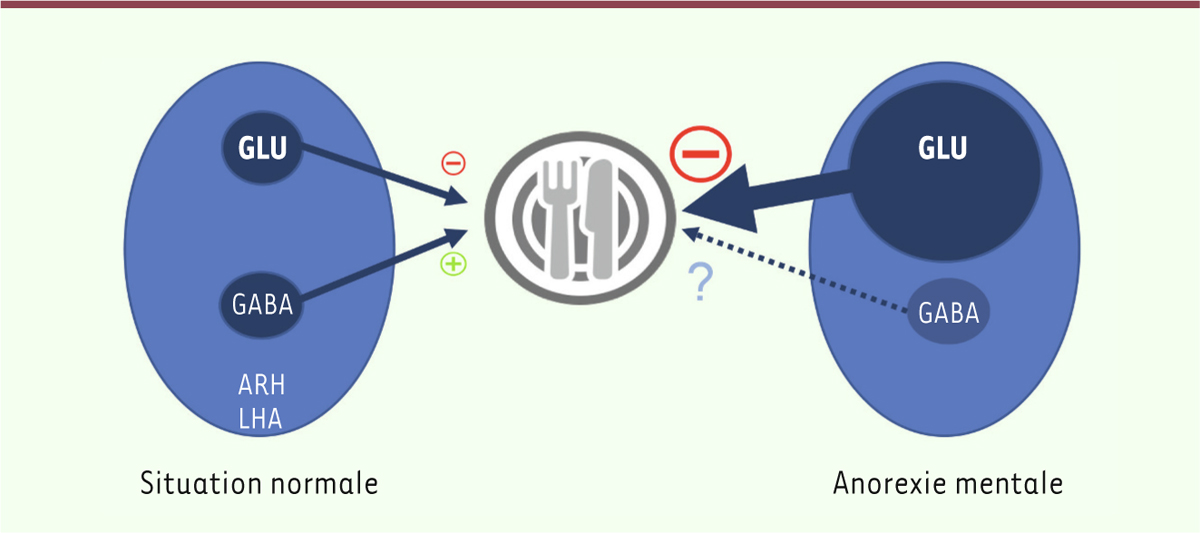
La spectroscopie par résonance magnétique (SRM) est une technique d’IRM qui permet d’étudier la composition biochimique d’une région d’intérêt d’un volume minimal d’un cm3 (voxel) en IRM 3 teslas. De nombreux métabolites peuvent être analysés, parmi lesquels le N-acétylaspartate, qui est un marqueur neuronal, le glutamate-glutamine, un marqueur de neurotransmission synaptique, ou encore le myo-inositol, un marqueur glial. Nous avons montré que la réponse glutamatergique de l’hypothalamus à la prise alimentaire est anormale chez les individus souffrant d’anorexie mentale. De plus, le rapport glutamine-glutamate / créatine chez ces individus après une nuit de jeûne et avant ingestion d’un petit déjeuner calibré s’est avéré être significativement supérieur à celui des témoins. En revanche, une heure après le petit déjeuner, ce rapport diminue considérablement chez les individus souffrant d’anorexie mentale, mais pas chez les témoins [7]. Ainsi nos résultats indiquent l’existence d’un dysfonctionnement dans le tonus glutamatergique hypothalamique des individus souffrant d’anorexie mentale, correspondant à une inversion de la réponse glutamatergique à la prise alimentaire, associée à un tonus basal « à jeun » plus élevé (Figure 1). Ces changements doivent être interprétés à la lumière de résultats obtenus précédemment chez la souris : l’activation spécifique de populations neuronales glutamatergiques dans le noyau arqué de l’hypothalamus (ARH) et l’aire hypothalamique latérale (LHA) provoque en effet une satiété chez des souris ayant un accès illimité à l’alimentation [8, 9].
| Figure 1. Hypothèse de la dysrégulation du tonus glutamatergique hypothalamique dans
l’anorexie mentale. Les populations neuronales GABAergiques à neuropeptide Y
et agouti-related protein (NPY/AgRP) du noyau arqué de l’hypothalamus (ARH),
mais aussi celles de l’aire hypothalamique latérale (LHA), sont activatrices
de la prise alimentaire (i.e., orexigènes), alors que les neurones
glutamatergiques à pro-opiomélanocortine (POMC) de l’ARH et les neurones
glutamatergiques de la LHA sont inhibiteurs de la prise alimentaire (i.e.,
anorexigènes) [8, 9]. Dans l’anorexie mentale, l’activité
neuronale glutamatergique basale (avant prise alimentaire) est anormalement
élevée dans l’hypothalamus, ce qui pourrait entraîner un défaut de
perception de la sensation de faim et ainsi limiter la prise
alimentaire. |
L’IRM de diffusion (diffusion tensor imaging, DTI), quant à elle, permet de mesurer le déplacement des molécules d’eau dans le parenchyme cérébral. Cela permet ensuite, grâce à l’anisotropie de la diffusion des molécules d’eau due à la « barrière » des gaines de myéline, de « reconstruire » les faisceaux d’axones (tractographie), et il devient possible de comptabiliser le nombre de fibres nerveuses passant entre deux régions d’intérêt, ici différents noyaux hypothalamiques [10]. Afin d’étudier les changements de la microstructure hypothalamique pouvant expliquer les altérations fonctionnelles détectées en SRM, une « segmentation » est effectuée sur les séquences d’IRM anatomique pour individualiser chaque noyau hypothalamique. Un algorithme probabiliste détermine ensuite le nombre de fibres passant à travers chaque noyau hypothalamique. Notre étude, la première à réaliser une tractographie intra-hypothalamique, a ainsi permis de mettre en évidence une altération des « connectomes » de l’ARH et de la LHA chez les sujets souffrant d’anorexie mentale [7]. Le nombre de fibres nerveuses passant à travers l’ARH était considérablement réduit par rapport à celui de sujets témoins. Une altération de la connectivité de l’ARH en cas de sous-poids a d’ailleurs déjà été rapportée chez la souris [11, 12] (→).
(→) Voir la Nouvelle de S.G. Bouret, m/s n° 11, novembre 2004, page 958
À l’inverse, la densité de fibres nerveuses dans la LHA était significativement plus importante que chez les sujets témoins. Or cette sous-région de l’hypothalamus joue un rôle capital non seulement dans le contrôle de la prise alimentaire, mais aussi dans l’intégration des informations intéroceptives et la modulation de l’activité des centres corticaux impliqués dans la prise de décision et la représentation du corps, qui est également perturbée dans l’anorexie mentale [13, 14] (→)
(→) Voir la Synthèse de P. Parnet et al., m/s n° 1, janvier 2016, page 85
Les techniques récentes de neuroimagerie sont donc très utiles pour explorer les anomalies structurelles et fonctionnelles présentes chez les individus souffrant d’anorexie mentale. Les résultats de notre étude centrée sur l’hypothalamus nous ont permis de formuler l’hypothèse de l’implication du « cerveau homéostasique » dans la pathogenèse de cette maladie considérée jusqu’alors comme comportementale, et fournissent un nouvel outil diagnostique au clinicien. Sur le plan thérapeutique, quelques essais de neurostimulation cérébrale profonde sont en cours, mais centrés sur des régions extra-hypothalamiques [15]. Nos résultats permettent désormais d’envisager la possibilité d’une activation ou d’une inhibition de sous-structures hypothalamiques dysfonctionnelles chez les patients afin de faciliter le retour à une prise alimentaire suffisante.