| |
| Med Sci (Paris). 36(2): 112–115. doi: 10.1051/medsci/2020006.Une nouvelle génération d’immunothérapies ciblant la
voie CD39/CD73/adénosine pour favoriser la réponse immunitaire
anti-tumorale Laurent Gros,1 Carine Paturel,2 Ivan Perrot,2 Armand Bensussan,3,4 Jean-François Eliaou,1,5 Jérémy Bastid,3 and Nathalie Bonnefoy1,3* 1Institut de recherche en cancérologie de Montpellier, Inserm
U1194, université de Montpellier, institut régional du cancer de
Montpellier, 34298Montpellier,
France 2Innate Pharma, 117 avenue de Luminy, 13009Marseille,
France 3OREGA Biotech, 69130Ecully,
France 4Inserm UMRS 976, université Paris Diderot, Sorbonne Paris
Cité, laboratoire immunologie, dermatologie et oncologie,
75475Paris,
France 5Département d’immunologie, centre hospitalier régional
universitaire de Montpellier et faculté de médecine, université de
Montpellier, 34295Montpellier,
France MeSH keywords: 5'-Nucleotidase, Immunité acquise, Adénosine, Antigènes CD, Apyrase, Humains, Immunothérapie, Thérapie moléculaire ciblée, Tumeurs, Transduction du signal, antagonistes et inhibiteurs, immunologie, métabolisme, physiologie, analogues et dérivés, méthodes, tendances, thérapie |
Le concept d’immunosurveillance et la compréhension des mécanismes par lesquels le
système immunitaire peut éradiquer des tumeurs ont conduit au développement de nouvelles
formes d’immunothérapie du cancer visant à promouvoir ou rétablir une réponse
immunitaire anti-tumorale efficace et durable. Cette idée révolutionnaire de cibler, non
plus les cellules tumorales, mais les cellules immunitaires, est à l’origine d’avancées
médicales majeures. Des résultats sans précédent ont en effet été obtenus en utilisant
des inhibiteurs des points de contrôle du système immunitaire (immune checkpoint
inhibitors, ICI) tels que les anticorps anti-PD-1, anti-PD-L1, et
anti-CTLA-4, pour traiter des cancers réfractaires aux traitements conventionnels par
chimiothérapie, radiothérapie, ou thérapie ciblée, dont le pronostic était jusqu’alors
très défavorable [1-3]. Ces nouvelles immunothérapies,
utilisées seules ou en combinaison, font désormais partie de l’arsenal thérapeutique
contre un grand nombre de cancers, et ont permis d’obtenir des rémissions complètes.
Toutefois, les effets bénéfiques durables ne concernent qu’une minorité des patients
traités (20 % à 30 % tous cancers confondus), tandis que les autres patients présentent
une résistance innée ou acquise aux ICI [4]. La mise au point de traitements combinant immunothérapie et
radiothérapie ou chimiothérapie, mais aussi l’identification de nouvelles cibles afin
d’améliorer l’efficacité des ICI sont au cœur des nouvelles stratégies thérapeutiques
contre le cancer. Dans ce contexte, le ciblage des voies d’immunosuppression du
microenvironnement de la tumeur constitue l’un des enjeux. Les résultats de nos récents
travaux de recherche, publiés dans Cell Reports [5], fournissent le rationnel scientifique pour le
développement clinique de deux anticorps ciblant les protéines CD39 et CD73, et sont en
faveur de leur utilisation dans l’immunothérapie des cancers. |
CD39, CD73, et adénosine : de nouvelles cibles thérapeutiques contrôlant la
réponse immunitaire anti-tumorale L’adénosine, par ses propriétés immunosuppressives, est un acteur majeur de
l’échappement des tumeurs au contrôle par le système immunitaire. Ce nucléoside joue
un rôle essentiel dans la migration, la prolifération, et la mort cellulaire [6]. C’est un frein puissant à
la réponse immunitaire par sa capacité à inhiber l’activation des cellules
dendritiques, la prolifération et l’activation des lymphocytes T effecteurs,
l’activation des cellules natural killer (NK), ou au contraire en
activant les fonctions suppressives des lymphocytes T régulateurs et des macrophages
pro-tumoraux de type M2 [6]. La production
d’adénosine dans le microenvironnement tumoral est liée à l’activité de deux
ectonucléotidases, CD39 (ectonucléoside triphosphate diphosphohydrolase 1, ENTPD1)
et CD73 (ecto-5’-nucléotidase, NTE5). Une augmentation de l’expression de CD39 et
CD73 dans le lit tumoral témoigne d’un environnement immunosuppresseur. CD39, sous forme membranaire ou soluble, hydrolyse l’adénosine triphosphate (ATP) et
l’adénosine diphosphate (ADP) en adénosine monophosphate (AMP). L’AMP est converti à
son tour en adénosine par CD73. À l’inverse de l’adénosine, l’ATP extracellulaire
libéré lors de la mort des cellules tumorales agit comme un signal immunogénique
puissant [7]. L’ATP, en se
liant aux récepteurs membranaires purinergiques P2X et P2Y, favorise la maturation
des cellules dendritiques et l’amorçage (priming) de la réponse
anti-tumorale. L’ATP inhibe la prolifération des cellules tumorales et favorise leur
mort. Le rapport ATP/adénosine est donc un élément important pour la fonction
anti-tumorale du système immunitaire, et les enzymes CD39 et CD73 apparaissent comme
des enzymes clefs, dont l’activité séquentielle contrôle la concentration d’ATP
(immunostimulatrice) et d’adénosine (immunosuppressive) [8] (Figure
1). Confortant l’hypothèse du rôle de CD39 et CD73 dans le
contrôle de la réponse immunitaire anti-tumorale, plusieurs études montrent que les
souris déficientes en CD39 ou CD73 ont moins de métastases et une croissance de
tumeurs syngéniques transplantées diminuée [9-11].
Par ailleurs, le blocage de l’activité de l’une ou l’autre de ces ectonucléotidases
par des inhibiteurs chimiques ou des anticorps monoclonaux a produit des effets
encourageants dans des études pré-cliniques [12-14].
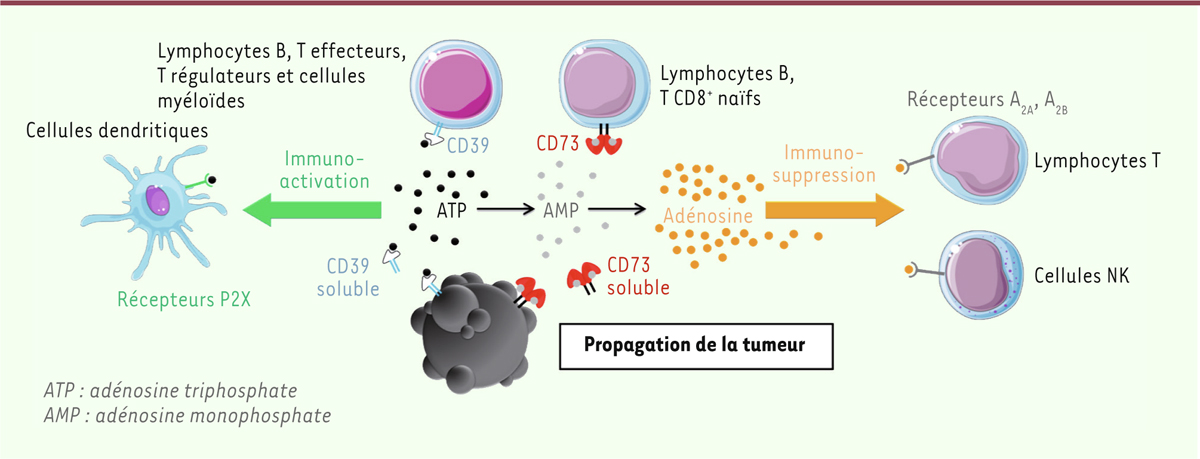
 | Figure 1. La voie ATP/AMP/adénosine. Les exoenzymes CD39 et CD73 favorisent
l’accumulation d’adénosine dans le microenviro nnement tumoral et
inhibent les réponses anti-tumorales. CD39 et CD73 sont exprimées par
certaines cellules immunes infiltrant la tumeur et par les cellules
tumorales elles-mêmes. Elles transforment l’ATP extracellulaire,
relargué par les cellules tumorales mourantes, en AMP, puis en
adénosine. L’adénosine, en se fixant sur les récepteurs A2A et A2B,
inhibe les fonctions effectrices des lymphocytes T CD8+ et des cellules
NK. La diminution de la quantité d’ATP, quant à elle, diminue
l’activation des cellules dendritiques via les récepteurs P2X. Ces deux
actions concomitantes favorisent la prolifération et la dissémination
des cellules tumorales. |
|
Neutralisation de l’activité ATPasique de CD39 : impact sur l’efficacité des
thérapies anti-tumorales En utilisant trois modèles murins (mélanome B16F10, fibrosarcome MCA205, et
adénocarcinome colorectal MC38), nous avons montré que l’invalidation du gène codant
CD39 chez la souris est associée à une augmentation des fonctions effectrices des
lymphocytes T CD8+ et CD4+ infiltrant la tumeur et à un retard
de la progression tumorale. Cependant, l’invalidation du gène codant CD39 ne permet
à elle seule la régression complète des tumeurs dans aucun de ces trois modèles. En
revanche, elle potentialise le taux de réponse favorable aux ICI anti-PD-1 et
anti-CTLA-4, et permet une rémission complète (élimination des tumeurs) et durable
chez 20 % des animaux traités par un anticorps anti-PD-1 dans le modèle de mélanome
B16F10, particulièrement résistant à ces immunothérapies. Dans le modèle de
fibrosarcome MCA205, le traitement de souris déficientes en CD39 par l’anticorps
anti-PD-1 seul retarde légèrement la croissance tumorale, mais n’induit pas de
rémission complète. Cependant, dans ce modèle, le taux de rémission complète obtenu
avec la combinaison de l’oxaliplatine et de l’anticorps anti-PD-1 passe de 65 % chez
les souris témoins à plus de 90 % chez les souris déficientes en CD39. Cet effet est
strictement dépendant des lymphocytes T CD8+ et CD4+, et est
associé au développement d’une mémoire immunitaire protectrice. Ces résultats
montrent que la neutralisation de l’activité ATPasique de CD39 chez la souris
potentialise l’efficacité des traitements anti-cancéreux utilisant des ICI combinés
ou non à une chimiothérapie, et augmente significativement les taux de réponse
complète et de survie. Ils ouvrent ainsi des perspectives pour de nouvelles
approches de thérapies combinées. |
Inhibition de CD39 et de CD73 : redondance ou synergie ? Le développement concomitant d’anticorps bloquant CD39 (IPH5201) ou CD73 (IPH5301)
nous a permis d’aborder cette question pour la première fois. L’anticorps IPH5201
inhibe l’activité enzymatique de CD39 membranaire et soluble, et bloque efficacement
l’hydrolyse de l’ATP extracellulaire. Son utilisation augmente le taux de réponse à
l’oxaliplatine des souris porteuses du fibrosarcome MCA205 et invalidées pour le
gène codant CD39 mais exprimant la protéine CD39 humaine, alors que son utilisation
en monothérapie n’affecte pas la croissance tumorale chez ces souris. L’anticorps IPH5301 bloque la dégradation de l’AMP en adénosine par CD73, et son
affinité pour cette enzyme est similaire à celle de deux anticorps de référence,
MEDI9447 et CD73.4, actuellement en cours d’essais cliniques de phase Ib/II et
I/IIa. Cependant, IPH5301 est plus efficace pour bloquer l’activité enzymatique de
CD73 sous forme membranaire ou soluble et pour restaurer la prolifération des
lymphocytes T in vitro. Ces anticorps IPH5201 et IPH5301, lorsqu’ils sont utilisés seuls, bloquent
efficacement la production d’adénosine et restaurent in vitro la
prolifération des lymphocytes du sang périphérique de sujets sains ou de patientes
atteintes d’un cancer du sein, dans un milieu riche en ATP. Remarquablement, dans
les mêmes expériences in vitro, lorsqu’ils sont utilisés ensemble à
des doses qui étaient insuffisantes pour restaurer la prolifération des lymphocytes
quand ils étaient utilisés seuls, IPH5201 et IPH5301 agissent en synergie pour
supprimer l’effet suppressif lié à la dégradation de l’ATP en adénosine et pour
favoriser la prolifération des lymphocytes T. Ainsi, les blocages de l’activité
enzymatique de CD39 et CD73 n’apparaissent pas redondants, mais synergiques pour
limiter l’inhibition des lymphocytes T dépendante de l’adénosine et améliorer ainsi
l’immunité anti-tumorale (Figure
2).
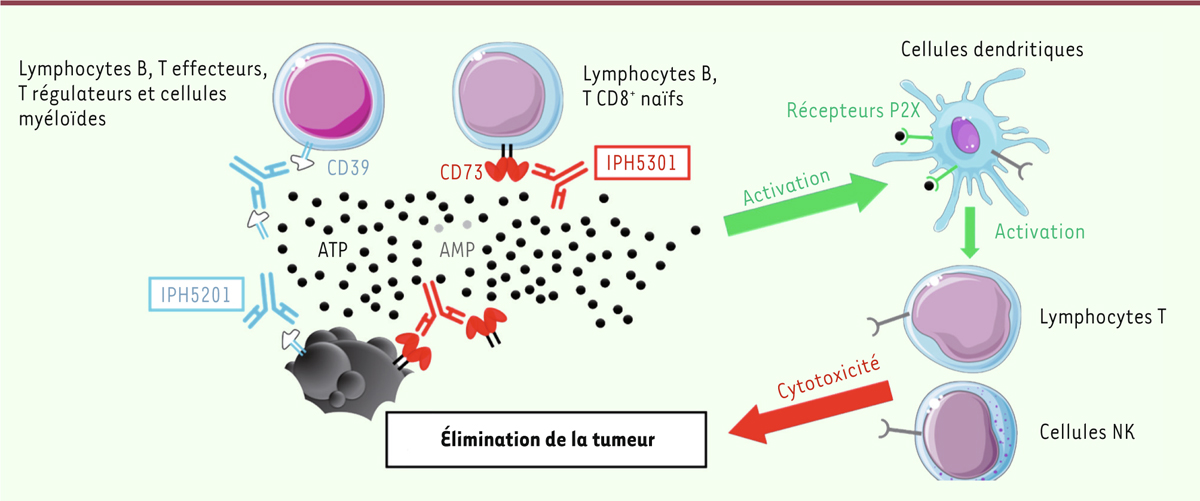
 | Figure 2. Mécanisme d’action des anticorps IPH5201 et IPH5301. Les anticorps
IPH5201 et IPH5301 bloquent respectivement l’activité enzymatique de
CD39 et celle de CD73, donc l’hydrolyse de l’ATP et de l’AMP
extracellulaire. Ces deux actions conjointes permettent, d’une part de
limiter la production d’adénosine et ainsi l’inhibition des cellules
immunes exprimant les récepteurs de l’adénosine (récepteurs A2A, A2B),
et, d’autre part, de potentialiser l’activation des cellules
dendritiques via les récepteurs P2X. L’activation optimale des cellules
immunes infiltrant la tumeur permet la mise en place de réponses
anti-tumorales efficaces et l’élimination de la tumeur. |
|
AB, JFE, JB et NB sont actionnaires et/ou salariés d'Orega Biotech et
inventeurs de brevets couvrant des anticorps anti-CD39. CP et IP sont salariés
d'Innate Pharma et inventeurs de brevets couvrant des anticorps anti-CD39 ou
anti-CD37. LG déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Hodi
FS
,
O’Day
SJ
,
McDermott
DF
, et al.
Improved survival with ipilimumab in patients with metastatic
melanoma . N Engl J Med.
2010; ; 363 :
:711.–723. 2.
Topalian
SL
,
Hodi
FS
,
Brahmer
JR
, et al.
Safety, activity, and immune correlates of anti-PD-1 antibody in
cancer . N Engl J Med.
2012; ; 366 :
:2443.–2454. 3.
Brahmer
JR
,
Tykodi
SS
,
Chow
LQ
, et al.
Safety and activity of anti-PD-L1 antibody in patients with
advanced cancer . N Engl J Med.
2012; ; 366 :
:2455.–2465. 4.
Jenkins
RW
,
Barbie
DA
,
Flaherty
KT
. Mechanisms of resistance to immune checkpoint
inhibitors . Br J Cancer.
2018; ; 118 :
:9.–16. 5.
Perrot
I
,
Michaud
HA
,
Giraudon-Paoli
M
, et al.
Blocking antibodies targeting the CD39/CD73 immunosuppressive
pathway unleash immune responses in combination cancer
therapies . Cell Rep.
2019; ; 27 : (2411–25)
:e9.. 6. de Andrade
Mello
P,
Coutinho-Silva
R,
Savio
LEB. Multifaceted
effects of extracellular adenosine triphosphate and adenosine in the
tumor-host interaction and therapeutic perspectives .
Front Immunol.
2017;; 8 : :1526.. 7.
Silva-Vilches
C
,
Ring
S
,
Mahnke
K
. ATP and its metabolite adenosine as regulators of
dendritic cell activity . Front Immunol.
2018; ; 9 : :2581.. 8.
Bastid
J
,
Regairaz
A
,
Bonnefoy
N
, et al.
Inhibition of CD39 enzymatic function at the surface of tumor
cells alleviates their immunosuppressive activity .
Cancer Immunol Res.
2015; ; 3 :
:254.–265. 9.
Sun
X
,
Wu
Y
,
Gao
W
, et al.
CD39/ENTPD1 expression by CD4+ Foxp3+
regulatory T cells promotes hepatic metastatic tumor growth in
mice . Gastroenterol.
2010; ; 139 :
:1030.–1040. 10.
Stagg
J
,
Divisekera
U
,
Duret
H
, et al.
CD73-deficient mice have increased antitumor immunity and are
resistant to experimental metastasis . Cancer
Res.
2011; ; 71 :
:2892.–2900. 11.
Stagg
J
,
Beavis
PA
,
Divisekera
U
, et al.
CD73-deficient mice are resistant to
carcinogenesis . Cancer Res.
2012; ; 72 :
:2190.–2196. 12.
Antonioli
L
,
Yegutkin
GG
,
Pacher
P
, et al.
Anti-CD73 in cancer immunotherapy: awakening new
opportunities . Trends Cancer.
2016; ; 2 :
:95.–109. 13.
Antonioli
L
,
Novitskiy
SV
,
Sachsenmeier
KF
, et al.
Switching off CD73: a way to boost the activity of conventional
and targeted antineoplastic therapies . Drug Discov
Today.
2017; ; 22 :
:1686.–1696. 14.
Nikolova
M
,
Carriere
M
,
Jenabian
MA
, et al.
CD39/adenosine pathway is involved in AIDS
progression . PLoS Pathog.
2011; ; 7 :
:e1002110.. |