| |
| Med Sci (Paris). 36(2): 109–112. doi: 10.1051/medsci/2020005.Étude des premiers événements contribuant à
l’implantation des cellules cancéreuses dans une niche
métastatique Claire Marceaux1 and Marie-Liesse Asselin-Labat1,2* 1Personalised Oncology Division, The Walter and Eliza Hall
Institute of Medical Research, Department of Medical Biology, The University
of Melbourne, Parkville, Australie. 2Cancer Early Detection and Advanced Research Center, Knight
Cancer Institute, Oregon Health and Science University,
Portland,
États-Unis. MeSH keywords: Adhérence cellulaire, Humains, Métastase tumorale, Tumeurs, Cellules souches tumorales, Granulocytes neutrophiles, Espèces réactives de l'oxygène, Transduction du signal, Niche de cellules souches, Microenvironnement tumoral, physiologie, anatomopathologie, métabolisme |
Le processus à l’origine de la migration des cellules cancéreuses dans un organe afin de
former des métastases est finement contrôlé et nécessite de nombreuses modifications
cellulaires. En effet, ces cellules doivent pénétrer et survivre dans la circulation
sanguine, sortir des vaisseaux sanguins, pour finalement coloniser un nouvel organe
[1]. Pour subsister dans
l’organe hôte, les cellules métastatiques s’adaptent et modifient leur niche cellulaire.
Il est important de caractériser cette niche cellulaire afin de comprendre les
évènements responsables de la formation des métastases et d’identifier de nouvelles
stratégies thérapeutiques. |
Méthodes pour étudier la niche métastatique in vivo Les évènements moléculaires et cellulaires à l’origine de l’implantation d’une
cellule cancéreuse dans un nouveau microenvironnement sont restés longtemps peu
étudiés à cause du manque d’outils pour évaluer ces changements in
vivo. De nouvelles techniques ont récemment été développées pour
étudier spécifiquement in vivo les cellules qui forment la niche
dans laquelle les cellules tumorales métastatiques viennent s’implanter. Ces
techniques utilisent des marqueurs fluorescents permettant de visualiser et d’isoler
les différents types cellulaires présents dans la niche (Figure 1).
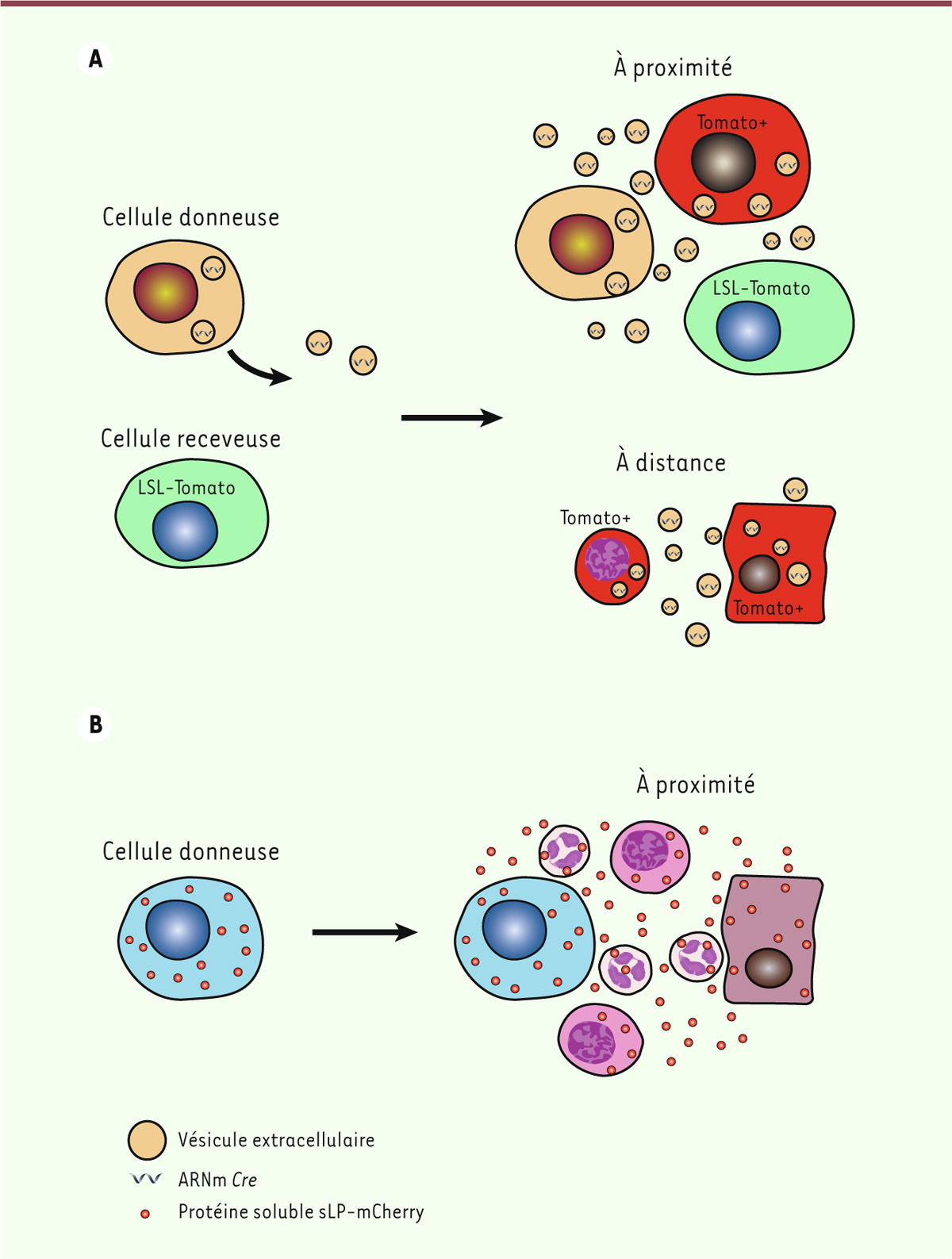
 | Figure 1. Méthodes de marquage in vivo des cellules de la niche métastatique
situées au voisinage des cellules tumorales.
A. Les cellules cancéreuses donneuses
(orange) sécrètent des vésicules extracellulaires (EV) contenant l’ARNm
codant la recombinase Cre. L’incorporation de ces EV par des cellules
receveuses (vertes) génétiquement modifiées pour exprimer un
fluorochrome exclusivement après recombinaison par l’enzyme Cre, se fait
soit à proximité soit à distance des cellules donneuses, et produit des
cellules acceptrices fluorescentes (rouges), ce qui facilite leur étude.
LSL-Tomato : Lox-STOP-Lox-Tomato cassette.
B. Les cellules cancéreuses
métastatiques donneuses (bleues) expriment des molécules liposolubles
fluorescentes (sLP-mCherry, en rouge), qui sont incorporées, par
diffusion passive, dans les cellules adjacentes aux cellules
cancéreuses. |
Les cellules tumorales secrètent constamment des facteurs solubles ou des vésicules
extracellulaires (extracellular vesicles, EV) qui transportent des
molécules spécifiques affectant les fonctions des cellules receveuses [2]. Ce système de transport par
les EV a été exploité par Zomer et al. pour marquer les cellules de
la niche métastatique in vivo [3]. Leur méthode, fondée sur l’utilisation du
système Cre-loxP, consiste à modifier les cellules cancéreuses donneuses pour
qu’elles expriment la recombinase Cre, dont l’ARNm est sécrété dans leurs EV. En
parallèle, les cellules receveuses sont modifiées génétiquement pour exprimer une
protéine rapporteur fluorescente seulement après recombinaison de l’allèle
correspondant par l’enzyme Cre. Les cellules ayant invaginé des EV (contenant l’ARNm
codant Cre) provenant des cellules métastatiques deviennent alors fluorescentes.
Cette méthode permet d’analyser les cellules affectées par les cellules donneuses en
les comparant directement avec les cellules n’ayant pas incorporé d’EV
(Figure 1A). Les auteurs ont montré que l’expression de la
protéine Cre dans les cellules receveuses ne se faisait que par transfert de son
ARNm présent dans les EV, et non lorsque la protéine était sécrétée sous forme
libre. Cette approche permet d’étudier les communications cellulaires in
vitro, mais également in vivo, à proximité ou à
distance de la tumeur primaire, au niveau du site métastatique, grâce à l’imagerie
réalisée directement sur l’animal vivant. Plus récemment, Ombrato et al. [4] ont décrit une méthode permettant de détecter
les cellules situées dans le proche environnement des cellules métastatiques par un
marquage passif n’impliquant pas le transfert via les EV. Cette
méthode consiste à modifier génétiquement des cellules de cancer du sein pour
qu’elles expriment une molécule liposoluble attachée à une protéine fluorescente
mCherry (sLP-mCherry). Cette molécule est sécrétée librement ou dans les EV des
cellules tumorales, et pénètre passivement dans les cellules adjacentes à travers
leur membrane plasmique (Figure 1B). Ombrato et
al. ont montré que seules les protéines libres, et non les protéines
présentes dans les EV, pénétraient dans les cellules proches, offrant ainsi une
méthode différente de celle décrite par Zomer et al. La sLP-mCherry
est stable dans les cellules receveuses pendant environ 48 heures, ce qui facilite
l’analyse des premiers évènements se déroulant dans les cellules de la nich, mais ne
permet pas une étude des changements cellulaires sur le long terme. Cette méthode de
visualisation par microscopie des cellules formant la niche cellulaire permet la
localisation précise de cette dernière, et met en évidence les interactions
intercellulaires qui s’y produisent. De plus, la présence d’un fluorochrome permet,
après dissociation du tissu hôte, d’isoler des cellules composant la niche par
cytométrie en flux, pour des analyses moléculaires (e.g., RNAseq)
et fonctionnelles. Ces deux méthodes de marquage cellulaire à partir des cellules cancéreuses présentent
des avantages différents. La technique Cre-loxP (Figure 1A) [3] permet d’analyser sur le long terme les
différents évènements moléculaires induits par les cellules tumorales à distance de
la tumeur primaire, au site métastatique. La méthode utilisant une protéine libre
liposoluble (Figure 1B) [4]
facilite, quant à elle, l’analyse des premiers évènements qui ont lieu dans la niche
métastatique, dès l’implantation des cellules tumorales dans un organe hôte. |
Évènements précoces de préparation de la niche métastatique Les cellules tumorales modifient leur microenvironnement pour promouvoir leur
croissance, notamment en augmentant l’angiogenèse afin de recevoir plus de
nutriments et d’oxygène, ou en exprimant des molécules bloquant leur reconnaissance
par les cellules du système immunitaire [5]. De façon similaire, les cellules qui nichent dans un nouveau
microenvironnement pour former une métastase altèrent les cellules normales autour
d’elles, par exemple en limitant leur accès aux métabolites nutritifs, au profit des
cellules métastatiques [6].
Plusieurs études ont montré le rôle des cellules de la lignée myéloïde
(CD11b+) pour préparer une niche métastatique et favoriser la
croissance de cellules tumorales métastatiques dans le poumon [7-10]. La méthode développée par Ombrato
et al. [4] a désormais
permis de montrer l’effet direct des cellules métastatiques sur les cellules
épithéliales normales du poumon pour promouvoir la croissance des cellules
cancéreuses (Figure 2).
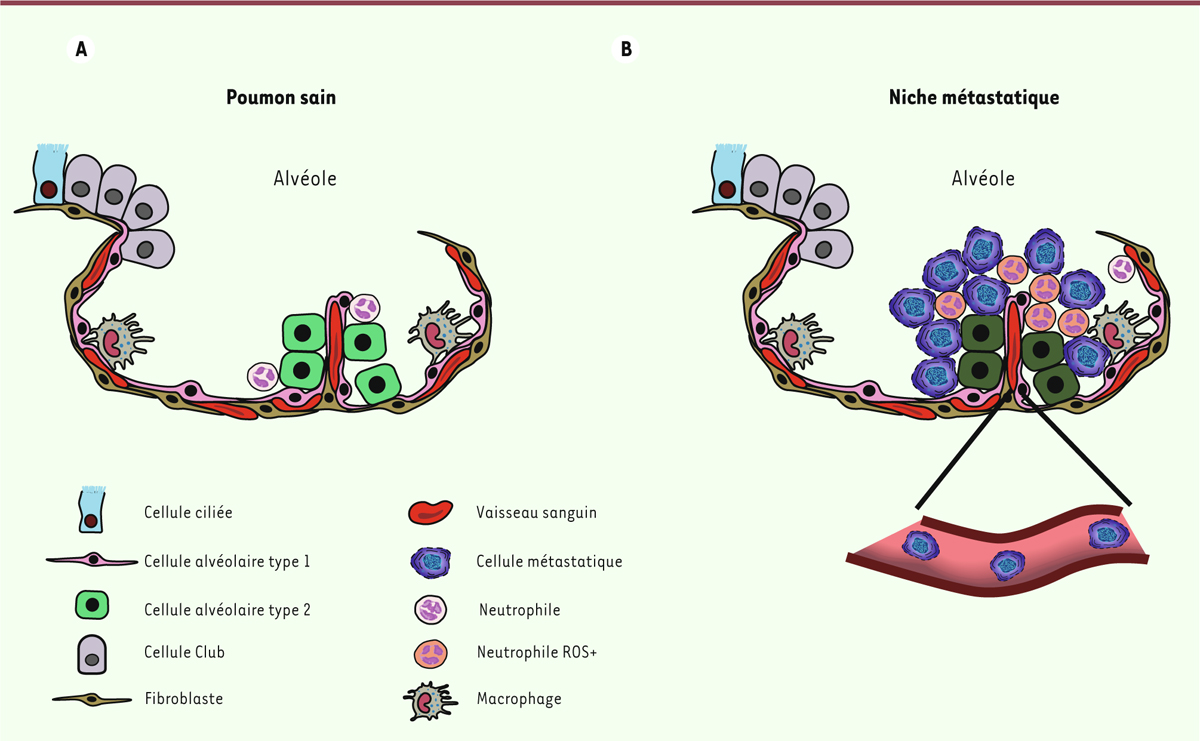
 | Figure 2. Changements cellulaires dans la niche métastatique.
A. Schéma de l’organisation des
alvéoles pulmonaires saines. B.
L’implantation des cellules métastatiques, après migration dans les
vaisseaux sanguins, entraîne notamment le recrutement de polynucléaires
neutrophiles exprimant de grandes quantités de dérivés réactifs de
l’oxygène (reactive oxygen species, ROS) et modifie les propriétés des
cellules alvéolaires environnantes, ce qui favorise l’implantation et la
prolifération des cellules métastatiques. |
Les monocytes et les macrophages jouent un rôle important dans la formation de la
niche métastatique. Ainsi, la déplétion des macrophages du poumon réduit la
migration des cellules du cancer du sein et l’implantation de métastases pulmonaires
[7]. L’infiltration de polynucléaires
neutrophiles dans les tumeurs est également associée à un mauvais pronostic de
survie des patients. Une méta-analyse a suggéré que la proportion de neutrophiles
par rapport aux lymphocytes dans les tumeurs solides constitue un biomarqueur de
survie [8]. Des études dans
des modèles précliniques ont en effet démontré le rôle des neutrophiles pour
préparer une niche pré-métastatique et promouvoir les métastases pulmonaires du
cancer du sein [9,10]. En utilisant leur méthode de marquage avec
sLP-mCherry (Figure 1B), Ombrato et al. ont
démontré in situ la présence des neutrophiles dans la niche
métastatique dès l’implantation des premières cellules cancéreuses disséminées par
voie sanguine. Une augmentation des dérivés réactifs de l’oxygène (reactive
oxygen species, ROS) a été observée dans les neutrophiles présents dans
la niche métastatique, par rapport aux neutrophiles pulmonaires présents à distance
de la métastase. Cette augmentation des ROS, connue pour activer une réponse
inflammatoire pro-tumorale, a aussi été retrouvée dans des modèles murins de cancer
du poumon, où elle favorise la croissance tumorale [11]. La co-culture de polynucléaires
neutrophiles avec des cellules tumorales in vitro augmente leur
prolifération, mais ce phénomène est bloqué en présence d’un inhibiteur de ROS,
prouvant l’importance de ces ROS produites par les neutrophiles pour la croissance
des métastases [4]. Les cellules métastatiques affectent non seulement les cellules du système
immunitaire, mais aussi les propriétés des autres cellules tumorales et des cellules
épithéliales normales. En effet, Zomer et al. ont montré que
l’invagination des EV sécrétées par des cellules métastatiques, par des cellules
tumorales non métastatiques augmente leur potentiel migratoire et invasif. De plus,
Liu et al. ont démontré que les EV des cellules cancéreuses
modulent à distance les cellules épithéliales normales du poumon, induisant la
sécrétion par les cellules alvéolaires de facteurs permettant le recrutement des
neutrophiles pro-inflammatoires et la préparation de la niche pré-métastatique
[9]. Une fois installées dans le poumon,
les cellules du cancer du sein ont la capacité de modifier les cellules épithéliales
situées autour d’elles, leur conférant des propriétés similaires à celles des
cellules souches épithéliales du poumon. Ces cellules épithéliales provoquent alors
la prolifération des cellules cancéreuses, ce qui favorise la croissance de la
tumeur métastatique [4]. Ces différentes études et le développement de nouvelles méthodes pour identifier et
isoler les cellules affectées par les cellules cancéreuses, à proximité ou à
distance de celles-ci, permettent une meilleure compréhension de l’impact des
cellules cancéreuses sur leur environnement. |
Implications thérapeutiques Compte tenu de l’instabilité génétique des cellules tumorales et de leur capacité à
s’adapter rapidement à leur environnement pour proliférer, migrer ou adopter des
moyens de résistance aux thérapies, cibler les cellules normales autour de la tumeur
primitive ou de sa métastase peut constituer une stratégie de traitement. Des
médicaments bloquant l’angiogenèse ou activant les cellules du système immunitaire
ont déjà prouvé l’intérêt d’une telle stratégie. Étant donné que les décès des
patients atteints d’un cancer sont la plupart du temps causés par les métastases,
bloquer la migration et l’implantation des cellules métastatiques dans la niche
métastatique est une nouvelle possibilité thérapeutique à explorer. Cependant, il
reste beaucoup à apprendre sur le microenvironnement des cellules métastatiques et
la manière dont les cellules cancéreuses manipulent cet environnement, à distance
avant leur implantation, et une fois arrivées sur le site de la métastase. Les
méthodes de marquage des cellules de la niche métastatique développées par Zomer
et al. [3], et plus
récemment par Ombrato et al. [4], offrent de nouvelles perspectives pour comprendre les communications
entre les cellules cancéreuses et non cancéreuses voisines, et identifier ainsi de
nouvelles cibles thérapeutiques. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1.
Quail
DF
,
Joyce
JA
. Microenvironmental regulation of tumor
progression and metastasis . Nat Med.
2013; ; 19 :
:1423.–1437. 2.
Raposo
G
,
Stoorvogel
W
. Extracellular vesicles: exosomes, microvesicles,
and friends . J Cell Biol.
2013; ; 200 :
:373.–383. 3.
Zomer
A
,
Maynard
C
,
Verweij
FJ
, et al.
In vivo imaging reveals extracellular vesicle-mediated
phenocopying of metastatic behavior . Cell.
2015; ; 161 :
:1046.–1057. 4.
Ombrato
L
,
Nolan
E
,
Kurelac
I
, et al.
Metastatic-niche labelling reveals parenchymal cells with stem
features . Nature.
2019; ; 572 :
:603.–608. 5.
Hanahan
D
,
Weinberg
RA
. Hallmarks of cancer: the next
generation . Cell.
2011; ; 144 :
:646.–674. 6.
Fong
MY
,
Zhou
W
,
Liu
L
, et al.
Breast-cancer-secreted miR-122 reprograms glucose metabolism in
premetastatic niche to promote metastasis . Nat Cell
Biol.
2015; ; 17 :
:183.–194. 7.
Linde
N
,
Casanova-Acebes
M
,
Sosa
MS
, et al.
Macrophages orchestrate breast cancer early dissemination and
metastasis . Nat Commun.
2018; ; 9 : :21.. 8. Templeton
AJ,
McNamara
MG,
Šeruga
B, et al.
Prognostic role of neutrophil-to-lymphocyte ratio in solid
tumors: a systematic review and meta-analysis . J
Natl Cancer Inst.
2014;; 106 :
:dju124.. 9.
Liu
Y
,
Gu
Y
,
Han
Y
, et al.
Tumor exosomal RNAs promote lung pre-metastatic niche formation
by activating alveolar epithelial TLR3 to recruit
neutrophils . Cancer Cell.
2016; ; 30 :
:243.–256. 10.
Wculek
SK
,
Malanchi
I
. Neutrophils support lung colonization of
metastasis-initiating breast cancer cells .
Nature.
2015; ; 528 :
:413.–417. 11. Engblom
C,
Pfirschke
C,
Zilionis
R, et al.
Osteoblasts remotely supply lung tumors with cancer-promoting
SiglecF-high neutrophils . Science.
2017;; 358 :
:eaal5081.. |