| |
| Med Sci (Paris). 36(1): 44–49. doi: 10.1051/medsci/2019268.L’azadirachtine, un pesticide naturel aux effets
multiples Nadia Aribi,1* Béatrice Denis,2 Samira Kilani-Morakchi,1 and Dominique Joly2 1Laboratoire de Biologie Animale Appliquée. Faculté des
Sciences. Université Badji Mokhtar Annaba. BP12, 23000, Annaba,
Algérie 2Laboratoire Évolution, Génomes, Comportement, Écologie, UMR
9191, CNRS, IRD, Université Paris-Sud et Université
Paris-Saclay, avenue de
la Terrasse, F-91198Gif-sur-Yvette,
France |

vignette (Photo © Wikimedia commons) De nombreuses maladies (cancers, autisme, hyperactivité, maladie de Parkinson, etc.) et
affections (respiratoires, immunitaires, santé reproductive, etc.) touchant l’être
humain peuvent être attribuées, du moins en partie, à l’impact de polluants, parmi
lesquels les pesticides chimiques et/ou synthétiques dont les effets néfastes sont
largement documentés [1, 2] (→).
(→) Voir la Synthèse de S.H. Thany et al., m/s
n° 3, mars 2013, page 273
Cependant, en l’absence de ces pesticides, les vecteurs d’agents pathogènes pour l’homme
(comme les moustiques porteurs de parasites ou de virus) tout comme les ravageurs de
cultures (invertébrés, parasites, champignons, etc.) sont susceptibles de causer de
fortes nuisances à l’homme et à son environnement économique [3]. L’utilisation de produits phytopharmaceutiques
est donc largement préconisée, mais leur choix nécessite d’être en conformité avec les
objectifs de développement durable, tels que définis et adoptés en 1995 par
l’Organisation des Nations unies. Les composés naturels dotés d’un effet pesticide sont
de plus en plus utilisés dans le cadre de stratégies de lutte intégrée1 [4,5]. Différentes
molécules naturelles (issues de minéraux ou d’organismes vivants, comme les animaux, les
plantes et les bactéries) sont utilisées pour la protection des plantes [4]. Ces molécules ont été identifiées à la suite
d’études toxicologiques qui avaient été conduites à petite échelle. Leur production et
leur utilisation à grande échelle ont, par la suite, été rendues possible grâce à
l’essor de la biotechnologie. Ces molécules naturelles prennent progressivement des
parts plus importantes sur le marché des pesticides, comparativement aux insecticides
classiques qui sont nocifs pour l’environnement [4] et connus pour leurs potentielles implications dans des affections qui se
révèlent transgénérationnelles [5]. |
L’azadirachtine et ses usages en médecine humaine Azadirachta indica A. Juss (encore appelé Antelaea
azadirachta L ou Melia azadirachta L ; ou plus
communément de son nom vernaculaire margousier ou, en anglais, neem) est un arbre
utilisé en médecine traditionnelle depuis plus de 2 000 ans [6, 7]. Caractérisée par une croissance rapide et par certaines
variétés résistantes aux gelées, son essence a connu un essor massif (Figure 1) pour différents usages
(médecine traditionnelle, agronomie, ornementation). De cet arbre, plus de 300
composés phytochimiques ont été isolés [8, 9],
notamment des limonoïdes (ou tétranortriterpènes : azadirachtine, azadirone,
azadiradione, etc.), des protolimonoïdes du groupe gédunine (nimbine, nimboline,
salanine, etc.), des flavanoïdes (nimbaflavone) et d’autres constituants, comme les
tanins [10, 11]. La structure complexe
des molécules extraites du margousier et leurs modes d’action en relation avec leurs
propriétés électroniques ont été précisés par de Castro et al.
[12]. Malgré des
concentrations qui varient selon les différents segments du végétal, l’azadirachtine
en constitue la molécule prédominante [9,
11–13]. Elle peut être isolée à partir de deux
autres espèces proches d’Azadirachta : A. excelsa
et A. siamensis [9].
L’azadirachtine a suscité l’intérêt des chercheurs depuis longtemps, de par la
diversité de ses propriétés pharmacologiques, mais aussi par son activité pesticide
[6, 9].
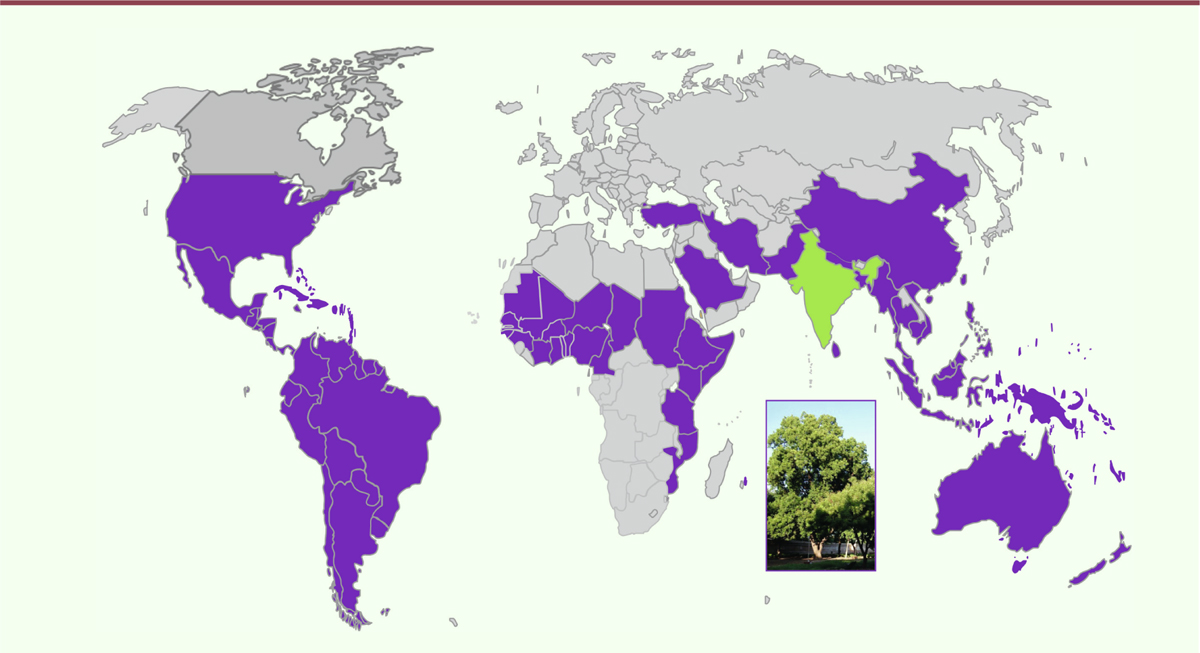
 | Figure 1.Carte de répartition du margousier (en violet) à partir de sa région
d’origine en Inde (en vert) [ 7]
(modifiée d’après Fernandez et al. [ 9]). |
|
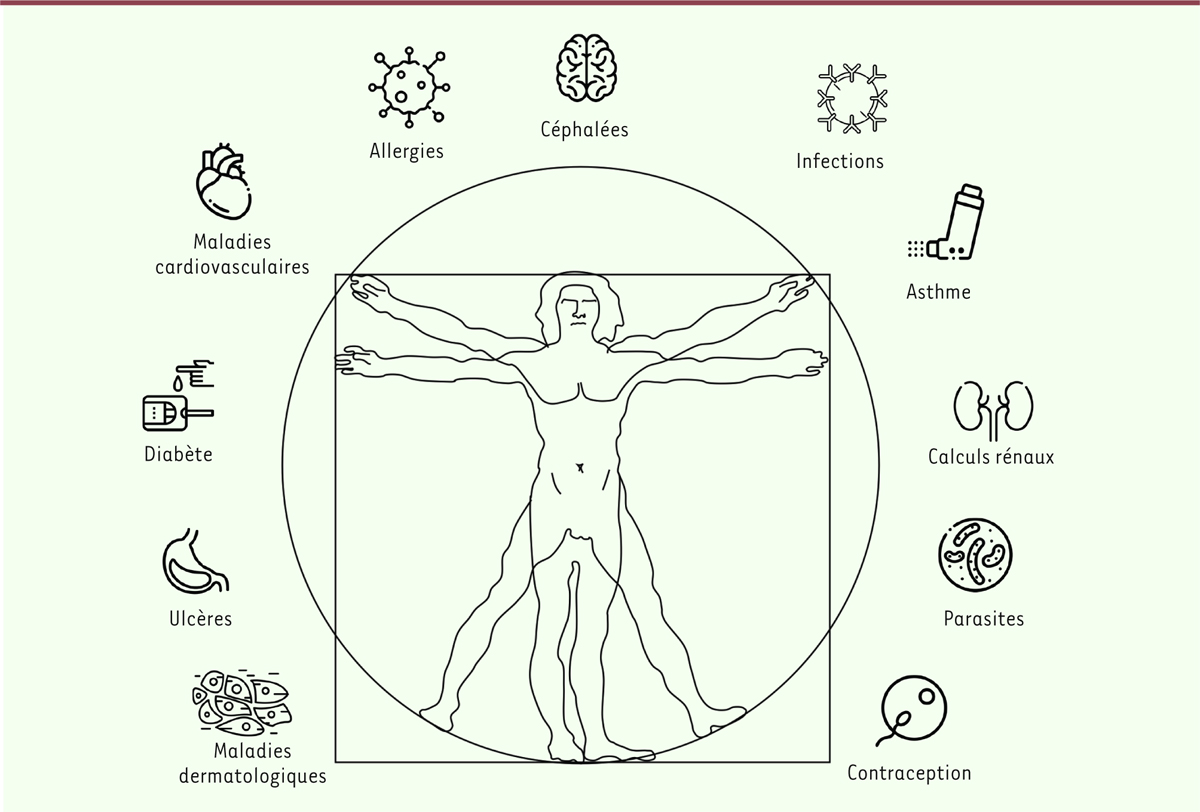
Effets bénéfiques de Azadirachta indica Azadirachta indica, réputé dans la médecine traditionnelle en Asie
et en Afrique, est utilisé pour traiter de multiples affections (Figure 2) : les allergies (comme
antihistaminique), l’asthme, les céphalées, les infections microbiennes et virales,
le paludisme, les calculs rénaux, le diabète, mais aussi les maladies
cardiovasculaires (hypertension, athérosclérose), gastriques (ulcères) et
dermatologiques (plaies septiques, furoncles, démangeaisons dues à la varicelle,
gale, leishmaniose). Azadirachta indica présente aussi des
propriétés fongicides, antiparasitaires (helminthes), antipyrétiques,
anti-inflammatoires immunostimulantes, immunomodulatrices, neuroprotectrices (dans
la maladie de Parkinson), contraceptives et anticancéreuses [8–11, 13-17]. Le
potentiel fongicide du margousier semble lié à la présence d’azadirachtine et de
nimbine [8] ; son effet anticarcinogène
reposerait sur l’azadirachtine et le nimbolide [9]. L’azadirachtine est également utilisée comme répulsif contre les
insectes hématophages (les moustiques) qui sont vecteurs de nombreux agents
pathogènes pour l’homme [6].
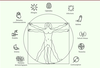 | Figure 2. Les usages multiples de l’azadirachtine en pharmacopée traditionnelle
(schéma réalisé à partir d’images de www.flaticon.com). |
Les composés à activité biologique agissent en modulant de multiples voies de
signalisation cellulaire et différents mécanismes moléculaires des actions observées
avec l’azadirachtine, le nimbolide et la gédunine, sont maintenant connus [9, 11].
Les substances actives d’A. indica agissent au niveau des signaux
cellulaires qui régulent l’expression de facteurs pro-apoptiques et anti-apoptiques,
mais aussi de ceux qui modulent le processus inflammatoire [9]. L’azadirachtine peut ainsi interagir avec les récepteurs de
l’acide rétinoïque et exercer des réponses anti-inflammatoires et antimétastatiques
dans des lignées de cellules humaines [18]. Les effets anticancéreux des composés issus d’A.
indica ont été démontrés dans les cancers gynécologiques [11, 16], mais aussi dans les cancers gastrointestinaux, du sein, de
la prostate, de la peau et du sang [11].
L’azadirachtine est considérée comme non-toxique pour les hommes et les vertébrés à
sang chaud [6] et sans génotoxicité pour les
mammifères [19]. |
Koriem [14] ainsi que
Ghedira et Goetz [10] ont établi une liste
des propriétés pharmacologiques, des résultats de tests de toxicité, et des doses
recommandées pour les différentes fractions d’A. indica. Ils
décrivent également les principales utilisations thérapeutiques traditionnelles et
modernes de la plante. Ainsi, en application topique chez le lapin, l’huile de
margousier ne montre aucun effet significatif sur le poids du corps et des organes,
ou sur des marqueurs enzymatiques métaboliques [14]. Pour l’azadirachtine, l’un des composants purifiés du margousier,
si elle est utilisée aux doses recommandées, aucun effet néfaste significatif n’est
observé [6]. Chez les petits mammifères (rats
et chiots), elle ne présente pas, non plus, d’effet carcinogène et est sans impact
sur la fonction reproductive, le système nerveux ou le stress oxydatif au cours de
deux générations [20]. Les
deux formulations testées ne présentent donc pas d’effet significatif sur le
métabolisme lorsqu’elles sont utilisées aux doses préconisées. Chez le rat, de
faibles doses d’azadirachtine ne produisent en effet aucune malformation chez les
fœtus. Pourtant, aux doses létales médianes (DL 50) (soit 5 g/kg), une mutagénocité
et une génotoxicité ont pu être observées [20] et des doses supérieures conduisent à une augmentation des aberrations
chromosomiques des spermatocytes [20]. Chez
les poulets âgés de moins de 7 jours, l’administration quotidienne d’extraits
d’A. indica (durant 28 jours) est à l’origine d’une diminution
du poids corporel et de la prise alimentaire, avec la présence d’un stress toxique
[10]. En cas d’ingestion de doses
excessives d’huile de margousier, des cas d’empoisonnement, d’encéphalopathie et de
syndrome de Reye2, ont été rapportés [14, 20].
Chez l’homme, l’azadirachtine n’est donc pas recommandée en cas de grossesse,
d’allaitement ou chez les enfants de moins de 12 ans [14]. |
L’azadirachtine et son action biocide L’azadirachtine est le biocide le plus performant et le plus commercialisé dans le
monde [6, 21]. Ce pesticide naturel est utilisé avec
succès dans les agro-écosystèmes [6, 7, 22], d’autant qu’il n’induit aucun impact sur les organismes
microbiens présents dans le sol [23]. D’ailleurs, l’OMS et le programme environnemental des Nations unies
préconise son utilisation [7]. |
Chez les espèces cibles, l’azadirachtine possède notamment des effets anti-appétants,
stérilisants et régulateurs du développement [6, 7, 13, 22]. Mordue
et al. [6] notent en
particulier qu’elle entraîne une cytotoxicité, l’apoptose des cellules, des effets
antimitotiques, et une anomalie de la croissance (mues inhibées, anormales ou
retardées). Elle induit également une altération de différents processus
reproductifs, comme la fécondité, la fertilité, l’oviposition, la viabilité des
œufs, l’oogenèse, la vitellogenèse, la spermiogénèse et le développement des gonades
[6, 13, 24].
L’impact de cette molécule est aussi observé sur la modulation de l’expression de
gènes liés au développement, au stress et à l’immunité [25–27] et sur la transcription de gènes liés à l’apoptose [28]. Les propriétés
anti-appétantes de l’azadirachtine sont liées à son incidence sur la chémoréception,
à des dommages sur différents tissus, comme les muscles (suppression du
péristaltisme), le corps gras ou les cellules intestinales [13, 29], mais aussi à une perturbation des processus physiologiques et
biochimiques digestifs [13]. L’induction
d’une mémoire sensorielle aversive est également notée [30]. L’azadirachtine agit en inhibant la signalisation de l’hormone juvénile (HJ) et de la
20-hydroxyecdysone (20E), des hormones essentielles à la reproduction et au
développement des arthropodes [6, 22]. Elle interfère aussi avec la voie de
signalisation de l’insuline, connue pour interagir avec l’HJ et les ecdystéroïdes,
les hormones impliquées dans le processus de mue des arthropodes [28, 31]. L’azadirachtine agit également sur le système nerveux
central (SNC) en inhibant la transmission cholinergique excitatrice
via les canaux calciques [32]. À noter que des liens entre insuline et
neuromodulation, comme la régulation du métabolisme de la dopamine, ont été mis en
évidence [31]. Néanmoins, malgré l’intérêt que cette molécule a suscité ces quatre dernières
décennies, le ou les mécanismes d’action de l’azadirachtine à l’origine de son effet
insecticide restent encore à définir [6, 7] et la définition de l’inter-relation entre la
structure de la molécule et son activité semble cruciale afin de comprendre les
interactions moléculaires effectivement responsables des différentes bioactivités de
l’azadirachtine [9]. |
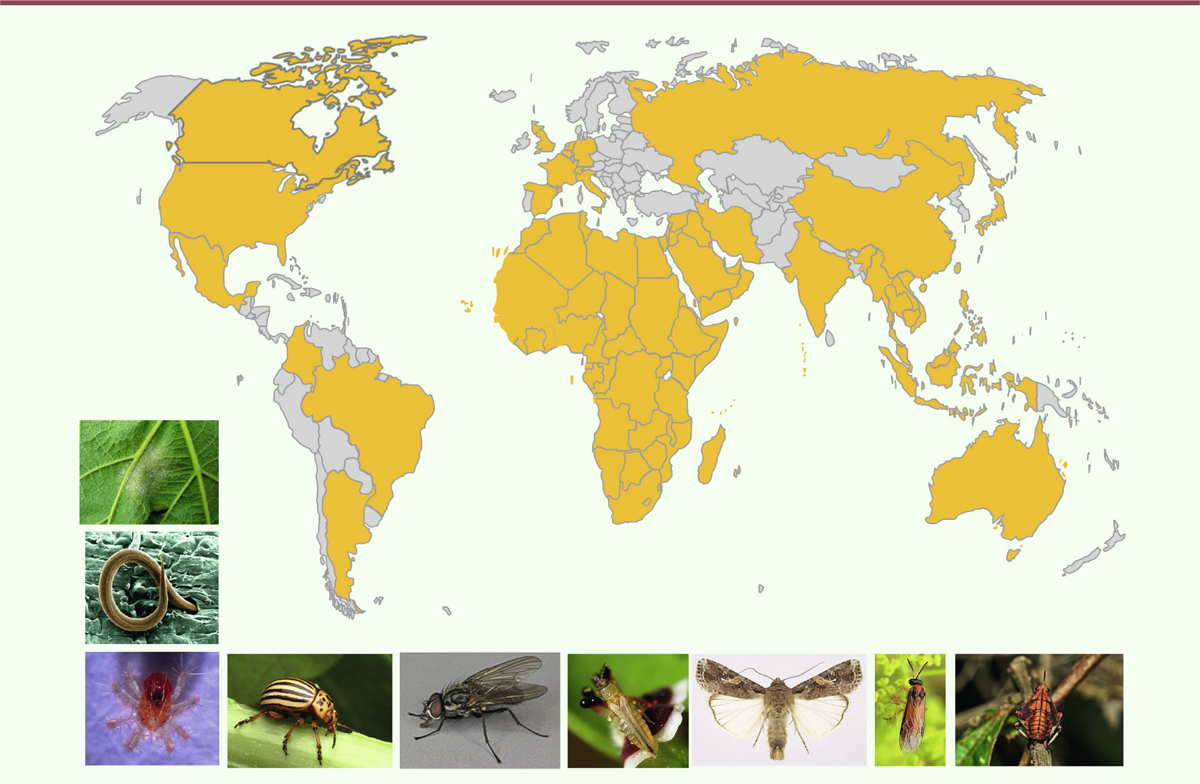
Les organismes que visent l’utilisation de l’azadirachtine regroupent toutes les
espèces susceptibles de causer des ravages dans les cultures ou de transmettre des
maladies à l’homme ou à l’animal. L’azadirachtine est ainsi utilisée pour lutter
contre divers fléaux (Figure
3) comme les insectes (lépidoptères, diptères, coléoptères,
hyménoptères, hétéroptères, homoptères et hémiptères) et autres arthropodes [6, 7,
22], mais aussi contre les nématodes, les
annélides et les champignons pathogènes [6,
8, 17]. Elle est particulièrement efficace contre la majorité des
insectes phytophages, comme les aleurodes, les pucerons, les doryphores, les thrips,
les charençons, les larves de papillons, la pyrale, les cochenilles, la noctuelle de
la tomate et diverses espèces de mouches. Elle provoque des effets extrêmement
variés et d’intensité variable qui affectent la plupart des fonctions vitales des
arthropodes.
 | Figure 3. Usage de l’azadirachtine dans le monde (zone en jaune) (d’après le Global
Azadirachtin Market Forecast 2024). Photographies de quelques espères
cibles. De haut en bas et de gauche à droite : champignon :
Plasmopara viticola sur feuille de vigne ; nématode
: Meloidogyne incognita, acarien : Panonychu
sulmi ; insectes : coléoptère : Leptinotarsa
decemlineata, diptère : Deliaradicum,
lépidoptère : Spodoptera frugiperda,
hyménoptère : Athalia rosae, thysanoptère :
Frankliniella occidentalis, hémiptère : Kalidasa
lanata. (photos Wikipedia®). |
Depuis 1985 aux États Unis, et plus récemment en Europe, l’azadirachtine est utilisée
comme anti-acariens dans la literie humaine [21]. Une société française est la seule à avoir développé une
technologie antiacarienne brevetée, fondée sur des extraits naturels de margousier,
et à avoir obtenu une autorisation de mise sur le marché par la commission
européenne (règlement biocide 528/2012). La technologie utilisée, de
micro-encapsulation, permet d’isoler les principes actifs et de les protéger
(lumière, oxydation, humidité). Des tests cliniques ont par ailleurs montré
l’innocuité de cette technologie, et la plupart des grandes marques française de
literie utilise ce procédé… |
… et les organismes non visés Les organismes « non visés » regroupent toutes les espèces qui ne sont pas ciblées
par le produit mais qui peuvent être impactées. Comparée à la plupart des
insecticides conventionnels, l’azadirachtine, biocide naturel, est citée comme étant
le moins nocif pour l’environnement et les organismes non visés [6, 7,
22]. Elle présente en effet, en plus
d’une rapide biodégradabilité, une absence de phénomène de résistance qui est
appréciée [6, 7] ; ceci est liée non seulement à la complexité de la structure
chimique de la molécule, mais aussi à ses multiples modes d’action [6, 7]. La
photodégradation de l’azadirachtine et des autres dérivés limonoïdes du
margousier3, est à l’origine de leur faible
persistance et, par conséquent, d’un moindre impact environnemental [7]. Pourtant, le terme « naturel » associé à ces
produits n’est pas synonyme de « sans danger », et la sélectivité et la non toxicité
des insecticides naturels n’est pas absolue [20]. L’azadirachtine agit en effet comme un régulateur de croissance, ou perturbateur du
développement (comme les agonistes ou antagonistes des ecdystéroïdes et de l’hormone
juvénile) [6, 7]. Un impact de ce type de produits sur les arthropodes utiles n’est
donc pas à écarter [33] et
plusieurs études, bien que controversées, ont révélé la toxicité des produits issus
du margousier sur des espèces non visées [34–37]. Ainsi, chez les abeilles, des altérations comportementales et
morphologiques ont été observées chez les individus soumis à l’azadirachtine, mais
aucun effet sur la viabilité (pour les abeilles ouvrières), le vol ou sur la
respiration n’a été mis en évidence [36, 37]. La sensibilité
des insectes à l’azadirachtine est étroitement liée à divers facteurs, comme le mode
d’exposition, la concentration de la molécule et l’espèce d’abeilles…
L’azadirachtine reste ainsi considérée comme le pesticide le moins nocif vis-à-vis
d’Apis mellifera, l’abeille mellifère commune [38]. Chez la drosophile, pourtant,
l’azadirachtine affecte la reproduction des mâles et des femelles, en altérant la
fécondité en induisant des troubles de la gamétogenèse et en diminuant leur
fertilité post-accouplement [24]. Chez les
organismes aquatiques, l’azadirachtine est considérée comme un agent prometteur
contre les parasites et les infections bactériennes [35, 39]. Elle est considérée comme relativement inoffensive et
dotée d’un potentiel immunostimulant. Mais là encore, des effets nocifs ont été
observés chez certaines espèces de poissons, comme le poisson chat
Heteropneustes fossilis [39]. Une utilisation prudente est d’ailleurs préconisée à proximité des
zones de pisciculture. Chez les organismes non ciblés, les effets de l’azadirachtine peuvent aussi varier en
fonction de sa formulation. Si l’huile de margousier peut entraîner une infertilité
et des effets tératogènes chez le rat, ou si ses formulations commerciales restent
plus toxiques pour les acariens, les parasitoïdes et les abeilles [36, 37],
aucune altération n’a été rapportée pour son principe actif qu’est l’azadirachtine
[40]. |
L’appréhension des impacts de biocides sur des organismes non ciblés et la
possibilité de risques futurs ne doit pas être ignorée. Les effets
transgénérationnels, impliquant la modulation de facteurs épigénétiques, restent
également une possibilité à prendre en considération [5]. Selon sa préparation et sa formulation, un même produit peut, ou
pas, présenter des effets délétères pour des organismes non ciblés. La préparation
de l’azadirachtine en micro ou nanoparticules (d’argent ou de silice) pourrait ainsi
offrir un produit qui soit plus efficace avec des coûts moindres et une meilleure
sécurité environnementale [13, 33]. Le produit actif peut alors être utilisé à
doses faibles, afin d’agir sur les populations ciblées tout en induisant peu
d’effets sur les espèces non visées et les ennemis naturels [13, 33]. Les nouvelles
techniques de production fondées sur la précipitation des produits actifs, qui sont
faciles à mettre en œuvre, améliorent l’efficacité biologique de la molécule et
permettent d’optimiser une libération du produit actif spécifiquement vers les sites
d’action [33], tout en améliorant sa
stabilité [33] et la durabilité de la
molécule [13]. Il n’en demeure pas moins que l’utilisation de molécules naturelles pour supprimer ou
limiter le développement d’espèces visées peut avoir des impacts collatéraux
importants sur la faune non ciblée, notamment sur les communautés entomologiques et
les pollinisateurs. Dans le contexte actuel alarmant de l’érosion de la
biodiversité, telle qu’elle a été constatée lors de la 7e réunion
plénière de la Plateforme intergouvernementale scientifique et politique sur la
biodiversité et les services écosystémiques4,
une évaluation qualitative et quantitative de l’utilisation massive de telles
molécules en agronomie reste à approfondir. |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. ThanySH,
ReynierP,
LenaersGNeurotoxicité
des pesticides : quel impact sur les maladies neurodégénératives
? . Med Sci (Paris).
2013; ; 29 :
:273.–278. 2. VrijheidM,
CasasM,
GasconM,
et al.
Environmental pollutants and child health-A review of recent
concerns . Int J Hyg Environ Health.
2016; ; 219 :
:331.–342. 3. BirchANE,
BeggGS,
SquireGRHow
agro-ecological research helps to address food security issues under new IPM
and pesticide reduction policies for global crop production
systems . J Exp Bot.
2011; ; 62 :
:3251.–3261. 4. CantrellCL,
DayanFE,
DukeSONatural
products as sources for new pesticides . J Nat
Prod.
2012; ; 75 :
:1231.–1242. 5. BrevikK,
LindströmL,
McKaySD,
ChenYHTransgenerational
effects of insecticides-implications for rapid pest evolution in
agroecosystems . Curr Opin Insect Sci.
2018; ; 26 :
:34.–40. 6. MordueLAJ,
MorganED,
NisbetAJ,
GilbertLI,
IatrouK,
GillSSAzadirachtin,
a natural product in insect control . Comprehensive
Molecular Insect Science . Oxford, UK:
: Elsevier; , 2005 :
:117.–135. 7. BenelliG,
CanaleA,
TonioloC,
et al.
Neem (Azadirachta indica):
towardtheidealinsecticide? . Nat Prod Res.
2017; ; 31 :
:369.–386. 8. SaleemS,
MuhammadG,
HussainMA,
BukhariSNA.
A comprehensive review of phytochemical profile, bioactives
for pharmaceuticals, and pharmacological attributes of Azadirachta
indica . PhytotherRes.
2018; ; 32 :
:1241.–1272. 9. FernadezSR,
BarreirosL,
OliveiraRF,
et al.
Chemistry, bioactivities, extraction and analysis of azadirachtin
: State of the art . Fitoterapia.
2019; ; 134 :
:141.–150. 10. Ghedira
K,
Goetz
P. Azadirachta
indica A. Juss. Neem, Meliaceae .
Phytothérapie.
2014;; 12 :
:252.–7. 11. GuptaSC,
PrasadS,
TyagiAK,
et al.
Neem (Azadirachta indica): an indian traditional panacea with
modern molecular basis . Phytomedicine.
2017; ; 34 :
:14.–20. 12. de
CastroEA,
de
OliveiraDA,
FariasSA,
et al.
Structure and electronic properties of
azadirachtin . J Mol Model.
2014; ; 20 : :2084.. 13. ChaudharyS,
KanwarRK,
SehgalA,
et al.
Progress on Azadirachta indica based biopesticides in replacing
synthetic toxic pesticides . Front Plant Sci.
2017; ; 8 : :610.. 14. KoriemK
M.. Review on pharmacological and
toxicologyical effects of oleum azadirachtin oil .
Asian Pac J Trop Biomed.
2013; ; 3 :
:834.–840. 15. HummelHE,
LangnerS,
HeinDF,
et al.
Unusually versatile plant genus Azadirachtawith many useful and
so far incompletely exploited properties for agriculture, medicine and
industry . Acta FytotechnZootechn.
2016; ; 18 :
:169.–175. 16. MogaMA,
Ba˘lan
A,
Anastasiu
CV, et al.
An overview on the anticancer activity of Azadirachta indica
(neem) in gynecological cancers . Int J Mol
Sci.
2018; ; 19 : :3898.. 17. ChutuloEC,
ChalannavarRK.
Endophytic mycoflora and their bioactive compounds from
Azadirachta indica : a comprehensive review . J
Fungi.
2018; ; 4 : :42.. 18. Lim
TK. Azadirachta
indica . In: Lim
TK eds. Edible medicinal
and non medicinal plants . Dordrecht,
Netherlands: : Springer; ,
2014;; 8 :
:409.–55. 19. SaxenaA,
KesariVP.
Lack of genotoxic potential of pesticides, spinosad,
imidacloprid and neem oil in mice (Mus musculus) . J
Environ Biol.
2016; ; 37 :
:291.–295. 20. Mossa
AH,
Mohafrash
SMM,
Chandrasekaran
N. Safety of natural
insecticides: toxic effects on experimental animals .
Biomed Res Int.
2018; :4308054.. 21. PrakashG,
BhojwaniSS,
SrivastavaAK.
Production of azadirachtin from plant tissue culture: state
of the art and future prospects . Biotechnol
Bioprocess Eng.
2002; ; 7 :
:185.–193. 22. MorganED.
Azadirachtin, a scientific gold mine .
Bioorg Med Chem.
2009; ; 17 :
:4096.–4105. 23. SpyrouIM,
KarpouzasDG,
Menkissoglu-SpiroudiU.
Do botanical pesticides alter the structure of the soil
microbial community? . Microb Ecol.
2009; ; 58 :
:715.–727. 24. AribiN,
OulhaciC
M,
Kilani-MorakchiS,
et al.
Azadirachtin impact on mate choice, female sexual receptivity and
male activity in Drosophila melanogaster (Diptera
Drosophilidae) . Pest Biochem Physiol.
2017; ; 143 :
:95.–101. 25. LaiD,
JinX,
WangH,
et al.
Gene expression profile change and growth inhibition in
Drosophila larvae treated with azadirachtin . J
Biotechnol.
2014; ; 185 :
:51.–56. 26. KoodalingamA,
DeepalakshmiR,
AmmuM,
RajalakshmiA.
Effects of NeemAzal on marker enzymes and hemocyte phagocytic
activity of larvae and pupae of the vector mosquito Aedes
aegypti . J Asia-Pac Entomol.
2014; ; 17 :
:175.–181. 27. ShaurubESH,
El-MeguidAA.
El-Aziz NMA. Quantitative and ultrastructural changes in the
haemocytes of Spodoptera littoralis (Boisd.) treated individually or in
combination with Spodoptera littoralis multicapsid nucleopolyhedrovirus
(SpliMNPV) and azadirachtin . Micron.
2014; ; 65 :
:62.–68. 28. ShaoX,
LaiD,
ZhangL,
XuH.
Induction of autophagy and apoptosis via PI3K/AKT/TOR
pathways by Azadirachtin A in Spodoptera litura Cells .
Sci Rep.
2016; ; 6 :
:35.–48. 29. ShuB,
ZhangJ,
CuiG,
et al.
Azadirachtin affects the growth of Spodopteralitura fabricius by
inducing apoptosis in larval midgut . Front
Physiol.
2018; ; 9 : :137.. 30. YanY,
GuHY,
XuHH,
ZhangZX.
Induction of aversive taste memory by azadirachtin and its
effects on dopaminergic neurons of Drosophila . J
South China Agric Univ.
2017; ; 38 :
:12.–18. 31. NässelD
R,
BroeckJ
V. Insulin/IGF signaling in
Drosophila and other insects: factors that regulate production, release and
post-release action of the insulin-like peptides .
Cell Mol Life Sci.
2016; ; 73 :
:271.–290. 32. QiaoJ,
ZouX,
LaiD,
et al.
Azadirachtin blocks the calcium channel and modulates the
cholinergic miniature synaptic current in the central nervous system of
Drosophila . Pest Manag Sci.
2014; ; 70 :
:104.–147. 33. da
CostaJT,
ForimMR,
CostaES,
et al.
Effects of different formulations of neem oil-based products on
control Zabrotes subfasciatus Boheman, 1833 (Coleoptera Bruchidae) on
beans . J Stored Prod Res.
2014; ; 56 :
:49.–53. 34. ScudelerEL,
SantosDCD.
Effects of neem oil (Azadirachtaindica A. Juss) on midgut
cells of predatory larvae Ceraeochrysaclaveri (Navás, 1911) (Neuroptera
Chrysopidae) . Micron.
2013; ; 44 :
:125.–132. 35. BanerjeeA,
MannaS,
SahaS
K. Effect of aqueous extract of
Azadirachta indicaA.Juss (neem) leaf on oocyte maturation, oviposition,
reproductive potentials and embryonic development of a freshwater fish
ectoparasite Argulus bengalensis Ramakrishna, 1951(Crustacea
Branchiura) . Parasitol Res.
2014; ; 113 :
:4641.–4650. 36. BarbosaWF,
ToméHV,
BernardesRC,
et al.
Biopesticide-induced behavioral and morphological alterations in
the stingless bee Melipona quadrifasciata . Environ
Toxicol Chem.
2015; ; 34 :
:2149.–2158. 37. BernardesRC,
ToméHVV,
BarbosaWF,
et al.
Azadirachtin-induced antifeeding in neotropical stingless
bees . Apidologie.
2017; ; 48 :
:275.–285. 38. EfromCFS,
RedaelliLR,
MeirellesR
N,
OuriqueCB.
Side-effects of pesticides used in the organic system of
production on Apis mellifera Linnaeus, 1758 . Braz
Arch Biol Technol.
2012; ; 55 :
:47.–53. 39. KumarA,
PrasadM,
SuzukiN,
et al.
Influence of a botanical pesticide, azadirachtin, on
ultimobranchialgland of the freshwater catfish Heteropneustes
fossilis . Toxicol Environ Chem.
2013; ; 95 :
:1702.–1711. 40. DallaquaB,
SaitoFH,
RodriguesT,
et al.
Azadirachta indica treatment on the congenital malformations of
fetuses from rats . J Ethnopharmacol.
2013; ; 150 :
:1109.–1113. |